极性反转一锅法制备联芳基七元内酯
2016-09-13解卉旖徐莉梅赵锦妮杜文婷
解卉旖,徐莉梅,赵锦妮,杜文婷
(杭州医学院,浙江 杭州 310053)
极性反转一锅法制备联芳基七元内酯
解卉旖,徐莉梅,赵锦妮,杜文婷*
(杭州医学院,浙江杭州310053)
以N-杂环卡宾做极性反转催化剂,以无水碳酸钾为碱、18-冠-6为相转移催化剂,给氧条件下一锅法合成了一系列联芳基七元内酯。该方法适用于各种结构类型的底物;相对于传统的联芳基七元内酯合成方法来说,具有操作简单、一步反应、条件温和,对环境相对友好及较高产率等优点,为联芳基七元内酯的合成提供了一种实用并具有原子经济性的途径。
联芳基七元内酯;N-杂环卡宾;极性反转;一锅法
联芳基七元内酯是一种具有抗心律失常活性的生物活性化合物,它也是许多多功能环氧树脂的重要结构部分,是各种粘合剂、密封胶、覆胶的组成成分,是某些化工产品的必要原料[1],因此探索合成联芳基七元内酯的方法引起有机与药物化学工作者的关注。近年来,已有多篇文献报道联芳基七元内酯的多种合成方法[2],包括联芳基二醇或者二醛的氧化内酯化、联芳基烯烃的氧化断裂、联芳基二羧酸的还原等等,见Scheme 1。这些合成方法存在以下技术缺陷:需用贵重稀缺或难以制备的金属催化剂、毒性/强腐蚀性试剂,反应过程污染严重,反应条件苛刻(无水无氧、加压、高温、长时间反应等)和后处理繁琐及产率低等。即使是Gerhard B报道的分子内偶联方法[2h],也需要以镍复合物和三苯基磷催化并需要丁基锂试剂参与。
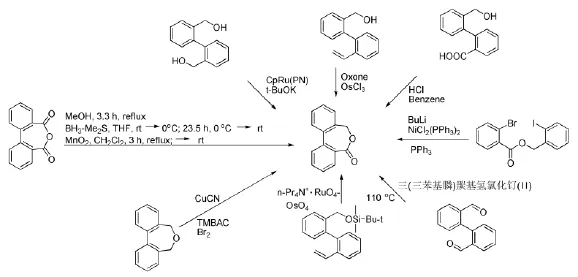
Scheme 1
极性反转的有机催化反应打破了传统意义上对于合成子反应性能的理解,开辟了一条用非传统方法构建碳碳键的途径,成为有机化学家用来改变常规反应模式的常用方法。随着对极性反转机理理解的加深,极性反转催化剂被不断开发、应用,氰化物由于其剧毒特性渐渐淡出在极性反转有机催化中的应用,N-杂环卡宾(NHCs)由于其性质独特,种类繁多且毒性较小等优点而成为该类反应中最常用的有机小分子催化剂之一。用于极性反转的NHCs最常见的应用有Benzoin反应、Stetter反应、酯交换反应、开环反应等。本文报道的N-杂环卡宾(NHCs)通过极性反转参与促进的联芳基七元内酯的合成新方法,与NHCs介导的酯交换反应有本质差别,其生成机理也会截然不同。另一方面,N-杂环卡宾的二聚体往往因为化学不稳定性而难以分离得到,我们在研究过程中成功分离得到两种N-杂环卡宾二聚体。
1 实验部分
1.1仪器与试剂
核磁共振采用Brüker AM型(中国,杭州)核磁共振仪测定,三甲基硅烷为内标。元素分析采用Carlo ERBA-1108型元素分析仪器。质谱采用Finnigan LCQ DECA光谱分析仪测定。薄层层析(TLC)和柱层析分别使用山东青岛海洋化工厂生产的薄层层析硅胶GF254型硅胶和300~400目柱层析硅胶。实验中所用无水乙腈和18-冠-6由百灵威科技公司购置。原料1和催化剂I,II,III自制获得。
1.2实验方法
1.2.1联芳基七元内酯2的合成
向干燥的反应管中依次加入化合物1(0.2mmol)、N-杂环卡宾噻唑盐III(0.2 mmol)和无水乙腈4 mL,搅拌下加入无水碳酸钾(0.4 mmol)和18-crown-6(0.12 mmol)。用氧气置换反应体系中的空气,氧气下(气球)室温反应约3 h,待原料反应完全后停止反应,以旋转蒸发仪蒸干溶剂,柱层析(乙酸乙酯:石油醚 =1:40)分离,得产物2-联苯[c,e]氧杂卓-5(7H)-酮2a:m.p.131℃~134℃;1H NMR(400 MHz,CDCl3)δ 8.02(dd,J=7.8,1.2 Hz,1H),7.73~7.62(m,3H),7.60~7.52(m, 2H),7.51~7.43(m,2H),5.05(d,J=24.0 Hz,2H)。13C NMR(100 MHz,CDCl3)δ 169.4,138.8,135.5,134.4,132.9,131.4,129.8,129.1,128.8,128.7,127.5,126.9,122.3,72.8.LRMS:[M]+,210.1;Anal.Calcd for C14H10O2(210):C,80.34;H,5.39;O,14.27.Found:C,80.26;H,5.41;O,14.20。
3-溴代联苯 [c,e]氧杂卓-5(7H)-酮2b:1H NMR(400 MHz,DMSO)δ 8.00(d,J=8.0 Hz,1H),7.85~7.77(m,3H),7.50~7.46(m,3H),5.50(d,J=9.0 Hz,1H),5.48(d,J=9.0 Hz,1H).LRMS:[M]+,287.9。
9-溴代联苯 [c,e]氧杂卓-5(7H)-酮2c:1H NMR(400 MHz,DMSO)δ 8.43(d,J=8.0 Hz,1H),7.68~7.54(m,6H),5.51(d,J=9.0 Hz,1H),5.44(d,J=9.0 Hz,1H).LRMS:[M]+,288.0。
3,9-二溴代联苯[c,e]氧杂卓-5(7H)-酮2d:1H NMR(400 MHz,DMSO)δ 8.38(d,J=7.0 Hz,1H),7.84~7.59(m,6H),5.50(d,J=9.0 Hz,1H),5.43(d,J=9.0 Hz,1H).LRMS:[M]+,367.9。
3,9-二硝基联苯[c,e]氧杂卓-5(7H)-酮2e:1H NMR(400 MHz,DMSO)δ 8.40(s,1H),8.31~8.24(m,3H),8.05(d,J=7.4 Hz,1H),7.61 (d,J=7.4 Hz,1H),5.36(d,J=9.0 Hz,1H),5.26(d,J=9.0 Hz,1H).LRMS:[M]+,300.0。
3,9-二甲氧基联苯[c,e]氧杂卓-5(7H)-酮2f:1H NMR(400 MHz,DMSO)δ 7.88~7.70(m,3H),7.23(dd,J=7.5,1.5 Hz,1H),7.12(d,J =1.5 Hz,1H),7.02(dd,J=7.5,1.5 Hz,1H),5.17(d,J=9.0 Hz,1H),5.07(d,J=9.0 Hz,1H),4.09(s,3H),4.01(s,3H).LRMS:[M]+,270.1。
3,9-二甲基联苯[c,e]氧杂卓-5(7H)-酮2g:1H NMR(400 MHz,DMSO)δ 7.68-7.62(m,3H),7.41~7.38(m,3H),5.05(d,J=9.0 Hz,1H),4.92(d,J=9.0 Hz,1H),2.40(s,3H),2.396(s,3H).LRMS:[M]+,238.1。
3,10-二甲氧基联苯[c,e]氧杂卓-5(7H)-酮2h:1H NMR(400 MHz,DMSO)δ 7.85~7.68(m,3H),7.23(dd,J=7.5,1.5 Hz,1H),7.13(d,J=1.5 Hz,1H),7.01(dd,J=7.5,1.5 Hz,1H),5.52(d,J=9.0 Hz,1H),5.43(d,J=9.0 Hz,1H),3.83(s,3H),3.77(s,3H).LRMS:[M]+,270.1。
3,10-二甲基联苯[c,e]氧杂卓-5(7H)-酮2i:1H NMR(400 MHz,DMSO)δ 7.67~7.62(m,3H),7.45~7.37(m,3H),5.06(d,J=9.0 Hz,1H),4.93(d,J=9.0 Hz,1H),2.46(s,3H),2.43(s,3H).LRMS:[M]+,238.1。
二萘[2,1-c:1',2'-e]氧杂卓-3(5H)-酮2j:1H NMR(400 MHz,DMSO)δ 8.24(d,J=8.0 Hz,1H),7.96(d,J=8.0 Hz,1H),7.65~7.59(m,3H),7.37~7.32(m,5H),7.12-7.10(m,1H),6.99~6.98(m,1H),5.24(d,J=9.0 Hz,1H),5.12(d,J=9.0 Hz,1H).LRMS:[M]+,310.1。
1.2.2N-杂环卡宾二聚体3和4的合成
向干燥的反应管中依次加入2’-(溴甲基)联苯基-2-甲醛(1a)55 mg(0.2 mmol)、N-杂环卡宾噻唑盐I 31.4 mg(0.1 mmol)和无水乙腈4 mL,搅拌下加入氢化钠16.0 mg(0.4 mmol)。用氧气置换反应体系中的空气,氧气下(气球)室温反应约3 h,待原料反应完全后停止反应,以旋转蒸发仪蒸干溶剂,柱层析(乙酸乙酯:石油醚 =1:40)分离,得产物2a 13.5 mg收率为33%;同时柱层析(二氯甲烷:甲醇 =30:1)得到N-杂环卡宾二聚体(3)8.4 mg,收率为9%:1H NMR(400 MHz,CDCl3)δ 7.38~7.30(m,6H),7.24~7.21(m,4H),4.95(s,4H),3.77(t,J=6.6 Hz,4H),2.74(t,J=6.2 Hz,4H),2.01(s,6H).LRMS:[M]+,466.2。
向干燥的反应管中依次加入2’-(溴甲基)联苯基-2-甲醛(1a)55 mg(0.2 mmol)、N-杂环卡宾噻唑盐 III 25.5 mg(0.1 mmol)和无水乙腈4 mL,搅拌下加入叔丁醇钾44.9 mg(0.4 mmol)。用氧气置换反应体系中的空气,氧气下(气球)室温反应约3 h,待原料反应完全后停止反应,以旋转蒸发仪蒸干溶剂,干法上样柱层析(乙酸乙酯:石油醚 =1:40)分离,得产物2a 24.4 mg,收率为58%,同时柱层析(乙酸乙酯:石油醚 =1:4)得到N-杂环卡宾二聚体 (4)6.9 mg,收率14%:1H NMR(400 MHz,CDCl3)δ 3.25(s,6H),2.10(s,6H),2.06(s,6H).LRMS:[M]+,254.1。
2 结果与讨论

Table 1对联芳基七元内酯合成的反应条件筛选优化a
借鉴前期对NHCs极性反转催化下的α-芳基酮和芳香羧酸苄酯的合成经验[3],我们有针对性地选择了卡宾盐、碱和溶剂进行了筛选优化(Table 1)。以卡宾盐I为催化剂,乙腈为溶剂,对具有代表性的碱K2CO3、NaH和t-BuOK进行筛选优化,发现碳酸钾更有利于目标产物的生成(Entries 1,2,6);而碳酸钾与相转移催化剂18-冠-6配合,可使产率得到显著提高(Entries 9,10)。对溶剂的筛选优化结果,类似于NHC参与的醛与卤代烃的亲核取代反应[3],仍旧是无水乙腈略胜一筹(Entries 3-5);卡宾盐I、II和III(50 mol%)在相同碱和溶剂条件下分别参与反应,结果显示III得到的联芳基七元内酯明显高于I和II(Entries 6-8)。在Entry 2与Entry 3记录的反应中,意外的分别分离得到了催化剂N-杂环卡宾的二聚体3与4(Scheme 2),证明了醛基与溴甲基反应过程中,卡宾盐到NHCs的转化率过低,部分卡宾盐自身反应生成了二聚物,从而无法实现催化循环;这也是当卡宾盐I由50 mol%投料量变成100 mol%投料量,产率发生显著提高的重要原因(Entry 3,9)。从而我们初步确定了最佳反应体系:以卡宾盐III化学计量参与反应,碳酸钾配合相转移催化剂18-冠-6,在无水乙腈溶剂中室温、给氧,可高效生成联苯七元内酯。

Scheme
在上述最佳反应体系下,我们应用不同取代的卤苄联苯基甲醛和溴甲基联萘甲醛合成联芳基七元内酯衍生物,结果表明,在优化条件下可以得到65%~92%的产率(Table 2)。该方法适用于联芳基七元内酯的合成。
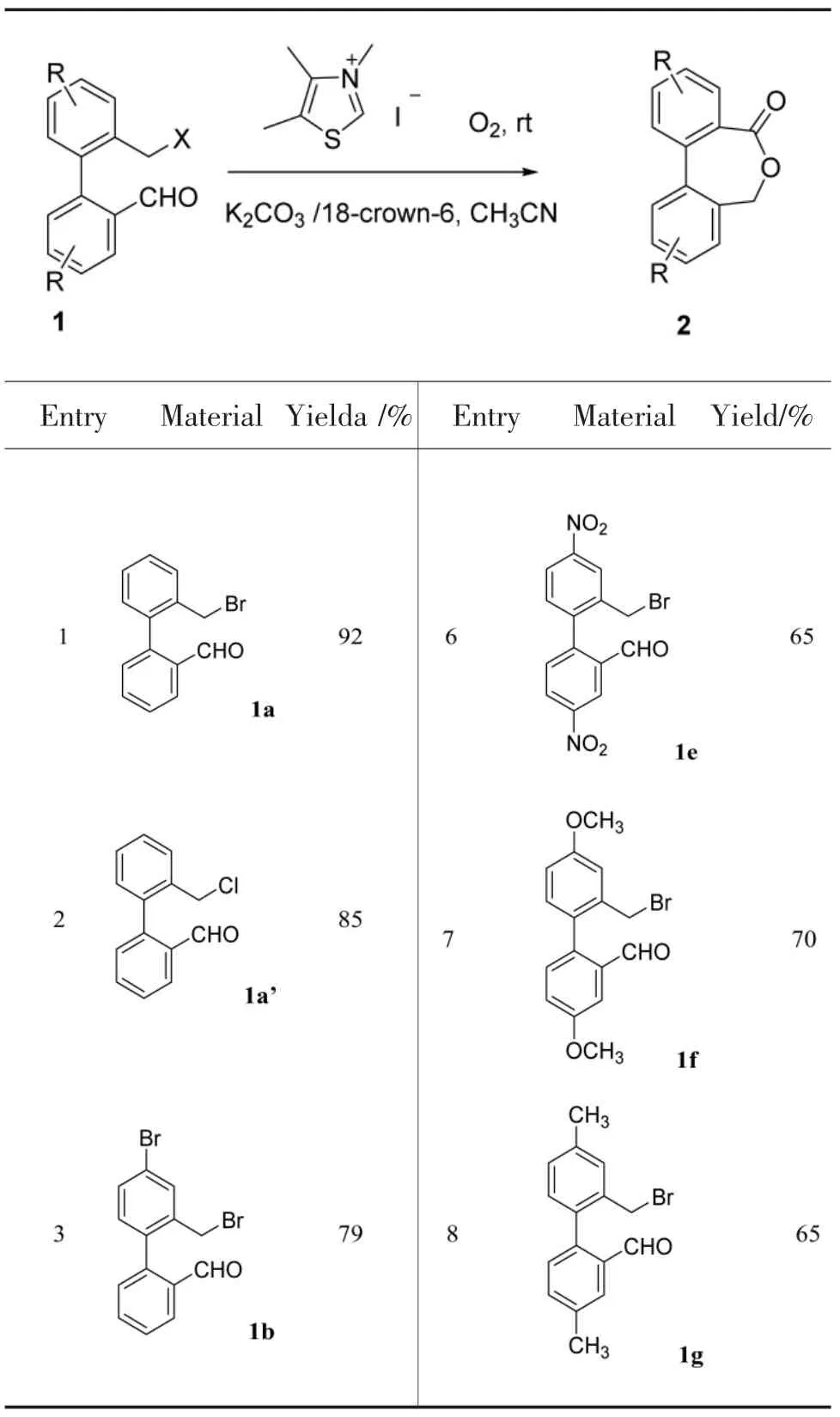
Table 2 NHCs促进联芳基七元内酯的合成方法的底物拓展
aThe reaction was performed under oxygen,with 1 (0.2 mmol)and 100 mol%of III,in the presence of anhydrous K2CO3(2 equiv)and of 18-crown-6(0.6 equiv)in 4 mL of anhydrous CH3CN.
3 结论
给氧条件下,以无水乙腈为溶剂,以卡宾盐III为催化剂,以无水碳酸钾为碱、18-冠-6为相转移催化剂,对卡宾盐进行现场游离,室温搅拌反应约3 h,一锅法合成了一系列联芳基七元内酯衍生物。本方法属分子内偶联,但产物的生成机理依靠NHCs的极性反转,与传统的分子内偶联截然不同,相对于传统的联芳基七元内酯合成方法来说,具有操作简单、一步反应、条件温和,且避免使用金属催化剂及苛刻条件,对环境相对友好等优点,以100 mol%噻唑类卡宾盐参与反应可获得高产率,为联芳基七元内酯的合成提供了一条实用并具有原子经济性的途径。
[1](a)Samvelyan V M,Vasilyan S S.Antiarrhythmic properties of some cholinolytic substances[J].Krovoobrashchenie,1981,14:13-18.(b)Atsushi S,Takeshi E,Akane S. Low shrinkage epoxy-cationic curable compositions:WO,2007135094 A1[P].2007-11-29.(c)Ralf R,Richard P K.N-Heterocycles with a 2-azaallyl system.5.7-Methoxyand 7-alkylthio-5H-dibenz[c,e]azepinium salts:7-membered N-heterocycles with an integrated 2-azaallyl system [J].Chemiker-Zeitung,1991,115:193-201.
[2](a)Wu X F.A general and efficient zinc-catalyzed oxidation of benzyl alcohols to aldehydes and esters[J].Chemistry-A European Journal,2012,18:8912-8915.(b)Makoto B E,Yuto S,Haruhiko F,et al.Highly efficient synthesis of medium-sized lactones via oxidative lactonization:concise total synthesis of isolaurepan[J].Org.Biomol. Chem.,2010,8:39-42.(c)Sohei O,Takahide F,Yuji M,et al.Hydroruthenation triggered catalytic conversion of dialdehydes and keto aldehydes to lactones[J].Chem. Commun.,2009,(44):6741-6743.(d)Ito M,Osaku A,Shiibashi A,et al.An efficient oxidative lactonization of 1,4-diols catalyzed by CpRu(PN)complexes[J].Org. Lett.,2007,9:1821-1824.(e)Edwards D J,House D,Sheldrake H M et al.Kinetic and thermodynamic control of axial chirality in biaryl-derived fused oxazolidine lactams exploiting a centre-axis relay of unit efficiency[J].Organic&Biomolecular Chemistry,2007,5:2658-2669.(f)Whitehead D C,Travis B R,Borhan B.The OsO4-mediated oxidative cleavage of olefins catalyzed by alternative osmium sources[J].Tetrahedron Lett.,2006,47:3797-3800.(g)Schomaker J M,Travis B R,Borhan B.Direct lactonization of alkenols via osmium tetroxide-mediated oxidative cleavage[J].Org.Lett.,2003,5:3089-3092.(h)Gerhard B,Jürgen H,Petra H,et al.Novel concepts in directed biaryl synthesis.Part 90.Synthesis of constitutionally unsymmetric 7-membered biaryl lactones by Nimediated intramolecular coupling[J].Synlett 2000,(12):1822-1824.
[3] (a)Li Y,Du W,Deng W P.NHCs-mediated benzoates formation directly from aromatic aldehydes and alkyl halides[J].Tetrahedron,2012,68:3611-3615.(b)Lin L,Li Y,Du W,et al.The NHCs-mediated cross-coupling of aromatic aldehydes with benzyl halides:synthesis of α-aryl ketones[J].Tetrahedron Lett.,2010,51:3571-3574.
A One-pot Synthesis of Biaryl Seven-membered Lactones via Umpolung Reaction
XIE Hui-yi,XU Li-mei,ZHAO Jin-ni,DU Wen-ting*
(Hangzhou Medical College,Hangzhou,Zhejiang 310053,China)
To develop a simple and efficient procedure for the synthesis of biaryl seven-membered lactones.The umpolung reaction was promoted by N-heterocyclic carbenes under oxygen,with anhydrous potassium carbonate as base and with 18-crown-6 as a phase-transfer catalyst.The practical protocol was found to be compatible with different structurally diverse substrates.This synthesis method has the advantage of operation simplicity,one-step reaction,mild condition,relative environment-friendly and moderate to high yields,providing a useful and atom-economic approach to the synthesis of biaryl seven-membered lactones.
biaryl seven-membered lactones;N-heterocyclic carbine;umpolung reaction;one-pot
1006-4184(2016)8-0030-05
2016-03-18
2016年度浙江省自然科学基金一般项目 (LY16H300004),2016年浙江省大学生科技创新活动计划 (新苗人才计划,2016R436005),2014年度浙江省卫生高层次创新人才项目。
解卉旖(1996-),女,浙江金华人,在读专科生。
杜文婷,女,博士,副教授。E-mail:ddwwtt@163.com。
