不同来源高度免疫缺陷小鼠微卫星DNA遗传检测的分析
2016-09-13周舒雅岳秉飞李保文
范 涛, 王 洪, 魏 杰, 周舒雅, 岳秉飞, 李保文
(中国食品药品检定研究院,北京 100050)
不同来源高度免疫缺陷小鼠微卫星DNA遗传检测的分析
范涛, 王洪, 魏杰, 周舒雅, 岳秉飞, 李保文
(中国食品药品检定研究院,北京100050)
目的对不同来源的高度免疫缺陷小鼠进行遗传背景的检测分析,旨在发现经遗传修饰的小鼠遗传背景是否符合近交系遗传特征。方法对收集到的4种不同来源以NOD为背景的高度免疫缺陷小鼠,选取30个微卫星DNA位点进行PCR检测,通过凝胶电泳结果和STR扫描确定基因型,进行遗传分析。结果4组20个样本中共有17个位点呈现多态性,A、B两组小鼠30个微卫星位点表现为纯和,其他两组小鼠中不同位点均出现杂合个体;A、B两组遗传距离最小,保持着较高的遗传相似度。结论研究表明,不同来源高度免疫缺陷小鼠遗传背景有差异。
免疫缺陷小鼠;微卫星;遗传质量
高度免疫缺陷小鼠“NSG”是在NOD(non-obese diabetic)小鼠的背景下,发生重症联合免疫缺陷Prkdcscid(protein kinase, DNA activated, catalytic polypeptide,Prkdc;severe combined immune deficiency,SCID)和白细胞介素2受体γ链(interleukin 2 receptor gamma chain,Il2rg)缺失突变产生的。该小鼠模型表现为成熟T、B淋巴细胞、功能性NK细胞缺失,细胞因子信号缺少。由于其免疫缺陷程度相对于其他品系更高,能更好地适用于人类造血干细胞、外周血单核细胞和肿瘤的异种移植,而成为一种理想的人源化免疫缺陷小鼠模型。不同来源的高度免疫缺陷小鼠有不同的建立方法:一种方法是同源导入,通过回交获得以受体小鼠品系为背景的双基因突变型小鼠;另一种是利用基因编辑技术直接在背景品系小鼠上进行改造,更快、更直接地获得目标动物。微卫星又称短串联重复序列(short tandom repeat, STR),作为分子标记在实验动物的遗传质量检测中具有良好的适用性,被广泛应用[1-4]。具有高度多态性的简单重复序列可以用于区分不同近交系小鼠,而在同品系内不同个体间,微卫星DNA则呈单态性[5,6],可以用于近交系遗传质量评价。本实验通过选择30个微卫星位点对收集到的4种不同来源,不同制作方法的“NSG”小鼠进行遗传检测,旨在发现这些遗传工程小鼠从制作之初背景品系的选取,到后期建系保种的过程,在遗传质量方面是否符合近交系特点。
1 材料和方法
1.1材料

图1 4组小鼠在D5Mit48位点PCR凝胶电泳结果Fig.1 PCR gel electrophoresis at loci D5Mit48 of mice in the four groups
4种不同来源的“NSG”小鼠由本单位收集保存并提供,生产许可证号【SCXK(京)2014-0013】。4种小鼠中有两种是在背景品系上做的基因敲除,两种为同源倒入。每品系5只,4~6周龄,雌雄在选择时不做限制,SPF级环境饲养,选择1只B6小鼠作为参照。
1.2方法
1.2.1小鼠DNA提取:将4种不同来源高度免疫缺陷小鼠顺序编为A、B、C、D四个组。剪取小鼠尾尖3~5 mm放入EP管中,加蛋白酶K缓冲液裂解过夜,酚/氯仿法提取DNA,浓度稀释至50~100 ng/μL,4℃保存。
1.2.2微卫星位点的选择:根据文献报道[7],选择30个多态性较高的微卫星位点,覆盖小鼠1~20号染色体,引物序列详见表1,引物由英潍捷基(上海)贸易有限公司合成。
1.2.3PCR扩增:反应体系:总反应体系20 μL,其中:10× PCR buffer 2 μL,上、下游引物各1 μL,dNTP 1.2 μL,镁离子1.5 μL,Taq酶0.2 μL,基因组DNA 1 μL,纯水12.1 μL。PCR反应条件:95℃预变性5 min;94℃变性30 s;退火温度(54~64℃)30 s;72℃延伸30 s;35个循环;72℃延伸8 min;扩增产物4℃保存。
1.2.4电泳:2.5%琼脂糖凝胶,电泳。溴化乙锭染色,用紫外可见分析仪查看结果并记录。
1.2.5STR扫描:将21个样本扩增产物放入STR扫描仪,用GeneMarker V2.2.0读取各样本在各位点扩增片段的大小。每个位点按照片段大小顺序记为a、b、c、d,根据等位基因分型的不同,各微卫星位点的基因型以aa、ab、ac等方式记录,基因型全部纯和,判断为符合近交系特征;反之出现杂合基因型则不符合近交系遗传特点。
1.2.6数据结果:用Lynch法计算组间相似系数,同时将数据放入PopGen1.32进行统计分析。
2 结果
2.1PCR检测分析结果
30个微卫星位点均能扩增出条带。根据电泳结果进行初步筛查,可观察到多态性位点,以D5Mit48位点为例(图1),C组1、2、4、5号小鼠在该位点上与其他组别个体间有差别,呈现多态性。通过与B6 PCR结果的比较,D7Mit12、D14Mit3、D18Mit19、D19Mit3、D19Mit16位点两种品系的扩增片段长度一致,表现为单态性。
2.2STR扫描及结果
琼脂糖凝胶电泳用肉眼难以观察区别小于10 bp的片段,STR扫描可以精确检测片段的具体长度,区分相差1 bp的DNA片段。根据STR扫描结果,可以更准确地判断各位点的多态性,同时判断位点为纯合还是杂合,判读方法如图2所示。C组在D12Mit7位点出现了两种片段长度,经扫描,1、4、5号样本出现106 bp和122 bp两个波形,说明该小鼠在这个位点为杂合状态,基因型记录为ab;2号样本和3号样本各在122 bp和106 bp出现了一个波形,说明这两只小鼠在该位点为纯和型并表现出多态性,记录为bb、aa,以此类推。4组20个实验样本判读结果(表1)。
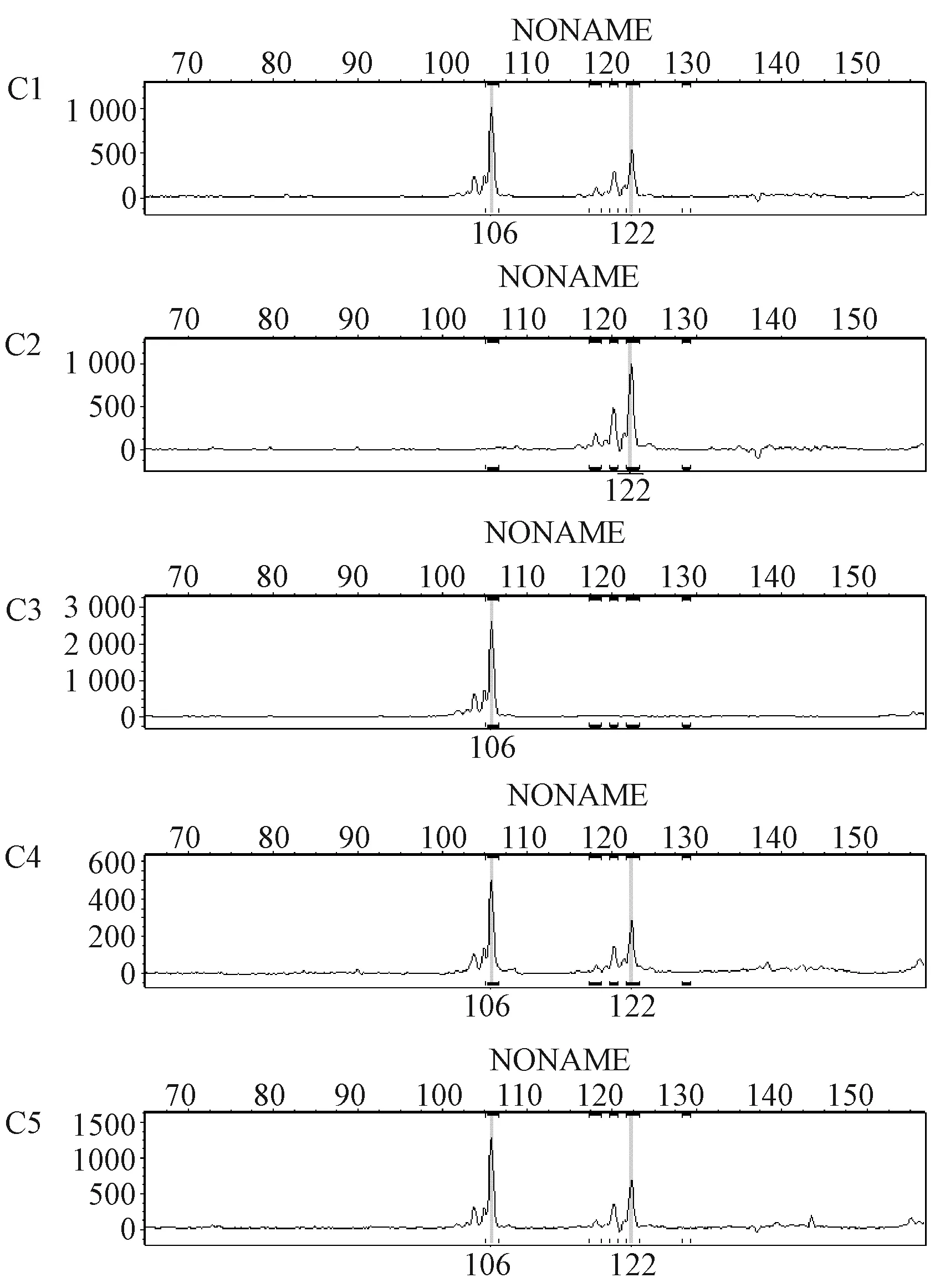
图2 C组样本在D12Mit7位点的微卫星扫描波形Fig.2 The waveforms of loci D12Mit7 in STR scanning of samples of the group C
根据STR扫描结果,参照样本B6所有微卫星位点都为纯合状态;A、B组的10只小鼠30个微卫星位点均为纯合状态; C组的5个样本中在D2Mit15、D8Mit33、D9Mit21、D9Mit23、D11Mit4、D12Mit7、D17Nds3、D17Mit11、D18Mit9、D19Mit16 等10个位点上,出现多个杂合型个体;D组的样本仅有一只小鼠在D19Mit6位点上表现为杂合型。4组20个样本中共有17个位点呈现出多态性,包括:D1Mit365、D2Mit15、D3Mit29、D5Mit48、D6Mit8、D6Mit102、D8Mit33、D9Mit21、D9Mit23、D11Mit4、D12Mit7、D16Mit9、D17Nds3、D17Mit11、D18Mit9、D19Mit16、DXMit16。
2.34种小鼠相似系数
按Lynch法计算相似系数其结果(表2)。A组与B组小鼠相似度最高,其次是B组与D组;C、D两组相似性最低。C组与其他三组都有较低的相似性。
2.44种小鼠遗传距离比较
通过PopGen1.32软件分析Nei’(1978)遗传距离、遗传相似度指标结果(表3)。通过计算可以看出A组与B组遗传距离最小,保持着较高的遗传相似度。
3 讨论
Jackson实验室发布的高度免疫缺陷小鼠是通过将NOD.CB17-Prkdcscid/J与B6.129S4-Il2rgtm1Wjl/J两品系杂交,产生同时具备Prkdcscid和Il2rg基因型的F1代后,与NOD.CB17-Prkdcscid/J回交8代,产生的杂合子相互交配得到Prkdcscid和Il2rg双纯合型(Il2rg是X-link基因,雄性为半合子)的NSG小鼠[8]。国内不少实验室和基因工程公司则使用基因编辑技术,在NOD或NOD/SCID(NOD.CB17-Prkdcscid)小鼠上进行基因改造而获得同样的动物模型。不论哪种方式,最终获得的目标动物都应符合近交系特点。根据实验结果,A、B两组中所包含的10只小鼠样本30个位点均处于纯和状态,符合近交系特点;C组的5只小鼠样本中,在10个位点上出现多个个体的基因型为杂合,可以判定其不符合近交系遗传特征。D组有一只小鼠在1个位点上出现杂合基因型,可将其本身及其后代淘汰,不进入繁育体系。
根据报道[9],不同近交系在D7Mit12、D19Mit3两个微卫星位点呈单态性,实验证明NOD小鼠也符合该特点。不同组别的小鼠在同一位点上也具有多态性。例如A组全部样本在D1Mit365位点、C组在D6Mit8位点上都出现了与其他三组不一致的DNA片段长度,但都为纯合的基因型,这可能是在小鼠模型构建之初选择了不同的亚系而导致的。又如A组在D3Mit29、D17Nds3两个位点各出现了1只与组内其他4只不同的基因型,如果该样本处在基础群或核心群中,可以在日后的繁育管理中将其淘汰,避免在该位点出现杂合等位基因。
近交系小鼠的遗传质量直接影响着实验结果的可靠性[10,11],大多数基因工程小鼠都是以近交系为背景进行基因改造而来。遗传质量的改变可能发生在建立时选用的小鼠自身发生遗传变异,遗传背景不符合近交系特点;也可能发生在后续的建系保种过程中,如回交倒入品系不合格,回交未超过5代(N5),未严格按照全同胞兄妹繁殖等。

表1 30个微卫星座位的引物序列、扩增条件及各组基因型结果

表2 任意两组间相同等位基因数量与相似系数
注:对角线以上部表示两组间相同位点数量,对角线以下为两组间相似系数。
Note. The number of the same alleles (above the diagonal) and similarity index (below the diagonal)
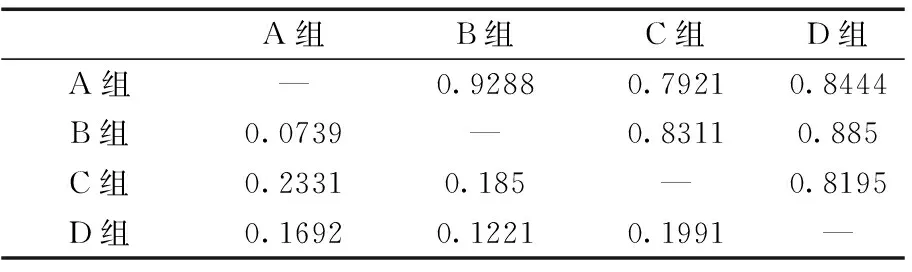
表3 任意两组间遗传相似度和遗传距离
注:对角线以上部表示两组间遗传相似度,对角线以下为两组间遗传距离。
Genetic identity (above the diagonal) and genetic distance (below the diagonal)
微卫星DNA具有位点充足,遗传稳定,多态性高,片段短容易扩增等优势,非常适合用于近交系的遗传监测。近交系遗传修饰小鼠在保种、扩繁的过程中除目的基因的检测外,定期对基础群和核心群的繁殖个体进行遗传背景的筛查很有必要,及时发现不合格的个体并不作选留,可维护整个种群的纯合性。本文通过微卫星DNA分子标记对不同来源高度免疫缺陷小鼠的遗传质量进行检测,为近交系小鼠微卫星位点的筛选提供数据支撑,同时,对建立动物模型质量评价提供参考。对于今后的保种和繁殖以及使用的意义和社会价值的重要性进行阐述。
[1]Basta PV, Whitmore SP, Basham KB, et al. Microsatellite analysis in FVB/N mice [J]. Comp Med, 2004, 54(5): 524-527.
[2]Katoh H, Yoshino S, Inui Y, Honda S, et al. Microsatellite genotyping for genetic quality testing using sperm cells in the mouse [J]. Exp Anim, 2005, 54( 4): 373-376.
[3]陈振文, 欧阳兆和, 董罡, 等. 用微卫星标记技术对国内BALB/c小鼠遗传质量的分析 [J]. 遗传, 2004, 26(6): 845-848.
[4]李芳芳, 魏杰, 王洪, 等. 应用微卫星标记对两个豚鼠封闭群的遗传学研究 [J]. 中国比较医学杂志, 2014, 24(12): 33-38.
[5]欧阳兆和, 陈振文, 李瑞生, 等. 微卫星DNA多态性在十种近交系小鼠遗传监测中的应用研究[J]. 中国比较医学杂志,2004,14(2):71-74.
[6]王纯耀,杨卫红,宋国英,等.微卫星DNA在近交系小鼠遗传监测中的应用 [J]. 中国兽医学报, 2008, 28(3): 333-335.
[7]王洪, 杜小燕, 徐平, 等. 上海KM小鼠种子群体遗传状况分析 [J]. 中国比较医学杂志, 2014, 24(12): 27-32.
[8]JAX Mice, JAX Mice & Services, The Jackson Laboratory, Bar Harbor, ME. World Wide Web (http://www.jax.org/strain/005557)
[9]刘先菊, 王艳蓉, 高子琪, 等. 近交系小鼠微卫星DNA引物的筛选和Tm值优化研究 [J].实验动物科学, 2012, 29(1): 9-13.
[10]张树辉,魏泓,史景泉.近交系小鼠微卫星DNA多态性的研究[J]. 遗传, 2000, 22(6): 375-378.
[11]刘先菊, 王艳蓉, 张丽芳, 等. 常用近交系小鼠微卫星 DNA多态性的分析研究 [J]. 实验动物科学, 2010, 27(5): 1-4.
Genetic monitoring and analysis of highly immunodeficient mice from different sources by microsatellite DNA markers
FAN Tao, WANG Hong, WEI Jie, ZHOU Shu-ya, YUE Bing-fei, LI Bao-wen.
National Institutes for Food and Drug Control, Beijing 100050, China)
ObjectiveTo test and analyze the genetic background of highly immunodeficient mice from different sources. Methods Four highly immunodeficient mouse strains from different sources of NOD background were collected. 30 microsatellite DNA sites were detected, and the genotype can be displayed by gel electrophoresis and STR scanning. Results17 microsatellite sites exhibit polymorphism in 20 mice of the four groups. There were 30 homozygous loci in the mice of groups A and B, and heterozygous in the other two groups. The genetic distance is minimum between groups A and B, showing a higher genetic similarity. ConclusionsThe genetic backgrounds are different in highly immunodeficient mice from different sources.
Immunodeficient mice; Microsatellite; Genetic quality; Mice
范涛(1983-),男,技师,专业:实验动物保种。E-mail:crvchinaft@126.com。
李保文(1967-),男,副主任技师。E-mail:libaowen2003@aliyun.com。
研究报告
R-33
A
1671-7856(2016) 08-0091-05
10.3969.j.issn.1671-7856.2016.08.015
2016-04-28
