小麦淀粉合成相关酶基因 SSⅡa、 SBEⅡa和 SBEⅡb表达序列多态性及对淀粉质量分数的影响
2016-09-12韩俊杰王昊龙李卫华
韩俊杰,王昊龙,李 咏,蔡 曼,李卫华
(石河子大学 农学院,新疆兵团绿洲生态农业重点实验室, 新疆石河子 832003)
小麦淀粉合成相关酶基因SSⅡa、SBEⅡa和SBEⅡb表达序列多态性及对淀粉质量分数的影响
韩俊杰,王昊龙,李咏,蔡曼,李卫华
(石河子大学 农学院,新疆兵团绿洲生态农业重点实验室, 新疆石河子832003)
为了探究小麦淀粉合成相关酶SSⅡa、SBEⅡa和SBEⅡb基因表达序列核苷酸多态性及其与淀粉质量分数的关系,根据GenBank中已公布的基因序列设计特异引物,克隆基因的表达序列并测序,通过Clustal X2比对分析,用Dnasp 5.0计算核苷酸多态性信息,并建树做单倍型与淀粉质量分数的相关分析。结果表明,克隆得到3个基因的ORF(Open reading frame)序列,NCBI/Blast同源比对SSⅡa、SBEⅡa和SBEⅡb与GenBank中已登记的序列的同源性分别为98.19%、98.64%和99.04%。在SSⅡa、SBEⅡa和SBEⅡb中分别发现40、14和18个SNP位点,其中共包括4个InDel。在SSⅡa中,其第2外显子区为变异富集区,Tajima’s D检验D值均不显著。可见,这3个基因的多态性信息均较丰富,其单核苷酸多态性与小麦淀粉质量分数之间存在一定的对应关系。
小麦;表达序列;核苷酸多态性;淀粉质量分数
淀粉是成熟小麦籽粒最重要的组分,约占小麦籽粒质量的65%左右,其中直链淀粉约占24%,支链淀粉约占75%[1]。作物淀粉的合成是一个复杂过程,在质体(造粉体、叶绿体等)中进行,主要受腺苷二磷酸葡萄糖焦磷酸化酶(ADPG Pyrophosphorylase,AGPase)、颗粒型淀粉合酶(granule-bound starch synthase,GBSS)、可溶性淀粉合酶(Starch Synthase,SS)、淀粉分支酶(Starch Branching Enzyme,SBE)和淀粉去分支酶(Starch Debranching Enzyme,DBE)等酶的调控,且每种酶有数量不同的同工酶组成[2]。AGPase主要催化ADP-葡萄糖(ADPG)的形成而作为淀粉合成的底物[3];SBE从淀粉长链非还原末端切下一个小片段并将其连接到淀粉链的一个葡萄糖残基上,形成分支[4];DBE主要催化多糖链中α-1-6-糖苷键的水解,去除多余的分支,起修饰作用[5];SS可以分为4种类型:SSⅠ、SSⅡ、SSⅢ和SSⅣ。SSⅠ主要负责10个以下的葡聚糖支链合成[6],SSⅡ负责中等长度支链形成[7],SSⅢ则负责25~35个长链的合成[8],SSⅣ通过参与淀粉颗粒引物的形成来控制淀粉颗粒的数目[9]。若淀粉合成相关酶基因发生突变或其表达受抑制,其所编码的淀粉合成酶活性会下降或丧失,淀粉质量分数也相应地降低或丧失[10]。因此,研究与淀粉合成密切相关的酶基因,了解基因多态性对淀粉合成的影响,有助于从分子水平上了解造成淀粉质量分数差异的原因具有重要意义。Yamamori等[11]用3个 SSⅡ基因缺体系品种杂交,得到同时缺失SSⅡa、SSⅡb和SSⅡd的小麦材料,研究发现该材料中直链淀粉质量分数有大幅度提高,而支链淀粉质量分数则下降,说明SSⅡ基因主要负责支链淀粉合成;Jiang等[12]对水稻SSⅡa基因研究表明,在基因编码区264位点处发生碱基替换(G-A),这个突变导致谷氨酸转变为天冬氨酸(E-D),从而造成SSⅡa酶活性的改变,影响支链淀粉中等长度分支链的合成。SBE分为4种:SBEⅠ、SBEⅡa、SBEⅡb和SBEⅢ,但是在不同的作物中,其表现并不相同。在马铃薯、水稻和玉米的研究中发现,SBEⅠ活性的降低对直链淀粉的合成无显著影响[13]。但是,在玉米和水稻中,通过抑制SBEⅡb使得直链淀粉表观质量分数增加[14],然而分析玉米SBEⅡa的突变体显示,SBEⅡa突变使叶片中直链淀粉质量分数增加[15]。Regina等[16]对小麦和大麦的研究发现,抑制SBEⅡa/SBEⅡb的表达会导致直链淀粉的增加。自从2001年Thornsberry等[17]对玉米dwarf8基因多态性研究和关联分析以来,利用基因多态性和功能预测及验证的报道越来越多。基因组中表达序列一般呈连续或间隔分布,而EST序列在多数情况下是与之相对应,因此从EST序列的角度探究核苷酸多态性对表观性状的影响可能更具重要意义。目前,关于小麦淀粉合成相关酶基因的核苷酸多态性及其与小麦淀粉质量分数之间的关系还未见详细报道,因此,本试验以12份不同淀粉质量分数的小麦品种(系)为材料,研究小麦淀粉合成相关酶基因表达序列的多态性,通过对SSⅡa、SBEⅡa和SBEⅡb基因序列的多态性分析,探究基因多态性和淀粉质量分数之间的关系,为后期功能标记的开发和辅助育种奠定理论基础。
1 材料与方法
1.1材 料
本试验在对来自国内外200多份小麦品种(系)的淀粉质量分数分析的基础上,选择12份具不同淀粉质量分数的代表性品种(系),材料名称及淀粉质量分数见表1。2013-2014年种植于石河子大学农学院试验站,提取花后15 d的籽粒RNA用于相关基因克隆,成熟籽粒磨粉后用于淀粉质量分数的测定。
大肠杆菌Top10、载体pEASY-T1、凝胶回收试剂盒购自全式金公司,植物总RNA提取试剂盒购自天根公司,PCR试剂、LATaq酶、Quant cDNA第1链合成试剂盒、限制性内切酶及其他工具酶均购自宝生物工程有限公司,引物合成及测序由北京六合华大基因科技股份有限公司完成。
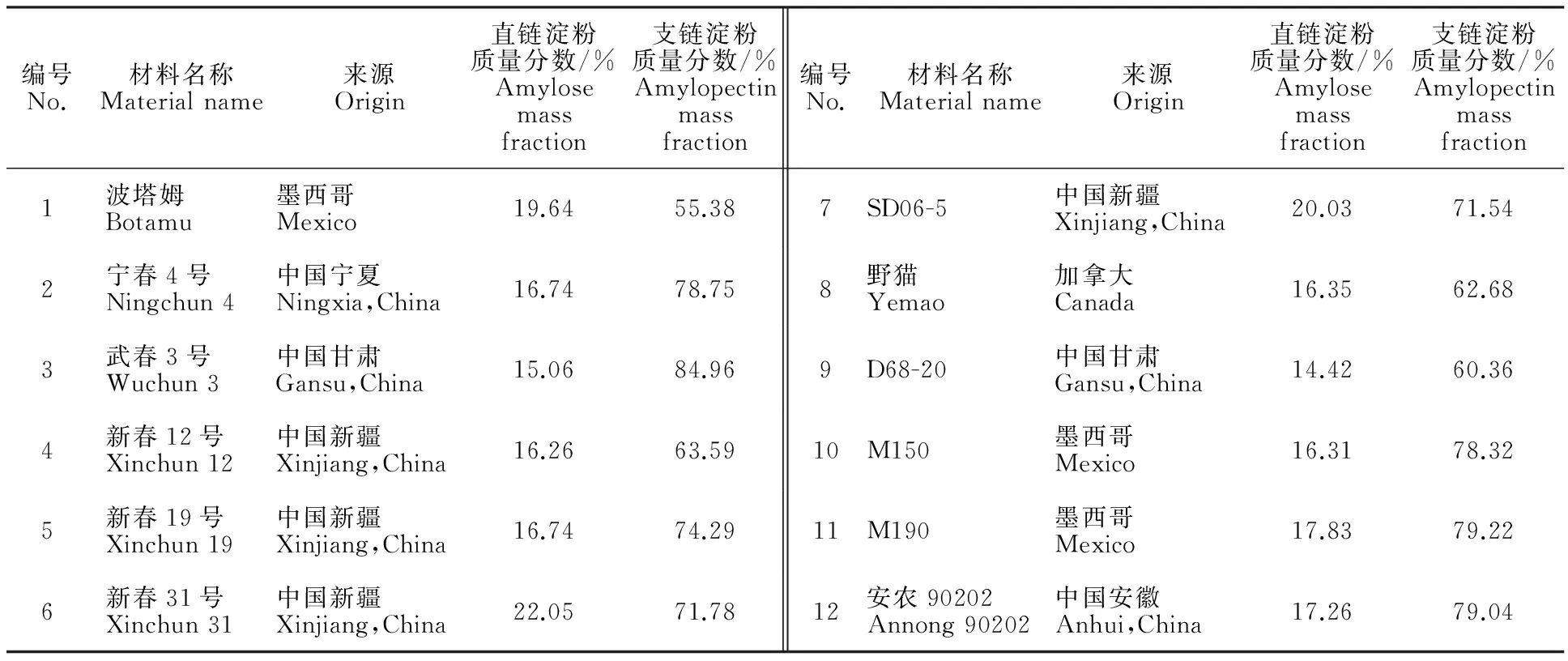
表1 不同小麦品种(系)名称及淀粉质量分数
1.2小麦籽粒总RNA的提取及反转录
取花后15 d籽粒参照RNA提取试剂盒说明书提取总RNA,12 g/L琼脂糖凝胶电泳检测,呈现3条清晰明亮条带的RNA留待备用。紫外分光光度计检测RNA浓度和纯度,对于质量好的则用于cDNA第1链的合成。cDNA于-20 ℃保存。
1.3目的片段的克隆
NCBI核苷酸数据库搜索SSⅡa(AF155217.2)、SBEⅡa(AF286319.1)、SBEⅡb(AY740401.1)的cDNA序列,Primer 5.0设计扩增引物(表2),扩增大小分别为2 842、2 860、2 970 bp,其中SSⅡa采取分段扩增方法。
PCR反应体系(10 μL):LATaq酶0.1 μL,BufferⅡ5 μL,dNTP 1.6 μL,cDNA 1 μL,上、下引物各0.5 μL,ddH2O 1.3 μL。
PCR反应条件为:94 ℃预变性3 min,94 ℃变性30 s,58 ℃(57 ℃/59 ℃)退火30 s,72 ℃延伸2 min、35个循环,最后72 ℃延伸10 min。

表2 SSⅡa、 SBEⅡa 和 SBEⅡb基因片段扩增引物
1.4目的片段测序
PCR产物经10 g/L琼脂糖凝胶电泳检测后,将正确的条带用凝胶回收试剂盒回收目的片段,回收片段与pEASY-T1载体连接、转化,提取质粒,送北京六合华大基因科技股份有限公司测序。对每个品种的每个基因测定4次克隆,对克隆结果进行比对分析。
1.5核苷酸多态性分析
测序结果完成以后,由DNAMAN软件拼接,Clustal X2软件进行比对,经BioEdit软件和MEGA 5.1处理后,由PAUP软件建树,建立各品种(系)的亲缘进化关系。用软件DnaSP 5.0研究核酸多态性和中性突变,核苷酸多样性用参数θw和π表示; Tajima’s D表示中性突变,正值表示高频多态性,负值表示低频多态性,如果分离位点数目和核苷酸多样性的值有偏差,则认为不遵循中性模型。
1.6直、支链淀粉质量分数的测定
成熟小麦籽粒的直、支链淀粉质量分数采用金玉红等[18]双波长法进行测定。
2 结果分析
2.1SSⅡa、SBEⅡa和SBEⅡb基因序列结构分析
NCBI查找小麦SSⅡa基因DNA序列全长7 252 bp,包含7个内含子和8个外显子及5′端和3′端非编码区,从247 bp开始为cDNA编码,到6 898 bp位点编码终止,编码799 aa;SBEⅡb基因全长14 896 bp,包含16个外显子和15个内含子及两端非编码序列,从1 371 bp开始编码,到11 175 bp位点终止,编码基因全长2 511 bp,编码836 aa;SBEⅡa基因DNA序列全长10 219 bp,包含22个外显子和21个内含子及两端非编码区,从78 bp开始至9 970 bp终止编码,共编码cDNA长度2 472 bp,编码823 aa(图1)。

图中箭头位置表示本试验引物开始位置。 The arrows indicate the positions of the primers used in this experiment.
2.2SSⅡa、SBEⅡa和SBEⅡb基因序列多态性分析
将验证正确的重组质粒进行测序,测序结果经DNAMAN软件拼接。NCBI/Blast(http://www.ncbi.nlm.nih.gov/blast/)核苷酸同源比对结果表明,SSⅡa、SBEⅡb和SBEⅡa与GenBank中已登记的序列同源性分别高达98.19%、99.04%和98.64%。3个基因的多态性分析结果见表3。
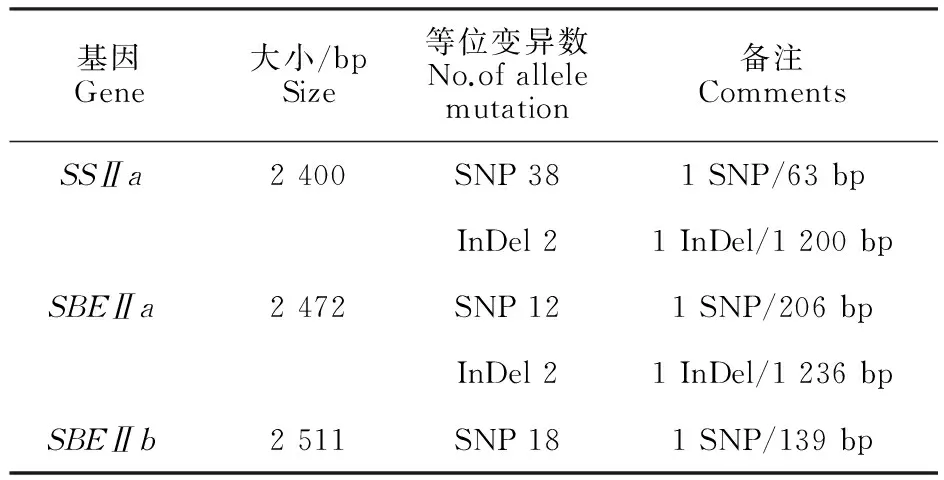
表3 基因序列多态性分布
对SSⅡa基因多态性分析表明,整个编码区共有40个碱基位点变化,其中有2个InDel(图2),SNP位点主要发生在第1、第2外显子内,在不同的品种中都有碱基变化,但不同位点的变化材料不同。在第2外显子区共有29个SNP位点,在所有的单核苷酸变异中,有24个为碱基的转换,其他为颠换,其中20个为非同义突变,造成了氨基酸变异。在对SBEⅡa的核苷酸多态性分析中,共有12个SNP位点和2个InDel,主要发生在第3、第15和第18外显子区,在‘新春19号’和‘M150’的第45~53 bp和第213~215 bp处分别由9 bp和3 bp碱基缺失,这些SNP位点中有8个位点造成氨基酸序列变异,其他均为同义突变。对SBEⅡb核苷酸多态性分析表明,在发现的18个SNP位点主要集中在第3外显子区,其中共有12个非同义突变位点,如第1 986位点(A→G)使天冬酰胺转变为天冬氨酸,第2 173位点(A→G)使谷氨酰胺转变为精氨酸,这些非同义变异位点也可能是影响淀粉合成的原因之一。
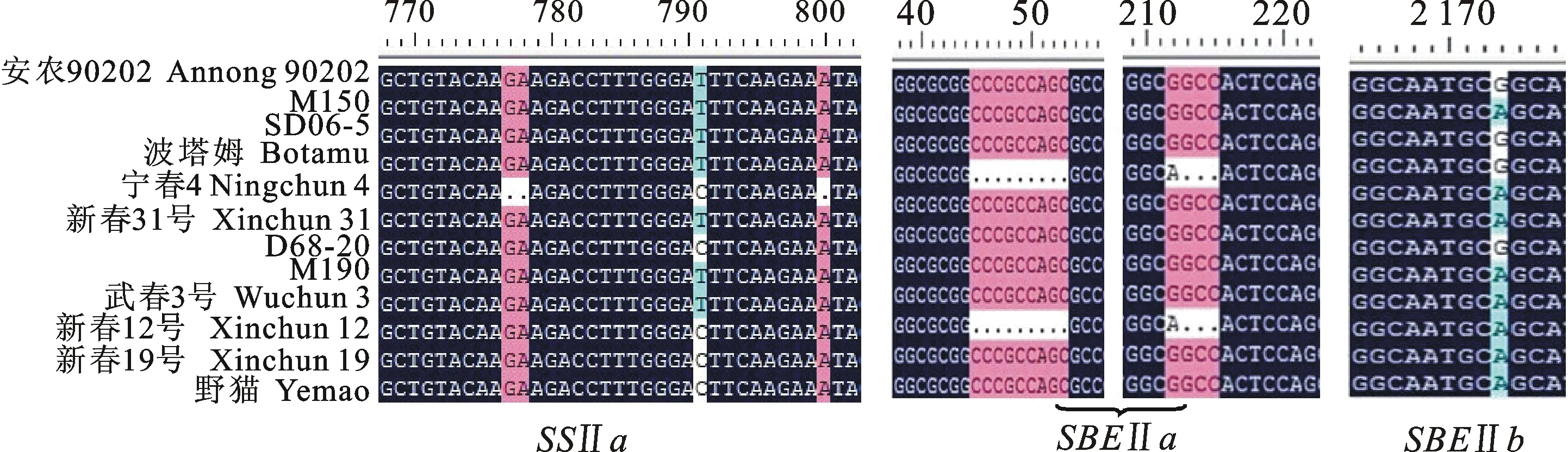
图2 SSⅡa、 SBEⅡa和 SBEⅡb基因部分序列比对结果
2.3SSⅡa、SBEⅡa和SBEⅡb编码区核苷酸多态性分析
用Dnasp 5.0软件(http://www.ub.edu/dnasp/)分析这3个基因的单核苷酸多态性。本研究中π值为0.016 37~0.018 84,平均为0.017 78;Watterson’sθw值为0.016 68到0.025 23,平均值为0.020 27(表4)。上述结果表明所检测的基因具有高度的核苷酸多样性。表4还反映出各个基因的核苷酸多样性变化不同,其中SBEⅡa的π值最大,为0.018 84,而SBEⅡb的π值最小,为0.016 37,且π值在非同义部分变化范围较大。3个基因的单倍型数相同,SSⅡa、SBEⅡa和SBEⅡb均为3种,但是单倍型多样性不一致,变化范围为0.53~0.87。单倍型多样性最高的为SBEⅡb基因(0.87),最低的为SSⅡa基因(0.53)。同义突变多样性(πsyn为0.001 68)低于非同义突变多样性(πnonsyn为0.008 08)。
为了检测这3个淀粉合成相关酶基因在进化过程中是否受到自然选择的作用,是否与标准进化的选择中性理论有偏差。本试验采取6种不同的方法对目的基因进行分析(表4)。利用Dnasp 5.0软件分析Tajima’s D,Fu and Li’s F*和Fu and Li’s D*。通过中性检测发现,只有SSⅡa基因的Tajima’s D为正值,其余2个基因全为负值。
2.4基因序列单倍型分析
为了探究供试的12个不同小麦品种(系)SSⅡa、SBEⅡa和SBEⅡb的进化关系,利用建树工具采用临近结合树法(Neighbor-joining tree)对材料做单倍型分析(图3)。在12个供试材料中,每个基因包含的单倍型数相同,各单倍型中所包含的材料数不尽相同,每种单倍型所包含材料的淀粉质量分数也有所差异。
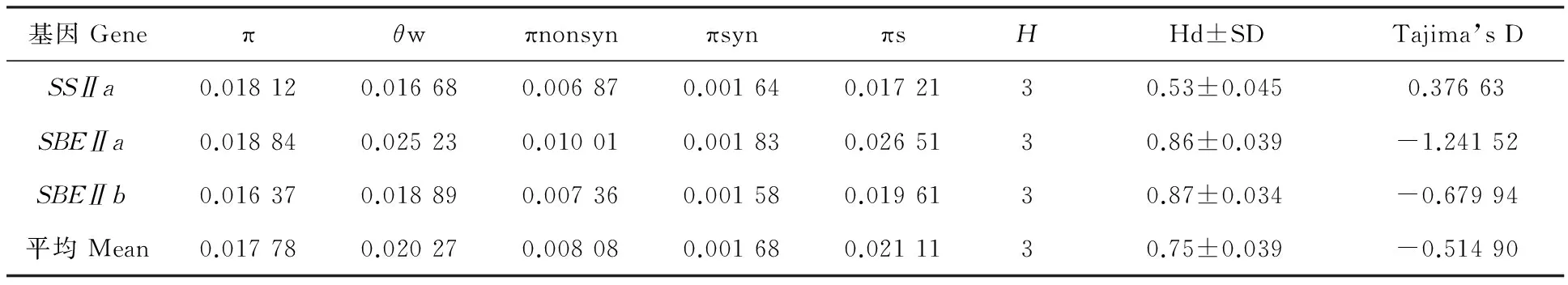
表4 小麦3个淀粉合成关键酶基因的核苷酸多样性的评价
注:π和θw为总核苷酸多样性;πnonsyn为非同义突变多样性;πsyn为同义突变多样性;πs为沉默位点多样性;H为单倍体型数;Hd为单倍型多样性;SD为标准差。
Note:π andθw mean nucleotide diversity; πnonsyn ,πsyn and πs mean nucleotide diversity of non-synonymous,synonymous and silent sites,respectively;H mean number of haplolypes; Hd mean haplotype diversity; SD mean standard deviation.
SSⅡa被分为3种单倍型,第1种单倍型(Ⅰ)包括3个品种(系),分别为‘M150’、‘武春3号’和‘安农90202’,这3个品种均为支链淀粉较高的品种(系),同时直链淀粉属于中等偏低类型;第2种单倍型(Ⅱ)包括‘新春12号’‘新春19号’‘宁春4号’‘D68-20’和‘野猫’5个品种(系),与其他2种单倍型距离明显较远,该类型直链淀粉质量分数均较低;单倍型(Ⅲ)中包括4个品种(系):‘M190’‘SD06-5’‘波塔姆’和‘新春31号’,除了‘波塔姆’支链淀粉质量分数较低外,其他3个品种(系)支链淀粉质量分数均较高。SBEⅡa也包含3种单倍型,单倍型(Ⅰ)又分为3种亚单倍型,在亚单倍型Ⅰ1中,‘新春19号’‘M150’‘M190’和‘安农90202’聚在一起,且这4个品种(系)的支链淀粉质量分数均较高;亚单倍型Ⅰ2中,‘新春12号’‘野猫’和‘D68-20’则相对较近,也都是支链淀粉质量分数较低的品种(系)类型,同时它们的直链淀粉质量分数也都属于偏低类型。这2种亚单倍型品种在分类中被分在同一个单倍型中。第2种单倍型(Ⅱ)中,‘宁春4号’和‘SD06-5’为支链淀粉质量分数较高的品种。SBEⅡb被分为3种单倍型,其中第1种单倍型又分为两种亚单倍型。包含在亚单倍型Ⅰ1中的有‘波塔姆’‘安农90202’‘新春31号’和‘SD06-5’,除了‘波塔姆’以外,其他3个品种的支链淀粉质量分数均较高,它们共同形成一簇;而在亚单倍型Ⅰ2中5个材料均是直链淀粉质量分数较低的类型,它们也被分在同一簇中;单倍型Ⅱ中,‘武春3号’和‘M150’为高支链淀粉质量分数品种。从单倍型分析结果来看,单倍型与淀粉质量分数之间存在较好的对应关系,初步推测支链淀粉质量分数相近的材料可能有相似的单核苷酸序列变异。
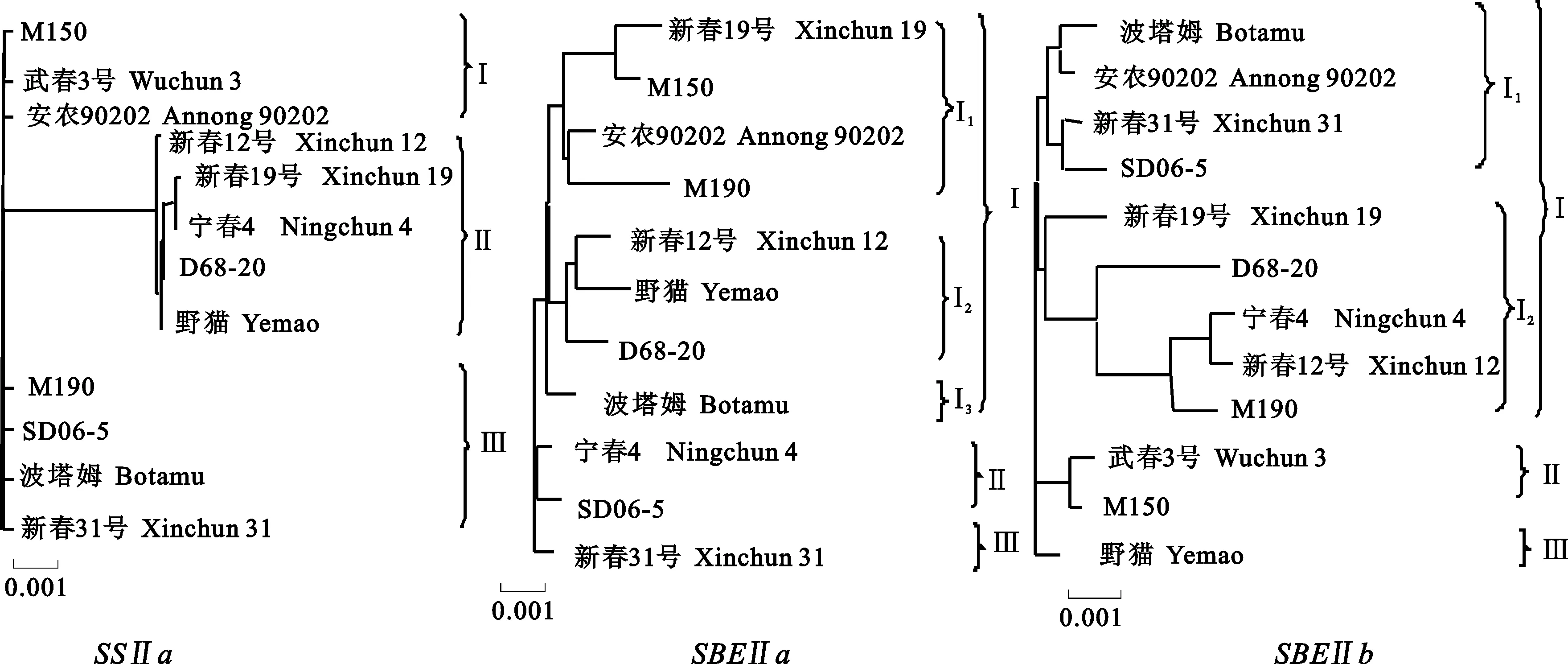
图3 不同品种淀粉合成关键酶基因单倍型关系结构树
3 讨 论
单核苷酸多态性是单个核苷酸变异引起的,是所有遗传变异中最为常见的一种。在玉米基因组中每 57 bp约有1个SNP[19],大豆基因组中每 272 bp约有1个SNP[20],人类基因组中每1 000 bp约有1个SNP[21]。目前,SNP检测大多是基于DNA序列的整个基因序列的检测,然而EST序列是在生物基因组中表达并体现功能的序列,常常编码功能基因,因此,在EST中筛选SNP可能更具有意义。最近很多研究结果通过ESTs序列数据分析发现基因相关的SNPs。Josuseche等[22]对玉米的EST序列进行分析,并成功地从68 000条EST序列中发现2 439个候选的SNPs位点以及822个插入/缺失多态性位点。Picoult-Newberg等[23]曾在来自19个不地区人的cDNA文库的EST序列中完成了850个候选SNP位点的发掘。Fahrenkrug 等[24]将自建猪的cDNA文库中EST 序列和GenBank中非冗余数据库确定SNPs位点进行比对分析,在403个扩增中发现了1 650候选SNPs位点。因此,对基因表达序列分析也是发现SNP的有效手段。
本试验结果表明,SSⅡa基因ORF序列SNP频率约为1/60 bp,主要发生在第2外显子区域,推测此区域的高度变异可能改变SS酶的活性,影响了淀粉合成。本试验中SSⅡa基因编码区的SNP频率要高于其他研究成果[25],如水稻1SNP/232bp、大豆1SNP/272 bp等。在27~810 bp 出现一个热点突变区,这也可能是由于供试材料数目较少所造成。Ponomarenko等[26]的研究表明,自然选择很可能是植物中SNP大量出现的原因,如果这些SNP位点发生在编码域且在自然选择的作用下而得到保留时,就可能会推进生物的进化。在本研究中,SSⅡa基因的20个非同义突变中,大部分位于第2外显子区域,如第380位点(T→C)的转变,不仅造成氨基酸的变异,更引起超家族特征基序的出现(如第216和226位点的变异导致出现酪蛋白激酶Ⅱ磷酸化位点),改变了氨基酸序列的理化性质(如等电点、亲疏水性等);在SBEⅡb中,第1 986位点(A→G)转变位于第16外显子区域,使天冬酰胺转变为天冬氨酸,导致氨基酸生化性质的改变。同样的,在SBEⅡa中也存在着相似位点。这些突变位点很可能是影响支链淀粉质量分数变化的原因之一。然而,由于小麦淀粉的合成是由多基因控制的复杂性状,这些位点的改变可能会影响淀粉的合成,但这些突变位点对淀粉合成的影响有待于进一步验证。
多样性指数π表示每个核苷酸在基因序列中被随即替换的可能性,主要是用来反映一个基因的遗传变异程度,对这3个基因编码区核苷酸多样性分析结果表明,SSⅡa、SBEⅡa和SBEⅡb的π值分别为0.018 12、0.018 84和0.016 37,这与已报道的玉米、大刍草均有所不同[27-28],这也说明π的变异可能与植物种类有关。π值可以表明基因区段所承受的选择压力大小,SBEⅡa基因的π值最大,说明该基因所承受的选择压力最小。在这3个基因的中性检测结果中,Tajima’s D值都没有表现出显著性,说明这3个基因在自然选择中均遵循中性理论。单倍型多样性指从样本中随即抽取2个不同单倍型的概率,单倍型多样性高说明遗传多样性高,遗传资源丰富。在单倍型分析中,这3个基因分为不同的单倍型,但不同的单倍型与支链淀粉质量分数之间有一定的对应关系,支链淀粉质量分数较高品种(系)往往被分在同一簇中,低支链淀粉质量分数品种(系)也被分在同一类,说明支链淀粉质量分数相近的材料有相似的单核苷酸序列变异。但是,其中也存在一些特殊的材料,如在SSⅡa的第3种单倍型中,‘波塔姆’的支链淀粉质量分数较低,却被分在高支链淀粉质量分数品种形成的簇中,其中的原因需要做进一步研究。
在本研究中,同样也存在着大量的同义SNP(sSNP),虽然不会造成氨基酸的变异,但是仍然有着重要的作用。有研究表明,sSNP会影响外显子的剪切,如果sSNP发生在某个外显子剪切增强子(ESEs)内,就会影响mRNA的剪切过程,因此,对本研究中出现的sSNP还需要进一步研究。
4 结 论
研究结果表明,在SSⅡa基因编码序列中共发现38个SNP和2个InDel,其中有20个非同义SNP;SBEⅡa中发现12个SNP和2个InDel,有8个非同义SNP位点;SBEⅡb中共发现18个SNP,有12个非同义SNP位点。单倍型分析结果表明,不同的单倍型与淀粉质量分数之间有一定的对应关系,且与支链淀粉质量分数的对应关系较好,支链淀粉质量分数相近的材料可能有相似的单核苷酸序列变异。
Reference:
[1]RAHAMN S.Genetic manipulation of starch properties in wheat[J].ChemistryinAustralia,1994,69(9):517-518.
[2]NAKAMURA Y.Towards a better understanding of the metabolic system for amylopectin biosynthesis in plants:rice endosperm as a model tissue[J].PlantandCellPhysiology,2002,43(7):718-725.
[3]HURKMAN W J,MCCUE K F,ALTENBACH S B,etal.Effect of temperature on expression of genes encoding enzymes for starch biosyntheses in developing wheat endosperm[J].PlantScience,2003,164(5):873-881.
[4]刘广田.小麦品质改良的目标与方法[M].北京:中国农业大学出版社,2003:76.
LIU G T.Genetic Improvement of Wheat Quality Objectives and Methodology[M].Beijing:China Agricultural University Publishers,2003:76(in Chinese).
[5]BALL S,GUAN H P,JAMES M,etal.From glycogen to amylopectin:a model for the biogenesis of the starch granule[J].Cell,1996,86(3):349-352.
[6]COMMURI P D,KEELING P L.Chain-length specificities of maize starch synthaseⅠenzyme:studies of glucan affinity and catalytic properties[J].ThePlantJournal,2001,25(5):475-486.
[7]CRAIG J,LIOYD J R,TOMLINSON K,etal.Mutations in the gene encoding starch synthase Ⅱ profoundly alter amylopectin structure in pea endosperm[J].ThePlantCell,1998,10(3):413-426.
[8]ROLDN I,WATTEBLED F,MERCEDES L M,etal.The phenotype of soluble starch synthase IV defective mutants ofArabidopsisthalianasuggests a novel function of elongation enzymes in the control of starch granule formation[J].ThePlantJournal,2007,49(3):492-504.
[9]EDWARDS A,FULTON D C,HYLTON C M,etal.A combined reduction in activity of starch synthase Ⅱ and Ⅲ of potato has novel effects on the starch of tubers[J].ThePlantJournal,1999,17(3):251-261.
[10]SHANNON J C,PIEN F M,CAO H,etal.Brittle-1,an adenylate translocator,facilitates transfer of extraplastidial synthesized ADP-glucose into amyloplasts of maize endosperms[J].PlantPhysiology,1998,117(4):1235-1252.
[11]YAMAMORI M,FUJITA S,HAYAKAWA K,etal.Genetic elimination of a starch granule protein,SGP-1,of wheat generates an altered starch with apparent high amylase[J].TheoreticalandAppliedGenetics,2000,101(1/2):21-29.
[12]JIANG H W,DIAN W M,LIU F Y,etal.Molecular cloning and expression analysis of three genes encoding starch synthase Ⅱ in rice[J].Planta,2004,218(6):1062-1070.
[13]SATOH H,NISHI A,YAMASHITA K,etal.Starch-branching enzyme Ideficient mutation specifically affects the structure and properties of starch in rice endosperm[J].PlantPhysiology,2003,133(3):1111-1121.
[14]NISHI A,NAKAMURA Y,TANAKA N,etal.Biochemical and genetic analysis of the effects of amylose-extender mutation in rice endosperm[J].PlantPhysiology,2001,127(2):459-472.
[15]BLAUTH S L,KIM K N,KLUCINEC J,etal.Identification of mutator insertional mutants of starch-branching enzyme 1 (sbe1) inZeamaysL[J].PlantMolecularBiology,2002,48(3):287-297.
[16]REGINA A,KOSAR H B,LI Z Y,etal.Multiple isoforms of starch branching enzyme-I in wheat:lack of the major SBE-I isoform does not alter starch phenotype[J].FunctionalPlantBiology,2004,31(6):591-601.
[17]THORNSBERRY J M,GOODMAN M M,DOEBLEY J,etal.Dwarf8polymorphisms associate with variation in flowering time[J].NatureGenetics,2001,28(3):286-289.
[18]金玉红,张开利,张兴春,等.双波长法测定小麦及小麦芽中直链、支链淀粉含量[J].中国粮油学报,2009,24(1):31.
JIN Y H,ZHANG K L,ZHANG X CH,etal.Determination of amylase and amylopection in wheat and wheat malt by dual-wavelength spectrophotometry[J].JournaloftheChineseCerealsandOilsAssociation,2009,24(1):31(in Chinese with English abstract).
[19]GUILLET C C,BIROLLEAU T C,MANICACCI D,etal.Nucleotide diversity of the ZmPox3 maize peroxidase gene:Relationships between a MITE insertion in exon2 and variation in forage maize digestibility[J].BiomedCentralGenetics,2004,5(1):19.
[20]ZHU Y L,SONG Q J,HYTEN D L,etal.Single-nucleotide polymorphisms in soybean[J].Genetics,2003,163(3):1123-1134.
[21]FRAZER K A,BALLINGER D G,COX D R,etal.A second generation human haplotype map of over 3.1 million SNPs[J].Nature,2007,449(7164):851-861.
[22]JOSUSECHE F,GAO G.,HANAFEY M,etal.High-throughput identification,database storage and analysis of SNPs in EST sequences[J].GenomeInformatics,2001,12:194-203.
[23]PICOULT-NEWBERG L,IDEKER T E,POHI M G,etal.Mining SNPs from EST databases[J].GenomeResearch,1999,9(2):167-174.
[24]FAHRENKRUG S C,FREKING B A,SMITH T P L,etal.Single nucleotide polymorphism (SNP) discovery in porcine expressed genes[J].AnimalGenetics,2002,33(3):186-195.
[25]唐立群,肖层林,王伟平.SNP分子标记的研究及其应用进展[J].中国农学通报,2012,28(12):154-158.
TANG L Q,XIAO C L,WANG W P.Research and application progress of SNP markers[J].ChineseAgricultureScienceBulletin,2012,28(12):154-158(in Chinese with English abstract).
[26]PONOMARENKO J V,MERKULOVA T I,VASILIEV G V,etal.rSNP-Guild,a database system for analysis of transcription factor binding to target sequences:application to SNPs and site-directed mutations[J].NucleicAcidsResearch,2001,29(1):312-316.
[27]田孟良,黄玉碧,谭功燮,等.西南糯玉米地方品种waxy基因序列多态性分析[J].作物学报,2008,34(5):729-736.
TIAN M L,HUANG Y B,TAN G X,etal.Sequence polymorphism of waxy genes in landraces ofwaxymaize from southwest China[J].ActaAgronomicaSinica,2008,34(5):729-736(in Chinese with English abstract).
[28]任凤阳.玉米自交系萌发特性的评价及SNP关联分析[D].山东泰安:山东农业大学,2014.
REN F Y.Evaluation of maize inbred lines germination characteristics and SNP association analysis[D].Tai’an Shandong:Shandong Agricultural University,2014(in Chinese with English abstract).
Corresponding authorLI Weihua,female,professor.Research area:quality improvement and molecular mechanism of wheat.E-mail:lwh_agr@shzu.edu.cn
(责任编辑:成敏Responsible editor:CHENG Min)
Correlation Analysis between Expression Sequence Polymorphisms of the Genes Encoding Wheat Starch Synthesis EnzymesSSⅡa,SBEⅡaandSBEⅡb,and Starch Mass Fraction
HAN Junjie,WANG Haolong,LI Yong,CAI Man and LI Weihua
(Agricultural College,Shihezi University,The Key Laboratory of Oasis Eco-agriculture of Xinjiang Corps,Shihezi Xinjiang832003,China)
To explore the correlation between nucleotide sequence polymorphism of the genes encoding wheat starch synthesis related enzymes SS Ⅱ a,SBE Ⅱ a and SBE Ⅱ b,and starch mass fractions,ORF (open reading frame) sequences ofSSⅡa,SBEⅡaandSBEⅡbgenes were cloned from twelve wheat varieties with different starch mass fractions,and Clustal X2 software was further used to analyze cDNA sequences of these genes. Homology analysis on the nucleotide sequences of these genes showed that the cDNA sequences ofSSⅡa,SBEⅡaandSBEⅡbgenes shared 98.19%,98.64%and 99.04% identities to their published sequences,respectively. In this study,there were 40 (SSⅡa),14 (SBEⅡa) and 18 (SBEⅡb) SNPs loci ofSSⅡa,SBEⅡaandSBEⅡbgenes,respectively. Using Dnasp 5.0 bioinformatics software,Tajima’s D of these three genes could be insignificant. Especially,there was a rich region of variation in the second exon ofSSⅡa. These data showed that polymorphism information of theSSⅡa,SBEⅡaandSBEⅡbgenes was rich and there was a certain correspondence between nucleotide polymorphisms and starch mass fractions.
TriticumaestivumL.; Expression sequence; Nucleotide polymorphisms; Starch mass fraction
2015-04-27Returned2015-06-18
National Natural Science Foundation of China (No.31260357).
HAN Junjie,male,master.Research area:genetic improvement of wheat quality.E-mail: hanjunjie1208@sina.com
2015-04-27
2015-06-18
国家自然科学基金(31260357)。
韩俊杰,男,硕士,从事小麦品质遗传改良研究。E-mail: hanjunjie1208@sina.com
李卫华,女,教授,博士生导师,主要从事小麦品质改良和分子机理研究。E-mail:lwh_agr@shzu.edu.cn
S330
A
1004-1389(2016)08-1150-08
网络出版日期:2016-07-14
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160714.1103.012.html
