河南地区一株鸡源H9N2亚型禽流感病毒的分离鉴定及HA基因变异分析
2016-09-12王丽荣董永军杭柏林刘兴友王三虎胡建和
王丽荣,董永军,杭柏林,刘兴友,王三虎,胡建和
(1.河南科技学院 动物科学学院,河南新乡 453003;2.河南科技学院抗体工程重点实验室,河南新乡 453003;3.新乡学院,河南新乡 453003)
河南地区一株鸡源H9N2亚型禽流感病毒的分离鉴定及HA基因变异分析
王丽荣1,2,董永军1,2,杭柏林1,刘兴友3,王三虎1,胡建和1
(1.河南科技学院 动物科学学院,河南新乡453003;2.河南科技学院抗体工程重点实验室,河南新乡453003;3.新乡学院,河南新乡453003)
由发病蛋鸡体内分离得到一株禽流感病毒,经PCR、血凝试验和免疫荧光鉴定为H9N2亚型,命名为A/Chicken /henanxy/2010(H9N2),病毒对SPF鸡无致病性,对其HA基因进行克隆测序,HA基因氨基酸裂解位点为PSRSSRGLF,符合低致病性禽流感的分类标准;并将HA基因和自GenBank读取的H9N2病毒的HA基因序列比较,表明河南分离株属于欧亚分支中的Y280-like分支,与A/Chicken /shandongHL/2010(H9N2)氨基酸同源性94.8%,可能是Y280-like个别核苷酸突变的一株。
H9N2亚型禽流感病毒;分离鉴定;HA基因;序列分析
A型流感病毒(Avian Influenza virus AIV)属于正粘病毒科,基因组为分节段的负链RNA,具有传染性强、易发生抗原变异、传播迅速、宿主范围广泛的特点,并有禽流感病毒感染人的病例报道[1-2]。市场开放、流通频繁等因素为禽流感的流行创造便利条件。禽流感病毒感染后,导致鸡只突然发病,或没有特征症状而引起产蛋下降,导致育雏及育成鸡新城疫等疫苗免疫失败。H9N2亚型禽流感病毒(H9N2 AIV)属于低致病性禽流感病毒,是目前中国禽类中流行的主要亚型。H9N2 AIV变异较快,不同毒株间可发生基因重组,不仅严重危害养禽业,而且对人类健康造成巨大的威胁,郭元吉等[1]从人体内分离到该病毒,2003年12月香港人感染H9N2 AIV[2]。虽然H9N2 AIV迄今尚未引起人类死亡,但H9N2 AIV比H5N1 AIV更容易跨越物种屏障,在人群中易于传播,还可能经过多次跨种传播,发生重配或突变,产生对人致病力更强的病毒,给公共健康带来严重威胁[3-4];因此,高度关注该亚型病毒的变异,分析其遗传演化关系,从分子水平研究H9N2流行毒株的基因来源,进一步探索H9N2亚型禽流感的流行趋势,为监控H9N2流行、变异提供资料。
流感病毒HA基因的变异性很强,是导致抗原变异的主要原因,最能反映流感病毒的变异程度[5-7]。因此,加强H9N2 AIVHA基因遗传演化的监测,了解H9N2 AIV流行趋势的变化规律,为更好地防治禽流感提供参考。本研究自河南某鸡场发病鸡体内分离得到病毒,鉴定为H9N2 AIV,并对其HA基因进行序列分析,为河南地区乃至全国H9N2 AIV抗原变化积累数据,丰富中国流感病毒的分子流行病学资料,为河南地区流感的防制、H9N2的分子特点及遗传变异研究提供参考。
1 材料与方法
1.1试验动物
白来航SPF鸡由SPF鸡胚(购自北京梅里亚维通实验动物技术有限公司)人工孵化出雏,孵化温度为37.8 ℃,孵化相对湿度为60%。
1.2病料样品
2010年河南地区某蛋鸡场海兰蛋鸡发生疑是H9N2疫情,患病蛋鸡主要表现产蛋率明显下降,蛋壳质量变差,伴有轻微呼吸道症状,发病持续时间较长,病鸡剖检可见腺胃肿胀,质地较硬,乳头凹凸不平,严重的气囊炎,气管出血,有粘液,支气管栓塞,有白色干酪样物质,肺脏出血等。调查中显示,在同地区其他鸡场也发生同样症状的疾病。本研究采集发病蛋鸡的气管、肺脏、脾脏等病料。
1.3抗原和抗体
H9N2和H5N1亚型禽流感病毒标准抗原及血清由中国农业科学院哈尔滨兽医研究所提供。鼠抗流感病毒NP蛋白的单抗、FITC-羊抗鼠IgG抗体均由中国农业科学院上海兽医研究所提供。
1.4主要试剂
RNA提取试剂盒MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0、RT-PCR试剂盒PrimeScriptTMRT-PCR Kit、TaKaRa ExTaqTM、DL2000 Marker均购自TaKaRa公司。GoldView核酸染料购自赛百盛。
1.5鸡胚成纤维细胞(CEF细胞)的制备
参照文献[8]的方法制备CEF细胞。
1.6病毒的分离
将无菌采集的病料剪碎、研磨,加入含双抗的PBS液,冻融2~3次,4 ℃、10 000 r/min离心10 min,取上清液进行过滤,滤液接种5枚10日龄SPF鸡胚,每枚0.2 mL。弃去24 h内死亡鸡胚,收集24~72 h死亡和未死亡鸡胚尿囊液分装,保存,备用。
1.7分离病毒的浓缩
取上述鸡胚尿囊液原液作1∶10稀释,接种SPF鸡胚,37 ℃孵化48~72 h,置4 ℃ 12 h后收获鸡胚尿囊液。取鸡胚尿囊液低速离心,取上清超速离心(40 000 r/min离心4 h),弃上清,沉淀用1 mL 灭菌PBS液悬浮后保存,备用。
1.8病毒血凝活性的测定
参照文献[9]的方法进行分离病毒的血凝活性测定。
1.9分离毒株的RT-PCR鉴定
用Trizol试剂提取分离病毒RNA,用M-MLV 反转录酶和随机引物进行反转录,以反转录产物为模板,分别利用禽流感病毒、新城疫病毒的特异性引物(表1)进行PCR扩增。PCR条件:94 ℃ 4 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。PCR产物用10 g/L 琼脂糖凝胶电泳检测。
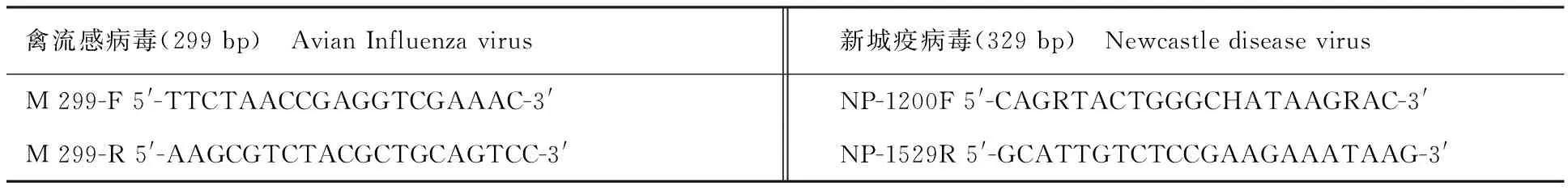
表1 分离毒株PCR鉴定的引物
1.10间接免疫荧光鉴定(IFA)病毒
待CEF细胞长成单层后,待检病毒10倍稀释,每孔加100 μL病毒稀释液感染细胞,同时设未感染阴性对照孔。24 h后,弃上清,细胞用φ=4%的多聚甲醛固定,经PBST洗涤3次,加入500倍稀释的鼠抗流感病毒NP蛋白的单抗,37 ℃孵育1 h,PBST洗涤3次,加入FITC-羊抗鼠IgG抗体,继续37 ℃孵育1 h,PBST洗涤3次,最后在荧光下显微镜观察。
1.11病毒的亚型鉴定
HA亚型鉴定参照文献[9-12]的方法进行。
NA亚型鉴定,通过PCR方法鉴定分离毒的NA亚型。引物N2NA-Fll21: 5′-CGCTACGGT-
TATGAGACTTTCAG-3′,N2NA-R1401:5′-ATATTCGCCCCATCAGGCCATGAG-3′,扩增产物为280 bp。PCR反应程序:94 ℃ 5 min;94 ℃ 1 min,54 ℃ 45 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。反应产物用10 g/L琼脂糖凝胶电泳检测。
1.12病毒EID50的测定
分离毒株第3代鸡胚尿囊液做10-5、10-6、10-7、10-8、10-9、10-10倍稀释,分别接种10日龄SPF鸡胚,每枚0.1 mL,每一稀释度接种5枚,37 ℃培养,弃去24 h死亡鸡胚,观察记录鸡胚死亡情况,于接种后72 h 4 ℃过夜冻死鸡胚,收获鸡胚尿囊液,测定其血凝价,血凝价≥1∶64判定为有病毒感染。按Reed-Muench方法计算其鸡胚半数感染量(EID50)。
1.13动物感染试验
取26只4周龄SPF鸡分成2组,将尿囊液用灭菌PBS稀释10倍,0.2 mL经静脉接种13只SPF鸡,另外13只接种PBS作为空白对照,感染后4 d,各剖杀3只,分别采集气管、肺脏、脾脏,进行病毒滴定,其余连续观察10 d,记录发病死亡情况。
1.14HA基因序列测定及进化分析
参照文献[4,12-14]的方法进行HA基因的扩增,将扩增产物转化大肠杆菌感受态细胞,送北京英俊公司测序。利用DNA STAR分析软件进行序列拼接,获得基因序列。并与NCBI上的禽流感病毒H9N2 AIVHA基因进行同源性比对,分析河南分离株HA基因的变异规律。
2 结果与分析
2.1病毒的分离及血凝活性测定
将河南地区发病蛋鸡的气管、肺脏和脾脏捣碎后,接种5枚10日龄SPF鸡胚,鸡胚在72 h内均未死亡,其中1枚鸡胚的尿囊液具有血凝活性,血凝效价为211,其余鸡胚尿囊液无血凝活性。
2.2RT-PCR鉴定
用M-MLV反转录酶和随机引物进行反转录,以反转录产物为模板,用AIV的M基因特异引物和NDV的NP基因特异性引物进行PCR扩增,琼脂糖凝胶电泳结果表明,用M基因特异引物可扩增出特异的条带,产物为300 bp左右(图1),与预期大小一致。表明分离的病毒为禽流感病毒。
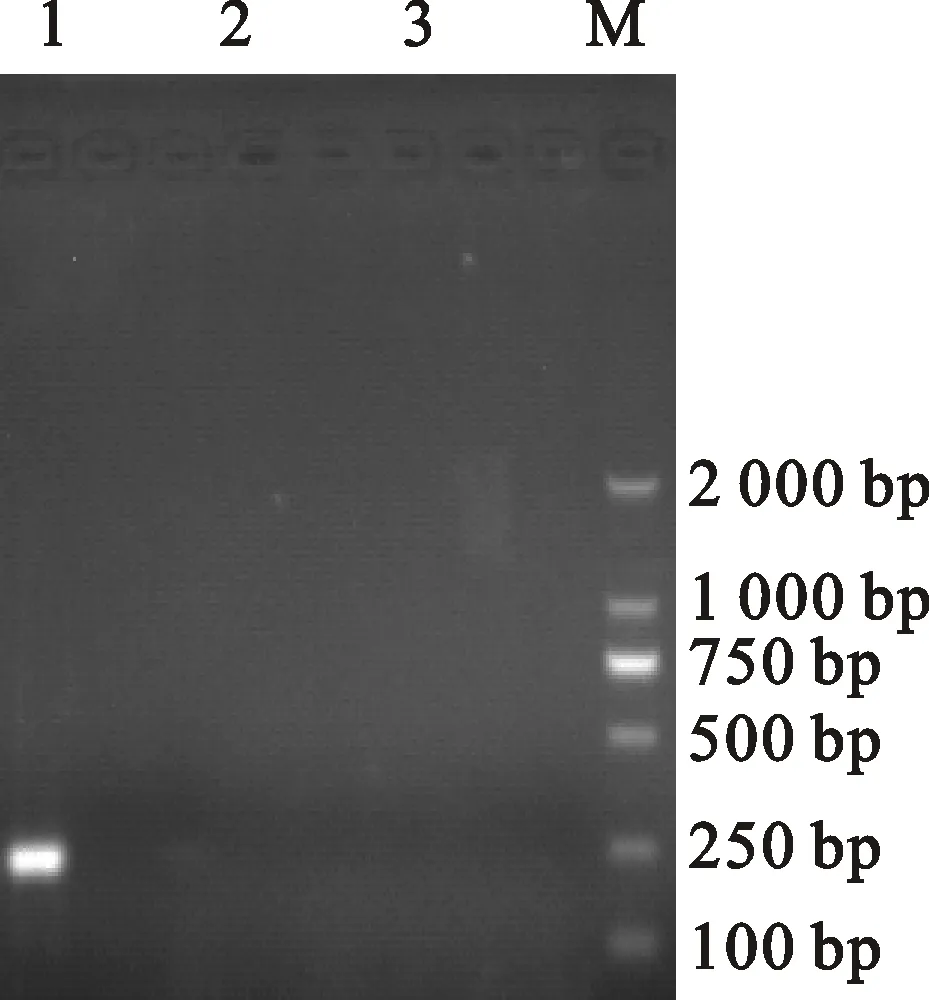
1.分离毒株Isolate;2新城疫病毒Newcastle disease virus;3.空白对照Negative control; M.Marker DL2000
图1分离毒株M基因PCR产物
Fig.1PCR products ofMgene for the isolate
2.3单克隆抗体的间接免疫荧光鉴定
待检病毒感染CEF细胞后,用鼠抗流感病毒NP蛋白的单抗进行间接免疫荧光试验,结果显示,待检病毒感染细胞呈现特异绿色荧光信号,而对照细胞没有特异的荧光信号。表明待检病毒是禽流感病毒(图2)。
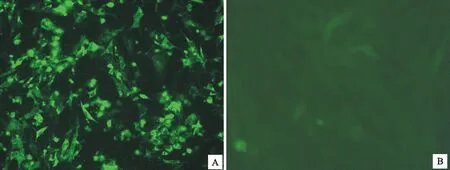
A.待检病毒 Quarantine virus; B.对照 Control
2.4病毒HA和NA亚型的鉴定
从表2可以看出,待检病毒的血凝活性可被H9N2亚型血清特异性抑制,而不受H5N1亚型禽流感病毒血清的影响。由图3可知,用H9N2的NA基因特异引物能扩增出300 bp左右预期片段。表明分离病毒为H9N2亚型AIV。
2.5病毒EID50
由表3可看出,鸡胚接种分离毒株,72 h内随着稀释倍数的降低,具有血凝活性的鸡胚数也随之下降,病毒稀释至10-9时,接种病毒鸡胚不再有血凝活性。按照Reed-Muench方法计算出分离病毒的EID50为10-10/μL。
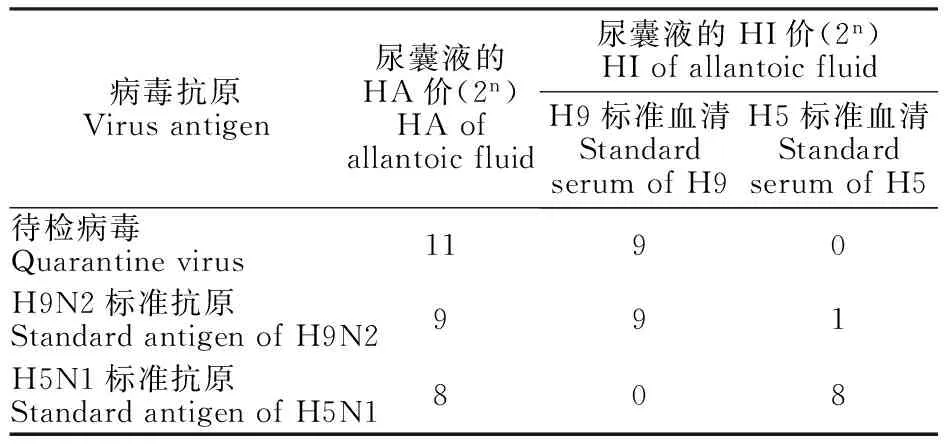
表2 血凝与血凝抑制结果
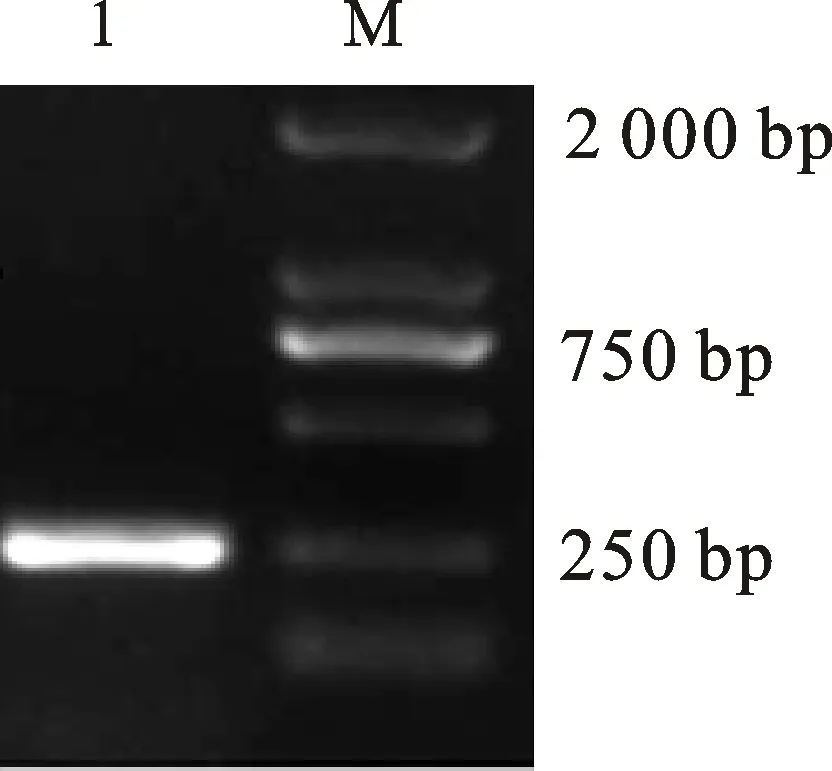
M. Marker DL2000;1.分离毒株 Isolate
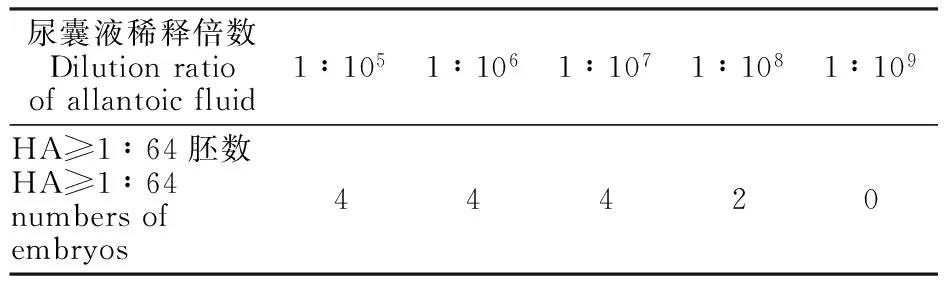
尿囊液稀释倍数Dilutionratioofallantoicfluid1∶1051∶1061∶1071∶1081∶109HA≥1∶64胚数HA≥1∶64numbersofembryos44420
注 Note:EID50=10-10/μL
2.6SPF鸡感染试验
静脉接种10倍稀释鸡胚第3代尿囊液0.2 mL,13只SPF鸡均未表现出明显的临床症状,感染后4 d,剖杀3只,采集各实质脏器进行病毒滴定,病毒主要集中在肺、气管和脾脏,其他器官未检测到病毒(表4)。

表4 接毒后SPF鸡感染结果
2.7HA基因的克隆
分离毒株经PCR扩增后,得到1条1 742 bp 的特异条带(图4),其大小与预期的结果基本一致,将该基因克隆到载体中,进行测序。
2.8分离毒株HA基因片段克隆和序列测定
将扩增产物与pMD18-T载体连接,PCR鉴定获得RT-PCR产物的阳性重组质粒,即pMD18-T/HA,对阳性重组质粒中插入的基因片段进行序列测定,结果分离毒株的HA基因片段大小为1 742 bp。
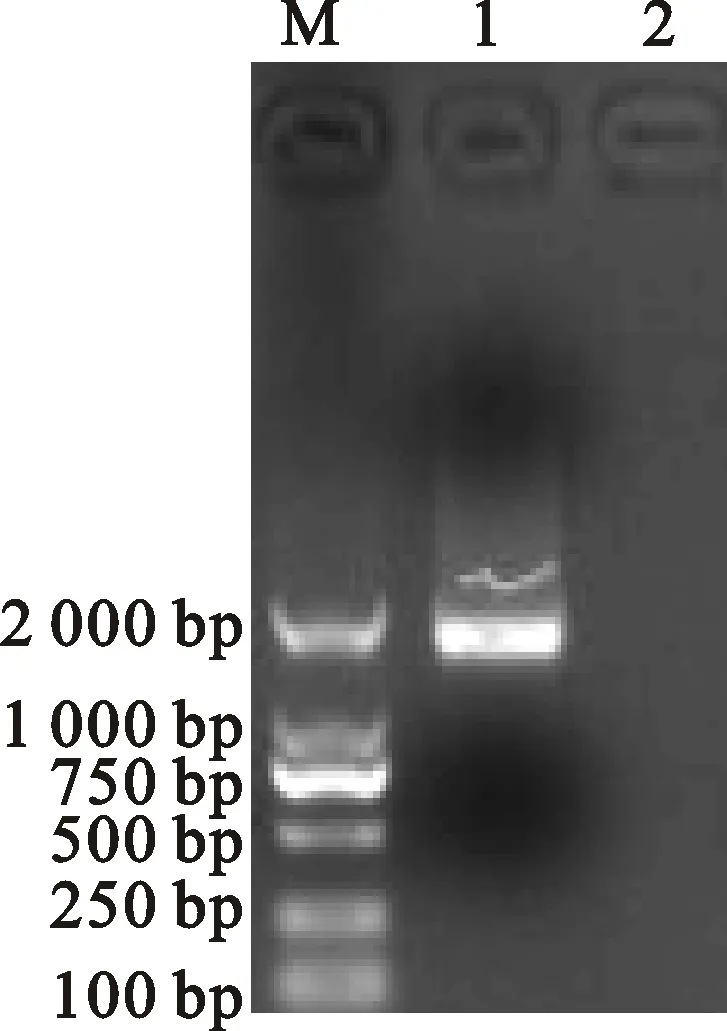
M. Marker DL2000; 1.分离毒株Isolate; 2.空白对照 Negative control
图4AIVH9N2分离毒株HA基因RT-PCR扩增
Fig.4RT-PCR amplification ofHAgene for H9N2 AIV isolate
2.9HA基因的进化树分析
河南分离毒株HA氨基酸裂解位点为 PSRSSRGLF,符合低致病性禽流感的分类标准。从HA基因进化关系可看出,与河南分离毒株(H9N2)HA基因同源性最高的是2010年山东分离毒株,且是同一年份,其2株病毒可能有一定的联系,均来源于Y280分支(图5)。分离毒株HA基因与NCBI上H9N2 AIV的HA氨基酸序列同源性为87.1%~99.3%;且分离毒株与2010年山东分离毒株氨基酸同源性为98.4%(图6)。
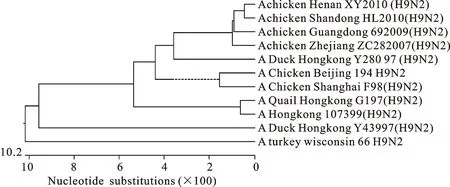
图5 (H9N2)分离株HA基因进化树
核苷酸和氨基酸同源性分析结果表明,该毒株与A/chicken/Shandong/HL/2010(H9N2) 毒株基本属于同一毒株,推测该野毒可能是河南山东地区流行株。
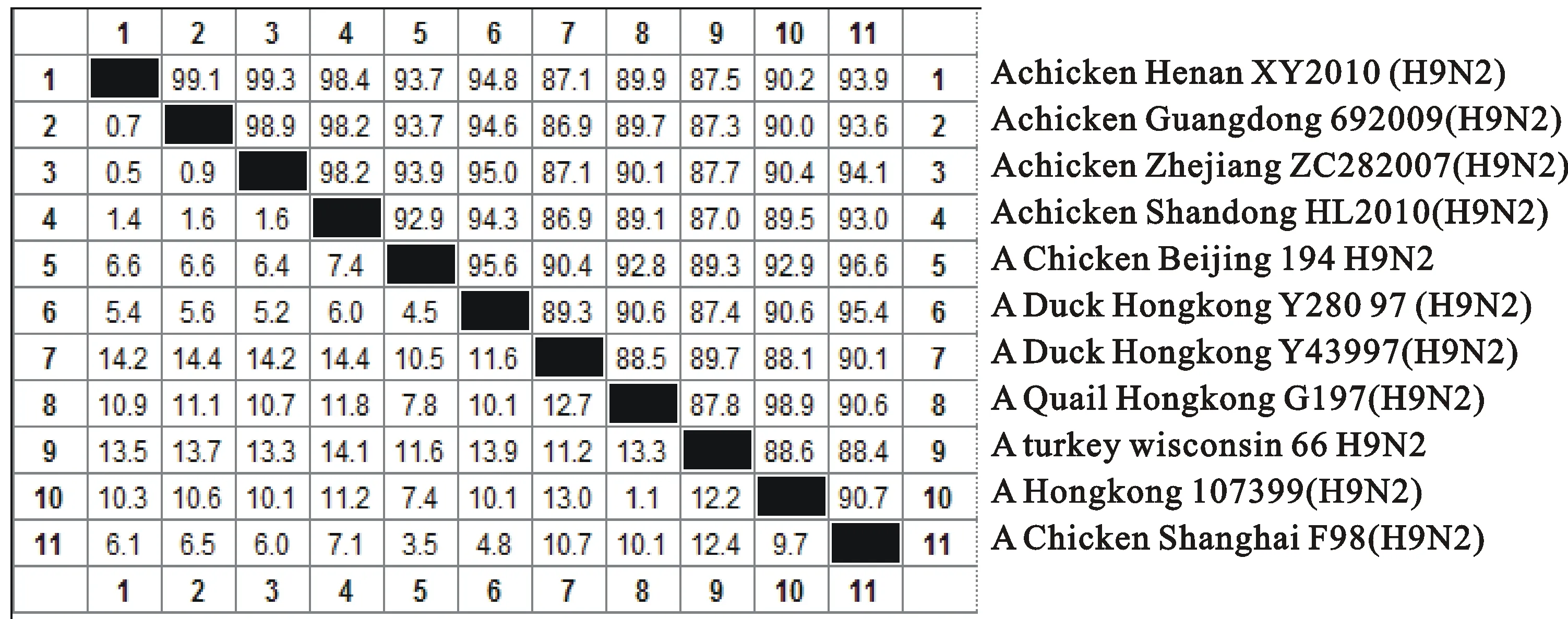
图6 (H9N2)分离株HA基因推导的氨基酸同源性(%)比较
3 讨 论
中国自1994年首次从鸡群中分离到H9N2 亚型禽流感病毒以来,目前H9N2 亚型禽流感在中国多省地区广泛存在,不仅是严重危害中国养禽业的主要疾病之一,而且还危害到人类的健康。过去,人们往往把目光放在如H5、H7等高致病性禽流感上,而对H9等低致病性禽流感未引起足够的重视,但目前种种迹象已表明,H9N2亚型禽流感的发病率和危害性日趋严重,给养禽业和公共健康带来较大的经济损失[15-17]。禽流感病毒的监测有助于了解禽流感病毒在禽类中的生态分布、传播规律及演化进程,为流感的防治提供重要依据。从国内外的流行病学和血清学调查发现,很多鸡场中都存在流感病毒[17-18]。刘金华等[11]在发病鸡体内分离得到多株H9N2亚型AIV;杨其峰等[12]自鸡胚中分离到H9N2 AIV,但从种蛋中分离到H9N2还不能作为H9N2可垂直传播的证据。
流感病毒HA基因变异性很强,是导致病毒抗原变异的主要原因,最能反映流感病毒的变异程度[9],非常有必要监测H9N2亚型禽流感病毒分离株的遗传变异情况。
近年来在河南地区的一些养鸡场相继发生疑是H9N2亚型禽流感病毒为主要症状的疾病,给养鸡业造成巨大经济损失,本研究的样品来自河南地区某蛋鸡场,是在鸡只发病初期采集的发病蛋鸡气管、肺脏等,并送至实验室进行检测。通过SPF鸡胚接种分离得到一株病毒,经鉴定分离毒株是H9N2亚型禽流感病毒。
SPF鸡人工感染未出现典型禽流感症状,但自感染SPF鸡体内分离到该病毒,分析H9N2 AIV对鸡来说是低致病性禽流感病毒,鸡可以携带H9N2病毒而不发病或者没有任何症状。与以前的 H9N2 亚型AIV一样,动物试验都不能复制出与临床一样的症状和病理变化,与SPF鸡体内不能提供HA蛋白裂解的胰蛋白酶有关,而HA能否裂解是AIV毒力的决定性因素,高致病性禽流感能够自身提供HA裂解所需要的酶,而低致病性禽流感需要其他细菌或者病毒提供其HA裂解所需要的胰蛋白酶[13]。Bano等[19]在实验室首先用H9N2病毒感染鸡,随后采用不同途径接种传染性支气管炎病毒、传染性鼻炎细菌或大肠杆菌,或者首先使用化学性免疫抑制剂后再用H9N2病毒攻击,以单独攻击H9N2病毒的鸡作对照,结果表明,继发大肠杆菌感染或处于免疫抑制状态下的试验鸡,对H9N2病毒的攻击均出现很高的死亡率,而单独攻击H9N2病毒的对照鸡没有出现死亡。2009年刘丽琦[14]也报道H9N2分离毒株感染的试验组动物小鼠并未出现明显的临床症状,也没有死亡出现,但也在试验动物肺、气管中分离到病毒。本研究与刘月焕等[15]研究报道3株临床分离毒株H9N2人工感染SPF鸡攻毒鸡全部表现正常,没有出现明显的呼吸困难、拉稀症状,剖检也未见明显的大体病变报道相一致。
目前,大多数流感病毒研究者都认为,H9N2 AIVHA基因存在欧亚大陆和北美大陆2个分支[13-14,17],美洲分支代表株是 A/turkey/Wisconsin/66(H9N2),欧亚分支可以分为3个亚分支:A/Quail/Hong Kong/G1/97(H9N2) 为代表的G1-like分支,以A/Duck/Hong Kong/Y280/97(H9N2)为代表的Y280-like,以A/Duck/Hong Kong/Y439/97(H9N2)为代表的Y439-like分支[13]。2010年河南分离株与以往中国分离的大部分毒株类似,属于欧亚分支中的Y280-like分支,与其相似性94.8%,可能是Y280-like个别核苷酸突变的一株;推测与2010年山东分离株是同一毒株。
当前H9N2亚型禽流感病毒在中国许多地方呈现地方流行性,不同的毒株之间可能发生基因重组,在免疫强度不断加大和生物学适者生存的规律下,促使病毒基因组不断发生变异和重组以适应生存的需要,有可能使病毒抗原位点改变或者裂解位点改变产生超强毒株或者免疫耐受毒株。因此,加强对H9N2亚型禽流感病毒的生物学特性和分子流行病学研究,不仅具有重要的学术意义,而且在养殖效益和公共卫生方面也有重大的现实意义[13,18]。
Reference:
[1]郭元吉,李建国,程小雯.禽H9N2亚型流感病毒能感染人的发现[J].中华实验和临床病毒学杂志,1999(2):5-8.
GUO Y J,LI J G,CHENG X W.Discovery of men infected by avian influenza A(H9N2 ) virus[J].ChineseJournalofExperimentalandClinicalVirology,1992(2):5-8(in Chinese with English abstract).
[2]高彦生.香港发生人的H9N2 禽流感[J].动物科学与动物医学,2004,21(1):26.
GAO Y SH.H9N2 bird flu in Hongkong [J].AnimalScienceandVeterinaryMedicine,2004,21(1):26(in Chinese).
[3]刘娟.H9N2亚型禽流感病毒抗原性及其与HA基因变异的相关性研究[D].山东泰安:山东农业大学,2013.
LIU J.Heterogeneities of antigenicity in relation to the genetic variation ofHAgene in different H9N2 avian influenza viruses[D].Tai’an Shandong:Shandong Agriculture University,2013(in Chinese with English abstract).
[4]张玉霞,袁小远,徐怀英,等.1株产蛋高峰鸡H9N2的分离鉴定及HA基因序列分析[J].西南农业学报,2013,26(6)2065-2069.
ZHANG Y X,YUAN X Y,XU H Y,etal.Isolation,identification and molecular characterization of H9N2 isolate from hen flock at peak of laying[J].SouthwestChinaJournalofAgriculturalSciences,2013,26(6):2065-2069(in Chinese with English abstract).
[5]石火英,孙 蕾,陈素娟,等.H9N2 亚型禽流感病毒复制特性的基因分析[J].畜牧兽医学报,2008,39(2):189-194.
SHI H Y,SUN L,CHEN S J,etal.Analysis of genes affecting the replication property of H9N2 avian influenza a viruses[J].ChineseJournalofAnimalandVeterinarySciences,2008,39(2):189-194(in Chinese with English abstract).
[6]SALOMON R,FRANKS J,GOVORKOVA E A,etal.The polymerase complex genes contribute to the high virulence of the human H5N1 influenza virus isolate A/Vietnam/1203/04 [J].TheJournalofExperimentalMedicine,2006,203(3):689-697.
[7]ZHU Q,YANG H ,CHEN W,etal.A naturally occurring deletion in itsNSgene contributes to the attenuation of an H5N1 swine influenza virus in chickens[J].JournalofVirology,2008,82(1):220-228.
[8]殷震,刘景华.动物病毒学(第二版)[M].北京:科学出版社,1997.
YIN ZH,LIU J H.Animal Virus[M].2nd Edition.Beijing:The Science Publishing Company,1997(in Chinese).
[9]程坚,刘秀梵,彭大新,等.表达H9亚型禽流感病毒血凝素基因的重组鸡痘病毒及其免疫效力[J].微生物学报,2002,42 (4):442-447.
CHENG J,LIU X F,PENG D X,etal.Recombinant fowlpox virus expressingHAfrom subtype H9N2 of avian influenza virus and its protective immunity against homologous challenge in chickens[J].ActaMicrobiologicaSinica,2002,42(4):442-447(in Chinese with English abstract).
[10]董永军,王丽荣,王秋霞,等.鸡源禽流感H9N2亚型河南分离株NS1基因克隆、序列分析及原核表达[J].中国兽医学报,2014,34(9):1481-1519.
DONG Y J,WANG L R,WANG Q X ,etal.Cloning,sequence analysis and prokaryotic expression ofNS1gene of H9N2 influenza virus isolated from Henan[J].ChineseJournalofVeterinaryScience,2014,34(9):1481-1519(in Chinese with English abstract).
[11]刘金华,吴清民,史为民,等.我国与韩国禽流感 H9N2病毒血凝素分子特性的区别[J].畜牧兽医学报,2004,35(1):79-82.
LIU J H,WU Q M,SHI W M,etal.The difference of the hemagglutinin of H9N2 chicken influenza viruses isolated in China and Korea[J].ChineseJournalofAnimalandVeterinarySciences,2004,35(1):79-82(in Chinese with English abstract).
[12]杨其峰,崔治中,巩艳艳.鸡胚中H9N2亚型禽流感病毒的分离鉴定[J].中国家禽,2010,32(6):15-18.
YANG Q F,CUI ZH ZH,GONG Y Y.Isolation and identification of H9N2 subtype avian influenza virus in Chicken embryos[J].ChinaPoultry,2010,32(6):15-18(in Chinese with English abstract).
[13]张坦.禽流感病毒H9N2亚型HF株的分离鉴定及生物学特性研究[D].郑州:河南农业大学,2012.
ZHANG T.Isolation and identification of avian influenza virus H9N2 subtype HF strain the study on its biological characteristics[D].Zhengzhou:Henan Agriculture University,2012(in Chinese with English abstract).
[14]刘丽琦.H9N2禽流感病毒致病性的初步研究及反向遗传系统的构建[D].北京:中国疾病预防控制中心,2009.
LIU L Q.Preliminary study on pathogenesis and reverse genetic system construction of avian H9N2 influenza virus[D].Beijing:China Center for Disease Control and Prevention,2009(in Chinese with English abstract).
[15]刘月焕,姜北宇,潘裕华,等.H9N2亚型禽流感病毒的分离鉴定[C].杭州:中国畜牧兽医学会禽病学会分会第十次学术研讨会论文集,2000:113-115.
LIU Y H,JIANG B Y,PAN Y H,etal.Isolation and identification of H9N2 subtype avian influenza virus[C].Hangzhou:Proceedings of the Tenth Symposium of Poultry Health Branch of Chinese Association of Animal and Veterinary Science ,2000:113-115(in Chinese with English abstract).
[16]LI Z J,JIANG Y P,JIAO P R,etal.TheNS1gene contributs to the virulence of H5N1 avian influenza viruses[J].JournalofVirology,2006,80(22):11115-11123.
[17]董永军,徐银兰,王丽荣,等.H9N2禽流感病毒河南分离株NS基因序列测定及进化生物信息分析[J].西北农业学报,2013,22(10):27-32.
DONG Y J,XU Y L,WANG L R,etal.Sequencing and bioinformatics analysising ofNSgene of H9N2 influenza virus isolated from Henan[J].ActaAgriculturaeBoreali-OccidentalisSinica,2013,22(10):27-32(in Chinese with English abstract).
[18]PUSHKO P,TUMPEY T M,BU F,etal.Influenza virus-like partides comprised of the HA,NA,and M1 proteins of H9N2 influenza virus induce protective immune responses in BALB cmice[J].Vaccine,2005,23(50):5751-5759.
[19]BANO S,NAEEM K,MALTK S A.Evaluation of pathogenic potential of avian influenza virus serotype H9N2 in chickens[J].AvianDiseases,2003,47(3 Suppl):817-822.
(责任编辑:顾玉兰Responsible editor:GU Yulan)
Isolation,Identification and Variation Analysis ofHAGene of Chicken H9N2 Subtype Avian Influenza Viruses in Henan
WANG Lirong1,2,DONG Yongjun1,2,HANG Bolin1,LIU Xingyou3,WANG Sanhu1and HU Jianhe1
(1. College of Animal Science ,Henan Institute of Science and Technology,Xinxiang Henan453003,China;2.Antibody Engineering Laboratory,Henan Institute of Science and Technology,Xinxiang Henan453003,China;3.Xinxiang University,Xinxiang Henan453000,China)
A newly H9N2 isolate,named A/Chicken /henanxy/2010(H9N2),was collected from Hen flock at peak of laying and PCR technique,hemagglutination test and immunofluorescence identified as subtype H9N2. A/Chicken /henanxy/2010(H9N2) was non-pathogenic to SPF chicken. TheHAgene sequence of the strains was determined. The sequence analysis ofHAgene showed that the amino acid sequence in HA cleavage motif was PSRSSRGLF,which indicated that A/Chicken /henanxy/2010(H9N2) was lentogenic. TheHAgene sequences among isolates and the reference strains in GenBank was analyzed by DNAStar software. The results demonstrated that A/Chicken /henanxy/2010(H9N2) belonged to Y280-like sublineage and the homology of amino acid forHAgene is 94.8% between the isolate A/Chicken /henanxy/2010(H9N2) and Y280-like sublineage. The conclusion can be referred for the genetic evolution of AIV H9N2HAgenes,to reveal the epidemic characteristics of the H9N2 in Henan region.
H9N2 avian infuenza virus; Identification;HAgene; Sequence analysis
2015-12-27Returned2016-01-06
The Key Sci-tech Project of the Higher Education Institution of Henan(No. 15A230013); Key Sci-tech Project of Xinxiang(No.ZG13009).
WANG Lirong,female,associate professor,Ph.D. Research area:veterinary micrbiology and immunology.E-mail: wlr202@126.com
2015-12-27
2016-01-06
河南省高等学校重点科研项目(15A230013);新乡市重点科技攻关(ZG13009)。
王丽荣,女,副教授,博士,主要从事兽医微生物与免疫学研究。E-mail: wlr202@126.com
S855.3
A
1004-1389(2016)08-1125-07
网络出版日期:2016-07-14
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20160714.1103.004.html
