梓葛冻干粉针对脑微血管内皮细胞缺氧/复氧损伤的保护作用
2016-09-12尚远宏田金凤李松青徐晓玉
尚远宏,田金凤,王 敏,李松青,徐晓玉
(1.攀枝花学院 干热河谷特色生物资源研发四川省高校重点实验室,四川攀枝花 617000;2.西南大学 药学院 重庆市药效评价工程技术研究中心,重庆 400716)
梓葛冻干粉针对脑微血管内皮细胞缺氧/复氧损伤的保护作用
尚远宏1,2,田金凤1,王敏1,李松青1,徐晓玉2,*
(1.攀枝花学院 干热河谷特色生物资源研发四川省高校重点实验室,四川攀枝花 617000;2.西南大学 药学院 重庆市药效评价工程技术研究中心,重庆 400716)
探讨梓葛冻干粉针对脑微血管内皮细胞(BMECs)缺氧/复氧损伤的保护作用。取新生10 d的SD大鼠乳鼠,分离、培养脑皮层微血管原代内皮细胞,并利用DMEM无糖培养基、三气培养箱缺氧容器(缺糖缺氧2 h)及5% CO2培养箱复氧培养24 h复制缺氧/复氧模型,MTT法BMECs细胞活力,Western blot法检测MMP-9的蛋白表达。结果显示,与模型组相比,梓葛冻干粉针(49.00、98.00 μg·mL-1)能促进缺氧/复氧模型中BMECs增殖;梓葛冻干粉针(24.50、49.00、98.00 μg·mL-1)能显著抑制BMECs细胞中MMP-9 蛋白表达升高(p<0.05);提示梓葛冻干粉针对脑微血管内皮细胞损伤的保护作用可能与降低MMP-9蛋白表达有关。
梓葛冻干粉针,BMECs,MMP-9,缺氧/复氧损伤
梓葛冻干粉针主要由《千金方》中方剂“羌活汤”中药食同源的葛根提取的葛根素和熟地黄提取的梓醇组成,并由西南大学中药研究所依据食疗养生防病思路自主研发的一个具有抗脑缺血作用的制剂(专利公开号CN101574361A),具有改善脑部微循环的作用[1]。
缺氧/复氧损伤模型是氧糖剥夺(oxygen-glucose deprivation,OGD)模型和复氧模型的结合,是模拟缺血再灌注情况较理想的体内模型。脑微循环由微血管和微血流组成[2],当缺血再灌注时,会加剧损伤缺血区微血管,增加管壁通透性。而影响脑微循环基本以血管内皮细胞为媒介来实现[3],其中金属基质蛋白(matrix metalloprotein-9,MMP-9)主要在内皮细胞、胶质细胞、神经元和白细胞表达,几乎能降解细胞外基质中的各种蛋白成分[4];MMP-9能够通过降解血管内皮细胞的基底膜来损伤血管内皮细胞,导致微血管壁通透性增强。因此,实验中采用原代培养大鼠脑微血管内皮细胞(brain microvascular endothelial cells,BMECs),复制脑微血管内皮细胞的缺氧/复氧损伤模型来模拟脑缺血再灌注损伤,研究梓葛冻干粉针对脑微血管内皮细胞损伤的保护作用。
1 材料与方法
1.1材料与仪器
取10日龄新生SD大鼠幼鼠体质量(8±2)g,SPF级,由重庆医科大学实验动物中心供应(合格证号:SCXK(渝)2007-0001),于西南大学药学院SPF级实验动物中心饲养(许可证号:SYXK(渝)2009-0002),用于获取脑微血管原代内皮细胞。
胰蛋白酶美国Amresco公司分装;DMEM/F12培养基粉美国GIBCO公司;胎牛血清美国HyClone公司;MTT美国Amersco公司分装;牛血清白蛋白美国Genview公司分装;尼莫地平德国拜耳医药保健有限公司;葛根素注射液成都天台山制药有限公司;梓葛冻干粉针西南大学中药研究所研制;MMP-9多克隆抗体北京博奥森公司,抗β-actin多克隆抗体北京博士德生物技术公司;蛋白marker加拿大Fermentas公司;ECL试剂盒美国Pierce生物技术公司;脱脂奶粉上海生工生物工程有限公司;其他化学试剂均为成都科龙化工试剂厂。
Ziss IX71倒置相差显微镜德国蔡司公司;CB150三气培养箱德国BINDER公司;EL204电子天平美国梅特勒-托利多公司;3410立式超低温冰箱美国thermo公司;6000CO2恒温培养箱美国NACPO公司;SW-CJ-2FD超净工作台苏州金净公司;移液器德国Eppendorf公司;TDL-50B低速台式离心机上海安亭科学仪器厂;6-96孔培养板美国Costar公司;25~75 cm2培养瓶美国Costa公司;YA121001血球计数板北京鼎国生物公司;SW-CJ-ZF净化细胞培养系统重庆新雅空调净化厂。
1.2脑皮层微血管内皮细胞分离、培养与纯化
参照文献方法[5-6]。取10日龄新生大鼠,颈椎脱臼处死后,用75%乙醇浸泡3~5 min消毒,T字形剪开头部皮肤和颅骨,无菌取出大脑,置冷的D-Hank’s液的培养皿中;将大脑半球在灭菌干滤纸上缓慢滚动以吸除软脑膜及脑膜大血管后置于无菌的含冷D-Hank’s液玻璃培养皿中,体视显微镜下仔细去除大脑白质、残余大血管和软脑膜,保留大脑皮质;用D-Hank’s液漂洗后剪碎成直径1 mm大小并移入15 mL离心管中,1200 r/min离心3 min,弃上清液;在沉淀的组织中按1∶1的量加入25%牛血清白蛋白后反复吹悬,2500 r/min离心8 min,重复离心2次;离心的血管沉淀按1∶2加0.1%的Ⅱ型胶原酶,37℃消化40 min,吹悬后移入离心管,1200 r/min离心5 min,沉淀中加入适量完全培养基混悬后按1×104个血管段/mL密度接种于用1%明胶包被的塑料培养瓶中;置饱和湿度、37℃、含5% CO2的培养箱静置培养,24 h后第1次换液,以后每2 d换一次液。第7 d细胞基本融合后,进行消化传代纯化。以0.25%胰酶-0.02% EDTA消化,传代培养,以2代细胞用于实验。
1.3缺氧/复氧模型的建立
2代的内皮细胞常规培养48 h后(六孔板中每孔细胞覆盖不低于90%,每孔细胞液为1.5 mL),弃原液,用0.01 mol/L PBS液冲洗2次,将(除正常组)所有孔换成DMEM无糖培养基(1.5 mL),放入5% CO2+1% O2+94% N2三气培养箱缺氧容器中,37℃培养2 h后取出培养板(缺糖缺氧2h),将无糖培养液均换成正常20%血清培养液后于37℃、5% CO2条件下复氧培养24 h。
1.4实验分组及给药方案
实验分为正常对照组、缺氧/复氧模型组、30.00 μg·mL-1葛根素注射液组、2.00 μg·mL-1尼莫地平组和24.50、49.00、98.00 μg·mL-13个剂量梓葛冻干粉针组。正常对照组:细胞在37℃、5% CO2条件下培养;缺氧-复氧模型组:细胞在给予上述缺氧处理2 h后再于37℃、5% CO2条件下培养24 h(20%血清培养基);给药组:在复氧时分别加入30.00 μg·mL-1葛根素注射液、2.00 μg·mL-1尼莫地平和24.50、49.00、98.00 μg·mL-13个剂量梓葛冻干粉针,其余过程同模型组。
葛根素注射液、梓葛冻干粉针和尼莫地平均以20%血清培养基溶解至浓度。在复氧时,各给药1次(1.5 mL)。每组均设复孔3个。
1.5BMECs细胞活力的测定
参照文献方法[7],采用MTT法。吸弃培养基,PBS洗3次,96孔板每孔加入5 mg·mL-1的MTT溶液各10 μL,于培养箱中37℃、5% CO2条件下孵育4 h后,弃去MTT液,每孔加入100 μL的DMSO,振荡器轻轻混匀10 min后,以酶标仪、490 nm波长检测OD值。
1.6Western blot法检测MMP-9的蛋白表达
样本处理:取需裂解的细胞,用PBS液润洗细胞2次,吸干PBS液后,6孔板孔底按每孔加入预冷的RIPA 100 μL的细胞裂解液(在使用前数分钟内加入PMSF且使其终浓度为1 mmol/L),加入裂解液后的细胞即刻放置冰上并不断摇晃使其充分接触裂解液,10 min后分别用细胞刮刮下细胞,用移液器吸入已编号的1.5 mL离心管中,裂解液于4℃,12000 r/min离心15 min后收集上清液,分装,-80℃保存(备用)。参照文献方法[8],采用聚丙烯酰胺凝胶电泳操作。MMP-9用8%分离胶,进行电泳,转膜,ECL显影,将胶片用Bio-Rad公司图像分析软件进行分析,测定目的蛋白条带和内参β-actin蛋白条带的累积光密度值(IOD值)。
1.7统计学分析

2 结果与分析
2.1缺氧/复氧模型中细胞生长形态
正常对照组内皮细胞单层铺满孔底,呈漩涡状排列。缺糖缺氧2 h后,模型组的细胞均不同程度地受到影响,微血管内皮细胞胞体回缩,部分细胞胞体开始变圆,细胞间连接疏松。复氧24 h后,模型组的细胞间连接更疏松,出现部分胞体收缩和脱落,而用药组均不同程度地使细胞间隙变小,少量胞体收缩变圆,且变圆的细胞仍未脱落。见图1。

图1 梓葛冻干粉针对微血管内皮细胞在缺氧/复氧损伤前后形态变化的影响(100×)Fig.1 Effects of Zige lyophilized powder on morphology changes in BMECs hypoxia-reoxygenation injury(100×)注:A、正常对照组;B、模型组(缺糖缺氧2 h时);C、模型组(复氧24 h时);D、梓葛冻干粉针49.00 μg·mL-1组(复氧24 h时)。
2.2梓葛冻干粉针促进缺氧/复氧模型中BMECs增殖
缺氧/复氧损伤后,与正常组相比,模型组OD值显著降低(p<0.01),显示造模成功;与模型组相比,葛根素注射液组(30.00 μg·mL-1),尼莫地平组(2.00 μg·mL-1),梓葛冻干粉针98.00 μg·mL-1和49.00 μg·mL-1组均显著提高OD值(p<0.05,p<0.01);与模型组相比,梓葛冻干粉针24.50 μg·mL-1组无显著性差异。见表1。
2.3梓葛冻干粉针抑制BMECs缺氧/复氧损伤下MMP-9蛋白表达的升高
经Western blot法检测,正常对照组BMECs细胞中有少量MMP-9 蛋白表达;缺氧/复氧损伤下,与正常对照组相比,复氧24 h后,模型组的BMECs细胞中MMP-9 蛋白表达升高(p<0.01),显示造模成功。各药物组均能显著抑制BMECs细胞中MMP-9 蛋白表达升高(p<0.05,p<0.01),提示梓葛冻干粉针(24.50、49.00、98.00 μg·mL-1)对血管内皮细胞完整性具有保护作用。见图2。

表1 梓葛冻干粉针对缺氧/复氧损伤BMECs细胞活力的影响
注:与正常对照组比较# #p<0.01;与模型组比较* p<0.05,** p<0.01,图2同。
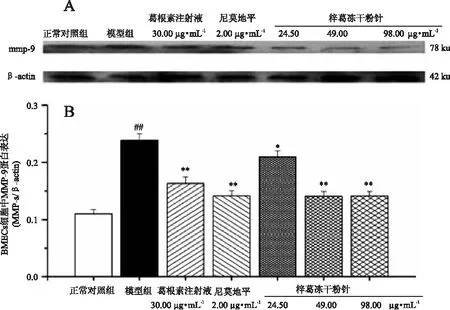
图2 梓葛冻干粉针对BMECs缺氧/复氧损伤下中MMP-9蛋白表达的影响Fig.2 The protein expression levels of MMP-9 on BMECs after hypoxia-reoxyge-nation injury注:A、BMECs缺氧/复氧损伤下各实验组MMP-9蛋白表达;B、BMECs缺氧/复氧损伤下MMP-9蛋白相对表达趋势。
3 讨论
脑微循环由微血管和微血流组成,对维持组织器官的功能和内环境平衡起着重要的作用,是保证脑组织形态结构、功能代谢的关键[3]。在脑缺血再灌注疾病发生时,改善血管的通透性及其相关因素是至关重要[9]。微血管通透性增高的两个途径是内皮细胞膜通透性的升高和内皮细胞的形态发生变化导致内皮细胞间弥散通道的开放[10]。血管内皮细胞的金属基质蛋白(MMP-9)和细胞紧密连接蛋白(Occludin、Claudin-5和ZO-1)的结构、功能异常与微血管通透性破坏密切相关[11-12]。其中,MMP-9激活时能够通过降解血管内皮细胞的基底膜来损伤血管内皮细胞,引起细胞壁通透性增强或开放,缺血后脑组织MMP-9活性增高是缺血后脑损伤的重要机
制之一[13]。有研究表明脑缺血时基质金属蛋白酶的水平增加,且缺血的一侧半球增加程度比对侧明显,给予外源性组织金属蛋白酶抑制剂和抗基质金属蛋白酶的单克隆抗体可减轻缺血性脑损伤[14]。实验中,梓葛冻干粉针(24.50、49.00、98.00 μg·mL-1)可抑制BMECs细胞中MMP-9蛋白表达的升高,达到减轻细胞损伤的效果,从而保护微血管完整性,降低微血管通透性,可能改善脑部微循环,这与已发表的其能改善脑微循环障碍相吻合[1],说明其在脑缺血再灌注损伤干预中具有潜在应用价值。
4 结论
本文初步证实梓葛冻干粉针对血管内皮细胞完整性的保护作用机制可能与降低MMP-9蛋白表达有关,为脑微血管介导的脑保护作用提供参考,也可能为扩大梓葛冻干粉针的临床适应证提供参考。
[1]尚远宏,田金凤,汪宏锦,等.梓葛冻干粉针对大鼠急性脑微循环障碍的改善作用[J].中国中药杂志,2014,39(4):733-737.
[2]金惠铭.微血管功能调节的中西医结合研究[J].微循环学杂志,2004,14(2):1-4.
[3]杨利孙,章翔,易声禹.脑损伤后脑循环障碍的机制及其与脑水肿的关系[J].中华创伤杂志,2000,16(1):49-52.
[4]Wang G,Guo Q,Hossain M,et al.Bone marrow-derived cells are the major source of MMP-9 contributing to blood-brain barrier dysfunction and infarct formation after ischemic stroke in mice[J].Brain Research,2009,(1294):183-192.
[5]Xue Q,Liu Y,Qi H,et al.A novel brain neurovascular unit model with neurons,astrocytes and microvascular endothelial cells of rat[J].International J Biological Sci,2013,9(2):174-176.
[6]Liu Y,Xue Q,Tang Q,et al.A simple method for isolating and culturing the rat brain microvascular endothelial cells[J].Microvascular research,2013,(90):199-205.
[7]郭洋,伊鹏霏,吕钊君,等.大鼠脑微血管内皮细胞的体外培养及鉴定[J].沈阳农业大学学报,2010,41(2):170-174.
[8]张平,沈陈林,李琳,等.阿司匹林抑制脂多糖诱导RAW264.7细胞MMP-9表达及机制研究[J].中国临床药理学与治疗学,2015,20(4):388-393.
[9]孟淑静,曹春蕊,任艳焕,等.血管通透性及其相关因素研究进展[J].实用心脑肺血管病杂志,2011,19(10):1814-1815.
[10]李向红.脑缺血的微血管改变[J].微循环学杂志,1997,7(1):13-16.
[11]Jiao H,Wang Z,Liu Y,et al.Specific role of tight junction proteins claudin-5,occludin,and ZO-1 of the blood-brain barrier in a focal cerebral ischemic insult[J].J Molecular Neurosci,2011,44(2):130-139.
[12]Lapierre L A.The molecular structure of the tight junction[J].Advanced drug delivery reviews,2000,41(3):255-264.
[13]Newman K M,Jean-Claude J,Li H,et al.Cellular localization of matrix metalloproteinases-in the abdorminal aortic aneurysm wall[J].J Vasc Surg,1994,20(5):814-820.
[14]Rosenberg G A,Navratil M,Barone F,et al.Proteolytic cascade enzymes increase in focal cerebral ischemia in rats[J].J Cereb Blood Flow Metab,1996,16(3):360-366.
Protective effect of Zige lyophilized powder on brain microvascular endothelial cells after hypoxia-reoxygenation injury
SHANG Yuan-hong1,2,TIAN Jin-feng1,WANG Min1,LI Song-qing1,XU Xiao-yu2,*
(1.Key Laboratory of Dry-hot Valley Characteristic Bio-Resources Development at university of Sichuan Province,Panzhihua University,Panzhihua 617000,China; 2.College of Pharmacetical Sciences,Southwest University,Chongqing Engineering Research Center for Pharmacodynamics Evaluation,Chongqing 400716,China)
To investigate the protective effect of Zige lyophilized powder on brain microvascular endothelial cells(BMECs) after hypoxia-reoxygenation injury.BMECs of the 10 d rats were isolated and cultured,the model of BMECs with the hypoxia-reoxygenation injury was estabished by DMEM sugar-free medium,three gas incubator oxygen container(lacking oxygen and sugar for 2 h),and 5% CO2incubator for 24 h after oxygen training.The proliferation of endothelial cells was detected by MTT method.The protein expression levels of MMP-9 were detected by WB method.Zige lyophilized powder(49.00,98.00 μg·mL-1)could promote BMECs proliferation in hypoxia-reoxygenation model.The increasing level of MMP-9 protein in a hypoxia-reoxygenation injury on cultured BMECs was inhibited significantly by Zige lyophilized powder(24.50,49.00 and 98.00 μg·mL-1)(p<0.05).It showed that the possible mechanism of Zige lyophilized powder for injection on protecting the cell integrity would be associated with the decreasing MMP-9 protein expression.
Zige lyophilized powder for injection;BMECs;MMP-9;Hypoxia-reoxygenation injury
2015-08-27
尚远宏(1980-),男,博士,研究方向:中药药理和食品研究,E-mail:shyh611@126.com。
徐晓玉(1958-),女,硕士,教授,研究方向:中药药理,E-mail:xuxiaoyu@swu.edu.cn。
国家青年基金项目(31402237);国家自然基金面上项目(81473549);攀枝花市社会发展科技计划项目(2014TX-10-3);四川省教育厅重点基金项目(14ZA0345,15ZA0370);四川省高校重点实验室开放基金项目(GR-2013-E-02,GR-2015-E-01)。
TS201.2
A
1002-0306(2016)07-0358-04
10.13386/j.issn1002-0306.2016.07.061
