不同容器发酵水豆豉预防CCl4诱导肝损伤的研究
2016-09-12冯霞,赵欣,*
冯 霞,赵 欣,*
(1.重庆第二师范学院 生物与化学工程系,重庆 400067;2.重庆第二师范学院 重庆市功能性食品协同创新中心,重庆 400067)
不同容器发酵水豆豉预防CCl4诱导肝损伤的研究
冯霞1,2,赵欣1,2,*
(1.重庆第二师范学院 生物与化学工程系,重庆 400067;2.重庆第二师范学院 重庆市功能性食品协同创新中心,重庆 400067)
本研究对不同容器发酵水豆豉的抗氧化能力以及肝损伤预防效果进行了研究。和肝损伤组小鼠相比(CCl4诱导肝损伤),浓度为4 g/kg的水豆豉乙醇提取物处理的各组小鼠的肝脏重量,肝指数,血清ALT、AST、LDH、MDA、IL-6、IL-12、TNF-α和IFN-γ水平显著降低(p<0.05),SOD、GSH-Px的水平显著提高(p<0.05)。通过RT-PCT实验也可以看出较肝损伤组水豆豉可以上调小鼠肝脏的Mn-SOD、Gu/Zn-SOD、CAT的表达,下调iNOS、COX-2、IL-lβ、TNF-α表达。通过实验结果可以看出,玻璃容器发酵水豆豉(GVFS)的肝损伤预防效果和抗氧化效果显著优于陶瓷容器发酵水豆豉(CVFS)和塑料容器发酵水豆豉(PVFS)(p<0.05)。
水豆豉,容器,CCl4,肝损伤,抗氧化
水豆豉是我国的一种传统发酵食品,大豆通过短时间的发酵制成水豆豉,在西南地区水豆豉常作为调味品使用。同时,在中国古代医书上对水豆豉的功效也有记载,水豆豉也作为一味中药使用,具有开胃健脾,清热解毒等功效;现代科学也证明水豆豉可作为功能性食品使用,有抗氧化、抗突变和预防癌症等功效[1]。水豆豉是通过细菌进行自然发酵的大豆制品,浸泡水量、发酵时间、发酵温度、后发酵时间等都能影响其理化性质和功能性作用[2],发酵容器的材质也可导致发酵温度、水分等因素产生差异,从而使大豆产品的发酵过程出现差别,影响其品质[3]。家庭发酵水豆豉常使用玻璃、陶瓷和塑料容器。在韩国有研究表明,发酵容器的差异对发酵大豆食品(大酱)的品质产生了影响,造成产品的品质出现较大差别[4]。
急性肝损伤是一种急性肝功能异常的病理状况,四氯化碳(CCl4)是一种可以造成急性肝损伤的化学物质,被常用于基础科学研究[5]。四氯化碳对肝脏的损伤作用与氧化应激和脂质过氧化反应有密切关系,当CCl4进入肝脏后,通过细胞色素P450的激活,生成OOCCl3·和OOCCl3·这两种自由基,在体内引起脂质过氧化反应,对肝细胞膜的产生损害,影响肝脏的结构和功能,同时造成Ca2+内流,进一步损伤肝细胞,加重肝损伤[6]。另外,CCl4还通过其代谢产物刺激肝脏枯否细胞大量释放促炎性细胞因子,使肝损伤的程度增加[7]。研究表明,水豆豉也具有较好的抗氧化效果[8],因此水豆豉可能通过其抗氧化能力起到预防和抑制CCl4诱导造成的肝损伤。本研究对塑料、陶瓷、玻璃这三种常用容器对水豆豉的肝损伤预防效果进行比较,并验证水豆豉的肝损伤预防作用与其抗氧化能力之间的关系。研究结果可以积累水豆豉发酵容器造成品质变化的理论依据,便于指导工业化生产水豆豉。
1 材料与方法
1.1材料与仪器
大豆黑龙江省嫩江县黑龙江农垦总局大西江农场出产(2014年秋季)。
丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转换酶(AST)、乳酸脱氢酶(LDH)、总超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)南京建成生物工程研究所;IL-6、IL-12、TNF-α、IFN-γ细胞因子美国BioLegend公司;CycleTESTTM PLUS DNA染色试剂盒德国Becton Dickinson公司;Trizol试剂、oligodT18、RNase、dNTP 和MLV美国Invitrogen公司;RT-PCR引物iNOS、COX-2、IL-lβ、TNF-α、Mn-SOD、Gu/Zn-SOD和CAT天根生化科技有限公司;其余试剂均为国产分析纯。
雄性SPF级昆明小鼠50只(6周龄,体重20~25 g,动物许可证号:SCXK(渝)2012-0001)购自于重庆医科大学动物实验中心。
LD2X-50FB立式压力蒸汽灭菌锅江西华科精密仪器有限公司;PYX-DHS-50X65BS隔水式电热恒温培养箱上海百典仪器设备有限公司;UV9600紫外分光光度计北京北分瑞利分析仪器(集团)公司;Bio-Rad小型水平电泳槽美国Bio-Rad公司;ABI 2720 PCR仪美国Applied Biosystems公司。
1.2实验方法
1.2.1不同容器发酵水豆豉及提取精选后的大豆与蒸馏水按1∶2比例(重量比)浸泡12 h,然后将大豆放置于高压蒸气灭菌锅中蒸煮(105℃,60 min)。将蒸煮后的大豆冷却至36℃后置于陶瓷、塑料和玻璃容器中放入恒温培养箱中保温发酵(36℃,72 h)。将发酵完成后的水豆豉进行冷冻干燥然后粉碎,加入20倍量的80%乙醇(v/v)提取12 h,重复提取3次并合并提取液,用旋转蒸发仪减压蒸干溶剂得到水豆豉提取物待用。
1.2.2动物诱导肝损伤实验将KM小鼠喂养1周适应环境后随机平均分为5组,分别是对照组、肝损伤组、陶瓷容器发酵水豆豉(CVFS)喂养组、塑料容器发酵水豆豉(PVFS)喂养组和玻璃容器发酵水豆豉(GVFS)喂养组,每组10只小鼠。正常组和对照组小鼠在3周实验过程中每天灌胃0.2 mL蒸馏水,CVFS、PVFS和GVFS喂养组小鼠每日按浓度4 g/kg分别灌胃0.2 mL陶瓷容器发酵水豆豉、塑料容器发酵水豆豉和玻璃容器发酵水豆豉组提取物溶液,持续3周。3周后对除对照组外其余各组小鼠实施绝食24 h后腹腔皮下注射CCl4(0.2 mL,CCl4∶橄榄油=1∶1),取心脏血及肝脏待用[5],同时测定其中肝指数,指数按公式计算:肝指数=(小鼠肝脏重量/小鼠体重)×100。
1.2.3小鼠血清指标检测将取得的小鼠血浆在4000 r/min下离心分离10 min后取上层血清,按试剂盒说明书测定小鼠血清中ALT、AST、LDH、SOD、GSH-Px和MDA的含量。
1.2.4小鼠细胞因子检测将取得的小鼠血浆在4000 r/min下离心分离10 min后取上层血清,按试剂盒说明书使用ELISA测定小鼠血清中IL-6、IL-12、TNF-α和IFN-γ的细胞因子水平。
1.2.5用RNAzol试剂提取各组小鼠肝脏组织中的总RNA,然后将其浓度稀释到1 μg/μL。在2 μL RNA 提取液中按次序分别加入1 μL的 oligodT18、RNase、dNTP、MLV 酶和10 μL的 5×buffer,然后合成cDNA(条件为:37℃ 120 min,99℃ 4 min,4℃ 3 min)。然后以反转录-聚合酶链反应法扩增iNOS(上游引物:5′-AGA GAG ATC GGG TTC ACA-3′;下游引物:5′-CAC AGA ACT GAG GG TAC A-3′)、COX-2(上游引物:5′-TTA AAA TGA GAT TGT CCG AA-3′;下游引物:5′-AGA TCA CCT CTG CCT GAG TA-3′)、IL-lβ(上游引物:5′-CTC CAT GAG CTT TGT ACA AGG-3′;下游引物:5′-TGC TGA TGT ACC AGT TGG GG-3′)、TNF-α(上游引物:5′-CTC CCT CCA GAA AAG ACA CCA T-3′;下游引物:5′-ATC ACC CCG AAG TTC AGT AGA CAG-3′)、Mn-SOD(上游引物:5′-TTC AAT AAG GAG CAG GGA C-3′;下游引物:5′-CAG TGT AAG GCT GAC GGT TT-3′)、Gu/Zn-SOD(上游引物:5′-GAA GAG AGG CAT GTT GGA GA-3′;下游引物:5′-CCA ATT ACA CCA CGA GCC AA-3′)和CAT(上游引物:5′-AGA TAC TCC AAG GCG AAG GTG-3′;下游引物:5′-AAA GCC ACG AGG GTC ACG AAC-3′)的mRNA表达,同时GAPDH(持家基因,上游引物:5′-CGG AGT CAA CGG ATT TGG TC-3′;下游引物5′-AGC CTT CTC CAT GGT CGT GA-3′)作为内参照同样进行扩增。最后以琼脂(含1%浓度溴化乙锭)电泳检查PCR扩增产物,并用Image1.44软件定量分析表达强度[9]。
1.2.6活性大豆异黄酮的测定将活性大豆异黄酮(大豆黄素和金雀异黄素)标准品溶于80%的乙醇中,配制成浓度为0.002~0.020 g/L的标准溶液。以Kromasil C18色谱柱(4.6 mm×25 mm,5 μm);流动相﹕40%甲醇;流速为1.0 mL/min;检测器灵敏度为0.02AUFS;检测波长为260 nm;柱温为50℃;取标准溶液20 μL注入六通阀中,测定峰面积。求得回归方程为Y大豆黄素=148338+1.70×108X(r=0.999);Y金雀异黄素=-316706+4.20×108X(r=0.995),得到标准曲线。取不同容器发酵水豆豉样品2 g,粉碎后加10倍量的蒸馏水稀释后4000 r/min离心取上清液,在80℃烘箱中干燥烘干。干燥物用200 mL的80%乙醇在恒温水浴(80℃)中回流提取两次,每次2 h,然后合并提取液,减压蒸干,用无水乙醇定容至10 mL作为待测液,将待测液测定后对照标准曲线得到水豆豉中活性大豆异黄酮的含量[10]。

表2 实验小鼠血清的ALT、AST和LDH水平
1.3数据统计
对所有的实验进行3次平行实验,然后将3次实验结果取平均值,使用SAS9.1统计软件采用one-way ANOVA 分析方法分析各组数据在p<0.05水平上是否具有显著差异[9]。
2 结果与分析
2.1不同容器发酵水豆豉对小鼠肝指数的影响
由表1可知,诱导肝损伤后CCl4处理各小鼠的体重较对照组小鼠有所下降,肝损伤组小鼠下降最多,水豆豉处理各组小鼠的体重没有显著差异(p>0.05)。CCl4处理各小鼠的肝脏重量较对照组小鼠显著增加(p<0.05),灌胃水豆豉提取物各组小鼠的肝脏重量比肝损伤组小鼠小,GVFS可以最大的缓解CCl4造成的肝组织重量上升。通过测得的小鼠体重和肝脏重量加以计算观察到肝损伤组小鼠的肝指数显著高于其他各组(p<0.05),对照组小鼠最低,GVFS、PVFS和CVFS喂养组小鼠的肝指数依次增加。肝损伤状态下,小鼠体重会出现下降,肝脏重量会增加,导致肝指数较正常小鼠大大提高[11],本实验也得到相似的结果,CCl4导致小鼠体重下降,肝脏重量增加,肝指数上升,水豆豉可以显著缓解这些现象,且GVFS的作用较另外两种容器发酵的水豆豉效果更好。
2.2不同容器发酵水豆豉对小鼠血清ALT、AST和LDH水平的影响
AST和ALT都是转氨酶,肝功能出现异常时在体内会出现显著变化,临床上常用检测血清中的AST、ALT 的酶学指标来判断肝功能是否正常,ALT 和AST在正常情况下稳定的分别分布在肝细胞浆和肝细胞的细胞浆、线粒体中,肝脏受损时AST,ALT 释放入血液中使血液中的AST,ALT水平出现异常的上升[11]。LDH是一种在体内广泛分布的酶,在肝脏中也有大量的分布,在肝脏损伤情况下,肝组织中的LDH水平会出现异常的大幅度上升,因此LDH在肝脏中的水平也作为肝损伤的重要评价指标[5]。由表2可知,肝损伤组小鼠的血清ALT、AST和LDH水平显著高于其他各组(p<0.05),对照组小鼠的ALT、AST和LDH水平最低。GVFS、PVFS和CVFS喂养可以缓解CCl4导致的ALT、AST和LDH水平上升,且GVFS的效果最明显。

表1 实验小鼠的体重、肝脏重量和肝指数
注:CVFS,陶瓷容器发酵水豆豉;PVFS,塑料容器发酵水豆豉;GVFS,玻璃容器发酵水豆豉。不同字母表示各组数据平均值之间存在显著性差异(p<0.05),表2~表4,图1、图2同。
2.3不同容器发酵水豆豉对小鼠血清SOD、GSH-Px和MDA水平的影响
SOD和GSH-Px都是体内重要的抗氧化功效物质,SOD和GSH-Px在血清中的含量高意味体内受到氧化损伤的程度低;MDA是体内脂质过氧化的重要表现,其异常升高代表体内受到严重的脂质过氧化[12]。CCl4在肝脏中导致脂质过氧化,损伤肝脏组织[6]。由表3可知,对照组小鼠血清中SOD、GSH-Px含量最高,MDA含量最低;肝损伤组小鼠呈现出相反的趋势,血清中的SOD、GSH-Px含量最低,MDA含量最高。GVFS喂养组小鼠的SOD、GSH-Px含量显著高于PVFS和CVFS喂养组,MDA含量显著低于PVFS和CVFS喂养组(p<0.05)。GVFS喂养后,较CCl4诱导肝损伤组,小鼠的血清SOD、GSH-Px水平升高,MDA水平下降,GVFS可能通过降低体内受氧化程度,从而起到抑制和预防肝损伤的作用。
2.4不同容器发酵水豆豉对小鼠血清IL-6、IL-12、TNF-α和IFN-γ细胞因子水平的影响
IL-6、IL-12、TNF-α和IFN-γ细胞因子都是重要的炎症因子,机体出现肝损伤导致的炎症后这些细胞因子显示出比正常状态下更高的水平[13]。本实验中也得到相似的结果,CCl4导致肝脏损伤并出现炎症,由表4可知,肝损伤组的IL-6、IL-12、TNF-α和IFN-γ细胞因子水平最高,水豆豉可以使各组受到CCl4作用的小鼠细胞因子水平下降,GVFS使这些细胞因子在小鼠体内下降的程度最大。
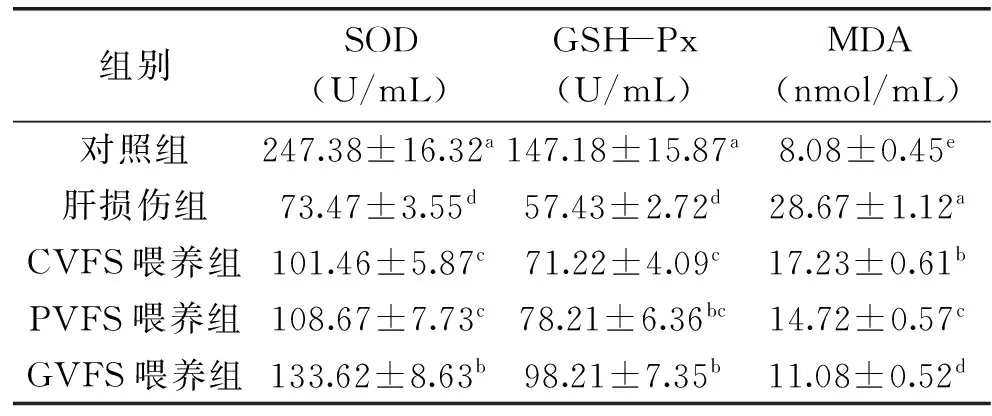
表3 实验小鼠血清的SOD、GSH-Px和MDA水平
2.5不同容器发酵水豆豉对小鼠肝脏中iNOS、COX-2、IL-lβ和TNF-α的mRNA表达的影响
COX-2 是一种肝细胞受损后表达会异常上升的诱导酶,在CCl4导致的肝损伤中,COX-2 的表达比正常小鼠大幅度提高;iNOS 和COX-2在CCl4致肝损伤的情况下表达呈正相关,iNOS表达也上升[13]。IL-lβ和TNF-α也是重要的炎症相关基因,在正常人群的肝脏中表达不明显,在肝损伤情况下出现强烈的表达[14]。由图1可知,对照组小鼠肝脏中的iNOS、COX-2、IL-lβ和TNF-αmRNA表达最弱,肝损伤组小鼠最高。水豆豉可以显著下调肝损伤小鼠肝脏中的iNOS、COX-2、IL-lβ和TNF-α表达,且GVFS下调的幅度最大,GVFS喂养组小鼠肝脏中的iNOS、COX-2、IL-lβ和TNF-α表达仅为肝损伤组小鼠的0.21、0.65、0.32和0.66倍。iNOS、COX-2、IL-lβ和TNF-α均可作为肝损伤的治疗靶点,GVFS可以显著降低肝组织中的iNOS、COX-2、IL-lβ和TNF-α表达,起到抑制肝损伤的作用。

图1 不同容器发酵水豆豉灌胃小鼠肝脏中iNOS、COX-2、IL-lβ和TNF-α表达水平Fig.1 mRNA expression levels of iNOS,COX-2,IL-lβ and TNF-α in liver of different vessels fermented Shuidouchi intragastric administrated mice
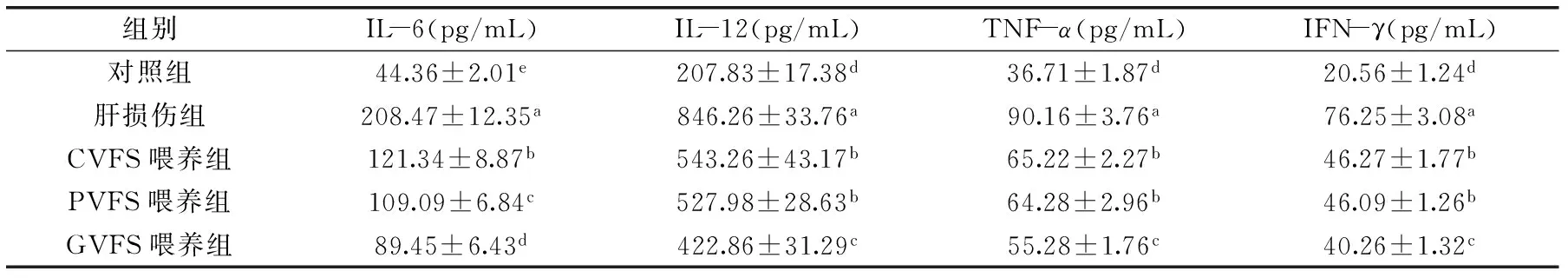
表4 实验小鼠血清的IL-6、IL-12、TNF-α和IFN-γ细胞因子水平
2.6不同容器发酵水豆豉对小鼠肝脏中Mn-SOD、Gu/Zn-SOD和CAT的mRNA表达的影响
SOD在动物体存在三种异构体,分别是Mn-SOD、Gu/Zn-SOD和EC-SOD,体内低水平的Mn-SOD和Gu/Zn-SOD会造成自由基的大量产生,加剧肝损伤程度。CAT作为生物防御体系中的一种关键酶,可以清除体内的氧自由基和促进过氧化氢分解,从而避免CCl4导致肝脏损伤后产生的大量氧自由基加剧肝损伤[15]。由图2可知,对照组小鼠肝脏中Mn-SOD、Gu/Zn-SOD和CAT的mRNA表达最强,CCl4可导致这些表达显著下降(p<0.05),不同容器发酵水豆豉的提取物可以显著缓解这些表达在肝脏中下降,且GVFS的缓解作用最为强烈,GVFS组小鼠肝脏中的Mn-SOD、Gu/Zn-SOD和CAT表达达到肝损伤组小组的1.95、14.33和1.40倍,高于PVFS和CVFS组。由此可见,水豆豉可以通过加强肝组织中的抗氧化表达来缓解和抑制肝损伤,而GVFS的作用最优,即采用玻璃发酵的水豆豉具有更好的效果。

图2 不同容器发酵水豆豉灌胃小鼠肝脏中Mn-SOD、Gu/Zn-SOD和CAT表达水平Fig.2 mRNA expression levels of Mn-SOD,Gu/Zn-SOD and CAT in liver of different vessels fermented Shuidouchi intragastric administrated mice
2.7不同容器发酵水豆豉的活性异黄酮含量比较
活性大豆异黄酮具有较强的抗氧化效果,也具有抑制炎症的作用[16]。经过检测可知不同容器发酵的水豆豉中的活性大豆异黄酮(大豆黄素和金雀异黄素)含量具有显著差异,GVFS的大豆黄素和金雀异黄素含量均显著(p<0.05)高于PVFS和CVFS。GVFS的抗氧化效果和肝损伤预防效果优于PVFS和CVFS的原因可能来源于其活性大豆异黄酮高于PVFS和CVFS。

表5 不同容器发酵水豆豉中大豆黄素和金雀异黄素的含量
3 结论
对不同容器发酵水豆豉的通过其抗氧化能力对CCl4诱导肝损伤的预防效果进行了研究,通过小鼠体内实验证明了不同容器发酵水豆豉间抗氧化能力有所差异,且产生的肝损伤预防效果也有显著差异。GVFS喂养的肝损伤小鼠的肝指数、血清的ALT、AST、LDH、MDA、IL-6、IL-12、TNF-α和IFN-γ水平显著低于CVFS、PVFS组;血清中SOD、GSH-Px显著高于CVFS、PVFS组(p<0.05)。通过RT-PCR分析肝组织看出GVFS可以下调iNOS、COX-2、IL-lβ、TNF-α表达和上调Mn-SOD、Gu/Zn-SOD、CAT表达,且作用同样强于CVFS和PVFS。对水豆豉中活性大豆异黄酮含量进行了比较,可以看出GVFS含有的大豆黄素和金雀异黄素显著高于PVFS和CVFS。实验结果可以体现出GVFS通过抗氧化能力起到的肝损伤抑制作用强于CVFS和PVFS,玻璃容器用来发酵水豆豉可以生产出保健功效更好的水豆豉产品。
[1]赵欣.PBL教学法在提高水豆豉感官评价水平上的应用[J].中国调味品,2014,39(4):24-27.
[2]赵欣,李贵节.发酵时间和浸泡水量对水豆豉理化特性和体外抗癌效果的影响[J].食品工业科技,2013,34(23):344-348.
[3]Chung SK,Lee KS,Cho SH.Effect of fermentation vessel on quality of Anchovy soy sauce[J].Korean Journal of Food Preservation,2004,11(2):233-239.
[4]Yoo SM,Kim JS,Shin DH.Quality changes of traditional Doenjang fermented in different vessels[J].Journal of the Korean Society of Agricultural Chemistry and Biotechnology,2001,44(4):230-234.
[5]Li GJ,Sun P,Wang Q,et al.Dendrobium candidum Wall.ex Lindl.attenuates CCl4-induced hepatic damage in imprinting control region mice[J].Experimental and Therapeutic Medicine,2014,8(4):1015-1021.
[6]朱安妮,李蕊,刘三海,等.四氯化碳诱导小鼠急性肝损伤模型的建立和优化[J].中国肝脏病杂志,2014,6(1):27-31.
[7]Lin X,Huang R,Zhang S,et al.Methyl helicterate protects against CCl4-induced liver injury in rats by inhibiting oxidative stress,NF-κB activation,Fas/FasL pathway and cytochrome P4502E1 level[J].Food and Chemical Toxicology,2012,50(10):3413-3420.
[8]李雨枫,欧阳晶,苏悟,等.传统发酵豆豉蛋白质生物学变化与抗氧化能力研究[J].中国酿造,2014,33(11):20-24.
[9]赵欣,王睿,庞谅,等.苦丁茶黄酮通过caspases活化诱导人HSC-3口腔癌细胞凋亡的效果[J].现代食品科技,2015,31(4):1-7.
[10]Wang Q,Zhao X,Qian Y,et al.In vitro antioxidative activity of yellow tea and its in vivo preventive effect on gastric injury[J].Experimental and Therapeutic Medicine,2013,6(2):423-426.
[11]易若琨,赵欣.太明清对扑热息痛致小鼠肝损伤的保护作用[J].现代食品科技,2015,31(1):11-15.
[12]万全,王艳梅,林琳,等.黄缘盒龟多肽对D-半乳糖致亚急性衰老小鼠抗氧化能力的影响[J].现代食品科技,2013,29(9):2075-2080.
[13]王睿,孙鹏,赵欣.虫茶粗多糖对四氯化碳诱导小鼠肝损伤预防效果研究[J].现代食品科技,2015,31(5):6-11.
[14]Zhao X.Hawk tea(Litsea coreana Levl.var.lanuginose)attenuates CCl4-induced hepatic damage in Sprague-Dawley rats[J].Experimental and Therapeutic Medicine,2013,5(2):555-560.
[15]Ligumsky M,Sestieri M,Okon E,et al.Antioxidants inhibit ethanol-induced gastric injury in the rat.Role of manganese,glycine,and carotene[J].Scandinavian Journal of Gastroenterology,1995,30(9):854-860.
[16]赵欣,王强.不同后发酵时间的水豆豉理化特性比较研究[J].食品工业科技,2014,35(11):344-349,356.
Study on preventive effects of different vessels fermented Shuidouchi on CCl4induced hepatic damage
FENG Xia1,2,ZHAO Xin1,2,*
(1.Department of Biological and Chemical Engineering,Chongqing University of Education,Chongqing 400067,China; 2.Chongqing Collaborative Innovation Center of Functional Food, Chongqing University of Education,Chongqing 400067,China)
The antioxidation and hepatic damage preventive effects of different vessels fermented Shuidouchi were investigated.The 4 g/kg Shuidouchi ethanol extracts treated mice could significantly(p<0.05)reduce the liver weight,liver index,serum levels of ALT,AST,LDH,MDA,IL-6,IL-12,TNF-α,IFN-γ,and significant(p<0.05)raise the SOD,GSH-Px serum levels compared to the hepatic damage group mice(CCl4induced hepatic damage).By the RT-PCR assay,Shuidouchi could increase the Mn-SOD,Gu/Zn-SOD,CAT expressions and decrease iNOS,COX-2,IL-lβ,TNF-αexpressions compared to the control mice.From these results,the glass vessel fermented Shuidouchi(GVFS)had the better hepatic damage preventive effects and antioxidation effects than ceramic vessel fermented Shuidouchi(CVFS)and plastic vessel fermented Shuidouchi(PVFS)(p<0.05).
Shuidouchi;vessel;CCl4;hepatic damage;antioxidant
2015-09-07
冯霞(1976-),女,硕士,副教授,研究方向:食品营养和功能性食品,E-mail:fengxia@foods.ac.cn。
赵欣(1981-),男,博士,教授,研究方向:食品的功能性作用,E-mail:zhaoxin@zhaoxin.org。
重庆市教委科学技术研究项目资助(KJ1401415)。
TS201.4
A
1002-0306(2016)07-0338-05
10.13386/j.issn1002-0306.2016.07.056
