酸性蛋白酶基因Asp在红曲霉中的同源表达及序列分析
2016-09-12邱思佳霍丹群侯长军唐玉明于梦露殷忠原
邱思佳,霍丹群,*,侯长军,唐玉明,于梦露,殷忠原,邓 波,杨 平,
(1.重庆大学生物工程学院,重庆 400044;2.四川省泸州市酿酒科学研究所,四川泸州 646000;3.国家固态酿造工程技术研究中心泸州老窖股份有限公司,四川泸州 646000)
酸性蛋白酶基因Asp在红曲霉中的同源表达及序列分析
邱思佳1,霍丹群1,*,侯长军1,唐玉明2,于梦露1,殷忠原1,邓波3,杨平1,3
(1.重庆大学生物工程学院,重庆 400044;2.四川省泸州市酿酒科学研究所,四川泸州 646000;3.国家固态酿造工程技术研究中心泸州老窖股份有限公司,四川泸州 646000)
从红曲霉基因组中扩增出酸性蛋白酶基因Asp的编码区,构建其同源表达载体pBC-Hygro-Asp并导入到农杆菌GV3101备用。利用根癌农杆菌介导法将重组质粒导入红曲霉,并筛选获得Asp基因同源重组转化子,实现了酸性蛋白酶基因在红曲霉中的同源表达。转化子中酸性蛋白酶基因表达量是野生型菌株的3.30倍,能达到高产酸性蛋白酶的目的。对红曲霉酸性蛋白酶基因序列进行分析,结果显示该基因产物有两个天冬氨酸蛋白酶活性位点,为亲水性分泌蛋白,不参与信号转导,且与赤曲霉酸性蛋白酶有相同进化速率。
红曲霉,酸性蛋白酶,同源表达,序列分析
红曲霉(Monascus)是一种丝状子囊菌,归属于真菌界子囊菌门真子囊菌纲散囊菌目红曲科,以其酶系丰富、代谢产物多而被广泛应用于各类产品的发酵生产[1]。部分红曲霉菌株可产生大量活性较高的蛋白酶,可用于腌渍鱼、肉、豆腐等高蛋白食品。
酸性蛋白酶也称为天冬氨酸蛋白酶,是一种常用的蛋白水解酶。红曲霉作为白酒发酵的重要菌株,其产生的酸性蛋白酶对于白酒产量和质量具有重要 的影响。在白酒酿造中提高酸性蛋白酶含量,可强化蛋白质的水解,丰富酒醅中氨基酸的含量,不仅有利于微生物的生长提高原料出酒率,且分解产生的氨基酸可作为生成白酒香味的前体物质[2]。但目前酸性蛋白酶酶制剂成本高、活性低,不能广泛运用于生产[3]。
Asp基因能编码产生分子量为41 ku的酸性蛋白酶[4]。本文通过PCR方法从红曲霉基因组中扩增Asp基因,构建红曲霉表达载体pBC-Hygro-Asp,再利用根癌农杆菌(Agrobacterium)介导法将Asp基因导入红曲霉中,成功筛选出能高产酸性蛋白酶的红曲霉同源转化子菌株。该同源表达体系具有高效表达、准确加工、转化子遗传稳定的特点,可以在非选择压力下实现稳定传代,为进一步在生产中应用奠定了基础。目前还未见相关研究工作的报道。
1 材料和方法
1.1材料与仪器
酿酒红曲霉四川省泸州市酿酒科学研究所;质粒pBC-Hygro由法国P.Silar教授惠赠,该质粒总长度为6.8 kb,启动子和终止子分别为Neurospora crassa cpc-1和Aspergillus nidulanstrpC,;根癌农杆菌GV3101由本实验室保存。
红曲霉酸性蛋白酶基因片段引物由英潍捷基贸易公司合成;高保真酶Pfu DNA聚合酶、T4 连接酶、pMD-18T载体以及限制性内切酶Sma I购于Takara公司;真菌RNA提取试剂盒、逆转录试剂盒、质粒小提试剂盒OMEGA公司;氯霉素、潮霉素、头孢噻污钠、庆大霉素、其他常规分析纯试剂以及LB培养基和察氏培养基北京康为世纪科技有限公司。
红曲霉发酵培养基的配制:17.79 g麸皮,4.53 g豆粉饼,0.205 g KH2PO4,45 mL水,用0.1 mol/L盐酸将培养基pH调至5,灭菌20 min。
酸性蛋白酶鉴定培养基的配制:酪素0.5 g,琼脂2.5 g,加入到100 mL pH为3.5的乳酸-乳酸钠缓冲液中[5]。
普通PCR仪170-9713Bio-rad公司,基础电泳仪PowerpacBio-rad公司,恒温培养振荡器ZHWY-200D上海智城分析仪器制造有限公司,高速冷冻离心机X-22RBeckman公司,凝胶成像仪ChemiDoc MPBio-rad公司。
1.2实验方法
1.2.1红曲霉Asp基因的克隆根据GenBank中公布的紫红曲霉酸性蛋白酶基因序列(AB090877.1)和红曲霉表达载体pBC-Hygro多克隆位点的特征,设计Asp基因引物。引物序列:Asp-ORF-F:5′-TCCCCCGGGATGGTCGTCTTCAGCAAGATCAC-3′,Asp-ORF-R:5′-TCCCCCGGGTTATGCCTGAGG GGCAAATCCGA-3′。以红曲霉cDNA为模板,用上述引物扩增得到长度为1200 bp左右的基因片段。将该片段连接到pMD-18T载体,转入大肠杆菌(E.coli)DH5α,获得的阳性克隆委托华大公司测序,测序后进行Blast比对分析。
1.2.2Asp基因红曲霉同源载体的构建将包含有Sma I识别位点的Asp片段和载体pBC-Hygro分别用Sma I限制性内切酶进行酶切,使用胶回收试剂盒回收,纯化酶切后的Asp片段和线性pBC-Hygro载体,然后使用T4连接酶将Asp片段连接到pBC-Hygro载体上。使用引物Asp-ORF-F和Asp-ORF-R筛选重组子,并将筛选出的重组子进行Sma I酶切,验证酶切结果是否含Asp基因和线性质粒的两条片段。如图1所示。
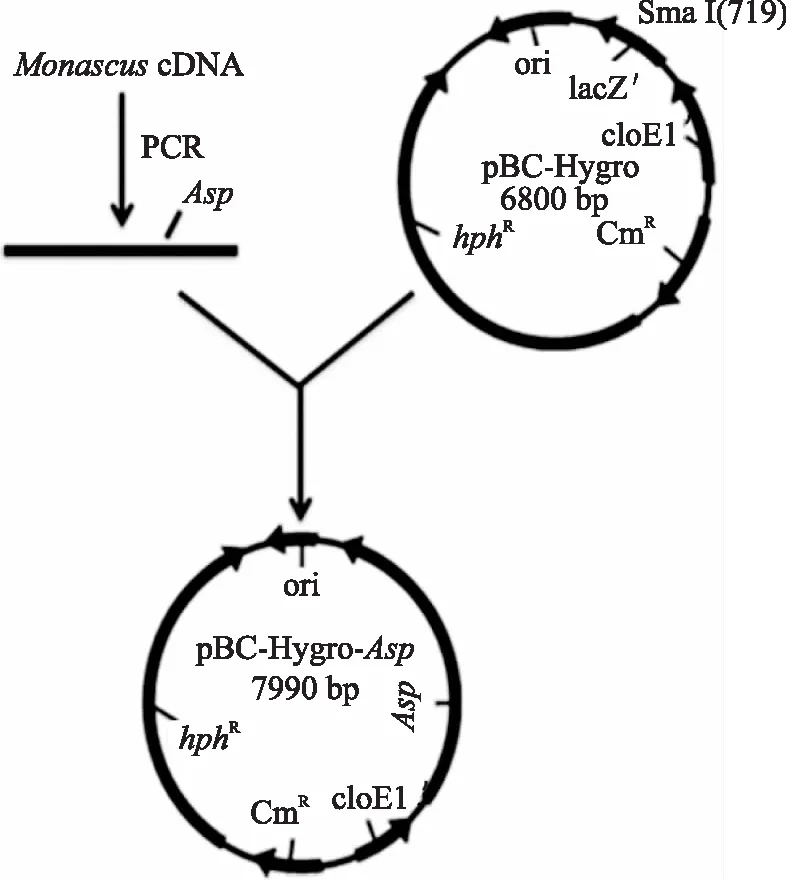
图1 表达载体pBC-Hygro-Asp的构建图谱Fig.1 pBC-Hygro-Asp expression vector
1.2.3Asp基因在红曲霉中的同源表达采用冻融法将重组质粒pBC-Hygro-Asp转化到根癌农杆菌中。从YEB平板(含34 μg/mL氯霉素、50 μg/mL利福平)上挑取重组农杆菌扩培,取菌液进行PCR扩增以验证重组载体是否已转入农杆菌。在重组农杆菌菌液中加入200 μmol/mL的乙酰丁香酮溶液,200 r/min培养4 h。同时用含有0.05%聚山梨酯-80的0.85%生理盐水洗脱固态培养的红曲霉孢子。将诱导好的根癌农杆菌和红曲霉孢子OD600值调至0.7,取等量诱导后的重组农杆菌与红曲霉孢子涂布在共培养培养基中的玻璃纸上,33℃培养2 d。将玻璃纸揭下置于察氏培养基平板(含34 μg/mL氯霉素、20 μg/mL头孢噻污钠)上,33℃培养7 d。挑取玻璃纸上长出的红曲霉单菌落转移至麦芽琼脂培养基(含100 μg/mL潮霉素)扩培,提取其基因组DNA,PCR检验潮霉素抗性基因hph序列,以验证重组质粒是否转入红曲霉[6]。检验hph序列所用引物序列为:hph-F:5′-GCAAGACCTGAAAC-3′,hph-R:5′-CTCCATACAAGCCAACCAC-3′。
1.3Asp基因表达量和酸性蛋白酶表观酶活的测定
参考GenBank:AJ417880.1设计红曲霉酸性蛋白酶qPCR内参引物,其序列为:actin-F:5′-CCCAAGTCCAACAGGGAG-3′,actin-R:5′-CACAGAGTCAAGCACGATA-3′。制备红曲霉野生型菌株和红曲霉转化子菌株的cDNA,以其为模板,对红曲霉酸性蛋白酶基因进行qPCR反应。
将红曲霉转化子菌株和野生型菌株分别接种于发酵培养基,33℃培养120 h[7-8]。在酸性蛋白酶鉴定培养基平板上打孔,将野生型菌株和红曲霉转化子菌株的发酵液分别滴1 mL到孔内,置于35℃,保温20 h,观测水解圈直径。
1.4红曲霉Asp基因的序列分析
1.4.1红曲霉酸性蛋白酶亲疏水性、跨膜结构域、信号肽分析蛋白质折叠时会形成疏水内核和亲水表面,同时在潜在跨膜区出现高疏水值区域。因此,通过亲疏水性图谱能反映其结构上的折叠情况。利用生物信息学工具:ProtScale、TMHMM server v 2.0、SignalP可分别实现对红曲霉酸性蛋白酶亲疏水性、跨膜结构域、信号肽的分析。
1.4.2红曲霉酸性蛋白酶系统进化树的构建和分子钟假说检验利用软件MEGA 5将红曲霉酸性蛋白酶基因序列与赤曲霉、米曲霉、烟曲霉、黑曲霉等13种常用曲霉属丝状真菌的酸性蛋白酶基因序列进行聚类分析,构建出系统进化树,可对这些物种的遗传多样性和亲缘关系作出分析。同时根据系统进化树的分支对红曲霉酸性蛋白酶基因和赤曲霉酸性蛋白酶基因进行分子钟假说检验。先假设红曲霉与赤曲霉的酸性蛋白酶以相同速率进化,再根据P值判断是否接受该假设,以此比对二者的进化速率[9]。
2 结果和分析
2.1红曲霉Asp基因的克隆
以红曲霉基因组为模板,用引物Asp-ORF-F和Asp-ORF-R进行PCR扩增,得到1200 bp左右的特异性条带,如图2所示。将所得序列测序后进行Blast比对,结果与GenBank AB090877.1序列相似度达100%,表明红曲霉酸性蛋白酶基因被成功克隆。

图2 红曲霉酸性蛋白酶基因Fig.2 Asp gene fragment of Monascus注:M:2000 bp的 DNA Marker;1~4:Asp基因片段。
2.2同源表达载体的构建
将重组质粒用引物Asp-ORF-F和Asp-ORF-R进行PCR扩增,进行三次重复实验,均得到1200 bp左右的特异性条带,如图3a。同时,用Sma I限制性内切酶对该重组质粒进行酶切,酶切结果显示两条带,一条长度约为1200 bp,为Asp基因片段,另一条长度约为7000 bp,为pBC-Hygro线性质粒,如图3b。以上两个结果表明质粒pBC-Hygro-Asp构建成功。
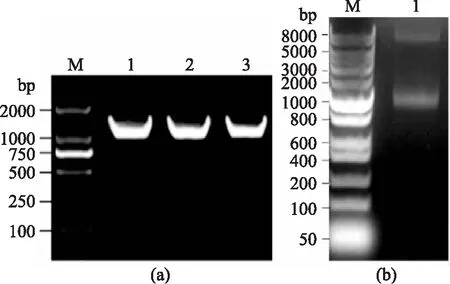
图3 重组表达质粒pBC-Hygro-Asp的构建Fig.3 Construction of pBC-Hygro-Asp recombinant plasm注:(a)M:2000 bp的DNA Marker;1~3:pBC-Hygro-Asp上的Asp基因片段;(b)M:8000 bp的DNA Marker;1:pBC-Hygro-Asp的酶切验证结果。
2.3转化子的鉴定和筛选
潮霉素磷酸转移酶基因hph是重组质粒上的潮霉素抗性基因,野生型红曲霉没有该基因,故可用于转化子的筛选。将经过转化处理的菌株提取基因组后用hph序列验证,扩增的目的产物长度为425 bp(图4),结果表明pBC-Hygro-Asp重组质粒被成功转入红曲霉,实现了红曲霉酸性蛋白酶菌株的同源转化。
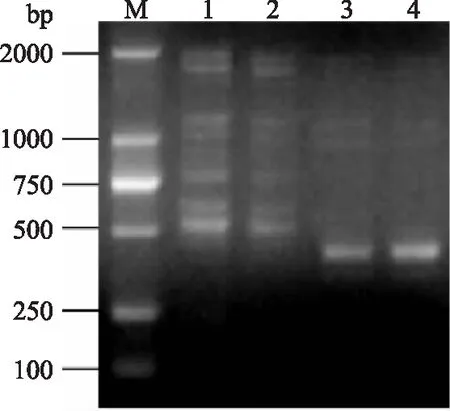
图4 红曲霉转化子菌株的hph验证Fig.4 hph gene verification of transformants注:1~2:野生型菌株;3~4:转化子菌株。
2.4转化子形态特征
从图5可看出在含有潮霉素(100 μg/mL)的麦芽琼脂培养基上接种的野生型红曲霉33℃培养9 d后并未生长,而在相同条件下接种的红曲霉转化子菌株表现出生长能力。同时,研究发现,在含潮霉素和不含潮霉素的条件下,转化菌株的表型产生一定的差异:在含潮霉素的培养基上,转化子菌株生长速度较缓慢,菌丝呈现鲜艳的橘红色,菌落边缘不规则且菌丝体较少;而在不含潮霉素的培养基上,菌株生长速度较快,与野生型菌株相比菌落形态相似,但在菌落外围出现了颜色更深的橘色圆圈。

图5 红曲霉菌株菌落形态Fig.5 The colonies of Monascus strain注:(a)野生型菌株,(b)转化子菌株,(c)含潮霉素培养基上的野生型菌株,(d)含潮霉素培养基上的转化子菌株。
原因可能是:红曲霉是经聚酮途径合成色素,转化子相比于野生型菌株能产生更多酸性蛋白酶,从而分解更多的蛋白质为氨基酸,这部分具有前体作用的氨基酸能够刺激红曲霉更多色素的合成[10]。同时,分解产生的氨基酸也能为红曲霉的生长提供更多的氮源。因此,导致红曲霉转化子菌株生长更旺盛,菌落颜色更鲜艳。
将红曲霉转化子进行传代培养,根据各代转化子总DNA中重组质粒pBC-Hygro-Asp上的hph片段以验证重组质粒的遗传稳定性。电泳结果表明,将转化子红曲霉传至第四代,该重组质粒在红曲霉中仍稳定表达,说明所构建的红曲霉转化子遗传稳定性较好(图6)。

图6 红曲霉转化子遗传稳定性验证Fig.6 The hph genetic stability of transformant注:1:第一代转化子菌株,2:第二代转化子菌株,3:第三代转化子菌株,4:第四代转化子菌株。
2.5转化子Asp基因表达量和表观酶活的测定结果
测量酸性蛋白酶鉴定培养基上的水解圈外径和水解孔内径,算出实际水解的面积。结果表明,红曲霉转化子菌株和野生型菌株的等量发酵液在鉴别培养基上20 h内产生的水解面积均值比为2.04。同时,qPCR结果显示,红曲霉转化子菌株的酸性蛋白酶基因表达量是其野生型菌株酸性蛋白酶基因表达量的3.30倍(图7)。说明重组质粒转入红曲霉后,酸性蛋白酶基因表达量上调,转化子菌株分解蛋白质的能力较野生型红曲霉菌株显著增强。因此,红曲霉酸性蛋白酶基因的同源表达实现了其酸性蛋白酶高产菌株构建的目的。

图7 红曲霉酸性蛋白酶基因qPCR结果Fig.7 The qPCR result of Monascus Asp
2.6红曲霉酸性蛋白酶基因序列分析结果
2.6.1红曲霉酸性蛋白酶亲疏水性、跨膜结构域、信号肽的分析结果根据红曲霉酸性蛋白酶基因序列,分析可得红曲霉酸性蛋白酶分子量为41.4 ku,从亲疏水性序列谱可判断目的序列的疏水性氨基酸分数最大值为2.056,最小值为-2.533,均值为-0.133,由此,可以认为红曲霉酸性蛋白酶具有亲水性。
跨膜受体是参与细胞与外界通信的特殊整合膜蛋白,在信号转导中发挥着重要的作用。胞外信号分子附加到跨膜受体,从而引发了细胞的信号转导。通过对红曲霉酸性蛋白酶信号肽的预测可以确定该蛋白是否能跨膜转移至特定亚细胞结构以及是否分泌到红曲霉体外。跨膜蛋白一般以疏水的α-螺旋与膜脂肪发生非共价结合,在细胞中常执行信号传导或转运通道功能。利用TMHMM分析,表明红曲霉酸性蛋白酶无跨膜螺旋区,即该蛋白不参与红曲霉与外界的通信,不能引发红曲霉的信号转导[11]。
红曲霉酸性蛋白酶信号肽分析结果表明最大C值出现在第21位氨基酸,为剪切位点。S-mean和D值作为区分分泌蛋白和非分泌蛋白的标准,非分泌蛋白计算值较低。研究结果揭示:红曲霉酸性蛋白酶的S-mean值为0.542,D值为0.481。因此,红曲霉酸性蛋白酶具有信号肽,它最可能的剪切位点在第20和21位点间,成熟蛋白启动的位置是第21位点,且该蛋白为分泌型蛋白。
2.6.2红曲霉酸性蛋白酶系统进化树构建和分子钟假说检验图8为红曲霉酸性蛋白酶基因进化树。其结果表明红曲霉与赤曲霉的亲缘关系最为接近,其次是红绶曲霉、米曲霉和黄曲霉,表明在这几种曲霉中该拷贝酸性蛋白酶序列没有发生快速变化。酸性蛋白酶家族共有模式为:[LIVMFGAC]-[LIVMTADN]-[LIVFSA]-D-[ST]-G-[STAV]-[STAPDENQ]-{GQ}-[LIVMFSNC]-{EGK}-[LIVMFGTA],其中D为氨基酸活性位点残基。将红曲霉酸性蛋白酶序列与家族序列比对,可知二者模式完全匹配。
此外,对红曲霉和赤曲霉的进化速率进行了分子钟假设的检验。假设红曲霉与赤曲霉以相同速率进化,以最先进化的红绶曲霉为外类群,发现三条序列共有位点为10个,卡方检验值为0.41(自由度为1,p=0.52),由于p值大于0.05,因此假设成立,红曲霉和赤曲霉的酸性氨蛋白酶以相同速率进化。

图8 红曲霉酸性蛋白酶基因进化树Fig.8 Phylogenetic tree of Monascus Asp
3 结论
本文通过红曲霉酸性蛋白酶基因的同源表达,得到红曲霉酸性蛋白酶的同源转化子,表明利用红曲霉孢子在根癌农杆菌介导下实现红曲霉的同源转化是可行的。获得的重组转化子的酸性蛋白酶基因表达量是野生型菌株的3.30倍,且经过传代验证仍具有该重组特性,遗传稳定性较好。根据对红曲霉酸性蛋白酶基因序列的分析,可得知红曲霉酸性蛋白酶是一种分泌型的亲水蛋白,不参与信号转导,且与酸性蛋白酶家族序列完全匹配,没有特异位点,并与赤曲霉的酸性蛋白酶有相同的进化速率。
[1]Lakshman,P L,Tachibana S,Toyama H,et al.Application of an acid proteinase from Monascus purpureus to reduce antigenicity of bovine milk whey protein[J].J Ind Microbiol Biotechnol,2011,38:1485-92.
[2]Steven C,Van S,Nicholas I,et al.Aspartic Acid protease from
Botrytis cinerea removes haze-forming proteins during white winemaking[J].J Agric Food Chem,2013,61:9705-9711.
[3]Yin L J,Hsu T H,Jiang S T.Characterization of acidic protease from Aspergillus niger BCRC 32720.[J]J Agric Food Chem,2013,61:662-666.
[4]Virginia M G,Alejandro T J,Ainhoa A C,et al.Purification and characterization of the extracellular aspartyl protease APSm1 from the phytopathogen fungus Stenocarpella maydis[J].Protein Expres Purif,2015,98:1046-1050.
[5]曹治云.黑曲霉产酸性蛋白酶催化机制和稳定剂研究[D].福建:福建师范大学,2005.
[6]Cai Q M,Jiang D H,JI H,et al.Establishment and Optimization of Agrobacterium-mediated Transform-ation Systems for Monascus purpureus[J].Journal of Microbiology,2010,30(5):68-73.
[7]郭继平,马光.响应面优化米曲霉酸性蛋白酶的固态发酵培养基[J].中国酿造,2009,209(8):125-128.
[8]Radha S,Nithya V J,HimakiranBabu R,et al.Production and optimization of acid protease by Aspergillus spp under submerged fermentation[J].Archives of Applied Science Research,2011,3(2):155-163.
[9]Long C X,Zhang B,Ma S,Research Progress of Molecular Clock[J].Agricultural Science & Technology,2012,13(12):2496-2498.
[10]朱雷,常慧萍,唐欣昀,等.几种酶活抑制剂对红曲霉色素合成的影响[J].微生物学通报,2007,47(4):706-709.
[11]薛庆中.DNA和蛋白质序列数据分析工具[M].第三版.北京:科学出版社,2014,80-83.
Homologous expression and sequence analysis of Monascus Asp gene
QIU Si-jia1,HUO Dan-qun1,*,HOU Chang-jun1,TANG Yu-ming2, YU Meng-lu1,YIN Zhong-yuan1,DENG Bo3,YANG Ping1,3
(1.College of Bioengineering,Chongqing University,Chongqing 400044,China; 2.Luzhou Liquor-making Science Research Institute,Luzhou 646000,China; 3.National Engineering Research Center of Solid-State Brewing, Luzhou Laojiao Group Co.Ltd.,Luzhou 646000,China)
In this work,the coding region of Asp was amplified by PCR from the genomic DNA of the Monascus and the homologous vector pBC-Hygro-Asp was constructed and then was introduced into the Agrobactium tumefaciens strain GV3101 for further study.The agrobacterial cells harboring the pBC-Hygro-Asp vector was introduced into the genome of Monascus via Agrobacterium tumefaciens-mediated method and the positive recombinant of Monascus was obtained.The expression level of acid protease gene in transformants strain was 3.30 times that of the wild Monascus,which indicated that the Monascus recombinant with high yield of acid protease was successfully achieved.The gene sequence of acid protease showed the gene had two aspartic proteases with active sites and the protease was a hydrophilic secretory protein without performance of signal transduction and keet the same evolution rate as that of Aspergillus ruber.
Monascus;acid protease;homologous expression;sequential analysis
2015-09-21
邱思佳(1990-),女,硕士研究生,研究方向:微生物分子生物学,E-mail:1990qsj@sina.com。
霍丹群(1965-),女,博士,教授,研究方向:微生物资源开发与利用、生物大分子的结构与功能,E-mail:huodq@cqu.edu.cn。
国家科技支撑计划(2014BAD07B02);四川省科技支撑计划(2010NZ0093);酿酒生物技术及应用四川省重点实验室项目(NJ2011-03,NJ2014-03);重庆大学大型仪器设备开放基金。
TS201.3
A
1002-0306(2016)07-0105-05
10.13386/j.issn1002-0306.2016.07.013
