反相微乳法与碱法、酶法制备的茶蛋白功能性质比较研究
2016-09-12万紫媛解新安
文 静,万紫媛,解新安,李 雁,李 璐
(华南农业大学食品学院,广东广州 510642)
反相微乳法与碱法、酶法制备的茶蛋白功能性质比较研究
文静,万紫媛,解新安*,李雁,李璐
(华南农业大学食品学院,广东广州 510642)
本文以绿茶茶渣为原料,采用新兴的反相微乳法提取制备茶渣蛋白,以开发利用茶渣蛋白为目标,对茶渣蛋白的功能特性展开研究,并与碱溶酸沉法、酶法茶蛋白功能性质比较分析。对CTAB-Tween80反相微乳提取制备的茶渣蛋白的功能性质进行研究,结果表明:茶渣蛋白在pH4.0时溶解度最低,溶解度随pH的增加呈现先降低后升高的趋势,其吸油性为2.54 g/g,持水力为1.78 g/g,乳化性为60.27%、乳化稳定性为84.56%,发泡性为68.69%、泡沫稳定性为59.30%。表明反相微乳法制备的茶渣蛋白除了在吸油性、持水力及泡沫稳定性方面与碱溶酸沉法和酶法稍有差异外,乳化性、乳化稳定性及发泡性等均优于碱溶酸沉法和酶法,因而反相微乳法可较好的保持茶渣蛋白的功能特性。
反相微乳,茶蛋白,功能特性,溶解性
茶蛋白属于植物蛋白,氨基酸组成丰富,不含胆固醇,非常适合高血脂、高脂质等特殊人群食用;茶蛋白还具有显著的抗氧化、清除自由基及预防辐射等作用。由于茶蛋白中含有约80%谷蛋白、约14%醇溶蛋白,难以用水直接提取,很难被机体直接消化吸收,因此茶蛋白是一种尚未被充分开发利用的植物蛋白资源[1]。目前常用的蛋白质提取方法有碱溶酸沉法和酶法。
碱法提取简单,提取率高,但是高浓度的碱液会造成不利反应,如导致蛋白的营养学特性发生变化,造成营养物质的损失;促进蛋白与糖等物质发生美拉德反应,易产生一些褐色物质等[2]。张士康等[3]通过对碱法提取的茶蛋白功能特性的分析,并与大豆浓缩蛋白比较,发现茶蛋白具有较优的功能性质。酶法提取条件较温和,但经过蛋白酶部分水解后的蛋白,其功能性质容易发生变化,不能保持蛋白质原有特性[4]。与碱法提取相比,目前酶法提取工艺尚不成熟,提取率较低,成本高的缺点制约了其在工业中的应用。
W/O(油包水)型微乳又称反相微乳或溶胀的反胶束,它是表面活性剂在非极性有机溶剂中自发形成的热力学稳定和光学透明的纳米级聚集体[5]。反相微乳中表面活性剂的非极性端朝外指向有机溶剂,极性端朝内聚集增溶一部分水形成“水池”,该“水池”具有增溶蛋白质的能力,从而实现植物蛋白的萃取[6]。利用反相微乳萃取生化物质是近些年来在非水相提取方面的一项新技术[7]。与传统的碱溶酸沉法、酶法相比,反相微乳法不仅具有成本低、可连续操作等优点,而且反应条件温和,其特有的“水池”结构对活性物质具有一定的保护作用,可减少蛋白质活性损失[8-9]。
本文采用CTAB-Tween80反相微乳提取制备茶蛋白,对其功能特性展开研究。参考文献中碱溶酸沉法、酶法茶蛋白功能性质数据,分析比较反相微乳法与碱溶酸沉法、酶法茶蛋白的功能性质,对指导茶蛋白应用于食品中具有积极的意义,为反相微乳萃取茶蛋白的研究提供一定的理论基础。
1 材料与方法
1.1材料与仪器
绿茶茶渣馒头岭茶厂提供,煮沸浸提三次。色拉油为市售色拉油,十六烷基三甲基溴化铵(CTAB)来自于广州市雨韶贸易有限公司,实验所用试剂均为分析纯。
PL203电子天平梅特勒-托利多仪器有限公司;78-1磁力加热搅器金坛市富华仪器有限公司;FM200高剪切分散乳化机上海弗鲁克流体机械制造有限公司;FJ-200高速分散均质机上海标本模型厂;KQ-100超声波清洗机昆山市超声仪器有限公司;DF-15中药粉碎机温岭市大德中药机械有限公司;DL-5高速离心机上海安亭科学仪器厂;HH-2数显恒温水浴锅常州澳华仪器有限公司;HYP消化炉上海纤检仪器厂;凯氏定氮蒸馏装置上海精科;TA.XT2质构仪英国Stable Micro System公司。
1.2实验方法
1.2.1制备茶渣将茶叶按料液比1∶40(g∶mL)加入到预先加热至沸腾状态的蒸馏水中,100℃水浴搅拌浸提20 min后过滤,同法再浸提两次,得到茶渣备用。
1.2.2反相微乳法按照反相微乳表面活性剂浓度为0.01 g/mL,CTAB质量分数70%分别称取表面活性剂置于烧杯中,同时加入有机溶剂异辛烷/正辛醇(二者体积比为4∶1),在磁力搅拌器上搅拌使其溶解,待其完全溶解后,加入0.08 mL浓度为0.10 mol/L KCl的溶液,调节pH至10,根据加入的KCl溶液的量调节反相微乳的W0值,超声波振荡(功率为100 W,下同)至澄清透明,得到的体系即为反相微乳液。
取上述反相微乳液置于锥型瓶中,加入一定量的茶渣,茶渣添加量为0.015 g/mL,超声40 min,然后4000 r/min离心20 min。
萃取体系分为两层,上层为含有蛋白质的反相微乳层,下层为残渣,留取上层备用。
1.2.3碱溶酸沉法参考文献[10]用碱溶酸沉法制备茶渣蛋白,并对茶渣蛋白的溶解性、吸油性、持水力、胶凝性、乳化性及乳化稳定性和发泡性及泡沫稳定性进行研究,得到碱溶酸沉法茶蛋白在吸油性、持水力等方面有优势。基于此,本文选取碱溶酸沉法制备的茶蛋白与反相微乳法制备的茶蛋白的功能性质比较分析。
1.2.4酶法参考文献[1,11]用酶法制备茶蛋白,分别对其溶解性、吸油性、持水力等功能特性进行研究,酶法茶蛋白吸油性、泡沫稳定性等方面有优势。故本文选取酶法茶蛋白与反相微乳法茶蛋白的功能特性比较分析。
1.3茶蛋白功能性质的测定
1.3.1茶蛋白的溶解性称取茶蛋白200 mg分别溶解在50 mL pH为2、3、4、5、6、7、8、9、10、11、12、13的缓冲溶液中,80℃超声溶解1 h,3000 r/min离心20 min,测定上清液中蛋白含量[12]。蛋白质的测定参考GB 5009.5-2010凯氏定氮法。
根据下面的公式换算溶解度

1.3.2茶蛋白的吸油性称取200 mg茶蛋白置于15 mL刻度离心管中,加入10 mL色拉油,搅拌1 min后静置30 min,3000 r/min离心分离20 min,记录游离油的体积[13],茶蛋白的吸油性用下式计算:

1.3.3茶蛋白的持水力称取茶蛋白200 mg置于干燥离心管(m1)中,加入10 mL pH为7.0的缓冲溶液,搅拌均匀后60℃恒温水浴30 min,冷却30 min,15000 r/min离心分离10 min,除去上清液,称量离心管质量(m2),由下式计算茶蛋白的持水力[14]。
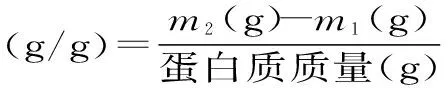
1.3.4茶蛋白的胶凝性称取1.0000 g的茶蛋白溶解于20 mL pH为7.0的缓冲溶液中,2.0 MPa均质3 min,然后转移至不锈钢离心管中,3000 r/min离心分离10 min,除去上层泡沫,用锡箔纸包好,置于80℃水中加热1 h,再用流动水冷却1 h,移至冰箱4℃过夜,取出凝胶物,观察胶凝性及其强度[14]。凝胶强度由质构仪测得,测定参数为:探头:A/BE(直径35 mm);测试深度:20 mm;触发应力:0.5 g;测试前速度:1 mm/s;测试速度:1 mm/s;测试后速度:10 mm/s。
1.3.5茶蛋白的乳化性及其稳定性称取1.0000 g的茶蛋白溶解到25 mL pH为7.0的缓冲溶液中,加入25 mL色拉油,2.0 MPa均质2 min,然后转移至不锈钢离心管中,在15000 r/min离心分离10 min,根据乳化层的高度计算其乳化性,同时测定乳化层中的含油率(W1)。然后将乳状液转移至50 mL试管中,50℃水浴30 min,测定其含油率(W2),根据前后两次测定的含油率计算茶蛋白的乳化稳定性[15]。
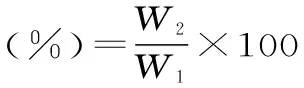
1.3.6茶蛋白的发泡性及其稳定性称取1.0000 g的茶蛋白溶解到50 mL pH为7.0的缓冲溶液中,用高速均质机以10000 r/min匀浆1 min,记录停止时刻的泡沫体积(V1)。泡沫的稳定性通过测定停止30 min后泡沫的体积(V2)来衡量[15]。
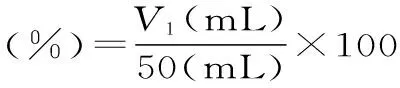

1.3.7数据统计分析所有实验的测定均进行三次,采用Micro soft excel 2010软件进行数据统计与分析。
2 结果与分析
2.1茶蛋白的溶解性
在蛋白质的功能性质之中,溶解性被认为是最重要的一个方面。植物蛋白的溶解性,即在各种条件下的溶解程度,是影响蛋白质在食品加工中利用程度的重要问题。良好的溶解性可以扩大蛋白质的潜在应用范围。蛋白质的乳化性、发泡性等都与其溶解性有着密切的关系[16]。掌握不同 pH下茶蛋白的溶解性,有利于指导茶蛋白在不同食品体系中的应用。反相微乳法制备的茶蛋白在不同pH下的溶解度如图1所示。
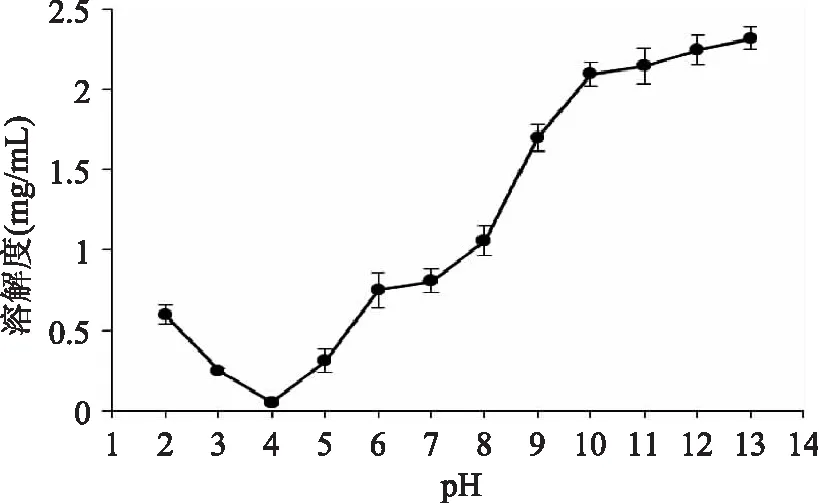
图1 茶蛋白在不同pH下的溶解度Fig.1 The solubility of tea protein at different pH
由图1可知,随着pH的增加,反相微乳法制备的茶蛋白的溶解度呈现先降低后升高的趋势,在pH为4.0左右时,茶蛋白的溶解度最低,这主要是因为茶蛋白的主要组成是碱溶性谷蛋白,谷蛋白的等电点在pH4.0左右,在此 pH附近其易发生沉淀,因此也可确定茶蛋白的等电点在pH4.0左右。随着pH上升,茶渣蛋白溶解度有较大的增加。
2.2反相微乳法制备的茶蛋白其他功能性质
反相微乳法制备的茶蛋白其他功能性质如表1所示。
蛋白质吸油性是指促进脂肪吸收和与脂肪结合的能力,对食品的风味来说,蛋白的吸油性是一重要的功能特性,可以提高食品对脂肪的吸收和保留能力,减少脂肪在加工过程中的损失,进而改善食品的适口性和风味。良好的吸油能力可以提高食品对脂肪的吸收和保存能力,减少脂肪在加工过程中的损失[17]。一般用每克蛋白质吸附油的质量来表示,常用离心法测定。从表1可知,反相微乳法制备的茶蛋白吸油性为2.54 g/g。

表1 反相微乳法制备的茶蛋白其他功能性质
蛋白质的持水力表示蛋白质的水化能力,即蛋白质分子通过直接吸附及松散结合而在其分子周围形成水化层的能力,这种吸水保水作用源于蛋白质的肽键和氨基酸侧链与水分子之间的相互作用而实现,蛋白质分子表面的极性基团与极性水分子具有亲合性,其结果和分子中极性基团的数目有关。蛋白质分子表面的极性基团越多,则吸水性越强。反相微乳法制备的茶蛋白持水力为1.78 g/g。
乳化性是指蛋白质将油水结合在一起形成乳状液的能力;乳化稳定性是指油水乳状液保持稳定的能力。蛋白质分子同时含有亲水性和亲油性基团,在油水混合液中可以扩散到油水界面形成油水乳化液,蛋白质促使油和水形成乳化液并保持乳化液稳定的能力即为蛋白质的乳化特性。蛋白质的乳化能力与其溶解性有关,较高的溶解度有较强的乳化能力。蛋白质能够扩散并吸附于油水界面,这是决定其乳化性最重要的特征。反相微乳法制备的茶蛋白乳化性为60.27%,乳化稳定性为84.56%。
蛋白质的水溶液受到机械搅拌时会有大量气体混入而形成一定的水一空气界面,蛋白质分子由于其极性及非极性基团的存在,表现出较强的表面活性而吸附到水一空气界面上形成蛋白质膜,从而降低界面张力,促进泡沫的形成,同时部分肤链在界面上伸展开来,通过分子内和分子间力相互作用,形成二维保护网络,维持泡沫的稳定。蛋白质的发泡性是蛋白质在食品工业应用中一种非常重要的性质。许多搅打型食品的质构和口感主要与蛋白组分的发泡性和泡沫稳定性有关,蛋白质在此起到表面活性剂的作用。反相微乳法制备的茶蛋白发泡性和泡沫稳定性分别为68.69%和59.30%。
蛋白质的胶凝性是指蛋白质形成胶体状结构的性能。它能使蛋白质具有较高的粘度、可塑性和弹性,既可做水的载体,也可做糖、风味剂以及其它配合物的载体,对食品加工极为有利。反相微乳法制备的茶蛋白可形成凝胶,凝胶强度为0.71±0.21。
3 讨论
本文选取CTAB-Tween80反相微乳制备茶蛋白,分析比较反相微乳法与碱溶酸沉法、酶法茶蛋白功能性质。碱溶酸沉法与酶法制备的茶蛋白功能性质如表2。
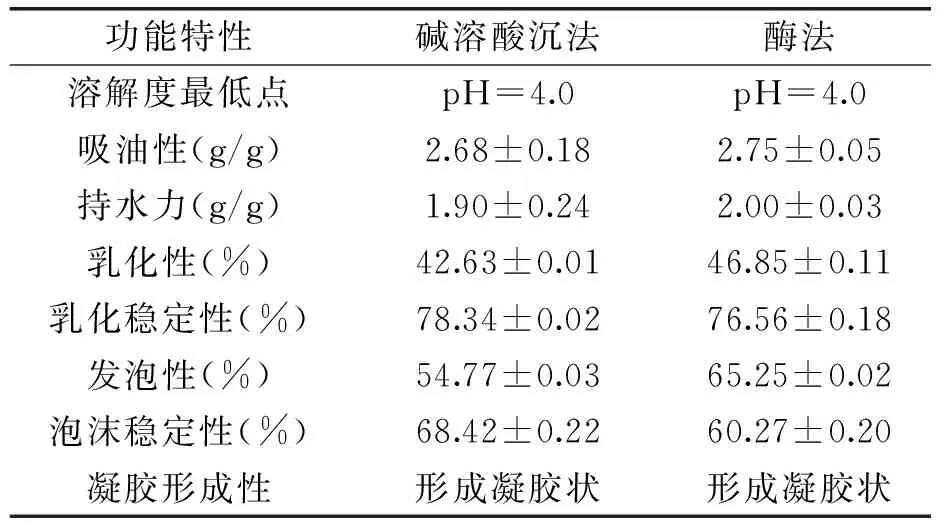
表2 碱法[10]、酶法[1,11]制备的茶蛋白功能性质
三种方法制备的茶蛋白均在pH为4.0左右时,茶蛋白的溶解度最低。随pH的增加,其溶解度均呈现先降低后增加的趋势。在同一pH条件下,茶蛋白溶解度的高低顺序为反相微乳法>碱溶酸沉法,这可能是与反相微乳对小分子量蛋白的选择性萃取有关,反相微乳对较小分子量的蛋白质萃取能力较强,小分子量的蛋白溶解性和分散性较好。反相微乳法对茶蛋白的溶解度具有较优的改善作用。
与反相微乳法制备的茶蛋白相比,碱溶酸沉法制备的茶蛋白的吸油性提高了5.51%,酶法制备的茶蛋白的吸油性提高了8.27%。碱溶酸沉法与酶法制备的茶蛋白吸油性优于反相微乳制备的茶蛋白。这种差异可能是由于反相微乳法制备的茶蛋白因受“水池”大小影响,其蛋白分子表面疏水基团较少,故与脂类物质的非极性基团相互作用较小,因此吸油性较低。
对反相微乳法和碱溶酸沉法、酶法制备的茶蛋白持水力进行比较,碱溶酸沉法制备的茶蛋白的持水力提高了6.74%,酶法茶蛋白持水力提高了12.4%。这可能是因为不同方法制备的蛋白质种类不同,而不同的蛋白质具有不同的结构,其内部带电极性基团对水的结合能力以及速度也存在着差异;另外由于反相微乳的萃取能力受“水池”大小影响,对大分子蛋白萃取能力较小,蛋白的含量较低,相对浓度较小。故蛋白质分子结合的水分子少,茶蛋白分子表面具有较多的疏水基团和较少的亲水基团。
与反相微乳法制备的茶蛋白乳化性、乳化稳定性相比,碱溶酸沉法、酶法制备的茶蛋白降低了29.27%、22.27%;乳化稳定性降低了7.36%、9.46%,反相微乳法制备的茶蛋白乳化性、乳化稳定性均优于碱溶酸沉法与酶法。茶蛋白的乳化性与其溶解度是密切相关的,一般情况下呈正相关;另一方面,反相微乳法制备的茶蛋白中残留的少量表面活性剂,会增强其乳化性,因此反相微乳法制备的茶蛋白乳化性优于碱溶酸沉法和酶法茶蛋白;酶法制备的茶蛋白由于碱性蛋白酶的水解作用,因而肽链变短,疏水基团暴露增加,小肽分子不能像大分子蛋白那样自由展开并适应界面张力,界面张力随着蛋白质在界面上浓度的降低而提高,因此酶法制备的茶蛋白的乳化稳定性降低[18]。
由表2可知,反相微乳法制备的茶蛋白发泡性优于碱溶酸沉法和酶法。与反相微乳法制备的茶蛋白相比,碱溶酸沉法和酶法制备的茶蛋白的发泡性降低了20.26%、5.01%。反相微乳法制备的茶蛋白大多是小分子蛋白[19],能很快进入气液界面,展开并重组界面,因而发泡性好;反相微乳法制备的茶蛋白在泡沫稳定性方面稍弱于酶法茶蛋白,这可能是因为蛋白酶的水解作用使蛋白质的疏水性氨基酸残基暴露,蛋白质分子快速吸附至气-水界面,导致界面表面张力降低,使得蛋白质泡沫稳定性较强。与反相微乳法制备的茶蛋白相比,碱溶酸沉法和酶法制备的茶蛋白的泡沫稳定性分别提高了15.38%、1.64%。
反相微乳法与碱溶酸沉法、酶法制备的茶蛋白都能形成凝胶,且凝胶都具有一定的性状和弹性。因此,茶蛋白有希望用于肉类、果冻、凝乳、奶酪等要求有一定凝胶性的食品中。反相微乳法制备的茶蛋白分子量小、肽链短,蛋白质分子间的结合力下降,导致反相微乳法制备的茶蛋白形成的凝胶强度较弱。
4 结论
本文用CTAB-Tween80反相微乳法制备茶蛋白,并比较了反相微乳法、碱溶酸沉法和酶法制备的茶蛋白的功能性质,得出以下结论:
反相微乳法制备的茶蛋白在溶解性、乳化性、乳化稳定性、发泡性方面均优于碱溶酸沉法;乳化性、乳化稳定性、发泡性分别提高了41.38%、7.94%、25.42%,在吸油性、持水力方面与碱溶酸沉法相差不大;
反相微乳法制备的茶蛋白在乳化性、乳化稳定性、发泡性方面优于酶法,分别提高了28.64%、10.45%、5.27%,而在泡沫稳定性方面与酶法茶蛋白相差不大。
[1]李圆圆.茶蛋白的酶法提取与功能性质研究[D].无锡:江南大学,2013(6).
[2]王忠英.茶叶中蛋白的提取及理化性质的研究[D].杭州:浙江工商大学,2006(6).
[3]张士康,王彬,张海华,等.茶渣蛋白功能特性研究[J].中国茶叶加工,2012,(3)31-34.
[4]Sajid Latif,Farooq Anwar,Abdullah I,et al.Aqueous enzymatic process for oil and protein extraction from moringa oleifera seed[J].European Journal of Lipid Science and Technology,2011,113(8):1012-1018.
[5]Hoar T P,Schulman J H.Transparent Water in Oil Dispersions:the Oleopathic Hydromicelle[J].Nature,1943(102):85-112.
[6]ZHAO Xihong,LI Yanmei,HE Xiaowei,et al.Study of the
Factors Affecting the Extraction of Soybean Protein by Reverse Micelles[J].Molecular Biology Reports,2010,37(2):669-675.
[7]Rashid O Anarbaey,Anastasia L Rgozina,Olga I Lavrik.DNA Polymerase Reveals Enhanced Activity and Processivity in Reverse Micelles[J].Biophysical Chenmistry,2009,141(1):11-20.
[8]Zhu K X,Sun X H,Chen Z C.Comparison of Functional Properties and Secondary Structures of Defatted Wheat Germ Proteins Separated by Reverse Micelles and Alkaline Extraction and Isoelectric Precipitation[J].Food Chemistry,2010(4):1163-1169.
[9]Zhou B,Wan J F,Wang J Z.Effect of Chaotropes in Reverse Micellar Extraction of Kallikrein[J].Process Biochemistry,2012,47(2):229-233.
[10]吴芳.非水溶性茶蛋白提取过程及其功能性质的研究[D].广州:华南农业大学,2014.
[11]王忠英.茶叶中蛋白的提取及理化性质的研究[D].浙江:浙江工商大学,2006.
[12]李娟,活泼,杨海燕.茶叶中非水溶性蛋白质提取工艺及功能性质的研究[J].浙江农业科学,2006(2):150-153.
[13]刘长江,宣丽,宗绪岩,等.啤酒糟提取蛋白吸水性和吸油性的研究[J].中国酿造,2009(9):65-69.
[14]宁正祥主编.食品成分分析手册[M].北京:中国轻工业出版社,1998.
[15]马勇,张丽娜,齐凤元,等.榛子蛋白质提取及功能特性研究[J].食品科学,2008,29(8):318-322.
[16]Suppavorasatit I,De Mejia E G,Cadwallader K R.Optimization of the Enzymatic Deamidation of Soy Protein by Protein-glutaminase and Its Effect on the Functional Properties of the Protein[J].J Agric Food Chem,2011,59(21):11621-11628.
[17]黄光荣,沈莲清,王向阳,等.茶叶蛋白质功能性质及其在肉制品中的应用研究[J].食品工程,2008(1):42-45.
[18]Gbogouri G A,Linder M,Fanni J,et al.Influence of Hydrolysis Degree on the Functional Properties of Salmon Byproducts Hydrolysates[J].Journal of food science,2004,69(8):615-622.
[19]Hecht H G,Peled H B.Structure Modifications of AOT Reverse Micelles due to Protein Incorporation[J].Journal of Colloid and Interface Science,2006,297:276-283.
Comparison of functional properties of tea protein in reverse micelles,alkali and enzymatic
WEN Jing,WAN Zi-yuan,XIE Xin-an*,LI Yan,LI Lu
(College of Food Science,South China Agriculture University,Guangzhou 510642,China)
To develop the utilization of tea residue protein,the effects of reverse micelle system CTAB-Tween80 on some functional properties of tea residue protein were investigated,compared with the effects of alkali-solution and acid-isolation as well as enzymatic method.The results showed that tea residue protein had the lowest solubility at pH4.0,then solubility had a rising trend with increasing pH.The oil absorption capacity and the water absorption capacity were 2.54 g/g and 1.78 g/g,respectively,while the foam stability was 59.30%.Besides,the emulsibility was 60.27% with reverse micelle system CTAB-Tween80 preparation,the number was 84.56% in terms of emulsion stability.And the foam capacity valued 68.69%.Tea residue protein with reverse micelle system CTAB-Tween80 preparation can form gel.In summary,tea residue protein with reverse micelle system CTAB-Tween80 preparation showed excellent emulsibility,emulsion stability and foam capacity despite its slightly poorer performance in the oil absorption capacity,water holding capacity and foam stability test,in comparison with tea residue protein with either alkali-solution and acid-isolation or enzymatic method,so reverse micelle system can keep the tea residue protein functional properties better.
reverse micelle;tea residue protein;functional properties;solubility
2015-08-11
文静(1991-),女,硕士研究生在读,研究方向:食品加工过程模拟与优化,E-mail:765258383@qq.com。
解新安(1964-),男,博士,研究员,研究方向:食品加工与模拟,E-mail:xinanxie@scau.edu.cn。
广州市科技计划项目(201510010099);现代农业产业技术体系建设专项资金(CARS-23)。
TS272.5
A
1002-0306(2016)07-0097-05
10.13386/j.issn1002-0306.2016.07.011
