杜香多糖的单糖组分分析及其理化性质研究
2016-09-12张乔会逄锦慧田盼盼王建中罗兴武
张乔会,逄锦慧,田盼盼,王建中,罗兴武,*
(1.湖北民族学院科技学院,湖北恩施 445000;2.北京林业大学林业食品加工与安全北京市重点实验室,北京 100083)
杜香多糖的单糖组分分析及其理化性质研究
张乔会1,2,逄锦慧2,田盼盼1,王建中2,罗兴武1,*
(1.湖北民族学院科技学院,湖北恩施 445000;2.北京林业大学林业食品加工与安全北京市重点实验室,北京 100083)
为分析杜香多糖的单糖组成、酶抑制作用及抗氧化性能,采用高效阴离子色谱法、PNPG法及ABTS法对杜香多糖样品进行了分析检测。检测得到杜香多糖含有鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖几种单糖组分;其对α-葡萄糖苷酶的抑制与浓度呈正相关,在3 mg/mL时,抑制率达30%;清除ABTS自由基的EC50为2.25 mg/mL。杜香多糖含有丰富的单糖组成,具有较好的α-葡萄糖苷酶抑制和体外抗氧化活性。
杜香,多糖,单糖组分,抗氧化,α-葡萄糖苷酶抑制
杜香(Ledum palustre L.)为杜香属的常绿灌木[1],是我国东北主要森林组成树种,其分布面积约占大兴安岭林地面积的70%[2]。据资料显示,大兴安岭杜香干叶年生产量可达536925 t[3]。杜香含有多种挥发性成分[4]、萜类[5]、熊果酸[6]、多糖[7]等成分。
多糖的单糖组成分析是其性质、结构及构效关系研究的一项基本且重要的内容,可以对多糖的研究利用提供直接的依据。目前对多糖的单糖组分分析主要采用糖腈乙酸酯衍生化[8-9]、糖醇乙酸酯化[10]、糖醇三氟乙酸化[11]、PMP衍生化[12-15]、硅烷衍生化[16]、甲基化后利用液相色谱[17-18]、气相色谱[19-20]、质谱[21]等及阴离子色谱图法[22-23]等进行检测分析。本文采用高效阴离子色谱法(HPAEC)分析多糖的单糖组成,操作简便,检测限低,且准确度和精密度均较高,不需要进行衍生化,可以达到简便、高效、准确地分析多糖的单糖组成等目的。学者对杜香进行了较多的研究,但都集中在杜香精油上,对杜香多糖研究较少,张乔会等对多糖提取做了初步研究[7],对其性质等几乎没有研究。随着天然产物研究的不段深入,杜香资源开发潜力巨大,研究杜香多糖的组分及其理化性质等可为杜香的综合开发利用提供理论依据,从而促进其开发。
1 材料与方法
1.1材料与仪器

表1 α-葡萄糖苷酶抑制率检测反应体系的组成
杜香内蒙古金河林业局提供,北京林业大学植物专家鉴定,自然风干,磨粉,过40目筛,备用。
磷酸氢二钠,磷酸二氢钠,氯化钠,氢氧化钠,98%浓硫酸,去离子水,超纯水,单糖标准品(鼠李糖,阿拉伯糖,木糖,甘露糖,葡萄糖,半乳糖)纯度≥99%,Sigma;α-葡萄糖苷酶,4-硝基苯-α-D-吡喃葡萄糖苷PNPG,纯度≥99%,Sigma;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐。
KQ-500E型超声波清洗器昆山市超声仪器有限公司;QI-901涡旋混合器海门市其林贝尔仪器制造有限公司;台式离心机上海安亭科学仪器厂;RE-5203旋转蒸发仪上海亚荣生化仪器厂;METTLER TOLEDO 电子天平梅特勒-托利多仪器(上海)有限公司;Thermo Heto Power Dry LL1500 Freeze Dryer美国Thermo Fisher Scientific公司;S-3400N扫描电子显微镜日本日立公司;E-1010溅射镀膜机日本日立公司;Model 680 Microplate reader 酶标仪:BIO-RAD;HHS4型恒温水浴锅上海浦东跃新科学仪器厂;PHS-25型pH计上海精密科学仪器有限公司;ICS-3000双系统离子色谱仪(包括AS50自动进样器)美国戴安公司;MILLI-Q Advantage A10超纯水机美国密理博公司。
1.2实验方法
1.2.1杜香水溶性多糖的提取纯化采用水提醇沉法[7]。准确称取一定量的杜香枝叶粉,按1∶35(m/v)加入去离子水,然后放入恒温水浴震荡箱中80℃震荡6 h,离心分离液体和固体粉末,向上清液中加入无水乙醇至上清液体系中乙醇浓度为85%,放置于4℃冰箱中静置1 h后分离固液两相,固体反复溶解后加醇沉淀,用 Sevage法去除样品中的蛋白质,即用氯仿∶戊醇或丁醇4∶1比例混合,加到样品中振摇,使样品中的蛋白质变性成不溶状态,离心除去,所得样品在-110℃真空冷冻干燥,便可得到杜香多糖成品。
1.2.2杜香多糖红外及紫外检测将多糖样品配成100 μg/mL的溶液,利用紫外光谱仪在200~400 nm波长下进行扫描;将得到的样品粉末放入红外光谱仪中,在400~4000 cm-1波数范围,按分辨率为2 cm-1对其进行测定。
1.2.3杜香粗多糖的水解多糖的水解按Ling Yan Meng方法[24]。称取样品4~6 mg放于小瓶中,加入0.125 mL 72%的硫酸溶液和1.35 mL超纯水后放置于烘箱中105℃反应2.5 h,其间每30 min摇晃一次,反应结束后对反应后的液体进行过滤(0.45 μm),取少量过滤液体稀释50倍,备用。
1.2.4标准混合单糖液的制备分别称取一定量的鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖等单糖配制成混合单糖标准液备用。
1.2.5离子色谱分析取水解完成并稀释后的样品及标准品用高效阴离子色谱仪进行检测分析。检测条件如下:色谱柱:Dionex CarboPacTMPA20分析柱(4 mm×250 mm),CarboPacTMPA20保护柱(3 mm×30 mm);检测器:脉冲安培检测器;流速:0.5 mL/min;检测温度:30℃;进样体积:25 μL。
1.2.6α-葡萄糖苷酶抑制率的测定采用分光光度法进行测定[25],以PNPG为底物,通过α-葡萄糖苷酶酶解反应会释放出硝基苯酚,在400 nm处有最大吸光度,可以根据这一特性测定样品对α-葡萄糖苷酶的抑制活性。
配制0.5 mol/L的磷酸盐缓冲液(pH6.7)、25 mg/mL的α-葡萄糖苷酶溶液和0.9133 mg/mL的PNPG,在96孔酶标板每个小孔中依次加入缓冲液、样品溶液、PNPG和酶溶液,混匀后在37℃条件下反应1 h,然后加入50 μL碳酸钠溶液(0.67 mol/L)终止反应,在400 nm下用酶标仪测定吸光度值。测定反应体系如表1所示。
抑制率计算公式为:
酶抑制率活性(%)=[A空白-(A样品-A样品对照)]/A空白×100
1.2.7杜香水溶性多糖的SEM分析在扫描电子显微镜(SEM)设备下观察冷冻干燥后的杜香水溶性多糖的表面形态,扫描电镜采用10千伏的加速电压,检测前,使用溅射镀膜机对材料表面进行喷金。
1.2.8杜香多糖对ABTS自由基清除率的测定杜香多糖对ABTS自由基清除率的测定参照Chen Dan-jun[26]和黎云龙[27]等的方法进行,即先制备形成ABTS自由基储备液。然后按1∶50的比例用蒸馏水稀释为在30℃、734 nm波长处的吸光度为0.7±0.02的ABTS工作液。
样品管中加入200 μL不同浓度的杜香多糖样品液和3 mL ABTS工作液;空白管用蒸馏水代替杜香多糖溶液;对照管用蒸馏水代替ABTS工作液;以上三组在室温条件下避光放置1 h后,于波长734 nm处测定其吸光度(A)。
1.2.9数据处理采用Microsoft Excel(Office 2007)软件整理数据,Orgin软件进行统计分析。
2 结果与分析
2.1杜香多糖的紫外及红外检测结果
由图1可以看出,样品在200~400 nm波长范围内没有特征吸收峰;由图2可见,红外谱图在杜香多糖红外谱图在3389、2889、1156~1024、1024 cm-1的尖峰以及1648、1567~1370、903 cm-1等处具有强弱不同的吸收峰,在3389 cm-1和1156~1024 cm-1的峰分别为O-H和C-O的伸缩振动,2889 cm-1的尖峰以及1567~1370 cm-1的不太尖的峰分别为C-H的伸缩振动和变角振动,1024 cm-1的较强吸收也说明了杜香多糖中可能有葡萄糖结构,1648 cm-1处出现吸收峰,推测该峰为醛基中C=O的伸缩振动引起的,在903 cm-1波数处还出现吸收峰,说明其可能含有β-型糖苷键。样品的紫外和红外检测检测结果符合多糖的光谱吸收特征[28],说明样品为多糖。
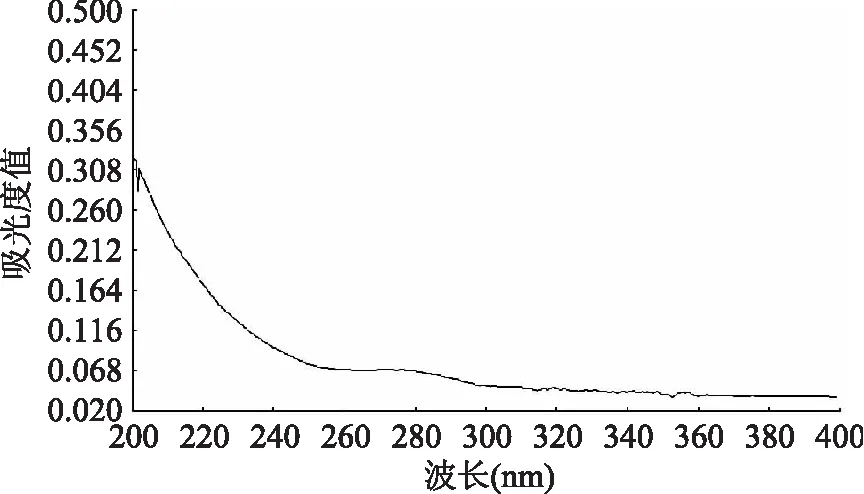
图1 杜香多糖紫外扫描光谱Fig.1 UV scanning spectrum of polysaccharide from Ledum
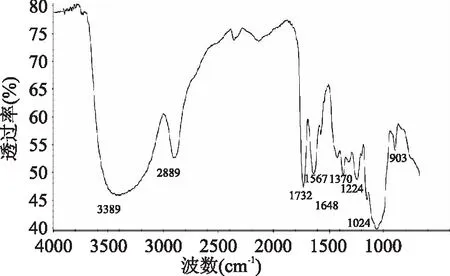
图2 杜香多糖的红外光谱图Fig.2 IR spectrum of polysaccharide from Ledum
2.2杜香水溶性多糖的电镜扫描分析
从以上电镜扫描图可以看出,冷冻干燥后的杜香水溶性多糖没有固定的形态,由于冷冻干燥的原因,整体结构类似海绵。符合多糖没有固定形态的物理特征。

图3 杜香多糖的扫描电镜图Fig.3 Scanning Picture of Ledum polysaccharide by SEM
2.3杜香多糖单糖组成分析结果
单糖混合标准液的离子色谱图见图4,通过对离子色谱工作站提供的图谱解析和单糖标准品混合样品的离子色谱图及离子色谱解数据的分析可知,从第一个峰到最后一个峰依次为鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖。
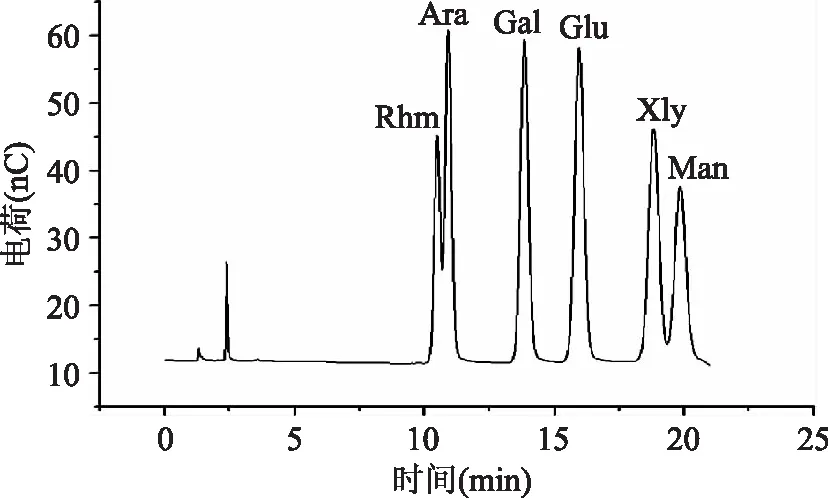
图4 标准混合单糖离子色谱图Fig.4 Ion chromatogram of standard mixed monosaccharides
杜香多糖的单糖组分组成从图5分析,经过标准品离子色谱图比对,确定了杜香多糖的单糖组成由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、甘露糖、半乳糖等单糖组成,且根据峰面积比较可知,葡萄糖及半乳糖成分含量相对较高。

图5 杜香多糖的离子色谱图Fig.5 Ion chromatogram of Ledum polysaccharide注:1:鼠李糖;2 阿拉伯糖;3半乳糖;4:葡萄糖;5:木糖;6:甘露糖。
2.4α-葡萄糖苷酶抑制率的测定结果
杜香多糖对α-葡萄糖苷酶的抑制率影响如图6所示。随着多糖液浓度的提高,抑制活性逐渐升高。根据抑制剂与抑制率曲线图可以看出,抑制剂浓度与抑制率基本呈现正相关关系,抑制率受浓度的影响明显,杜香多糖浓度增大,其对α-葡萄糖苷酶的抑制率升高。且当杜香多糖液浓度为3 mg/mL时,抑制率便达30%,相比于张淑鹏等提取的昆仑雪菊提取物具有较好的抑制效果[29]。

图6 杜香多糖对α-葡萄糖苷酶的抑制率Fig.6 Anti-α-glucosidase activity of Ledum polysaccharide
2.5杜香多糖的ABTS自由基清除结果
由图7可知:随浓度升高,杜香多糖和VC对ABTS自由基的清除率呈递增趋势,浓度越高,其清除效果越好,呈量效关系;当浓度为2.0 mg/mL时,杜香多糖的清除率为46.7%。由图可知,VC及样品对ABTS自由基的清除率在20%~60%间与浓度呈直线关系,可分别拟合成出一个一元一次方程,利用方程计算出杜香多糖及VC对ABTS自由基的EC50值分别为2.25 mg/mL和0.46 mg/mL。说明杜香多糖具有较好的抗氧化效果。
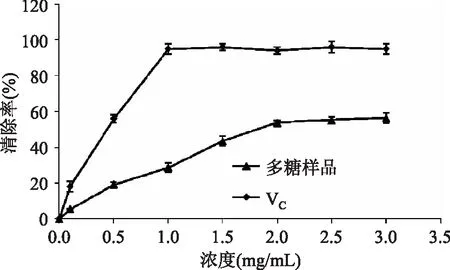
图7 杜香多糖与VC清除ABTS+能力的比较Fig.7 The scavenging rate of ABTS radical on polysaccharide from Ledum compared with VC
3 结果与讨论
本文利用水提醇沉法提取多糖,利用紫外及红外方法对其进行鉴定,利用电镜扫描进行表观鉴定,证明其含有多糖的典型基团,在200~400 nm范围内没有特征吸收峰,SEM下没有固定形态。利用高效阴离子色谱法对杜香总多糖水解后的单糖进行了组分分析,得到杜香总多糖含有鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖等单糖组分。采用PNPG法对杜香总多糖的α-葡萄糖苷酶抑制进行了分析测定,发现杜香多糖对α-葡萄糖苷酶的抑制与浓度呈正相关,抑制率受浓度的影响明显,杜香多糖浓度增大,其对α-葡萄糖苷酶的抑制率升高。且当杜香多糖液浓度为3 mg/mL时,抑制率便达30%,抑制效果较好。测定了其清除ABTS自由基的能力,其EC50值为2.25 mg/mL。分析单糖成分及其组成比例可为进一步纯化鉴定多糖结果提供基础依据,也可以为其开发利用提供一定方向。杜香多糖具有较好的抗氧化及α-葡萄糖苷酶抑制效果,可以将杜香多糖开发成具有辅助降血糖功能的保健食品等。
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1999:4.
[2]冯旭,周勇,郭立新.黑龙江省野生香料植物资源及其利用.国土与自然资源研究,1995;2(2):68~72.
[3]周以良.中国大兴安岭植被[M].北京:科学出版社,1991:239-310.
[4]N I Belousova,V A.Khan.Bicyclic monoterpenoids of the essential oil of Ledum palustre[J].Chemistry of Natural Compounds,1990,26(5):532-534.
[5]Xiu zhi long,Zhu xiu ling,Zhang dai jia,et al.A new way for chemical degradation of plastic by natural volatile constituents of Ledum palustre[J].Chinese Science Bulletin,2010,48(16):1718-1721.
[6]张乔会,逄锦慧,王建中,等.不同提取方法对杜香熊果酸提取得率的影响[J].食品工业科技,2014;35(23):217-222.
[7]张乔会,逄锦慧,王建中,等.响应面法优化杜香多糖提取工艺[J].天然产物研究与开发,2015,27(6):1105-1111.
[8]刘玉红.茶藨子木层孔菌多糖及其硫酸化衍生物的制备、结构分析与生物活性研究[D].济南:2007.
[9]艾连中,张灏,陈卫,郭本恒,等.干酪乳杆菌LC2W胞外多糖的分离纯化及性质研究[J].食品与机械,2007,23(1):9-11.
[10]Endwin P,Crowell P,Bumett R.Determination of the carbohydrate composition of wood pulps by gas chromatography of the alditol acetates[J].Analytical Chemistry,1967,39(1):121-124.
[11]Tamura Z.Nanogram order analysis of sugars by gas chromatography[J].Chemical & Pharmaceutical Bulletin,1967,15(2):246-247
[12]陈宁,赵君,李月惠,等.刺参水煮液糖蛋白组成成分分析[J].食品科学,2015,36(8):125-128.
[13]马耀宏,郑岚,杨俊慧,等.柱前衍生化HPLC法分析真菌多糖的单糖组成[J].食品科技,2012,37(1):254-259.
[14]玄光善,李青,王艳波.桦褐孔菌多糖脱色方法及其成分分析[J].食品科学,2014,35(10):207-211.
[15]屈浩亮,顾小红,汤坚,等.癞葡萄渣可溶性膳食纤维提取工艺的研究及其单糖组分分析[J].食品与机械,2008,24(4):73-78.
[16]孙明礼.半枝莲多糖的提纯、结构解析及其抗氧化活性的研究[D].西安:2008.
[17]宾宇波,王亚芸,任建武,等.铁皮石斛多糖分离纯化及单糖组成测定[J].食品工业科技,2014,35(4):122-125.
[18]张娟,王远兴,胡海涛,等.柱前衍生HPLC-UV-Q-TOF-MS分析黑灵芝多糖的酶解产物[J].食品工业科技,2014,35(5):285-288.
[19]邢丽,耿越.气相色谱法分析豌豆粉渣中多糖的单糖组分[J].食品科学,2014,35(22):252-254.
[20]杨俊红,张安强,孙培龙.金针菇子实体多糖均一组分FVP60-C2制备及单糖组成分析[J].食品科学,2013,34(3):86-89.
[21]刘晓飞,刘宁,张娜,等.气相色谱-质谱联用法测定玉米须多糖的单糖组成[J].食品科学,2012,33(20):249-251.
[22]Sun Shao Ni,Li Ming Fei,Sun Run Cang,et al.Sequential
extractions and structural characterization of lignin with ethanol and alkali from bamboo(Neosinocalamus affinis)[J].Industrial Crops and Products,2012,37(5):51-60.
[23]D Manns,A L Deutschle,B Saake,et al.Methodology for quantitative determination of the carbohydrate composition of brown seaweeds(Laminariaceae)[J].RSC Advances,2014,49(4):736-746.
[24]Ling Yan Meng,Su Min Kang,Xue Ming Zhang,et al.Fractional pretreatment of hybrid poplar for accelerated enzymatic hydrolysis:Characterization of cellulose-enriched fraction[J].Bioresource Technology,2012,110:308-313.
[25]王晟,张乔会,王建中,等.木瓜蛋白酶制备山杏源降糖肽工艺优化研究[J].食品工业科技,2014,35(9):169-173.
[26]Chen Dan jun,Fan Jun ting,Wang Peng,et al.Isolation identification and antioxidative capacity of water-soluble phenylpropanoid compounds from Rhodiola crenulata[J].Food Chemistry,2012,134(4):2126-2133.
[27]黎云龙,于震宇,郜海燕,等.骏枣多糖提取工艺优化及其抗氧化活性[J].食品科学,2015,36(4):45-49.
[28]高英,叶小利,李学刚,等.黄精多糖的提取及其对α-葡萄糖苷酶抑制作用[J].中成药,2010,32(12):2133-2137.
[29]张淑鹏,李琳琳,木合布力·阿布力孜,等.昆仑雪菊提取物对α-葡萄糖苷酶的抑制作用[J].现代生物医学进展,2011,11(6):1055-1058.
Characterization of the monosaccharide composition and physical and chemical properties of Ledum polysaccharides
ZHANG Qiao-hui1,2,PANG Jin-hui2,TIAN Pan-pan1,WANG Jian-zhong2,LUO Xing-wu1,*
(1.Science and Technology College of Hubei University for Nationalities,Enshi 445000; 2.Beijing Key Laboratory of Forest Food Processing and Safety,Beijing Forestry University,Beijing 100083)
The monosaccharide compositions,enzyme inhibition and antioxidant properties of Ledum polysaccharides were analyzed by the high performance anion exchange chromatography,PNPG and ABTS method.The anion exchange chromatography results showed that main composition of Ledum polysaccharide were rhamnose,arabinose,xylose,mannose,glucose and galactose.The inhibitory activity ofα-glucosidase effect was positively correlated with concentration,and the inhibition rate was 30%,when the concentration was 3 mg/mL.The EC50of scavenging effect of ABTS radical was 2.25 mg/mL.It contains abundant monosaccharide components and possessed excellent inhibitory activity ofα-glucosidase and antioxidant activity.
Ledum;polysaccharide;monosaccharide composition;antioxidant;inhibition of glucosidase
2015-08-27
张乔会(1986-),男,硕士,助教,研究方向:天然产物提取利用,E-mail:qiaohui.86@163.com。
罗兴武(1978-),男,硕士,副教授,研究方向:食品机械及天然产物提取,E-mail:lxwmss@163.com。
湖北民族学院科技学院自科课题(KJZ201604)。
TS201.1
A
1002-0306(2016)07-0071-05
10.13386/j.issn1002-0306.2016.07.006
