FAK对黑米花青素抑制HER-2阳性乳腺癌转移的影响研究
2016-09-12陈祥燕陈静瑶朱彦锋余小平
周 杰,陈祥燕,陈静瑶,李 飞,朱彦锋,余小平
(成都医学院公共卫生系,四川成都 610500)
FAK对黑米花青素抑制HER-2阳性乳腺癌转移的影响研究
周杰,陈祥燕,陈静瑶,李飞,朱彦锋,余小平*
(成都医学院公共卫生系,四川成都 610500)
目的:探讨粘着斑激酶(Focal Adhesion Kinase,FAK)在黑米花青素(Black Rice Anthocyanins,BRACs)抑制人表皮生长因子受体2(Human epidermal growth factor-2;HER-2)阳性乳腺癌转移中的作用。方法:以正常永生化乳腺细胞MCF-10A、HER-2阴性乳腺癌细胞MCF-7、HER-2阳性乳腺癌细胞MDA-MB-453为研究对象,使用Cell Counting Kits-8(CCK8)试剂盒检测细胞活性;伤痕愈合实验检测细胞转移状态;免疫印迹实验测定FAK、cSrc表达及磷酸化水平;免疫共沉淀实验检测HER/FAK蛋白间相互作用。结果:与对照组相比,分别用50、100、200、400 μg/mL BRACs处理MDA-MB-453细胞后,抑制率分别为18.74%、21.06%、22.82%、40.12%;200 μg/mL BRACs处理后MDA-MB-453细胞迁移距离减少37%;FAK及cSrc磷酸化水平降低,HER-2/FAK蛋白间相互作用减弱。结论:BRACs通过减弱FAK与HER-2受体相互作用抑制FAK及cSrc磷酸化从而抑制MDA-MB-453细胞增殖和转移,这可能是黑米花青素抑制MDA-MB-453细胞增殖和转移的分子机制之一。
人表皮生长因子受体2,乳腺癌,转移,粘着斑激酶
乳腺癌占全球癌症病例的25%,患癌女性死亡病例中乳腺癌患者占15%[1],极大威胁着女性健康。黑米花青素(BRACs)是来源于黑米皮中的黄酮类植物化学物质,现有研究资料证实这类化合物具有抗氧化、抗动脉粥样硬化、抗肿瘤等生物学效应[2-3]。已有研究表明,BRACs具有抑制HER2阳性乳腺癌血管生成、促进细胞凋亡作用[4]。在裸鼠MDA-MB-453移植瘤模型中,灌胃黑米花青素肿瘤增长速度减缓、肿瘤生长体积减小[5]。粘着斑激酶(FAK)是一种非受体酪氨酸激酶,主要作用是在整合素及黏着斑的作用下调节细胞表面受体从而参与调节细胞生理过程,FAK在多类肿瘤细胞中表现为过表达状态[6]。研究表明FAK通过整合素介导的信号通路参与调节细胞迁移和粘附[7],HER-2/HER-3受体信号通路通过在Y397、Y861以及Y925位点引起FAK磷酸化从而促进肿瘤侵袭[8],Vadlamudia等人发现HER-2受体能通过cSrc/FAK信号通路调节乳腺癌细胞转移能力[9]。本研究探讨BRACs对HER-2阳性乳腺癌细胞抗转移效应及FAK和cSrc对其抗转移效应的影响。
1 材料与方法
1.1材料与仪器
BRACs吉林新星天然药物公司(花青素含量43.2%);L-15不完全培养基凯基生物;DMEM高糖不完全培养基、DMEM/F12高糖不完全培养基美国Hyclone公司;胎牛血清、马血清美国Gbico公司;胰岛素日本Wako公司;EGF美国Peprotech公司;磁珠美国millipore公司;BCA试剂盒美国Thermo公司;鼠多克隆抗体Anti-HER-2、兔单克隆抗体Anti-FAK、鼠单克隆抗体Anti-cSrc、兔多克隆抗体Anti-Phospho-FAK(Y861)、兔多克隆抗体Anti-Phospho-cSrc(Y216)英国Abcam公司。
IX71倒置显微镜日本Olympus公司;XS2酶标仪中国BioTek公司;Thermo Scientific Forma 3110 CO2培养箱美国Thermo公司;PowerPacTMHC电泳仪美国Bio-RAD公司。
1.2细胞培养及分组
人乳腺癌细胞MDA-MB-453(雌激素受体阴性ER-,HER-2/neu高表达)中国科学院上海细胞库,含10%胎牛血清的L-15培养基常规培养;人乳腺癌细胞MCF-7(雌激素受体阳性ER+,HER-2/neu弱表达或不表达)中国科学院上海细胞库,含10%胎牛血清的高糖DMEM培养基常规培养;人正常上皮永生化细胞MCF-10A第三军医大学糜漫天教授惠赠,DMEM/F12培养基(5%马血清、20 ng/mL EGF、10 μg/mL胰岛素、0.5 μg/mL氢化可的松、100 μg/L霍乱毒素)常规培养。实验分为2组:空白对照组、BRACs处理组,处理浓度根据以往研究资料[10],设定为200 μg/mL,处理时间为24 h。
1.3CCK-8法检测BRACs对细胞增殖的影响
将MCF-10A、MCF-7、MDA-MB-453细胞调整细胞数至104个/mL,取100 μL接种于96孔板,培养24 h后加入终浓度为(0、50、100、200、400)μg/mL BRACs,每组设3个复孔。培养24 h,每孔加入10 μL CCK-8,继续培养3 h,于450 nm处测定吸光度(A)值。增殖率(proliferation rate,PI)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.4伤痕愈合实验检测细胞迁移能力
MCF-10A、MCF-7、MDA-MB-453细胞接种于24孔培养板,待细胞生长至90%密度,划痕处理,加入无血清培养基,分别用0、200 μg/mL BRACs处理细胞24 h后于相差显微镜下观察细胞迁移变化,用ImageJ软件计算各组划痕区域宽度平均迁移距离。
1.5Western Blot检测蛋白表达
Western Blot检测HER-2、FAK蛋白表达及FAK磷酸化水平。收取各实验组细胞总蛋白,用BCA法测定浓度,取100 μg总蛋白进行凝胶电泳后转移至聚偏二氟乙烯膜(PVDF),含10%脱脂牛奶的TBST封闭1 h,1∶1000稀释抗体4 ℃孵育过夜,TBST(含0.1%Tween-20的TBS缓冲液)漂洗3次(10 min/次),1∶2000稀释二抗室温孵育1h,TBST漂洗(3次,10 min/次)后进行化学发光法显色,Quantity One 软件分析结果。
1.6免疫共沉淀检测蛋白相互作用
Co-IP检测HER-2与FAK的相互关系。取细胞总蛋白,等量蛋白(1000 μg)液中加入HER-2抗体及免疫磁力珠进行免疫沉淀,SDS-PAGE电泳,转移至聚偏二氟乙烯膜(PVDF膜)上,然后加入FAK抗体4 ℃孵育过夜,HRP 结合的二抗37 ℃孵育2 h,ECL增强化学发光法检测蛋白间相互作用,并进行图像定量分析。
1.7统计学分析
实验数据用x±S表示,采用SPSS13.0软件进行单因素方差分析(one-way ANOVA),组间比较采用t检验。
2 结果与分析
2.1BRACs对MDA-MB-453细胞增殖的影响
BRACs分别处理正常乳腺上皮MCF-10A细胞、HER-2阴性乳腺癌MCF-7细胞以及HER-2阳性乳腺癌MDA-MB-453细胞24 h以后,用CCK8试剂盒检测细胞活性。如图1所示,BRACs对MCF-10A细胞活性无明显影响(p>0.05),50、200 μg/mL BRACs处理后MCF-7细胞活性有适当减少,无统计学意义(p>0.05),BRACs抑制了MDA-MB-453细胞的活性呈剂量依赖效应,与未加BRACs对照组相比,50、100、200、400 μg/mL BRACs对MDA-MB-453细胞抑制率分别为18.74%、21.06%、22.82%、40.12%(p<0.05)。

图1 BRACs对MDA-MB-453细胞活性的影响Fig.1 Effects of BRACs on the cell viability of MDA-MB-453 cells
2.2BRACs对MDA-MB-453细胞迁移的影响
细胞迁移是肿瘤细胞发生转移的重要过程,迁移有利于细胞从原来位置迁移到其他器官从而促进转移发生。BRACs处理MCF-10A、MCF-7以及MDA-MB-453三种细胞24 h后于相差显微镜下观察细胞迁移变化,用ImageJ软件计算各组平均迁移距离。如图2所示,与MCF-10A细胞相比,BRACs抑制了乳腺癌细胞MCF-7、MDA-MB-453细胞的迁移能力。200 μg/mL BRACs分别作用于MCF-7、MDA-MB-453细胞后,与未加BRACs对照组相比,MCF-7迁移距离与未加BRACs对照组相比降低了28%;MDA-MB-453细胞迁移距离相比未加BRACs对照组降低了37%,(p<0.05)。

图2 BRACs对MDA-MB-453细胞迁移的影响Fig.2 Effects of BRACs on the migration of MDA-MB-453 cells注:图A:a:对照组;b:200μg/mL BRACs组。
2.3BRACs对FAK磷酸化水平的影响
cSrc/FAK信号通路在调节HER-2阳性乳腺癌细胞转移中发挥着重要作用[9],使用免疫印记法(western blot)检测BRACs对HER-2阳性乳腺癌细胞cSrc、FAK磷酸化的影响,如图3所示,200 μg/mL BRACs分别作用于MCF-10A、MCF-7、MDA-MB-453细胞后,cSrc、FAK总表达量没有变化,cSrc、FAK磷酸化水平下降,BRACs降低了HER-2阳性乳腺癌MDA-MB-453细胞FAK的磷酸化,抑制了cSrc/FAK信号通路的激活。
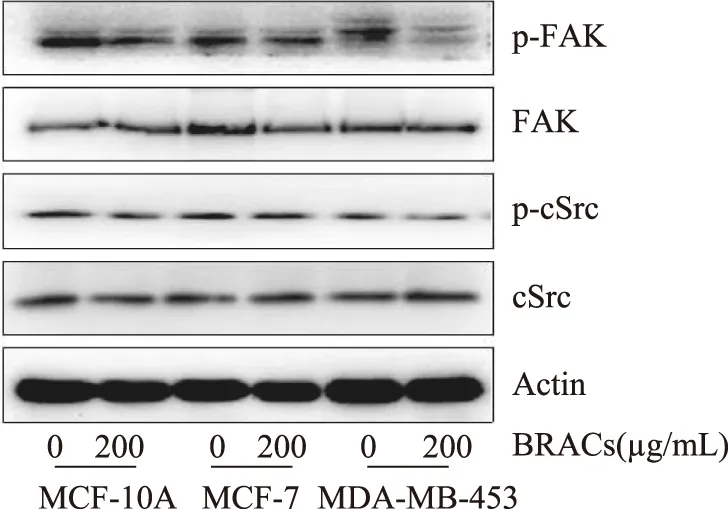
图3 BRACs对FAK和cSrc磷酸化水平的影响Fig.3 Effects of BRACs on the phosphorylation of FAK and cSrc
2.4BRACs对HER-2与FAK蛋白间相互作用的影响
已有研究表明FAK在HER-2/HER-3诱导的乳腺癌发生及侵袭中发挥重要作用[11],HER-2激活具有召集FAK诱导其磷酸化的能力,HER-2活化引起HER-2与FAK之间相互联系增加,选用免疫共沉淀法检测HER-2/FAK相互作用。先将人抗HER-2抗体、免疫磁力珠与样品蛋白免疫共沉淀以后检测FAK蛋白含量的变化。MDA-MB-453细胞为HER-2高表达乳腺癌细胞,如图4所示,选用HER-2抗体沉淀样品蛋白后MDA-MB-453组FAK信号更强,MDA-MB-453细胞经200μg/mL BRACs处理后,FAK信号减弱,这表明HER-2/FAK蛋白间相互联系减弱,BRACs可能是通过减弱HER-2与FAK的相互结合从而抑制FAK极其下游蛋白的磷酸化。
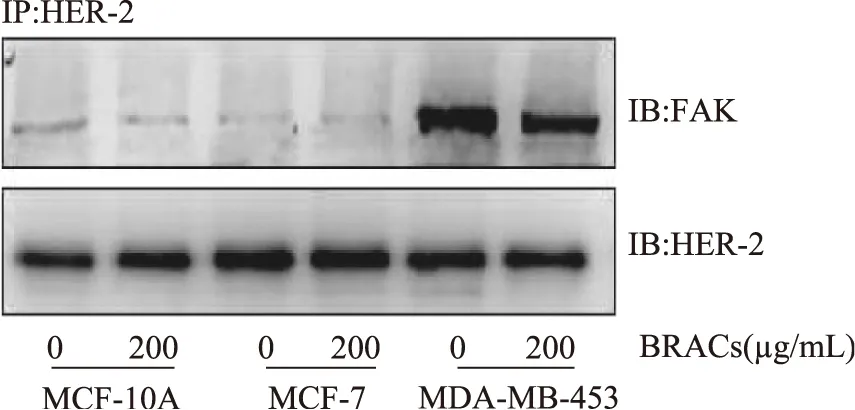
图4 BRACs对HER-2与FAK蛋白间相互结合的影响Fig.4 Effects of BRACs on the associationbetween HER-2 and FAK
3 讨论
HER-2是表皮生长受体家族的一员,20%~30%乳腺癌患者都表现为HER-2过表达状态,而HER-2过表达会抑制肿瘤细胞凋亡,增加肿瘤血管增生,造成病人预后不良和复发[12-13]。有研究表明,黑米花青素(BRACs)能抑制HER-2阳性乳腺癌移种移植瘤血管形成,抑制瘤体生长;抑制裸鼠肺转移瘤增殖,促进移植瘤细胞凋亡[14-15]。
FAK是一个非受体酪氨酸激酶,在肝细胞癌、肺癌、胰腺癌、乳腺癌等癌症中都表现为过表达状态,这使其成为一个治疗靶点[16]。HER-2/3受体高表达能促进FAK激活及其Y397、Y861和Y925位点磷酸化,FAK的磷酸化会通过激活下游FAK/Src/p130Cas信号通路调节细胞运动和粘附能力,从而造成肿瘤转移发生[17]。
本实验研究表明,BRACs处理HER-2阳性乳腺癌MDA-MD-453细胞后,细胞活性下降,抑制细胞增殖,细胞迁移和侵袭能力减弱;通过免疫印迹实验可以发现细胞FAK、cSrc磷酸化水平下降且HER-2与FAK蛋白间相互作用减弱。这表明BRACs在体外实验中能抑制HER-2阳性乳腺癌细胞迁移能力,且BRACs处理后FAK、cSrc磷酸化水平下调,HER-2/FAK蛋白间相互作用减弱,本课题组前期研究表明BRACs能与HER-2直接结合发挥抑制转移作用[18],这提示FAK在HER-2介导的阳性乳腺癌转移中发挥重要作用,BRACs可能通过抑制cSrc、FAK磷酸化以及抑制HER-2与FAK结合抑制其激活从而发挥抗HER-2阳性乳腺癌转移作用。但对于FAK在BRACs抗HER-2阳性乳腺癌中的具体机制需要进一步的研究。
[1]Lindsey A Torre,Freddie B,Rebecca LS,et al. Global Cancer Statistics,2012[J]. CA Cancer J Clin,2015,65(2):87-108.
[2]Faria A,Pestana D,Teixeira,et al. Blueberry anthocyanins and pyruvic acid adducts:anticancer properties in breast cancer cell lines[J]. Phytother Res,2010,24(12):1862-1869.
[3]Lee YK,Lee WS,Kim GS,et al. Anthocyanins are novel AMPKα1 stimulators that suppress tumor growth by inhibiting mTOR phosphorylation[J]. Oncol Rep,2010,24(6):1471-1477.
[4]Chang H,Yu B,Yu XP,Long Y,et al. Anti-cancer activities of an anthocyanin-rich extract from black rice against breast cancer cellsinvitroandinvivo[J]. Nutr cancer,2010,62:1128-1136.
[5]Liu W,Xu J,Wu S,et al. Selective Anti-Proliferation of HER2-Positive Breast Cancer Cells by Anthocyanins Identified by High-Throughput Screening[J]. PLoS ONE,2013,8(12):815-836.
[6]Golubovskaya VM. Targeting FAK in human cancer:from finding to first clinical trials[J]. Front Biosci(Landmark Ed),2014,19:687-706.
[7]Benlimame N,He Q,Jie S,et al. FAK signaling is critical for ErbB-2/ErbB-3 receptor cooperation for oncogenic transformation and invasion[J]. The Journal of cell biology,2005,171:505-516.
[8]马云龙,沈阳,任弘毅,等. 粘着斑激酶在Hep G2肝细胞粘附和迁移中的作用[J].生物医学工程杂志,2013,30(2):342-346.
[9]Vadlamudia RK,Sahinb AA,Adama L,et al. Heregulin and HER2 signaling selectively activates c-Src phosphorylation at tyrosine 215[J]. FEBS Lett,2003,543(1-3):76-80.
[10]罗丽萍,韩彬,陈祥燕,等.黑米花青素抑制HER-2阳性乳腺癌细胞转移的研究[J].营养学报,2014,36(4):392-394.
[11]Benlimame N,He Q,Jie S,et al. FAK signaling is critical for ErbB-2/ErbB-3 receptor cooperation for oncogenic transformation and invasion[J]. J Cell Biol,2005,171(3):505-516.
[12]Paterson MC,Dietrich KD,Danyluk J,et al. Correlation between c-erbB-2 amplification and risk of recurrent disease in node-negative breast cancer[J]. Cancer Res,1991,51(2):556-567.
[13]Slamon DJ,Clark GM,Wong SG,et al. Human breast cancer:correlation of relapse and survival with amplification of the HER-2/neu oncogene[J]. Science,1987,235(4785):177-82.
[14]于斌,余小平,易龙,等.黑米花青素对HER-2/neu高表达人乳腺癌细胞株MDA-MB-453移植瘤血管生成的影响[J].第三军医大学学报,2009,31(22):2206-2209.
[15]韩彬,罗丽萍,陈祥燕,等.黑米花青素对裸小鼠HER-2阳性乳腺癌肺转移的影响研究[J]. 营养学报,2014,36(3):258-262.
[16]Vita M Golubovskaya. Targeting FAK in human cancer:from finding to first clinical trials[J]. Front Biosci,2014,19:687-706.
[17]Luo M,Guan JL. Focal Adhesion Kinase:a Prominent Determinant in Breast Cancer Initiation,Progression and Metastasis[J]. Cancer Lett,2010,289(2):127-139.
[18]罗丽萍,余小平,韩彬,等.花青素主要成分与HER-2激酶区的分子对接[J].生物工程学报,2014,30(3):504-513.
Role of focal adhesion kinase in black rice anthocyanins inhibiting HER-2 positive human breast cancer cells
ZHOU Jie,CHEN Xiang-yan,CHEN Jing-yao,LI Fei,ZHU Yan-feng,YU Xiao-ping*
(Department of Public Health,Chengdu Medical College,Chengdu 610500,China)
Objective:To explore the role of focal adhesion kinase in HER-2 positive human breast cancer cells anti-metastasis by black rice anthocyanins(BRACs). Methods:To observe the effect of BRACs on the proliferation of MCF-10A,MCF-2 and MDA-MB-453 cells with CCK8 method. Metastasis of MCF-10A,MCF-2 and MDA-MB-453 cells were detected by wound healing experiments. The level of total and phosphorylated FAK and cSrc were detected by western blot. The interaction between HER-2 and FAK were analyzed by immunoprecipitation Results:Different concentration of BRACs including 50,100,200,400μg/mL were used to detect the influence which BRACs play on the growth MDA-MB-453 cells. Compared with control,the inhibition ratio of each group were 18.74%,21.06%,22.82%,40.12% respectively. The migration distance of MDA-MB-453 cells was decreased 37% by 200 μg/mL BRACs. The level of phosphorylated FAK and cSrc were reduced by BRACs and the interaction between HER-2/FAK was also decreased by BRACs. Conclusion:BRACs suppress the metastasis of HER-2 positive breast cancer cells via inhibiting the phosphorylation of FAK and cSrc by decrease the interaction between FAK and HER-2 which maybe a mechanism of anti-metastasis by BRACs.
HER-2;Breast carcinoma;metastasis;FAK
2015-07-13
周杰(1990-),女,硕士在读,研究方向:植物化学物抗肿瘤分子机制研究,E-mail:bravezhoujie@sina.com。
余小平(1970-),男,博士后,教授,研究方向:植物化学物抗肿瘤分子机制研究,E-mail:cyggwsyxp@sina.com。
国家自然科学基金资助项目(81273074);国家自然科学基金资助项目(81573154);四川省青年科技创新研究团队项目(2014TD0021);四川省省属高校科研创新团队项目(14TD0023);成都医学院学科建设项目(CYXK2012010)。
TS201.4
A
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000
