超声辅助酶解制备红豆多肽及其抗氧化性的研究
2016-09-12齐宝坤隋晓楠马文君王中江江连洲
李 杨,齐宝坤,隋晓楠,马文君,王中江,江连洲
(东北农业大学食品学院,哈尔滨 150030)
超声辅助酶解制备红豆多肽及其抗氧化性的研究
李杨,齐宝坤,隋晓楠,马文君,王中江,江连洲*
(东北农业大学食品学院,哈尔滨 150030)
采用超声辅助酶解法制备红豆多肽,并对其抗氧化性进行研究。在单因素实验基础上,采用响应面分析法对超声辅助酶解制备红豆多肽工艺进行优化,确定最优超声辅助酶解工艺为:碱性蛋白酶添加量3.5%,超声功率346 W,反应温度60 ℃,反应时间92 min,反应pH8.4。在最优工艺条件下,红豆多肽得率为85.84%。体系的抗氧化能力随着多肽浓度的增加而增强,当多肽达到一定浓度后,多肽浓度不再是抗氧化能力的主要影响因素。
超声波,酶解,红豆多肽,抗氧化性
红豆具有较高的营养价值,含有25%左右的蛋白质,并且氨基酸丰富,是一种优质的植物蛋白来源[1]。将蛋白质经过酶适度水解可以制备生物活性肽,其中抗氧化肽备受关注。目前国内对生物酶法制备红豆多肽的相关研究有一些报道,程谦伟等[2]采用碱性蛋白酶水解红豆蛋白制备红豆多肽,在优化的酶解条件下,其水解度为45.82%。刘琪等[3]采用Protex 6L直接酶解红豆粉制备红豆多肽,多肽得率可达84.29%,同时采用凝胶过滤色谱分析发现红豆蛋白中存在一些不容易被Protex 6L酶解的成分。梁英岳[4]采用碱性蛋白酶对红豆蛋白进行酶解,研究其酶解物的抗氧化性,通过体积排阻色谱表明,分子量为588~967 Da的多肽段抗氧化活性最高。超声波产生的空化效应和机械效应对物质的提取、酶解反应及高分子的降解等具有一定的促进作用,在超声作用下进行酶解反应可以缩短酶解时间、提高酶解效率、增加产物得率[5]。Jia等[6]研究发现,采用蛋白酶酶解小麦胚芽蛋白的过程中,超声预处理可以使疏水性氨基酸更快的释放,促进小麦胚芽蛋白的酶解反应。宿哲然等[7]研究表明125 W、40 kHz的超声作用能有效促进蛋清蛋白的酶解,水解度提高了13%~35.48%;然而对超声辅助酶解制备红豆多肽及其抗氧化性的研究较少,本文采用超声辅助碱性蛋白酶对红豆蛋白进行酶解制备红豆多肽,通过响应面分析法对超声辅助酶解工艺进行优化,并对红豆多肽的抗氧化性进行研究,为红豆抗氧化肽的研发及实际生产提供理论依据。
1 材料与方法
1.1材料与仪器
红豆(蛋白质21.2%、碳水化合物57.4%、脂肪0.7%、水分5.1%、灰分3.5%)市售;碱性蛋白酶(Alcalase 2.4L)(1.2×105U/mL)Novozymes公司;硫代巴比妥酸(TBA)国药集团化学试剂有限公司;其它试剂国产分析纯。
F2102型植物试样粉碎机天津泰斯特仪器有限公司;pHS-3C型酸度计上海江仪仪器有限公司;精密电动搅拌机江苏省金坛市荣华仪器;电热恒温水浴锅余姚市东方电工仪器厂;LDZ5-2型台式低速离心机上海安亭科学仪器厂;JY92-2D超声探头发生器宁波新芝生物科技有限公司;LGJ-25型冷冻干燥机上海医用科学仪器厂;TU-1901型紫外可见分光光度计北京普析通用仪器有限责任公司。
1.2实验方法
1.2.1红豆多肽的制备红豆→粉碎→过筛→加水混合→碱提→离心分离→取上清液→酸沉→离心分离→取沉淀→反复水洗和离心→沉淀复溶→蛋白溶液→超声辅助酶解→灭酶→离心分离→取上清液→调pH中性→冷冻干燥→红豆多肽
取一定质量的红豆粉碎后过50目筛,以料液比1∶6的比例加水混合配成混合液,用1 mol/L的NaOH溶液调节混合液pH为9进行碱提2 h,然后在4000 r/min下离心25 min取上清液,用1 mol/L的HCl溶液调节pH为4.5,在4000 r/min下离心25 min得沉淀,将沉淀反复水洗后离心分离,将沉淀复溶配成5%的蛋白溶液,调节蛋白溶液温度和pH,加入碱性蛋白酶(Alcalase 2.4 L)进行超声辅助酶解,酶解后于95 ℃灭酶10 min,然后在4000 r/min下离心25 min取上清液,调节pH中性后冷冻干燥即得红豆多肽。
1.2.2超声辅助酶解工艺单因素实验基本超声辅助酶解条件为:碱性蛋白酶添加量3%,超声功率300 W,反应温度55 ℃,反应时间80 min,反应pH8。在其他条件不变的情况下,以多肽得率(%)为考察指标,分别选取碱性蛋白酶添加量为1%、2%、3%、4%、5%,超声功率为100、200、300、400、500 W,反应温度为45、50、55、60、65 ℃,反应时间为40、60、80、100、120 min,反应pH为6、7、8、9、10,进行单因素实验。
1.2.3超声辅助酶解工艺响应面实验基于单因素实验,采用Design-Expert 7.0软件设计响应面分析实验。以多肽得率R(%)为响应值,选择碱性蛋白酶添加量A(%),超声功率B(W),反应温度C( ℃),反应时间D(min),反应pH E为影响因素,每个因素设定5个水平进行实验,其因素水平编码表见表1。
1.2.4红豆多肽浓度对其抗氧化性的影响在最优的超声辅助酶解工艺条件下制备红豆多肽,配成浓度分别为0.1、1、10、100、1000 μg/mL的多肽溶液,测定多肽溶液的抗氧化能力,包括OH自由基清除能力和DPPH自由基清除能力,探讨多肽浓度对其抗氧化性的影响。

表1 因素水平编码表
1.2.5多肽得率的测定采用三氯乙酸可溶性氮法测定[8],将酶解后的上清液与质量分数10%的三氯乙酸等体积混合,在4000 r/min下离心20 min,采用Follin-酚法测定上清液中可溶性氮。多肽得率计算公式如下:
多肽得率(%)=N1/N0×100
式中:N1为三氯乙酸中的可溶性氮的量(mg);N0为原料中总氮的量(mg)。
1.2.6·OH自由基清除能力的测定·OH自由基清除能力的测定采用D-脱氧核糖-Fe体系法[9]。吸取0.1 mL 1%的多肽溶液,移入试管中,加入0.1 mL 1.04 mmol/L的EDTA溶液、0.1 mL 1 mmol/L的FeCl3溶液、0.1 mL 2 mmol/L的VC溶液、0.1 mL 10 mmol/L的H2O2溶液、0.1 mL 60 mmol/L的D-脱氧核糖溶液和0.4 mL pH7.5 KH2PO4-NaOH缓冲溶液37 ℃水浴1 h,加入1 mL 25%的HCl溶液终止反应,然后加入1 mL 1%的硫代巴比妥酸(TBA)溶液,100 ℃水浴15 min,冷却后有沉淀,加入1 mL正丁醇萃取颜色,然后于532 nm处测定其吸光度。以不加多肽样品的空白作对照,·OH自由基清除能力的计算公式如下:
式中:A0为不加样品的空白吸光度;A1为加入D-脱氧核糖的样品吸光度;A2为不加D-脱氧核糖的样品吸光度。
1.2.7DPPH自由基清除能力的测定取2mL1%的多肽溶液于比色管中,加入2mL1mmol/L的DPPH乙醇溶液,充分混匀后在室温下避光反应30min,反应结束后在517nm处测定其吸光度。对照组为2mL无水乙醇溶液与2mL样液混合液的吸光度,空白组为2mLDPPH溶液与2mL蒸馏水混合液的吸光度,用无水乙醇调零。DPPH自由基清除能力的计算公式如下[10]:

式中:As为实验组的吸光度;Ac为对照组的吸光度;Ab为空白组的吸光度。
1.2.8数据处理采用统计学软件SPSS17.0对数据进行ANOVA差异显著性分析,p<0.05为显著性差异,采用Design-Expert7.0软件进行方差分析,采用Origin8.0软件作图。
2 结果与分析
2.1超声辅助酶解工艺单因素分析
2.1.1碱性蛋白酶添加量对红豆多肽得率的影响由图1可以看出,随着碱性蛋白酶添加量的增加,多肽得率逐渐升高,当酶添加量增加到4%时,多肽得率达到最大;继续增加酶添加量,多肽得率不再增大。随着碱性蛋白酶的增加,将蛋白质水解为多肽的量增加,导致多肽得率升高;当蛋白酶达到一定量时,大部分蛋白质几乎达到了水解平衡[11],蛋白酶添加量不会对多肽得率产生明显影响。
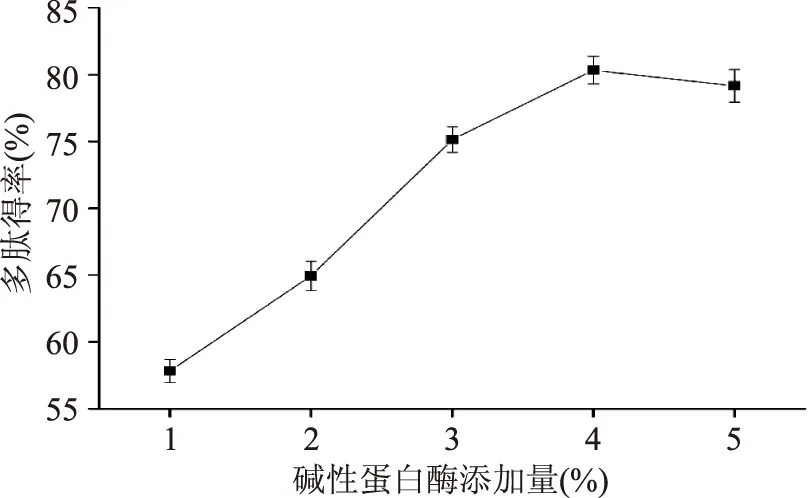
图1 碱性蛋白酶添加量对红豆多肽得率的影响Fig.1 Effect of adding amount of Alcalase on red bean peptides yield
2.1.2超声功率对红豆多肽得率的影响由图2可以看出,随着超声功率的增加,多肽得率呈先升高后下降的趋势。当超声功率为300 W时,多肽得率达到最大;继续增加超声功率,多肽得率反而又降低。超声作用会使蛋白质的酶作用位点更多的暴露出来,促进蛋白质的酶解作用,导致多肽得率升高;当超声功率过大时,空化作用和热作用会使酶分子变性失活,导致多肽得率下降[12]。
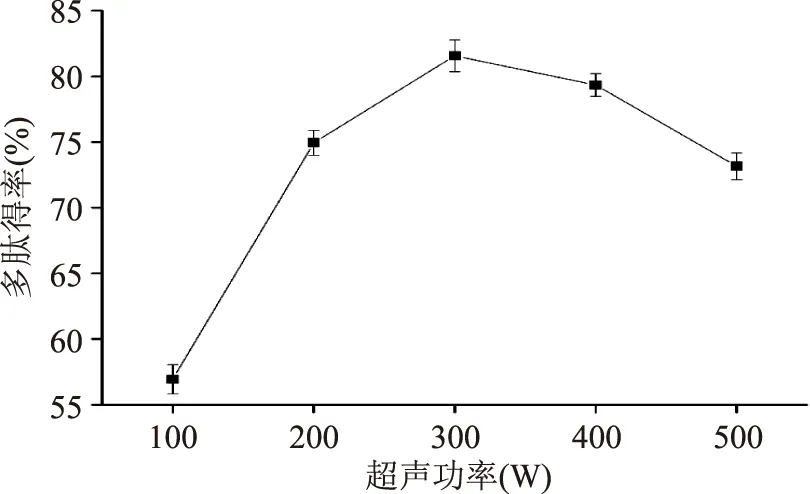
图2 超声功率对红豆多肽得率的影响Fig.2 Effect of ultrasonic power on red bean peptides yield
2.1.3反应温度对红豆多肽得率的影响由图3可以看出,随着反应温度的升高,多肽得率逐渐增加,当反应温度升高到55 ℃时,多肽得率达到最大;继续升高反应温度,多肽得率又会降低。蛋白酶具有一定的最适酶解温度范围[13],当超过该最适酶解温度范围,即温度过高或过低时,使酶活性下降,影响酶解反应速率,不利于多肽的生成,导致多肽得率的降低。

图3 反应温度对红豆多肽得率的影响Fig.3 Effect of reaction temperature on red bean peptides yield
2.1.4反应时间对红豆多肽得率的影响由图4可以看出,随着反应时间的延长,多肽得率逐渐升高,当反应时间延长到100 min时,多肽得率达到最大;继续延长反应时间,多肽得率不再升高并趋于稳定。在反应初期,底物浓度较大,随着反应时间的延长,酶与底物作用明显,使多肽得率增加,当反应达到一定程度后,底物浓度不断降低,大部分蛋白质几乎完全水解,多肽得率不会随着反应时间的延长而进一步增加。

图4 反应时间对红豆多肽得率的影响Fig.4 Effect of reaction time on red bean peptides yield
2.1.5反应pH对红豆多肽得率的影响由图5可以看出,随着反应pH的增加,多肽得率明显升高,当反应pH增加到8时,多肽得率达到最大;继续增加反应pH,多肽得率又会降低。蛋白酶都具有最适的pH范围,只有在最适的pH范围内才能发挥较好的酶解作用[14]。超出最适酶解pH范围,即过酸或过碱时,会造成酶分子结构的破坏,引起酶活性的降低,不利于酶解反应,导致多肽得率的降低。
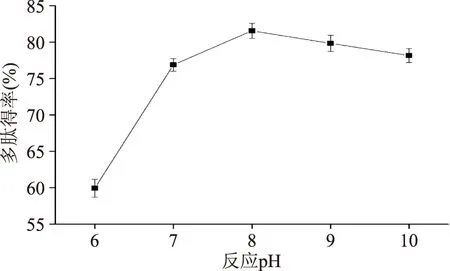
图5 反应pH对红豆多肽得率的影响Fig.5 Effect of reaction pH on red bean peptides yield
2.2超声辅助酶解工艺响应面分析
以碱性蛋白酶添加量A(%)、超声功率B(W)、反应温度C( ℃)、反应时间D(min)和反应pH E为影响因素,以多肽得率R(%)为响应值,采用软件Design-Expert 7.0来完成实验设计与数据处理,实验安排及结果见表2。

表2 实验安排及结果
通过统计分析软件Design-Expert 7.0进行数据分析,建立二次响应面回归模型如下:
R=81.91-1.99A-0.080B+0.53C-0.048D-0.51E+1.11AB-0.54AC+2.07AD+0.57AE+4.04BC-3.39BD+0.86BE+0.42CD+1.06CE-1.23DE-0.60A2-2.90B2-1.50C2-2.99D2-1.79E2
对模型方程进行方差分析,回归与方差分析结果见表3。

表3 回归与方差分析结果
注:**表示极显著(p<0.01),*表示显著(0.01 两因素交互作用(显著项)对多肽得率影响的响应面见图6。该模型中,BC和BD的交互作用显著(p<0.01),而其他两因素之间的交互作用均不显著(p>0.05),说明超声功率与反应温度的交互作用和超声功率与反应时间的交互作用对多肽得率影响较大。此外,图中均有极值点出现,再次证明了超声功率与反应温度的交互作用和超声功率与反应时间的交互作用对多肽得率的显著影响。虽然超声功率对多肽得率影响不显著(表3),但其与其他因素的交互作用对多肽得率的影响显著。 图6 两因素交互作用(显著项)对多肽得率影响的响应面Fig.6 Response surface analysis of effective interaction(significant items)on peptides yield 通过分析软件Design-Expert寻找最优超声辅助酶解工艺条件。当碱性蛋白酶添加量、超声功率、反应温度、反应时间和反应pH对应的编码值分别为-1.00、0.91、1.00、-0.78和0.81时,即碱性蛋白酶添加量为3.5%、超声功率为346 W、反应温度为60 ℃、反应时间为92 min、反应pH为8.4时,多肽得率有最大值为85.19%±1.63%。 为了验证模型预测的准确性,在最优超声辅助酶解工艺下,进行3次验证实验取平均值,多肽得率的平均值为85.84%与预测值85.19%±1.63%较接近,说明响应值的实验值与回归方程预测值吻合良好。最终确定最优超声辅助酶解工艺为:碱性蛋白酶添加量3.5%,超声功率346 W,反应温度60 ℃,反应时间92 min,反应pH8.4。 2.3红豆多肽浓度对其抗氧化性的影响 蛋白质通过酶的适度水解形成的多肽具有一定的抗氧化能力,对·OH自由基、DPPH自由基等具有一定的清除能力[15]。图7为不同浓度多肽对·OH自由基及DPPH自由基清除能力的影响,由图7可以看出,随着多肽浓度的增加,·OH自由基及DPPH自由基清除能力逐渐升高,这表明体系的抗氧化能力逐渐增强;当多肽浓度超过100 μg/mL后,体系抗氧化能力增强的趋势减弱,这表明多肽达到一定浓度后,多肽浓度不再是抗氧化能力的主要影响因素。 图7 多肽浓度对·OH自由基及DPPH自由基清除能力的影响Fig.7 Effect of peptides concentration on scavenging activity for ·OH and DPPH radicals 本文对超声辅助酶解制备红豆多肽工艺进行研究,探讨碱性蛋白酶添加量、超声功率、反应温度、反应时间和反应pH对红豆多肽得率的影响。在单因素实验基础上,采用响应面分析法对超声辅助酶解制备红豆多肽工艺进行优化,确定最优超声辅助酶解工艺为:碱性蛋白酶添加量3.5%,超声功率346W,反应温度60 ℃,反应时间92 min,反应pH8.4。在最优工艺条件下,红豆多肽得率为85.84%。抗氧化性分析表明,体系的抗氧化能力随着多肽浓度的增加而增强,当多肽达到一定浓度后,多肽浓度不再是抗氧化能力的主要影响因素。 [1]Chau C F,Cheung P C K,Wong,Y S. Functional properties of protein concentrates from three Chinese indigenous legume seeds[J]. Journal of Agricultural and Food Chemistry,1997,45:2500-2503. [2]程谦伟,刘昭明,孟陆丽等. 碱性蛋白酶水解制备赤豆蛋白肽的工艺研究[J]. 粮油加工,2010,2:43-45. [3]刘琪,江连洲,李扬. Protex6L直接酶解红豆粉提取红豆肽的研究[J]. 食品工业科技,2012,33(7):191-194. [4]梁英岳. 红豆蛋白的酶法水解工艺及其抗氧化肤的研究[D]. 广东:暨南大学,2010. [5]邓红,仇农学,孙俊等. 超声波辅助提取文冠果籽油的工艺条件优化[J]. 农业工程学报,2007,23(11):249-254. [6]Jia J Q,Ma H L,Zhao W R,et al. The use of ultrasound for enzymatic preparation of ACE-inhibitory peptides from wheat germ protein[J]. Food Chemistry,2010,119:336-342. [7]宿哲然,李新华,金嫘. 超声波对蛋清蛋白酶解的研究[J].食品科技,2006,31(12):74-76. [8]Jang A,Lee M. Purification and identification of angiotensin converting enzyme inhibitory peptides from beef hydrolysates[J]. Meat Science,2005,69:653-661. [9]Shu Y T,Shih J H,Jeng L M. Antioxidant properties of hot water extracts from agrocybe cylindracea[J]. Food Chemistry,2006,98(6):670-677. [10]Jamdar S,Rajalakshmi V,Pednekar M,et al. Influence of degree of hydrolysis on functional properties,antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate[J]. Food Chemistry,2010,121(1):178-184. [11]Bamdad F,Wu J P,Chen L Y. Effects of enzymatic hydrolysis on molecular structure and antioxidant activity of barley hordein[J]. Journal of Cereal Science,2011,54:20-28. [12]黄卓烈,林茹,何平等. 超声波对酵母过氧化氢酶及多酚氧化酶活性的影响[J]. 中国生物工程杂志,2003,23(4):89-93. [13]黄黎慧,张晓燕,倪小英等. 水酶法提取核桃油工艺研究[J]. 粮食科技与经济,2010,35(4):30-32. [14]张宇昊,王强. Alcalase酶水解花生蛋白制备花生短肽的研究[J]. 农业工程学报,2007,23(4):258-263. [15]苏晓雨. 红松种壳组成及多酚提取分离与抗氧化抗肿瘤功能研究[D]. 黑龙江:哈尔滨工业大学,2011. Research on preparation of red bean peptides by ultrasonic-assisted enzymatic hydrolysis and antioxidative activity LI Yang,QI Bao-kun,SUI Xiao-nan,MA Wen-jun,WANG Zhong-jiang,JIANG Lian-zhou* (College of Food Science,Northeast Agricultural University,Harbin 150030,China) Preparation of red bean peptides by ultrasonic-assisted enzymatic hydrolysis and antioxidant activity were researched. On the basis of single factor experiment,hydrolysis process of preparing red bean peptides with ultrasonic assist were determined by response surface methodology. The optimal hydrolysis parameters were as follows:adding amount of Alcalase was 3.5%,ultrasonic power was 346 W,reaction temperature was 60 ℃,reaction time was 92 min and reaction pH was 8.4. Under the optimal process conditions,yield of red bean peptides was 85.84%. Antioxidant capacity was enhanced with the increase of peptides concentration. When peptides reached a certain concentration,peptides concentration was no longer the main influence factors of antioxidant capacity. ultrasound;enzymatic hydrolysis;red bean peptides;antioxidant activity 2015-06-03 李杨(1981-),男,博士,副教授,研究方向:粮食、油脂及植物蛋白工程,E-mail:liyanghuangyu@163.com。 江连洲(1960-),男,博士,教授,研究方向:粮食、油脂及植物蛋白工程,E-mail:jlzname@yeah.net。 高等学校博士生学科点专项科研基金博导类资助课题(20132325110013);农业部岗位科学家(CARS-04-PS25)。 TS210 A 1002-0306(2016)01-0000-00 10.13386/j.issn1002-0306.2016.01.000


3 结论
