低分子量透明质酸对小鼠巨噬细胞和T细胞的免疫调节作用
2016-09-12柯春林李作美曾晓雄
柯春林,李作美,曾晓雄
(1.蚌埠学院 生物与食品工程系,安徽蚌埠 233030;2.南京农业大学 食品科技学院,江苏南京 210095)
低分子量透明质酸对小鼠巨噬细胞和T细胞的免疫调节作用
柯春林1,2,李作美1,曾晓雄2
(1.蚌埠学院 生物与食品工程系,安徽蚌埠 233030;2.南京农业大学 食品科技学院,江苏南京 210095)
低分子量透明质酸(LMWHA)由自由基氧化降解方法制备,通过体内动物实验和体外细胞实验研究了LMWHA对小鼠巨噬细胞和T细胞的免疫调节活性。在体内免疫抑制鼠实验中,察看了LMWHA对2,4-二硝基氟苯(DNFB)诱导的迟发型超敏反应(DTH)的影响,测定了血清溶菌酶含量、脾脏以及胸腺指数。结果表明:LMWHA(20~120 mg/kg·d)能够促进免疫抑制小鼠的DTH反应,改变血清溶菌酶含量、提高脾脏和胸腺指数,并呈作用剂量依赖关系。在体外细胞实验中,LMWHA(25~200 μg/mL)加强了小鼠腹腔巨噬细胞的吞噬活性以及一氧化氮合酶(iNOS)活性,提高了一氧化氮(NO)的生成量,促进了脾脏T淋巴细胞的增殖。由此可见LMWHA能够调节小鼠的细胞免疫和非特异性免疫功能。
低分子量透明质酸,免疫调节活性,巨噬细胞,T淋巴细胞
透明质酸(HA)由重复的N-乙酰氨基葡萄糖(GlcNAc)与葡萄糖醛酸(GlcA)二糖单位聚合而成,平均分子量为106u。HA对肿瘤形成、血管生成、炎症反应和免疫功能等均具有调节作用[1-2],其中高分子量HA具有免疫抑制作用[3]。HA能被物理、化学和生物的方法降解为低分子量透明质酸(LMWHA)[4-5]。LMWHA具有完全不同于HA的功能,尤其是免疫调节活性[2,5]。自从Knoflach 等首次发现LMWHA在体内具有免疫调节活性以来[6],人们发现LMWHA对机体的非特异性和特异性免疫系统都有调节作用。例如LMWHA(1.35×105u)可作为先天性免疫调节剂激活树突状细胞,并促进其成熟[7]。LMWHA在促进树突状细胞成熟的同时产生细胞毒性T淋巴细胞反应和免疫保护反应,而且LMWHA促进了树突状细胞和T细胞在淋巴结的聚集,具有免疫刺激作用,为潜在的抗癌疫苗佐剂[8]。但是,对于LMWHA体内和体外免疫调节作用的报道并不多,而且LMWHA的免疫调节活性与其制备方法、分子量等都有关系。为了探讨LMWHA免疫调节活性,本实验通过建立在环磷酰胺(CY)所致免疫抑制小鼠模型基础上,研究了氧化降解方法制备到的两种LMWHA对小鼠巨噬细胞和T细胞的免疫调节活性。并通过不同的体外免疫实验和体内动物实验,对两种分子量LMWHA的免疫调节活性进行了探索,为LMWHA免疫制剂的研发提供理论依据。
1 材料与方法
1.1材料与仪器
8周龄体重均为18~22 g的雌性昆明小鼠由军事医学科学院实验动物中心提供。
低分子量透明质酸(LMWHA-1,1.45×105;LMWHA-2,4.52×104u)本实验室制备;环磷酰胺(CY)江苏恒瑞医药;升血调元汤(SXTY-Tang)广州潘高药业;NO、iNOS以及溶菌酶测定试剂盒南京建成生物工程研究所;刀豆蛋白A(ConA)上海生化研究所;脂多糖(LPS)、四甲基偶氮唑盐(MTT)Sigma公司;RPMI 1640 培养基上海生工;胎牛血清杭州四季青生物工程材料有限公司;其余试剂均为国产分析纯。
Anke TDL-5型低速离心机上海安亭科学仪器厂;SORVALL Evolution R型高速低温离心机美国Kdndro;Laborota 4000型真空旋转蒸发仪德国Heidolph;Alpha 1-2型冷冻干燥机英国Labconco;BL-220 H分析天平日本Shimadzu;SW-CJ-IBU型超净工作台苏净集团安泰公司;HEPA class 100 型CO2培养箱美国Thermo;Bx-50型显微镜日本Olympus;Infinite M 200型酶标仪瑞士Tecan。
1.2实验方法

1.2.2LMWHA的体内免疫调节活性
1.2.2.1动物实验将54只雌性昆明种小鼠随机均分9组并分笼饲喂。第1组为阴性对照组,小鼠连续7 d灌胃生理盐水(0.3 mL/只)和第1、3、5 d皮下注射注射生理盐水(0.3 mL/只);第2组为环磷酰胺(CY)模型组,小鼠连续7 d灌胃生理盐水(0.3 mL/只)和第1、3、5 d皮下注射CY(75 mg/kg·d);第3组为阳性对照组,小鼠连续7 d灌胃升血调元汤(SXTY-Tang)(0.3 mL/只)和第1、3、5 d皮下注射CY(75 mg/kg·d);第4、5、6、7、8、9组为多糖+环磷酰胺组,小鼠分别按20、60、120 mg/kg·d连续7 d分别灌胃LMWHA-1(第4、5、6组)和LMWHA-2(第7、8、9组)多糖,同时第1、3、5 d皮下注射CY(75 mg/kg·d)。第7 d灌胃后便停食24 h,立即称重并处死小鼠。
1.2.2.2胸腺指数和脾脏指数的测定各组小鼠处死后,取出脾脏和胸腺并称重。脾脏(胸腺)指数=脾脏(胸腺)重量/小鼠体重(mg/g)。
1.2.2.3迟发型超敏反应的测定剪去小鼠腹部被毛(3 cm×3 cm),根据文献报道的方法测定迟发型超敏反应[10]。连续灌胃后的第3 d,用50 μL DNFB液(1.0%,丙酮与植物油以1∶1配比)在其腹部涂布,以激活迟发型超敏反应。7 d后,用20 μL DNFB在每组小鼠左耳涂布,以再次激活迟发型超敏反应。24 h后处死小鼠并用无菌剪剪下左右两只耳朵,然后用打孔器在每只耳朵上打孔(φ=6 mm)并称重。肿胀度=左耳重量(mg)-右耳重量(mg)。
1.2.2.4血清溶菌酶的测定采用溶菌酶测定试剂盒,按照操作说明进行血清溶菌酶含量测定。
1.2.3LMWHA的体外免疫调节活性
1.2.3.1酸性磷酸酶测定(腹腔巨噬细胞)根据文献的报道[11],稍做修改。取雌性昆明种小鼠,腹腔注射2.7%硫乙醇酸盐培养基(1 mL/20 mg体重)。饲养3 d,采用脱位法处死小鼠,75%乙醇浸泡5 min。向腹腔内注射RPMI1640培养液约5 mL,轻揉腹腔1~2 min,用吸管吸收细胞悬浮液后300×g离心5 min,收集细胞并以RPMI 1640培养液稀释至每毫升 2×106细胞数,每孔100 μL接种到96孔板中,在5% CO2培养箱中37 ℃培养2~3 h。用移液枪吸弃培养液,反复3次用RPMI 1640培养液洗去未贴壁细胞,即为纯化的腹腔巨噬细胞。实验分为5组,即阴性对照组,4个浓度梯度的LMWHA多糖组(25、50、100、200 μg/mL),加样处理24 h,每孔加50 μL样液和50 μL完全培养基(含10%的胎牛血清)。吸去上清,加1% TritonX-100(25 μL/孔)和对硝基苯磷酸盐(1 mg/mL)(150 μL/孔),反应1 h。每孔加50 μL的3 mol/L NaOH终止反应。405 nm波长下检测。酸性磷酸酶活性增长率(%)=(Abs样品组-Abs阴性对照组)×100/Abs阴性对照组
1.2.3.2腹腔巨噬细胞吞噬中性红实验根据徐远义等[12]的方法,稍做修改。依照上述实验步骤制备小鼠腹腔巨噬细胞,台盼蓝拒染检测其活性(>95%),后用完全RPMI 1640培养基(含10%的胎牛血清)调整小鼠腹腔巨噬细胞浓度为2×106/mL,实验分为5组,即阴性对照组,4个浓度梯度的LMWHA多糖组(25、50、100、200 μg/mL),于37 ℃,5% CO2条件下共同培养48 h(每孔加50 μL样液和50 μL完全培养基),弃上清,孔中细胞用PBS洗两次,加0.075%中性红(100 μL/孔),培养60 min后弃上清,未被吞噬的中性红以PBS洗2~3次去除。加冰醋酸∶乙醇=1∶1(100 μL/孔)裂解细胞,12~24 h后测A540nm(A540nm表示中性红吞噬能力)。
1.2.3.3NO生成量测定硝酸还原酶法检测细胞培养液NO3-及NO2-总量代表NO的生成量,参照试剂盒说明书进行。
1.2.3.4一氧化氮合酶(iNOS)活性测定采用比色法测定,参照试剂盒说明书进行。
1.2.3.5体外脾淋巴细胞增殖实验采用Dai等[13]的方法,稍做修改。配制0.5% LMWHA并用0.22 μm滤膜除菌。①脾淋巴细胞悬液的制备:取雌性昆明种小鼠,运用脱位法处死小鼠,75%乙醇浸泡5 min,用无菌剪剖开小鼠腹腔后取出脾脏并制成脾细胞悬液,于15 mL离心管300×g离心5 min,弃上清。加入2 mL红细胞裂解液,轻柔震荡2 min,破坏红细胞。然后加入10 mL RPMI 1640培养基300 g离心5 min,调整细胞浓度至1×107/mL的脾细胞悬液备用。② MTT比色法:将细胞密度为1×107/mL的脾细胞悬液接种到96孔板中,每孔50 μL。然后,分别加入各个浓度的样品溶液50 μL后继续培养72 h。每孔加入MTT(5 mg/mL)10 μL,继续培养4 h 后加入10% SDS-0.01N HCl 溶液100 μL溶解蓝紫色结晶并孵育过夜。用酶标仪测定各孔的OD570 nm。淋巴细胞增殖指数=药物组吸光值/正常对照组吸光值。
1.2.3.6统计学处理采用SPSS 16.0软件中的方差分析,根据Student-Newman-Keuls检验,p<0.05认为差异显著。
2 结果与分析
2.1低分子量透明质酸分析
在Agilent 1100 Series高效液相色谱仪上,以Shodex standard P-82(0.59×104~78.8×104u,Showa denko KK,Tokyo,Japan)为多糖标准品,用HPLC法测LMWHA的分子量。根据标准多糖得到的分子量换算公式,经过计算知LMWHA-1和LMWHA-2的分子量分别为1.45×105u和4.52×104u。
2.2LMWHA体内免疫调节活性结果
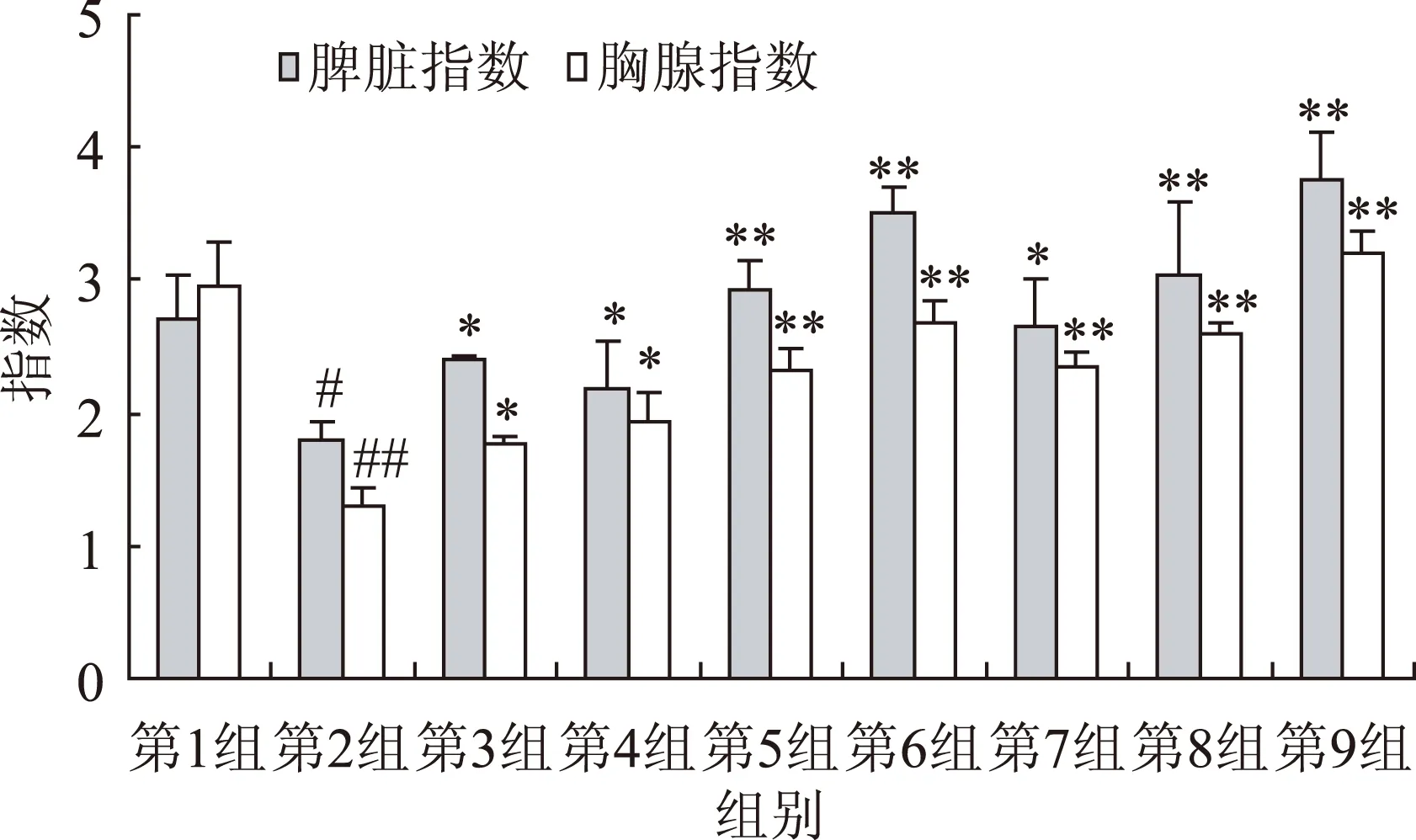
图1 LMWHA对免疫抑制鼠胸腺和脾脏指数的影响Fig.1 Effects of LMWHA on the thymus and spleen indices in different organs in immunosuppressed mice注:*p<0.05,与模型组比较;**p<0.01,与模型组比较;#p<0.05,与阴性对照组比较;##p<0.01,与阴性对照组比较,图2,图3同。
2.2.1LMWHA对免疫抑制小鼠胸腺指数和脾脏指数的影响结果见图1,注射CY后脾脏指数和胸腺指数均呈现下降趋势,与阴性对照组比较差异显著(p<0.05),说明免疫抑制动物模型建成。灌胃LMWHA后免疫抑制小鼠脾脏和胸腺指数明显提高,与CY组相比多糖组(60、120 mg/kg)脾脏和胸腺指数也显著提高,差异极显著(p<0.01)。但是脾脏指数升高较快,并且具有剂量依赖关系。
2.2.2LMWHA对迟发型超敏反应的影响从图2可以看出,与阴性对照组(第1组)相比,CY处理组(第2组)小鼠耳廓肿胀度显著减少(p<0.01),说明免疫抑制鼠动物模型良好。与CY处理组比较,LMWHA处理组(第4至9组)能显著提高耳廓肿胀度,并呈作用剂量依赖关系。与阴性对照组比较,LMWHA处理组除了LMWHA-2低剂量组(第7组)差异显著外(p<0.05),其余各组都是差异极显著(p<0.01),而且LMWHA-1的作用稍强于LMWHA-2。

图2 LMWHA对免疫抑制鼠迟发型超敏反应的影响Fig.2 Effect of LMWHA on the DTH response in immunosuppressed mice
2.2.3LMWHA对血清溶菌酶的影响LMWHA能升高正常小鼠和免疫抑制小鼠血清溶菌酶含量,尤其在免疫抑制状态下,作用更明显(图 3)。本实验发现,与阴性对照组(第1组)以及 CY处理组(第2组)相比,服用LMWHA后小鼠血清溶菌酶活力的上升显著,并呈作用剂量依赖关系。LMWHA低、中剂量组(第4、7、8组)差异显著外(p<0.05),中、高剂量组(第5、6、9组)差异极显著(p<0.01),尤以LMWHA-1高剂量组最为明显(第6组)。由于溶菌酶由单核细胞分泌,由此可见LMWHA能提高血液中单核吞噬细胞的活性。而且LMWHA-1对血清溶菌酶的作用强于LMWHA-2。
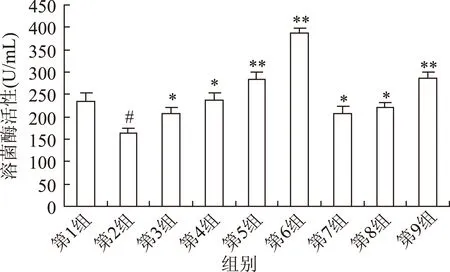
图3 LMWHA对免疫抑制鼠血清溶菌酶的影响Fig.3 Effect of LMWHA on the serum lysozyme in immunosuppressed mice
2.3体外免疫调节活性结果
2.3.1LMWHA对小鼠腹腔巨噬细胞酸性磷酸酶的影响由于巨噬细胞内酸性磷酸酶活力可被免疫抑制剂下调,又能被免疫激活剂上调,因此巨噬细胞内的酸性磷酸酶上调被认为是巨噬细胞激活的标志[14]。结果见图4A,LMWHA能明显的激活巨噬细胞,当浓度为100 μg/mL 时显示最强的作用效果,此时LMWHA-2和LMWHA-1的酸性磷酸酶活性增长率分别为47.99%和52.02%,明显高于阴性对照组的增长率(16.53%)。低于或高于该浓度,激活作用变弱,其剂量效应曲线呈钟罩形。本研究结果显示,LMWHA使小鼠腹腔巨噬细胞中的酸性磷酸酶活力明显升高,但LMWHA-1对巨噬细胞的激活作用稍弱于LMWHA-2,可能与其分子量有关。
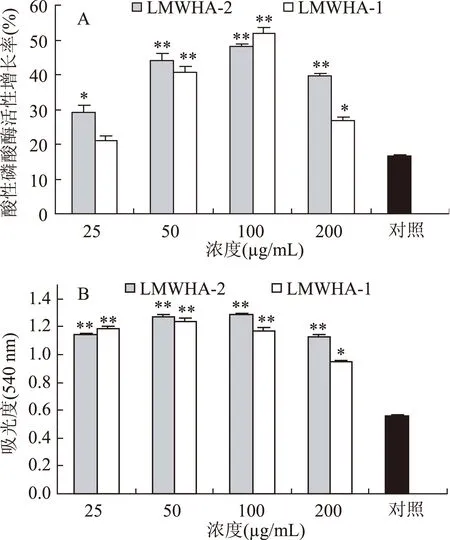
图4 LMWHA对小鼠腹腔巨噬细胞酸性磷酸酶(A) 和吞噬功能(B)的影响Fig.4 Effects of LMWHA on acid phosphatase activity(A) and phagocytic function in peritoneal macrophages(B)注:*p<0.05,与阴性对照组比较;**p<0.01,与阴性对照组比较。
2.3.2LMWHA对小鼠腹腔巨噬细胞吞噬功能的影响(中性红吞噬实验)本实验结果表明(图4B),小鼠腹腔巨噬细胞与LMWHA共同培养48 h后,与阴性对照组比较,其吞噬中性红的能力显著比阴性对照组高,其中25、50、100 μg/mL多糖组吞噬中性红的能力极显著增强(p<0.01),其中100 μg/mL时,LMWHA-2和LMWHA-1吞噬中性红的A540nm值分别为1.29和1.17。明显高于阴性对照组的A540nm值(0.56)。本结果表明LMWHA可加强巨噬细胞的吞噬功能并呈剂量效应关系。而且,LMWHA-2的作用效果强于LMWHA-1。
2.3.3LMWHA对小鼠腹腔巨噬细胞NO 生成量和iNOS活性的影响细胞内iNOS催化精氨酸经氧化脱氨生成NO,而作为信息分子的NO能作用机体免疫细胞的信号通路进而影响免疫调节效果[15]。结果见图5,与PBS空白对照组相比,各LMWHA组和阳性对照组(20 μg/mL LPS)NO生成量和iNOS均有增加(p<0.01),不同浓度组相比较差异很明显。本研究表明LMWHA能提高小鼠腹腔巨噬细胞NO生成量和iNOS活性。
2.3.4LMWHA对小鼠脾淋巴细胞增殖的影响结果见图6,在25~200 μg/mL浓度范围内,LMWHA可明显促进小鼠脾淋巴细胞增殖。当浓度为100 μg/mL时,LMWHA-1和LMWHA-2对淋巴细胞的吸光值分别为1.37和1.24,显示最强的作用效果,但略低于阳性对照组(ConA组)的吸光值(1.45)。本研究结果表明LMWHA对小鼠脾淋巴细胞增殖具有刺激作用,与许多免疫调节剂的量效关系曲线相似,其剂量效应曲线呈钟罩形。说明LMWHA具有一定的淋巴细胞的增殖作用,其中LMWHA-1的作用最强。
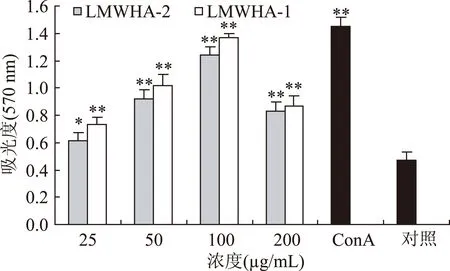
图6 LMWHA对小鼠脾淋巴细胞增殖的影响Fig.6 Effects of LMWHA on splenocyte proliferation注:*p<0.05,与正常对照组比较;**p<0.01,与正常对照组比较。
3 讨论

在体内动物实验中,灌胃LMWHA后免疫抑制小鼠脾脏和胸腺指数明显提高,尤以脾脏指数升高较快。由于环磷酰胺对免疫系统和造血功能能产生严重损害,由此可见LMWHA对抗了CY对免疫抑制小鼠脾脏造成的损害作用。在迟发型超敏反应中,与阴性对照组相比LMWHA处理组差异显著(p<0.05)。据报道T细胞介导的迟发型超敏反应在各种炎症性疾病的发病机制中起重要作用[16],本结果表明LMWHA能一定程度的增强免疫抑制鼠的细胞免疫功能。而且,LMWHA能提高血清溶菌酶的活性,其活力可作为机体非特异性免疫反应的重要指标。吞噬细胞激活后将产生许多活性物质,进而调节机体免疫细胞的活性,介导体液免疫和细胞免疫。本实验结果显示,LMWHA能提高小鼠非特异性免疫应答。
在体外细胞实验中,LMWHA通过影响酸性磷酸酶活性来可激活巨噬细胞,而且其吞噬中性红的能力显著比阴性对照组高。单核-吞噬细胞,包括骨髓中的前单核细胞、外周血中的单核细胞、以及组织内的巨噬细胞,介导机体的特异性和非特异性免疫反应,从而调节机体免疫应答反应。有研究表明,绝大多数多糖类物质可增强单核-吞噬细胞功能,发挥其免疫调节作用[17]。本结果表明LMWHA一定程度上影响机体的非特异性免疫应答。LMWHA也增强了小鼠巨噬细胞分泌NO的能力,促进脾淋巴细胞转化,据报道,多糖能通过刺激小鼠腹腔巨噬细胞来提高诱导型NO合酶(iNOS)活性和NO的生成量,从而发挥免疫调节活性[18]。本研究结果也显示类似的结果即LMWHA能提高小鼠腹腔巨噬细胞NO生成量和iNOS活性。由此可见LMWHA能一定程度上影响小鼠的特异性和非特异性免疫功能。而且,LMWHA-2对机体非特异性免疫调节能力高于LMWHA-1的,但LMWHA-1对机体特异性免疫调节能力高于LMWHA-2的。有报道说在体内LMWHA有很强的免疫调制功能[19],本实验的结果也说明LMWHA具有一定的免疫调节作用。
4 结论
本研究采用氧化降解方法制备到的两种低分子量透明质酸(LMWHA-1,LMWHA-2),通过体内动物实验和体外细胞实验研究了LMWHA对小鼠巨噬细胞和T细胞的免疫调节活性。结果表明LMWHA能够促进免疫抑制小鼠的DTH反应,改变血清溶菌酶含量、提高脾脏和胸腺指数;LMWHA能增强小鼠腹腔巨噬细胞的吞噬活性以及iNOS活性,提高了NO的生成,促进脾脏T淋巴细胞的增殖。结果提示,LMWHA能够增强免疫抑制小鼠巨噬细胞和T细胞的免疫功能。
[1]Dicker KT,Gurski LA,Pradhan-Bhatt S,et al. Hyaluronan:A simple polysaccharide with diverse biological functions[J]. Acta Biomater,2014,10(4):1558-1570.
[2]Stern R,Asari AA,Sugahara KN,et al. Hyaluronan fragments:An information-rich system[J]. European Journal of Cell Biology,2006,85(8):699-715.
[3]Delmage JM,Powars DR,Jaynes PK,et al. The selective suppression of immunogenicity by hyaluronic acid[J]. Annals of Clinical and Laboratory Science,1986,16:303-310.
[4]Wu Y. Preparation of low-molecular-weight hyaluronic acid by ozone treatment[J]. Carbohydrate Polymers,2012,89:709-712.
[5]张惠,刘爱华,臧恒昌,等. 低相对分子质量透明质酸制备方法及生物活性研究进展[J]. 中国药学杂志,2012,47(13):1022-1024.
[6]Knoflach A,Azuma H,Magee C,et al. Immunomodulatory functions of low-molecular weight hyaluronate in an acute rat renal allograft rejection model[J]. Journal of the American Society of Nephrology. 1999,10:1059-1066.
[7]Tesar BM,Jiang D,Liang J,et al. The role of hyaluronan degradation products as innate alloimmune agonists[J]. American Journal of Transplantation,2006,6(11):2622-2635.
[8]Alaniz L,Rizzo M,Garcia MG,et al. Low molecular weight hyaluronan preconditioning of tumor-pulsed dendritic cells increases their migratory ability and induces immunity against murine colorectal carcinoma[J].Cancer Immunology Immunotherapy. 2011,60(10):1383-1395.
[9]柯春林,乔德亮,曾晓雄.低分子量透明质酸的制备及其抗氧化活性的研究[J]. 食品工业科技,2010,31(1):107-110.
[10]Kuang HX,Xia YG,Yang BY,et al. Screening and comparison of the immunosuppressive activities of polysaccharides from the stems of Ephedra sinica Stapf[J]. Carbohydr Polym,2011,83:787-795.
[11]Liu CH,Xi T,Lin QX,et al. Immunomodulatory activity of polysaccharides isolated from Strongylocentrotus nudus eggs[J]. Int Immunopharmacol. 2008,8:1835-1841.
[12]徐远义,黄允宁,常越,等. 抗甲素增强大鼠腹腔巨噬细胞抗癌免疫功能的研究[J].免疫学杂志. 2006,22(4):396-398.
[13]Dai ZY,Zhang H,Zhang YP,et al. Chemical properties and immunostimulatory activity of a water-soluble polysaccharide from the clam of Hyriopsis cumingii Lea[J]. Carbohydr Polym,2009,77,365-369.
[14]Cohn ZA.The activation of mononuclear phagocytes:Fact,fancy,and future[J]. J Immunol,1978,121(3):813-816.
[15]Belska NV,Guriev AM,Danilets MG,et al. Water-soluble polysaccharide obtained from Acorus calamus L. classically activates macrophages and stimulates Th1 response[J]. International Immunopharmacology,2010,10(8):933-42.
[16]Heriazon A,Yager JA,Sears W,et al. Induction of delayed-
type hypersensitivity and interferon-gamma to Candida albicans and anti-hen-egg white lysozyme antibody as phenotypic markers of enhanced bovine immune response[J]. Vet Immunol Immunop,2009,129:93-100.
[17]易阳,曹银,张名位. 多糖调控巨噬细胞免疫应答机制的研究进展[J]. 中国细胞生物学学报,2011,33(11):1267-1277.
[18]张晋强,李彦东,马海利,等. 黄芪多糖对小鼠腹腔巨噬细胞iNOS基因表达及NO生成的影响[J]. 动物医学进展,2013,34(1):55-59.
[19]Knoflach A,Azuma H,Magee C,et al. Immunomodulatory functions of low-molecular weight hyaluronate in an acute rat renal allograft rejection model[J]. J Am Soc Nephrol,1999,10:1059-1066.
Immunomodulatory activity of low molecular weight hyaluronan on macrophages and T lymphocytes from mice
KE Chun-lin1,2,LI Zuo-mei1,ZENG Xiao-xiong2
(1.Department of Food and Bioengineering,Bengbu College,Bengbu 233030,China;2.College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
Low molecular weight hyaluronan(LMWHA)were prepared from hyaluronan by using free radical degradation,and the immunostimulatory activities of LMWHA on macrophages and T lymphocytes were evaluated by usinginvitrocell models andinvivoanimal experiments.The effect of LMWHA on the delayed type hypersensitivity response(DTH)induced by DNFB,serum hemolysin activity,thymus and spleen indexes from immunosuppressed mice were detected. The LMWHA(20~120 mg/kg·d)could induce DTH and increase the level of serum lysozyme and the indices of thymus and spleen in a dose-dependent manner. Furthermore,LMWHA(25~200 μg/mL)could promote the proliferation of splenocytes,strengthen the phagocytic activity and induce the increase of nitric oxide(NO)production and the activity of nitric oxide synthase(iNOS)in mouse peritoneal macrophages. The results showed that LMWHA could regulate the immune function of mice.
low molecular weight hyaluronan;immunomodulatory activity;macrophages;T lymphocytes
2016-01-08
柯春林(1976- ), 男,博士, 副教授, 主要从事糖生物学和糖生物工程方面的研究,E-mail:kexiao139@aliyun.com。
安徽省自然科学基金项目(1408085MH209);高校优秀青年人才支持计划重点项目(gxyqZD2016360);蚌埠学院学术技术带头人后备人选培养计划项目(院字[2014]182号)。
TS201
A
1002-0306(2016)15-0349-06
10.13386/j.issn1002-0306.2016.15.060
