羟基铁柱撑蒙脱石吸附玉米赤霉烯酮机理研究
2016-09-12方圣琼翁洪平潘文斌
方圣琼,翁洪平,李 晓,潘 进,潘文斌
(1. 福州大学 石油化工学院,福州 350116; 2. 福州大学 环境与资源学院,福州 350116)
羟基铁柱撑蒙脱石吸附玉米赤霉烯酮机理研究
方圣琼1,2,翁洪平2,李晓1,潘进2,潘文斌2
(1. 福州大学 石油化工学院,福州 350116; 2. 福州大学 环境与资源学院,福州 350116)
系统研究羟基铁柱撑改性蒙脱石(OH/Fe-Mont)吸附玉米赤霉烯酮的机理,并且通过XRD和FT-IR表征手段进行表征,研究表明:(1) OH/Fe-Mont对玉米赤霉烯酮(ZEA)吸附量远高于未改性蒙脱石(K10-Mont),当n(OH)/n(Fe)为1.5时最高达到0.283 mg/g,是K10-Mont吸附量(0.054 mg/g)的5倍;XRD分析表明羟基铁柱撑蒙脱石层间距扩增是吸附量增加的主要原因;(2) OH/Fe-Mont和K10-Mont对ZEA等温吸附符合Freundlich等温吸附模型;FT-IR分析表明离子交换是ZEA进入蒙脱石的主导机制;(3) OH/Fe-Mont和K10-Mont对ZEA吸附较佳pH值为8,温度为35 ℃;(4) 吸附动力学模型符合伪二级动力学模型,相关系数R2>0.99,且1.5OH/Fe-Mont初始吸附速率和平衡吸附量均远高于K10-Mont。
蒙脱石、羟基铁、玉米赤霉烯酮、吸附
0 引 言
霉菌毒素是真菌或霉菌在适宜的条件下产生的有毒、有害的代谢产物,主要有黄曲霉毒素,玉米赤霉烯酮,赭曲霉素和烟曲霉素等[1-6]。根据联合国粮食和农业组织的报告,约25%的粮食作物受到霉菌毒素的污染,造成巨大的经济损失[4],而中国饲料和食品受到霉菌毒素污染的比例超过60%~70%,尤其是南部和东部的地区[7]。因此解决食品霉菌毒素污染问题是一个世界性的难题[8]。
玉米赤霉烯酮(ZEA)是由多种镰刀菌次级代谢产生毒素产物,作为霉菌毒素最重要的一种,对谷物的污染有最广泛影响[9-10]。ZEA与雌性激素具有相似行为,易与子宫内雌激素受体发生不可逆结合,从而对畜禽生殖、生理产生巨大的危害[11-13],因此急需采取一些措施减缓这些问题。当前的物理、化学方法去除食品中霉菌毒素存在破坏食品的营养结构缺陷,而生物处理方法周期太长,因此,简单吸附可以成为最有效的方法。
蒙脱石是膨润土的主要矿物成分,具有层状结构,空隙中的高价阳离子易被低价阳离子取代,具有离子交换容量大等特征[14]。而目前研究主要集中在由有机阳离子改性蒙脱石后去除ZEA,而有机阳离子改性存在一定的环境风险,而对无机羟基铁柱撑蒙脱石对ZEA的吸附和吸附机理研究处于空白[11,15-16]。
1 实 验
1.1实验材料
ZEA标准样和K10-Mont均采购西格玛奥德里奇(Sigma-Aldrich)公司;K10-Mont的离子交换容量(CEC)为 24.6 mmol/100 g;ZEA分子式C18H22O5,其分子量为318.36,其pKa1值为7.62和log Kow为3.66[17],所有其它试剂的均为优级纯或色谱纯。ZEA储备液(250 mg/L)采用乙腈/甲醇为1∶1比例配置,储存在黑暗中零下20 ℃,实验用水均采用去离子水(18 MΩ·cm)。
1.2OH/Fe-Mont制备
1.2.1柱撑溶液制备
Fe(NO3)3·9H2O溶于去离子水,在室温下,将Na2CO3粉末缓慢加入并搅拌,然后加去离子水到200 mL继续搅拌2 h。混合溶液在60 ℃恒温水浴中陈化24 h。添加不同Na2CO3加到Fe(NO3)3·9H2O溶液获得不同n(OH)/n(Fe)的柱撑溶液,摩尔比例见表1所示[10,18-20]。
1.2.2OH/Fe-Mont制备
6 g K10-Mont加入100 mL去离子水制得悬浮液,60 ℃水浴搅拌下,柱撑溶液缓慢加入到悬浮液中,反应2 h后,悬浮液在60 ℃水浴中陈化[11,14-15],再经过多次去离子水洗涤和离心得到OH/Fe-Mont,产品在90 ℃下烘干。
1.3表征方法
XRD分析采用Rigaku MiniFlex 600进行分析,FT-IR光谱分析采用Thermo Nicolet iS10傅里叶变换红外光谱仪。
表1OH/Fe-Mont用量配比表
Table 1 Number of the pillared Montmorillonite and the dosage of reagents[18]
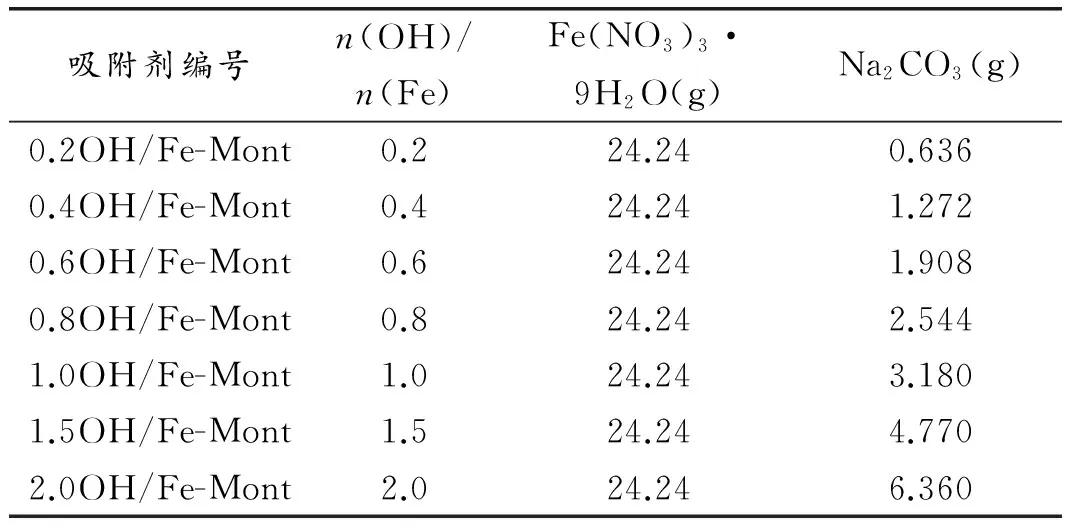
吸附剂编号n(OH)/n(Fe)Fe(NO3)3·9H2O(g)Na2CO3(g)0.2OH/Fe-Mont0.224.240.6360.4OH/Fe-Mont0.424.241.2720.6OH/Fe-Mont0.624.241.9080.8OH/Fe-Mont0.824.242.5441.0OH/Fe-Mont1.024.243.1801.5OH/Fe-Mont1.524.244.7702.0OH/Fe-Mont2.024.246.360
1.4ZEA吸附实验
1.4.1实验方法
对于所有的实验中,所用的OH/Fe-Mont和K10-Mont的量均为0.100 g,均做3个平行样,3组空白实验不添加蒙脱石,ZEA溶液体积为20.0 mL,用铝箔包裹以防曝光,在一个转速为170 r/min的恒温振荡器中震荡24 h。之后4 000 r/min离心机离心5 min,然后用HPLC(Agilent 1260高效液相色谱)分析ZEA。标准曲线采用9个标准样品,线性相关系数R2大于0.999。
1.4.2平衡吸附量
不同摩尔比OH/Fe-Mont和K10-Mont分别与ZEA标准溶液在温度37 ℃、避光、振动筛中震荡吸附反应24 h,达到吸附平衡,得到OH/Fe-Mont与K10-Mont的平衡吸附量。
1.4.3等温线吸附
取0.100 g的K10-Mont和OH/Fe-Mont分别加到不同初始浓度的ZEA(0.1,0.25,0.5,1,2.5,5 mg/L)20 mL溶液中进行等温吸附研究。
企业重组业务是指企业法律结构或经济结构发生重大改变的非日常经营活动,主要包括企业法律形式改变、合并、分立、股权收购、债务重组、资产收购等方式。企业重组涉及的税务处理分为一般性税务处理和特殊性税务处理两种。其中,特殊性税务处理需要同时满足五个条件:重组后连续十二个月不改变重组资产原本的实质性经营活动;重组时取得股权支付的主要原股东在重组后连续十二个月内不得转让该股权;重组具有合理的商业目的且不以免除、减少或推迟缴纳税款为主要目的;重组交易对价的股权支付比例要达到规定比例;被收购、合并、分立部分股权或资产比例达到规定要求。
1.4.4吸附影响因素
选用不同pH值(2,4,6,8,10),不同温度(15,25,35,45,55 ℃)和不同ZEA浓度(0.1,0.25,0.5,1,2.5,5 mg/L)对OH/Fe-Mont和K10-Mont吸附ZEA的影响。
1.4.5吸附动力学
0.100 g的K10-Mont和1.5OH/Fe-Mont分别混合在pH值为8的20 mL的5 mg/L ZEA溶液中,分别在0.25,0.5,0.75,1,2,4,8,12,24 h取样离心分离后测ZEA浓度。
2 结果与讨论
2.1n(OH)/n(Fe)影响和XRD分析
K10-Mont和不同n(OH)/n(Fe)柱撑蒙脱石在37 ℃时24 h吸附平衡吸附量见图1。从图1可知,未改性蒙脱石K10-Mont(即n(OH)/n(Fe)为0点)平衡吸附量为0.054 mg/g,而OH/Fe-Mont的吸附量在n(OH)/n(Fe)<1.5时,随着n(OH)/n(Fe)增大而增大,到n(OH)/n(Fe)为1.5时达到最大值,即对ZEA吸附量达到0.283 mg/g,远大于未改性前吸附量,是K10-Mont的5倍吸附量;而n(OH)/n(Fe)大于1.5时,吸附不增加反而出现下降。
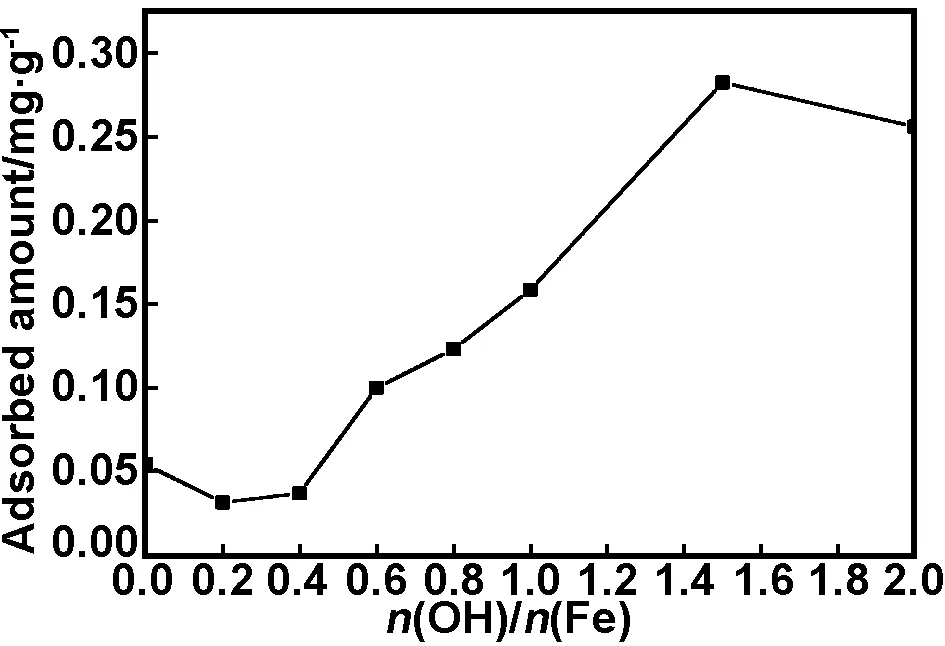
图1 不同n(OH)/n(Fe)对吸附量的影响
Fig 1 Effect of molar ratio on ZEA adsorption amount
XRD图和层间距d(001)见图2,从图可知用羟基铁柱撑改性后OH/Fe-Mont与未改性之前K10-Mont的X射线衍射图中并没有出现新的衍射峰,只是(001)晶面衍射峰出现的位置、强度和层间距d(001)发生了明显改变(图2),尤其是羟基铁柱撑后蒙脱石d(001)显著增大,说明羟基铁柱撑蒙脱石对层间距的扩大有明显的影响。从图2可知K10-Mont的d(001)为1.19 nm,羟基铁柱撑d(001)最大值出现在1.5OH/Fe-Mont,d(001)为1.62nm。
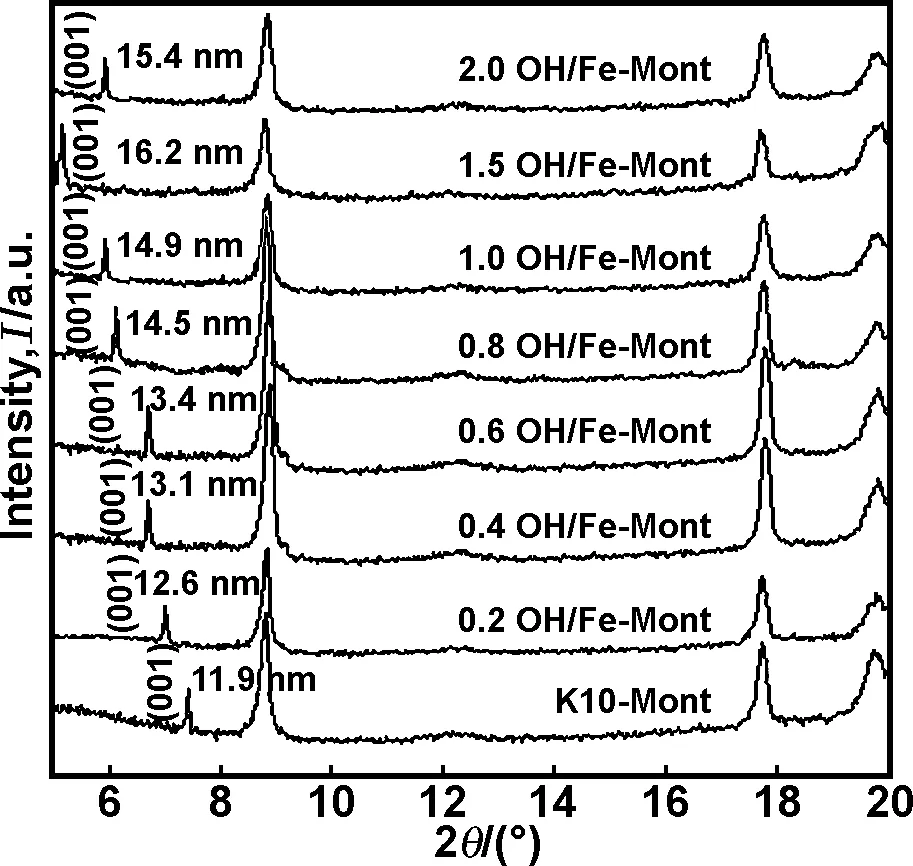
图2不同n(OH)/n(Fe)柱撑蒙脱石和K10-Mont的X射线衍射图
Fig 2 X-ray diffraction patterns of Mont pillared with different ratio of hydroxy-Fe
从图2可知层间距离的扩增分为两个阶段,当n(OH)/n(Fe)小于0.8,d(001)增速缓慢;当n(OH)/n(Fe)超过0.8,d(001)增速较快;在n(OH)/n(Fe)为1.5,层间距d(001)离达到顶峰为1.62 nm,说明铁离子的某些初级水解产物插层到部分蒙脱石颗粒的层间,导致层间距增加;当n(OH)/n(Fe)为2时,d(001)反而出现下降到1.54 nm,主要是n(OH)/n(Fe)的升高,柱撑溶液中pH值升高到一定限度,会导致大量的铁氢氧化物沉淀,沉淀物覆盖在蒙脱石表面,造成柱撑效果不佳。所有样品的XRD图并没有获得部分文献所报道的d(001)为(2.5±0.4) nm的柱撑结构,这似乎支持了Herrera等的观点[21],他认为铁阳离子的水解产物大小不一,而不像铝阳离子水解后可形成稳定的、大小一致的结构(Keggin结构),很难形成有序的柱撑结构。从羟基铁柱撑蒙脱石XRD分析结果中d(001)变化正好解释n(OH)/n(Fe)影响对吸附的影响,由于K10-Mont的d(001)小,因此吸附量小,而1.5 OH/Fe-Mont的d(001)值最大,因此相应对ZEA吸附量最大, 吸附量可提高5倍左右,这也说明了OH/Fe柱撑改性对改善蒙脱石吸附ZEA有明显效果,而羟基铁柱撑蒙脱石层间距扩增是吸附量增加的主要原因。
2.2等温吸附和FT-IR分析
蒙脱石对不同初始浓度ZEA吸附见图3。从图3可知1.5OH/Fe-Mont和K10-Mont对ZEA吸附量随着ZEA初始浓度的增加而增加,这是由于在低浓度时,可用于吸附位点附近的ZEA分子的量很小,因此吸附量少,当初始浓度增加,ZEA分子增加,竞争吸附位点明显加剧,因此ZEA吸附量上升。从图3也可知不管在低浓度和高浓度时,1.5OH/Fe-Mont对ZEA吸附量均远大于K10-Mont,说明羟基铁柱撑改性蒙脱石强化了对ZEA吸附。在本文中经过柱撑后的蒙脱石对ZEA的吸附量优于Alenander和Ramos等在其文章中提到常见的硅酸盐类矿物对ZEA的吸附量(0.023~0.313 mg/g)[22-23]。
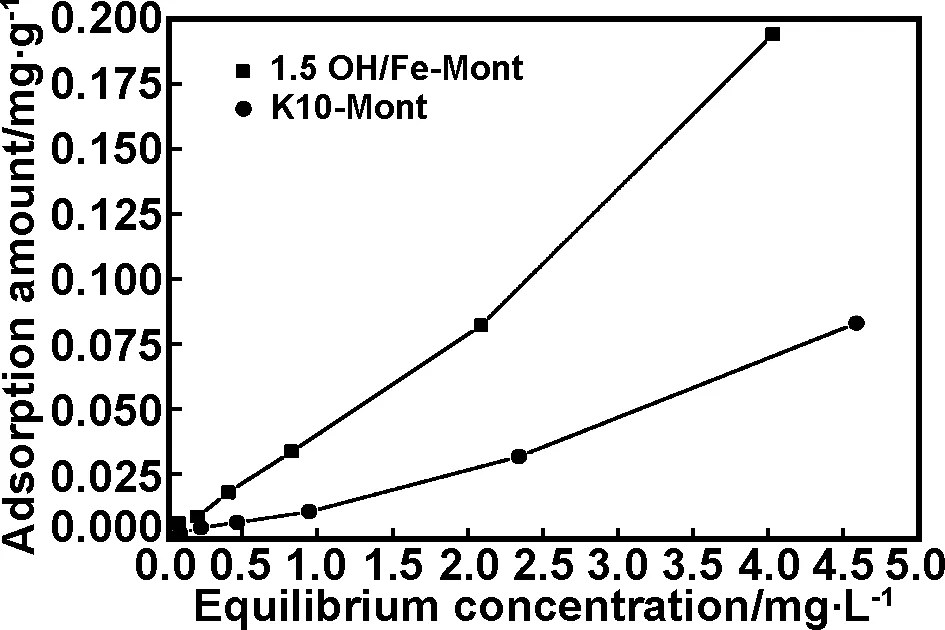
图3 吸附量与平衡浓度关系图
Fig 3 Effects of concentration on ZEA adsorption amount
对实验数据进行Langmuir 等温吸附(1) 模型和 Freundlich等温吸附(2)模型分析
(1)
(2)
上述方程中qe是平衡吸附量,mg/g;Ce是平衡浓度,mg/L;qmax是最大吸附量,mg/g;KL是Langmuir吸附系数,L/mg;KF是Freundlich吸附系数,mg/L·g-1。采用Langmuir和 Freundlich等温吸附的参数如表2所示。

表2 Langmuir 和 Freundilch等温吸附ZEA模型参数
从表2参数可知,Freundlich模型(R2≥0.95)比Langmuir模型(R2<0.05)更适合K10-Mont和1.5OH/Fe-mont吸附ZEA研究。Langmuir模型描述的是一种颗粒的单分子层吸附,吸附位点相同,而且所有的吸附过程是完全独立的,从表中可知Langmuir模型不适用K10-Mont和1.5OH/Fe-mont吸附模型,这也说明K10-Mont或1.5OH/Fe-mont吸附ZEA过程都是复杂的,而目前研究也表明蒙脱石吸附ZEA行为倾向于多层吸附,蒙脱石表面与层空间都是可用于吸附,ZEA可以与吸附材料发生表面络合反应或者是空间插层吸附,而Freundlich经验模型较好地反应了蒙脱石吸附ZEA的吸附平衡过程。在Freundlich经验模型中,1/n<1说明倾向于易于吸附,这也说明改性蒙脱石可作为脱除ZEA的吸附剂。


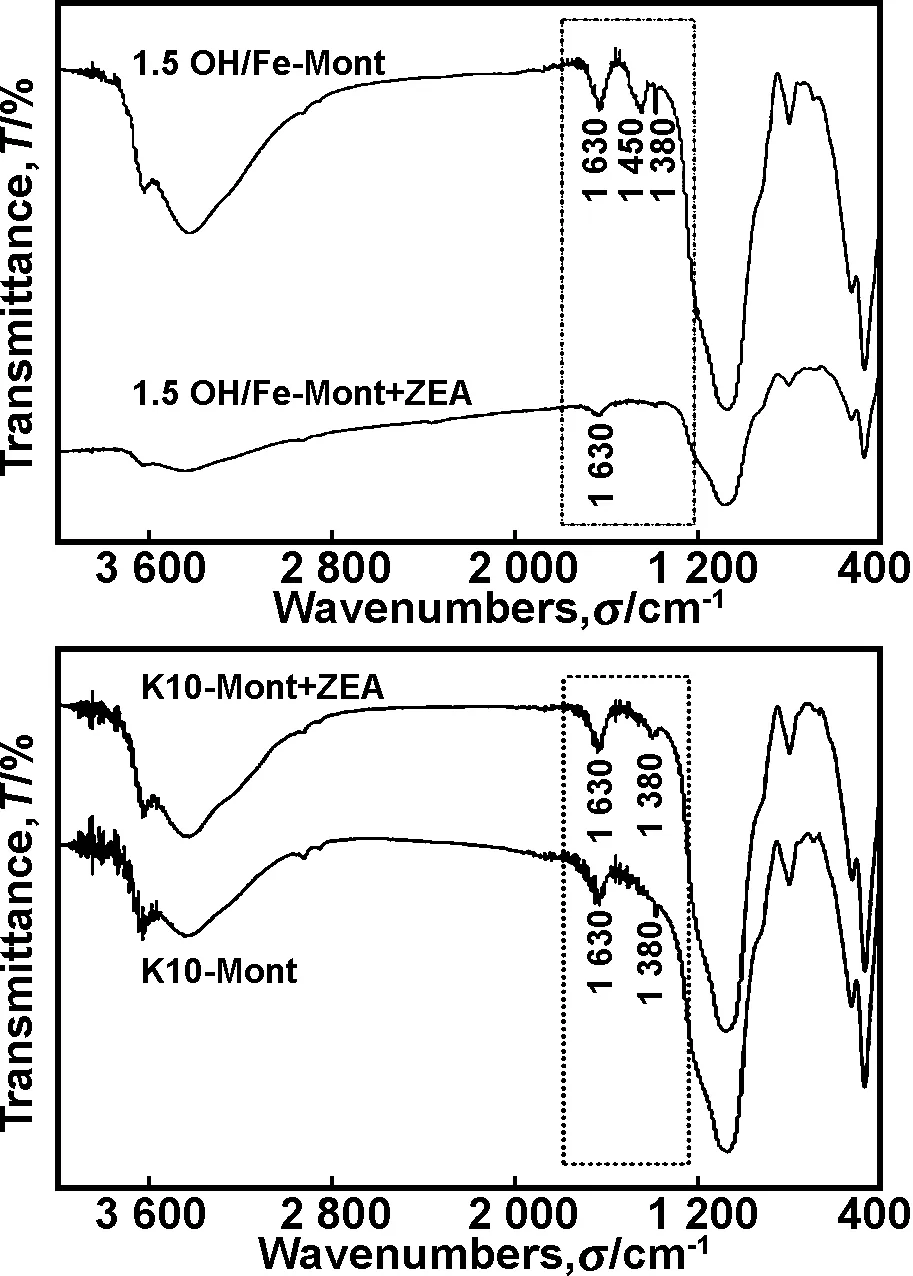
图4K10-Mont和 1.5OH/Fe-Mont吸附ZEA前后的FT-IR图谱(+ZEA表示吸附后)
Fig 4 FT-IR of both K10-Mont and 1.5OH/Fe-Mont adsorbed ZEA(+ZEA: after adsorbed)
2.3pH值和温度影响
pH值对吸附影响见图5,从图5可知ZEA吸附量随着pH值变化经历了两个阶段,当pH值<8时,随着pH值的升高吸附量增加到最大,当pH值>8时,pH值上升吸附量反而开始下降。ZEA与苯酚相似的酚羟基结构,可以看作是一种弱酸分子, ZEA 的pKa1是7.62。 当 pH值<7.62时, ZEA 分子带正电荷。在低pH值条件下,溶液中大量的H+消减了夹层中羟基的吸附点位,随着pH值上升,吸附量随着羟基吸附点位上升而上升。随着pH值的继续升高,溶液中有大量的氢氧化物使得吸附的优势被破坏,使吸附量减少。
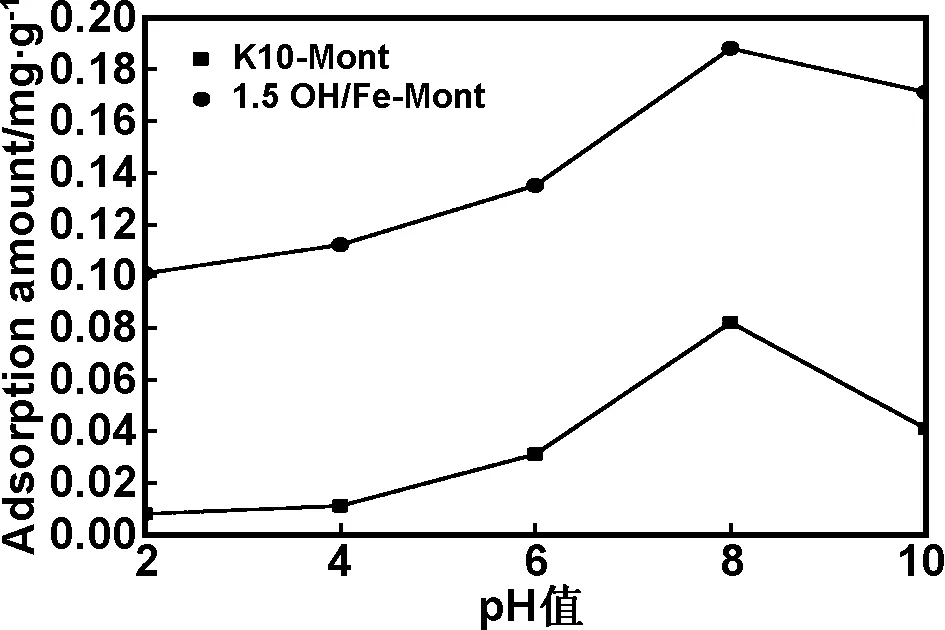
图5 pH值对吸附ZEA影响
温度对ZEA吸附的影响如图6所示,开始ZEA的吸附量开始随温度上升而上升,近35 ℃时最大,然后随温度上升开始下降。温度从15~35 ℃时,随温度上升,不饱和的蒙脱石活性位点大大增加,利于形成一种新的化学键牢固结合ZEA;相反,当温度超过35 ℃时,过高的温度提供能量使得化学键断裂,使得吸附量下降。一般家畜和家禽的体内pH值在6.5~7.5、体温37~42 ℃不等,这个pH值和温度是接近的最佳吸附pH值和温度,因此可考虑作为体内吸附剂。
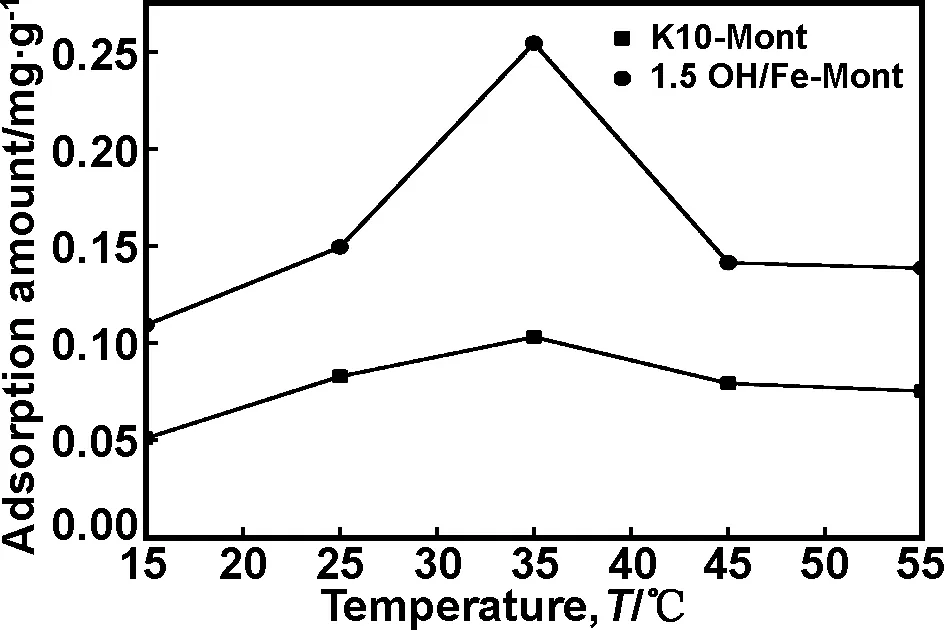
图6 温度对蒙脱石吸附ZEA的影响
Fig 6 Effects of temperature on ZEA adsorption amount
2.4吸附动力学
本文对吸附量与时间之间关系进行了动力学模型拟合,一个伪二级动力学模型拟合数据最好(图7),该模型已被广泛应用于水溶液中污染物的吸附研究[25-26]
(3)
(4)
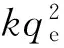
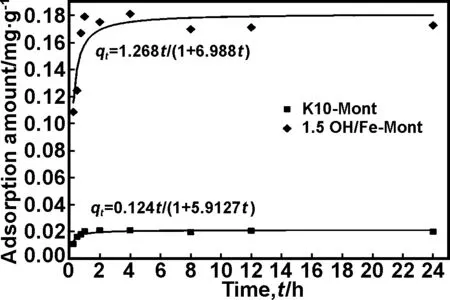
图7K10-Mont和 1.5OH/Fe-Mont吸附ZEA动力学
Fig 7 Kinetics of ZEA adsorption on K10-Mont and 1.5OH/Fe-Mont
表3吸附ZEA伪二级动力学方程参数
Table 3 Parameters of pseudo-second-order equation for adsorption of ZEA

吸附剂伪二级动力学方程R2kq2e/mg·g-1·h-1K/g·mg-1·h-1qe/mg·g-1K10-Mont0.99930.1242281.423240.021011.5OH/Fe-Mont0.99491.266838.515920.18136
从表3可知,相关系数R2>0.99,1.5OH/Fe-Mont初始吸附速率为1.2668 mg/g·h,qe为0.18136 mg/g,远高于K10-Mont的0.1242 mg/g·h和0.02101 mg/g,说明改性蒙脱石极大改善了其对水溶液中ZEA吸附,是去除ZEA的良好吸附剂。
3 结 论
(1)OH/Fe-Mont对ZEA吸附量远高于K10-Mont,n(OH)/n(Fe)为1.5时达到最高0.283 mg/g,是K10-Mont吸附量0.054 mg/g的5倍;XRD分析也证明羟基铁柱撑扩增了蒙脱石层间距,层间距d(001)从未柱撑K10-Mont的1.19 nm上升到柱撑后的1.62 nm,蒙脱石层间距扩增使其吸附量增加。
(2)蒙脱石对ZEA等温吸附符合Freundlich等温吸附模型,1/n<1说明倾向于易于吸附,这也说明改性蒙脱石可作为脱除ZEA的吸附剂;FT-IR分析表明离子交换是ZEA进入蒙脱石的主导机制。
(3)OH/Fe-Mont和K10-Mont对ZEA吸附最佳pH值约为8,最佳温度在35 ℃,类似于牲畜的体内环境。
(4)吸附动力学模型符合伪二级动力学模型,相关系数R2>0.99,1.5OH/Fe-Mont初始吸附速率和平衡吸附均远高于K10-Mont。
蒙脱石或柱撑蒙脱石与ZEA之间相互作用机制的阐明,有助于改性蒙脱石在霉菌毒素脱除中应用。而羟基铁柱撑蒙脱石能否在畜禽胃肠道有效地脱除ZEA,需要进一步通过体内实验研究。
[1]Savard M E. Mycotoxins-an introduction[J]. Stewart Postharvest Review, 2008, 4(6): 1-6.
[2]Jarvis B B, Miller J D. Mycotoxins as harmful indoor air contaminants.[J]. Applied Microbiology & Biotechnology, 2005, 66(4):367-372.
[3]Wild C P, Gong Y Y.Mycotoxins and human disease: a largely ignored global health issue[J]. Carcinogenesis, 2010, 31(1):71-82.
[4]Upadhaya S D, Park M A, Ha J K. Mycotoxins and their biotransformation in the rumen: a review[J]. Asian Australasian Journal of Animal Sciences, 2010, 23(9):1250-1260.
[5]Wei Qiumei,Yu Zhanguo.The main types and their harms of Mycotoxins[J]. Technical Advisor for Animal Husbandry, 2012, (5): 149.
魏秋梅,于占国. 霉菌毒素的主要种类及其危害[J]. 养殖技术顾问, 2012, (5): 149.
[6]IARC. Monographs on the evaluation of carcinogenic risk to humans[R]. Lyon: World Health Organisation, 1993.
[7]Wang Ruojun, Miao Zhaohua, Zhang Zhengxiong, et al. Investigation of mould toxin pollution of feed and feedstuff[J]. Feed Industry, 2003, 24(7):53-54.
王若军, 苗朝华, 张振雄,等. 中国饲料及饲料原料受霉菌毒素污染的调查报告[J]. 饲料工业,2003, 24(7): 53-54.
[8]Schollenberger M, Müller H M, Rüfle M, et al. Natural occurrence of 16 fusarium toxins in grains and feedstuffs of plant origin from Germany[J]. Mycopathologia, 2006, 161(1):43-52.
[9]Ramos A J, Hernandez E, Pla-Delfina J M, et al.Intestinal absorption of zearalenone and in vitro study of non-nutritive sorbent materials[J]. International Journal of Pharmaceutics, 1996, 128(1): 129-137.
[10]Bekci Z M, Antep M K, Merdivan M, et al. Zearalenone removal in synthetic media and aqueous part of canned corn by montmorillonite K10 and pillared montmorillonite K10.[J]. Journal of Food Protection, 2011, 74(6):954-959.
[11]Lemke S L, Grant P G, Phillips T D. Adsorption of Zearalenone by Organophilic Montmorillonite Clay[J]. Journal of Agricultural & Food Chemistry, 1998, 46(9):3789-3796
[12]Ac P. Mycotoxins and animal health[J]. Adv Vet Sci Comp Med, 1981, 25:185-243.
[13]Diekman M A, Green M L. Mycotoxins and reproduction in domestic livestock[J]. Journal of Animal Science, 1992, 70(5):1615-1627.
[14]Zeng L, Wang S P. Adsorption of zearalenone by montmorillonite[J]. Advanced Materials Research, 2013, 683: 343-347.
[15]Corporation H P. Preparation and characterization of montmorillonite intercalation compounds with quaternary ammonium surfactant: adsorption effect of zearalenone[J]. Journal of Nanomaterials, 2014, 9(1):1127-1138.
[16]Feng J, Shan M, Du H, et al. In vitro adsorption of zearalenone by cetyltrimethyl ammonium bromide-modified montmorillonite nanocomposites[J]. Microporous & Mesoporous Materials, 2008, 113(1):99-105.
[17]Dakovi A, Matijasevi S, Rottinghaus G E, et al. Adsorption of zearalenone by organomodified natural zeolitic tuff[J]. J Colloid Interface Sci, 2007, 311(1):8-13.
[18]Sun Chanshun. Preparation, characterization and adsorption behaviors of the inorganic pillared bentonites and its application in wastewater treatment[D]. Xi’an: Xi’an University of Architecture and Technology, 2008.
孙长顺.无机柱撑膨润土的制备、表征、吸附特性及其在废水处理中的应用研究[D].西安:西安建筑科技大学,2008.
[19]Palinko I, Lazar L, Hannus I, et al. Step towards nanoscale Fe moieties: Intercalation of simple and Keggin-type iron-containing ions in-between the layers of Na-montmorillonite[J]. Journal of Physics and Chemistry of Solids, 1996, 57(6): 1067-1072.
[20]Rightor E G, Tzou M S, Pinnavaia T J. Iron oxide pillared clay with large gallery height: synthesis and properties as a Fischer-Tropsch catalyst[J]. Journal of Catalysis, 1991, 130(91):29-40.
[21]Herrera R, Peech M. Reaction of montmorillonite with iron(Ⅲ)[J]. Proceedings Soil Science Society of America, 1970, 34(5):740-742.
[22]Huwig A, Freimund S, Käppeli O, et al. Mycotoxin detoxication of animal feed by different adsorbents.[J]. Toxicology Letters, 2001, 122(2):179-188.
[23]Ramos A J, Hernández E, Plá-Delfina J M, et al.Intestinal absorption of zearalenone and in vitro study of non-nutritive sorbent materials[J]. International Journal of Pharmaceutics, 1996, 128(1):129-137.
[24]Yuan Peng, Wang Fuya, Xiao Wansheng, et al. Characterization of iron delaminated pillared montmorillonite: a primary[J]. Study Journal of Mineralogy and Petrology, 2005, 25(3):37-40.
袁鹏, 王辅亚, 肖万生,等. 铁层离-柱撑蒙脱石的结构初探[J].矿物岩石, 2005, 25(3):37-40.
[25]Sciascia L, Liveri M L T, Merli M. Kinetic and equilibrium studies for the adsorption of acid nucleic bases onto K10 montmorillonite[J]. Applied Clay Science, 2011, 53(4):657-668.
[26]Goswami M, Borah L, Mahanta D, et al.Equilibrium modeling, kinetic and thermodynamic studies on the adsorption of Cr(Ⅵ) using activated carbon derived from matured tea leaves[J]. Journal of Porous Materials, 2014, 21(6):1025-1034.
Study on adsorption of zearalenone by hydroxy-Feintercalated montmorillonite
FANG Shengqiong1,2,WENG Hongping2,LI Xiao1,PAN Jin2,PAN Wenbin2
(1. School of Chemical Engineering, Fuzhou University,Fuzhou 350116, China;2. School of Environment and Resources, Fuzhou University,Fuzhou 350116, China)
Adsorption of zearalenone (ZEA) by hydroxyl-Fe intercalated montmorillonite (OH/Fe-Mont) was investigated, at the same time, the adsorption materials were analyzed by XRD and FT-IR instrument. Main conclusions of this work were drawn as follows: (1) The adsorption capacity of OH/Fe-Mont to ZEA was much higher than that of K10-Mont. When the molar ratio of OH/Fe was 1.5, the adsorption capacity of OH/Fe-Mont to ZEA reaches the maximum (0.283 mg/g), which was 5 times of that of the K10-Mont(0.054 mg/g). The result of XRD analysis shows that thed001of hydroxyl-Fe intercalated montmorillonite increased after modification. The increment of interlayer space of montmorillonite made the adsorption amount increase. (2) Freundlich model could well fit the adsorption isotherms of zearalenone by both OH/Fe-Mont and K10-Mont. FT-IR analysis shows that cationic exchange was the dominant mechanism for ZEA entering montmorillonite interlayer. (3) For sorption of Zearalenone by both OH/Fe-Mont and K10-Mont, the optimum adsorption conditions of pH was 8, the optimum temperature was 35 ℃. (4) A pseudo-second-order kinetic model could well fit the data, the correlation coefficient (R2) of two adsorbents were more than 0.99. Both initial rate and equilibrium adsorption amount of 1.5OH/Fe-Mont were higher than the K10-Mont.
montmorillonite; hydroxy-Fe; zearalenone; adsorption
1001-9731(2016)08-08143-06
国家自然科学基金青年科学基金资助项目(21303019)
2015-07-29
2015-11-18 通讯作者:李晓,E-mail: lxzwy@fzu.edu.cn
方圣琼(1978-),男,福建武平人,讲师,在读博士,师承李晓教授,从事环境友好材料和污染控制研究。
TB34
A
10.3969/j.issn.1001-9731.2016.08.025
