survivin启动子调控肿瘤干细胞标记CD133基因siRNA增殖型溶瘤腺病毒的构建及对肝癌细胞生长的抑制作用
2016-09-12王人颢朱志军申海莲
牛 坚,王 月,刘 斌,王人颢,朱志军,申海莲
survivin启动子调控肿瘤干细胞标记CD133基因siRNA增殖型溶瘤腺病毒的构建及对肝癌细胞生长的抑制作用
牛 坚1,王 月1,刘 斌1,王人颢1,朱志军2,申海莲3
目的 构建survivin启动子调控的靶向CD133基因的siRNA增殖型溶瘤腺病毒,研究其对肝癌细胞生长的影响。方法 RT-PCR法扩增survivin启动子,测序鉴定,双酶切连接,获得pH-XC2-survivin。酶切pH-XC2-survivin、pZD55-CD133-siRNA获得survivin启动子表达框的亚克隆和CD133-siRNA基因表达框的亚克隆,连接获得survivin启动子调控的siRNA增殖型溶瘤腺病毒表达载体质粒pT-ZD55-CD133-siRNA。增殖型溶瘤腺病毒survivin-T-ZD55-CD133-siRNA经PCR和测序鉴定。qRT-PCR法检测CD133表达,Western blot法检测E1A,CCK-8法检测细胞生长,流式细胞术检测细胞凋亡。结果 成功构建增殖型溶瘤腺病毒survivin-T-ZD55-CD133-siRNA。qRT-PCR法检测CD133 mRNA明显下降,Western blot证实 survivin-T-ZD55-CD133-siRNA在肿瘤细胞中表达E1A能抑制肝癌细胞CD133表达及生长。结论 构建的增殖型溶瘤腺病毒可有效降低肝癌细胞CD133的表达,用于肝癌基因治疗的进一步研究。
主题词 肝癌;干细胞;CD133;细胞增殖;基因表达
网络出版时间:2016-6-6 13:52:31 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160606.1352.004.html
肿瘤干细胞是指存在于肿瘤组织中的数量很少但有干细胞性质的细胞群体[1-2],在肿瘤的发生、发展中起重要作用,同时也在肿瘤耐药性、复发及转移的发生中发挥关键作用[3]。CD133是肝癌干细胞表面特征性的标志物[4]。靶向性是肿瘤基因治疗的关键环节。实现靶向性的手段之一就是利用特异性的基因表达调控序列使治疗基因序列在肿瘤细胞中特异表达。survivin基因的特点是在多种肿瘤细胞中表达水平高,但是在相应的正常组织少有表达[5]。据此可以利用survivin基因的启动子在肿瘤细胞表达的特异性而作为肿瘤基因治疗的新的靶向性调控序列。该研究通过构建survivin基因启动子调控的针对CD133的siRNA增殖型溶瘤腺病毒,探讨该增殖型溶瘤腺病毒对人肝癌细胞系Hep3B的生物学行为影响,探索肝癌基因治疗的新的方法。
1 材料与方法
1.1材料 293T细胞、pH-XC2、pZD55、pZD55-EGFP、pZD55-CD133-siRNA由上海交通大学附属仁济医院干细胞研究中心惠赠;人肝癌细胞系Hep3B(缺乏正常p53活性)由徐州医学院附属医院肝病研究中心保存;E1A、E1B一抗购自美国Santa Cruz公司;CCK-8试剂盒购自日本DOJINDO公司。
1.2survivin启动子的RT-PCR扩增及鉴定 根据survivin启动子序列设计一对引物,上游引物:5′-ACGTTACGTACGCGTTCTTTGAAAGCAGTC-3′,下游引物:5′-TATACTCGAGCCAGGCAGGGGGCAACGT-3′;以上引物分别含有SnaBⅠ和XhoⅠ限制性酶切位点。以HeLa细胞的基因组DNA为模板,RT-PCR扩增survivin启动子。PCR产物回收纯化同时测序分析。
1.3穿梭质粒pH-XC2-survivin的构建 survivin启动子PCR扩增产物以SnaBⅠ和XhoⅠ分别双酶切,连接至同样双酶切的pH-XC2(E1A区缺少启动子的增殖型溶瘤腺病毒质粒)中,转化大肠杆菌,扩增,用转EcoRⅠ和BamHⅠ双酶切鉴定,测序,提取质粒名为pH-XC2-survivin。
1.4穿梭质粒survivin-pT-ZD55-CD133-siRNA的构建 EcoR V、ClaⅠ酶切pH-XC2-survivin获得包含survivin启动子表达框的亚克隆;EcoR V、ClaⅠ酶切pZD55-CD133-siRNA获得包含CD133-siRNA基因表达框的亚克隆;上述2个亚克隆进行连接,获得survivin-pT-ZD55-CD133-siRNA。
1.5病毒的包装、鉴定 将质粒survivin-pT-ZD55-CD133-siRNA、pZD55-EGFP分别与腺病毒右臂质粒pBHGE3,通过Lipofectamin2000共转染293T细胞,经过病毒空斑纯化,包装成完整病毒颗粒。提取重组病毒DNA,测序鉴定正确者,即为目的病毒survivin-ZD55-CD133-siRNA、ZD55-EGFP。
1.6survivin-ZD55-CD133-siRNA的 PCR鉴定病毒感染细胞,待细胞病变后,收集细胞上清液,抽提病毒DNA。RT-PCR检测重组腺病毒是否插入目的基因,上游引物:5′-TCGTTTACTGAACCGTCAGATC-3′,下游引物:5′-ACACGGTCTCGTAGGTCAAG-3′,反应产物经琼脂糖凝胶电泳分析。
1.7病毒滴度的测定 病毒滴度的测定参考文献[6]。
1.8细胞培养及分组 细胞用含10%的小牛血清DMEM常规培养,实验所用细胞均处在对数生长期。根据实验要求分为:① Blank组:Hep3B;②shNC组:Hep3B-ZD55-EGFP;③ shCD133组:Hep3B-survivin-ZD55-CD133-siRNA。
1.9荧光定量PCR检测CD133在mRNA水平的变化 将Hep3B细胞低密度铺于6孔板,1 d后用感染复数(multiplicity of infection,MOI)=10的survivin-pT-ZD55-CD133-siRNA感染细胞,48 h后TRIzol法提取各组细胞的总RNA,按反转录试剂盒说明进行反转录。引物序列为上游引物:5′-TGCTCAGAACTTCATCACAAACAAT-3′,下游引物:5′-TAGGACAATACTGTTCGGGTAGTGT-3′;内参β-actin上游引物:5′-GTGAAGGTGACAGCAGTCGGTT-3′,下游引物:5′-CAGTGTACAGGTAAGCCCTG-3′。qRTPCR循环参数:第一步95℃预变性30 s,1个循环;第二步95℃、5 s,60℃、30 s,40个循环;第三步:熔解曲线95℃、15 s,60℃、1 min,95℃、15 s。数值分析采用最大二阶导数法(2-ΔΔCt)分析。
1.10Western blot法检测E1A、E1B蛋白表达将Hep3B细胞低密度铺于6孔板,24 h后用MOI= 10.0的survivin-ZD55-CD133-siRNA感染细胞,48 h后提取蛋白和蛋白缓冲液混合,煮沸后上检测蛋白样品,进行SDS-PAGE电泳。电泳停止后,电转移法将细胞蛋白分离到PVDF膜上。一抗(1∶1 000),二抗(1∶5 000)室温孵育后,PVDF膜用 ECL发光检测盒反应并在暗室显影。
1.11survivin-ZD55-CD133-siRNA对Hep3B细胞增殖的影响 具体操作参照Cell Counting Kit-8试剂盒操作说明。在酶联免疫测试仪上测定各样品吸光度(optical density,OD)值绘制生长曲线,计算各组实验对象1周的扩增情况。每孔设3个复孔。
1.12细胞凋亡检测 转染24 h后,收集Blank组、shNC组和shCD133组细胞后加入20 ng/ml表皮生长因子(EGF)及10 ng/ml成纤维细胞生长因子(bFGF)的无血清DMEM培养液,培养96 h后,用AnnexinV/FITC和PI染色,样品用流式细胞仪分析检测细胞凋亡情况。
1.13统计学处理 采用SAS 6.12软件进行方差和t检验分析,数据以±s表示。
2 结果
2.1survivin启动子有效片段PCR扩增 以HeLa细胞DNA为模板,PCR扩增 survivin启动子有效片段,产物经2%琼脂糖凝胶电泳,得到约298 bp大小的DNA片段,见图1。经测序验证正确。
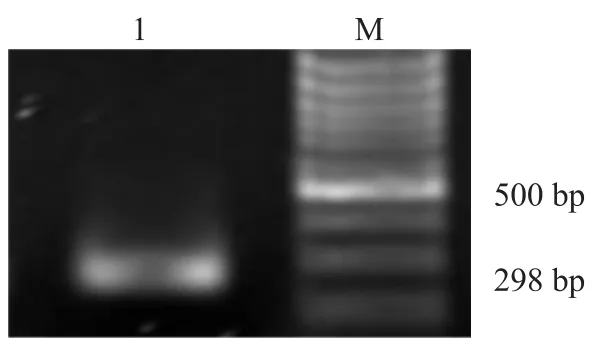
图1 survivin启动子片段PCR电泳图
2.2survivin-ZD55-CD133-siRNA鉴定和滴度测定 用survivin-ZD55-CD133-siRNA病毒DNA作为PCR反应模板,产物经琼脂糖凝胶电泳分析,可观察到在约500 bp的位置有一条带,与作为阳性对照的pT-ZD55-CD133-siRNA相同,与作为阴性对照的pZD55,在约436 bp的位置有一条带,表明survivin-ZD55-CD133-siRNA含有干扰序列。见图2。

图2 增殖型溶瘤腺病毒survivin-ZD55-CD133-siRNA鉴定
2.3Western blot法检测结果 E1A基因保留了病毒在肿瘤细胞中的复制能力。剔除了E1B(55 ku)基因,使病毒不能在正常细胞内复制。这两个方面都需要验证。结果表明,增殖型溶瘤腺病毒survivin-ZD55-CD133-siRNA、ZD55-EGFP感染 Hep3B细胞48 h后,可以检测到E1A的表达,而 Hep3B组没有E1A的表达。同时实验显示3组无E1B的表达。见图3。

图3 Western blot法检测Hep3B感染增殖型溶瘤腺病毒后E1A蛋白的表达
2.4qRT-PCR检测结果 各组重组增殖型溶瘤腺病毒颗粒转染人肝癌细胞Hep3B后,qRT-PCR结果显示:以Blank组表达量为1,shCD133组相对Blank组的CD133表达量的平均值为0.18±0.04,CD133的相对表达量下调了80%,shNC组相对Blank组表达量的平均值为0.96±0.06。shCD133组相对Blank组有显著的敲减作用(F=25.9,P<0.05),Blank组和shNC组表达量差异无统计学意义。
2.5增殖型溶瘤腺病毒survivin-ZD55-CD133-siRNA对Hep3B细胞增殖的影响 shCD133组、Blank组和shNC组细胞生长曲线显示shCD133组细胞生长明显减慢(P<0.05)。见图4。

图4 shCD133组、Blank组和shNC组生长曲线
2.6增殖型溶瘤腺病毒survivin-ZD55-CD133-siRNA对Hep3B细胞凋亡的影响 为了探讨增殖型溶瘤腺病毒survivin-ZD55-CD133-siRNA对肝癌细胞的增殖抑制作用是否依赖细胞凋亡性死亡,本研究采用AnnexinV/PI染色分析细胞凋亡情况。结果表明,与Blank组(25.3%,F=36.9,P<0.05)、shNC(24.3%,F=46.9,P<0.05)比较,shCD133组细胞阳性凋亡比例(41.3%)显著增加(图5)。

图5 AnnexinV/PI检测survivin-ZD55-CD133-siRNA对Hep3B细胞凋亡影响
3 讨论
肿瘤的发生、发展、转移及复发的关键是由那些能自我更新、无限增殖及多向分化潜能的干细胞亦即肿瘤干细胞引起的。肿瘤干细胞在很多实体瘤中普遍存在[7-8]。
CD133是一个5次跨膜糖蛋白,表达在未分化细胞和肿瘤细胞,是最重要的肿瘤干细胞标志物。CD133分子在胰腺癌[9-10]、肝细胞肝癌[11]及结直肠癌[12]等肿瘤组织中有明显表达,通过对肿瘤细胞膜突起的改变而影响细胞的极性、迁移及与相邻细胞的作用[13]。本实验通过构建增殖型溶瘤腺病毒survivin-ZD55-CD133-siRNA沉默 CD133基因,为CD133基因的功能研究提供有效手段。
肿瘤基因治疗的难点是将治疗基因特异且高效的导入癌细胞中,同时实现在肿瘤细胞中高表达,这就要求构建高靶向性的载体,这也是肿瘤基因治疗中被高度关注的领域[14]。近年增殖型溶瘤腺病毒成为研究的热点之一,以其为基础构建肿瘤基因治疗的载体,优点是可以充分利用腺病毒颗粒较小、扩散能力快的特点,与此同时大量扩增的病毒可以直接分解被感染的肿瘤细胞,还能感染附近的肿瘤细胞。增殖型溶瘤腺病毒载体一方面在肿瘤细胞内特异性扩增,另一方面还能将嵌合的外源基因的表达量放大成千上万倍,这极大增加了肿瘤的治疗效果,现已有利用增殖型腺病毒治疗肿瘤的实验报道[15]。本实验显示增殖型溶瘤腺病ZD55-EGFP对Hep3B细胞的生长有明显抑制作用。
治疗基因进入细胞,在细胞内高效、特异的表达,是需要解决的重要问题,而利用肿瘤细胞的特异性启动子控制治疗基因表达,是实现肿瘤基因治疗的重要手段。
本研究成功构建survivin启动子替换表达CD133-siRNA的增殖型腺病毒ZD55-CD133-siRNA的E1A启动子,经PCR、测序鉴定证实survivin启动子调控靶向CD133基因siRNA增殖型腺病毒survivin-ZD55-CD133-siRNA构建成功。对肝癌 Hep3B细胞进行体外研究表明构建的靶向CD133基因siRNA增殖型腺病毒对Hep3B细胞的生长有明显抑制作用,较对照组更易诱导细胞凋亡。本研究所改造的增殖型腺病毒表达载体在基础研究和应用研究中都有重要的作用。
[1]Hu M,Xiang F X,He Y F.Are cancer stem cells the sole source of tumor[J].J Huazhong Univ Sci Technolog Med Sci,2014,34 (5):621-5.
[2]Michishita M,Ezaki S,Ogihara K,et al.Identification of tumorinitiating cells in a canine hepatocellular carcinoma cell line[J]. Res Vet Sci,2014,96(2):315-22.
[3]Hao P P,Lee M J,Yu G R,et al.Isolation of EpCAM(+)/ CD133(-)hepatic progenitor cells[J].Mol Cells,2013,36 (5):424-31.
[4]Romano M,De Francesco F,Pirozzi G,et al.Expression of cancer stem cell biomarkers as a tool for a correct therapeutic approach to hepatocellular carcinoma[J].Oncoscience,2015,2(5):443 -56.
[5]Li Z L,Ueki K,Kumagai K,et al.Regulation of bcl-2 transcription by estrogen receptor-alpha and c-Jun in human endometrium [J].Med Mol Morphol,2014,47(1):43-53.
[6]Sassone F,Margulets V,Maraschi A,et al.Bcl-2/adenovirus E1B 19-kDa interacting protein(BNip3)has a key role in the mitochondrial dysfunction induced by mutant huntingtin[J].Hum Mol Genet,2015,24(22):6530-9.
[7]Liao W T,Ye Y P,Deng Y J,et al.Metastatic cancer stem cells:from the concept to therapeutics[J].Am J Stem Cells,2014,3 (2):46-62.
[8]Mertins S D.Cancer stem cells:a systems biology view of their role in prognosis and therapy[J].Anticancer Drugs,2014,25 (4):353-67.
[9]Tanase C P,Neagu A I,Necula L G,et al.Cancer stem cells:involvement in pancreatic cancer pathogenesis and perspectives on cancer therapeutics[J].World J Gastroenterol,2014,20(31):10790-801.
[10]Tang S C,Chen Y C.Novel therapeutic targets for pancreatic cancer[J].World J Gastroenterol,2014,20(31):10825-44.
[11]Tu T,Budzinska M A,Maczurek A E,et al.Novel aspects of the liver microenvironment in hepatocellular carcinoma pathogenesis and development[J].Int J Mol Sci,2014,15(6):9422-58.
[12]Ren F,Sheng W Q,Du X.CD133:a cancer stem cells marker,is used in colorectal cancers[J].World J Gastroenterol,2013,19 (17):2603-11.
[13]Gaedicke S,Braun F,Prasad S,et al.Noninvasive positron emission tomography and fluorescence imaging of CD133+tumor stem cells[J].Proc Natl Acad Sci U S A,2014,111(6):692-701.
[14]赵 明,范楚玲,郭 强,等.RunX2的真核表达载体的构建及其对乳腺癌细胞增殖和迁移的影响[J].安徽医科大学学报,2015,50(11):1593-6.
[15]Jian W,Zhong L,Wen J,et al.SEPTIN2 and STATHMIN regulate CD99-mediated cellular differentiation in Hodgkin′s lymphoma [J].PLoS One,2015,10(5):e0127568.
Construction and identification of replication-competent adenovirus expressing siRNA targeting CD133 gene regulated by survivin promoter and its inhibition of liver cancer cell growth
Niu Jian,Wang Yue,Liu Bin,et al
(Liver Disease Research Center,The Affiliated Hospital of Xuzhou Medical College,Xuzhou 221004)
Objective To construct a replication-competent adenovirus expressing siRNA targeting CD133 gene regulated by survivin promoter and investigate its inhibitory effect on Hep3B cells.Methods The fragment of the survivin promoter was amplified by PCR and inserted into pH-XC2 to reconstruct a recombinant plasmid pH-XC2-survivin.Complete digestion pH-XC2-survivin and pZD55-CD133-siRNA,combinational joining the subclones,then getting replication-competent adenovirus expressing short interference RNA targeting CD133 gene regulated bysurvivin promoter,replication-competent adenovirus was constructed.The recombined adenoviruses(T-ZD55-CD133-siRNA)were verified by PCR and sequencing.The effect of T-ZD55-CD133-siRNA on CD133 expression in Hep3B cells was detected by qRT-PCR.The expression of E1A was detected by Western blot.The antitumor potential of replication-competent adenovirus in Hep3B cells were evaluated by CCK-8 assay and cell apoptosis was detected by Flow cytometry.Results Replication-competent adenovirus were constructed successfully.Western blot analyses indicated that T-ZD55-CD133-siRNA might express E1A in adenovirus-infected Hep3B cells.TZD55-CD133-siRNA were more effective to inhibit CD133 mRNA expression and Hep3B cells proliferation.Apoptosis was significantly increased in the interference group compared with the control group.Conclusion Survivin-T-ZD55-CD133-siRNA expressing CD133-siRNA can inhibit CD133 expression and may be used for further investigation of gene therapy for liver cancer.
liver cancr;cancer stem cell;CD133;cell proliferation;gene expression
R 349.5
A
1000-1492(2016)07-0926-05
2016-04-16接收
天晴甘美基金项目资助(编号:CFHPC20132020);江苏省333人才项目(编号:Ⅲ-2290);徐州市重大科研项目(编号:KC14SX011)
1徐州医学院附属医院肝脏病研究中心,徐州 2210022北京友谊医院肝胆外科,北京 1000003上海交通大学附属同济医院干细胞研究中心,上海200000
牛 坚,男,副教授,责任作者,E-mail:njnj_001@163.com
