宫颈癌患者手术前后血清及病变组织中AGR2水平变化及意义
2016-09-11刘雪峰李堰松
刘雪峰 李堰松★
宫颈癌患者手术前后血清及病变组织中AGR2水平变化及意义
刘雪峰 李堰松★
目的 探讨人前梯度蛋白2(AGR2)在宫颈癌患者手术前后外周血清及病变组织中的动态变化及其临床意义。方法 采用酶联免疫吸附法(ELISA)分别测定35例宫颈癌、20例宫颈上皮内瘤变(CIN)患者血清和病变组织标本、20例健康体检者的血清标本及20例因子宫肌瘤行全子宫切除术患者的正常宫颈组织标本AGR2表达水平。结果 宫颈癌患者术前血清及癌组织中AGR2水平明显高于CIN组及正常对照组(P<0.01);宫颈癌及CIN组术后血清AGR2水平较术前下降显著(P<0.01);FIGO临床分期高、肿瘤直径>4cm、伴有淋巴结转移的宫颈癌患者组织及外周血中AGR2含量明显增高(P<0.05);宫颈癌组患者术前与术后血清中AGR2含量呈正相关(r=0.643,P=0.000);术前、术后血清中AGR2含量均与宫颈组织AGR2含量呈正相关(r=0.505,P=0.002和r=0.379,P=0.025)。结论 AGR2可能与宫颈癌发展、转移及预后相关,对早期发现CIN向宫颈癌转化及病情监测等方面具有重要的临床意义。
宫颈癌 前梯度蛋白2 宫颈上皮内瘤变
前梯度蛋白2(AGR2)是一种分泌蛋白,属于原癌基因,在多种肿瘤中呈过表达,如乳腺癌、卵巢癌、胃肠癌等,起促进肿瘤细胞存活、增殖及转移等作用,是一个潜在的肿瘤诊断和预后判断的标志物[1]。AGR2作为抑癌基因p53的抑制剂,直接参与细胞的恶性转化,并与化疗药耐药性有关[2]。近来,研究提出宫颈癌细胞起源于鳞柱状上皮交界处,AGR2是宫颈鳞柱状交界处特异性抗体。在宫颈鳞柱状交界处,癌前病变组织AGR2呈过度表达[3]。本文探讨AGR2在宫颈癌侵袭转移中的作用。
1 临床资料
1.1一般资料 选择2013年1月至2015年1月本院病理诊断宫颈癌患者35例及宫颈上皮内瘤变(CIN)患者20例。宫颈癌患者:年龄40~78岁,平均年龄(54.8±10.2)岁。<50岁8例、≥50岁27例。病理组织类型:鳞癌23例、腺癌12例。肿瘤直径:<4cm 26例、≥4cm 9例。根据2000年国际妇产科联盟(FIGO)分期标准进行宫颈癌临床分期:IA期11例、 IB期10例、IIA期10例、IIB期4例。按组织病理学分级:高分化13例、中分化10例、低分化12例。有淋巴结转移11例、无转移24例。纳入标准:(1)首次经病理学确诊的原发性宫颈癌。(2)均排除其他系统疾病以及妊娠,入院前3个月未曾接受过免疫抑制剂治疗。另选取同期健康体检者20例及因子宫肌瘤行子宫全切除术患者的正常宫颈组织20例作为正常对照组。且均签署知情同意书。
1.2方法 (1)标本采集 于术前3d及术后1周清晨空腹用肝素抗凝真空采血管采集静脉血4ml,于4℃条件下3000r/min,离心15min,取上清液编号后分装于EP管中,置-80℃冰箱保存,集中待测。(2)组织标本 术中取新鲜手术切除宫颈病变标本,立即放入液氮中保存备用。取组织块,在冷生理盐水中漂洗,除去血液,滤纸拭干,称重,放入5ml或10ml的小烧杯内,用移液管量取预冷的匀浆介质(pH7.4,0.01mol/ L Tris-HCL,0.0001mol/L EDTA-2Nα,0.01mol/L蔗糖0.8%的氯化钠溶液),用组织研磨机(OMNIBead Ruptor 24 多样品研磨珠均质仪) 6m/s研磨制成10%组织匀浆,匀浆液离心3500r/min,离心15min,取上清液编号后分装于EP管中,置-80℃冰箱保存,集中待测。(3) AGR2检测 采用酶联免疫吸附法(ELISA)法检测,人前梯度蛋白2(AGR2)ELISA试剂盒购自USCLIFE公司,严格按检测说明书操作。试验开始前进行标准品的倍比稀释,样品稀释液直接作为标准浓度0ng/ml。分别设空白孔、标准孔和待测样品孔。使用酶标仪(450nm)测量各孔的吸光度(OD值)。通过标准曲线计算样品浓度。
1.3统计学方法 应用SPSS18.0统计学软件。计量资料以(±s)表示,两样本均数比较采用t检验,多组间比较采用方差分析,相关性分析采用Person相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1AGR2在宫颈癌及CIN组织及手术前后外周血清中的表达 宫颈癌患者术前血清中AGR2水平明显高于CIN组及正常对照组(t=4.552,P=0.000;t=10.147,P=0.000);CIN组患者术前血清明显高于正常对照组(t=6.171,P=0.000);而宫颈癌患者组织中AGR2水平明显高于CIN组及正常对照组(分别t=4.298,P=0.000;t=8.769,P=0.000);CIN患者组织中AGR2含量明显高于正常对照组(t=6.723,P=0.000);宫颈癌及CIN组术后血清AGR2水平较术前下降显著(t=5.888,P=0.000;t=6.103,P=0.000) 见表1。
表1 AGR2在不同宫颈组织和血清中的表达水平(±s)
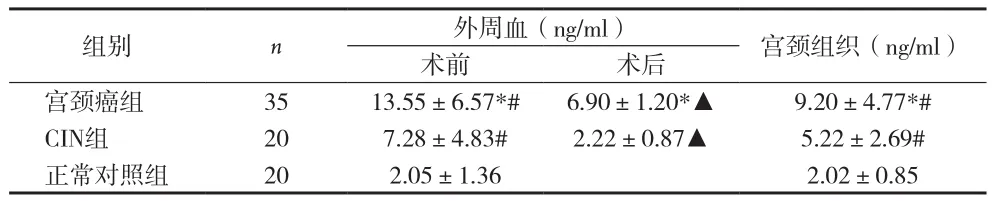
表1 AGR2在不同宫颈组织和血清中的表达水平(±s)
注: 与CIN组比较,*P<0.01;与正常对照组比较,#P<0.01;与术前比较,▲P<0.01
组别 n 外周血(ng/ml) 宫颈组织(ng/ml)术前 术后宫颈癌组 35 13.55±6.57*# 6.90±1.20*▲ 9.20±4.77*# CIN组 20 7.28±4.83# 2.22±0.87▲ 5.22±2.69#正常对照组 20 2.05±1.36 2.02±0.85
2.2宫颈癌组织及外周血中AGR2水平与临床病理参数的关系 宫颈癌患者外周血及组织中,肿瘤直径越大,AGR2表达水平越高(P<0.05)。在FIGO分期中,II期患者外周血及组织的AGR2水平比I期明显增高(P<0.01)。有淋巴结转移的宫颈癌患者,其血清及组织中AGR2水平明显高于无淋巴结转移患者(P<0.05)。见表2。
表2 宫颈癌组织及外周血中AGR2水平与临床病理参数的关系(±s)
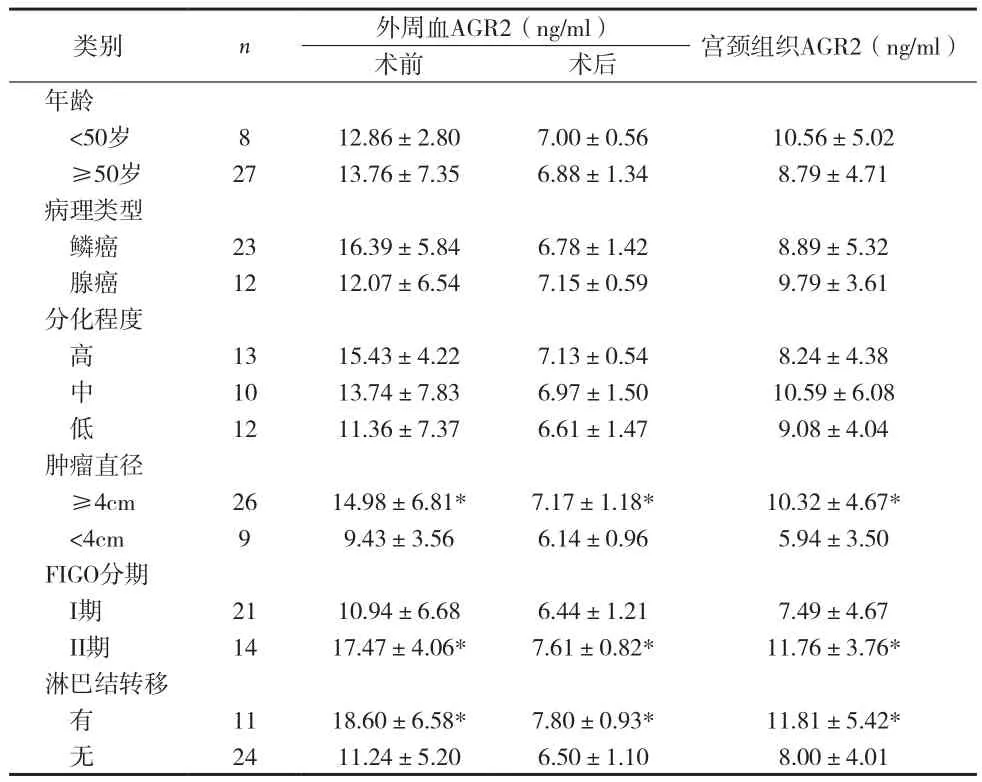
表2 宫颈癌组织及外周血中AGR2水平与临床病理参数的关系(±s)
注:*P<0.05
类别 n 外周血AGR2(ng/ml) 宫颈组织AGR2(ng/ml)术前 术后年龄<50岁 8 12.86±2.80 7.00±0.56 10.56±5.02 ≥50岁 27 13.76±7.35 6.88±1.34 8.79±4.71病理类型鳞癌 23 16.39±5.84 6.78±1.42 8.89±5.32腺癌 12 12.07±6.54 7.15±0.59 9.79±3.61分化程度高13 15.43±4.22 7.13±0.54 8.24±4.38 中10 13.74±7.83 6.97±1.50 10.59±6.08 低12 11.36±7.37 6.61±1.47 9.08±4.04肿瘤直径≥4cm 26 14.98±6.81* 7.17±1.18* 10.32±4.67* <4cm 9 9.43±3.56 6.14±0.96 5.94±3.50 FIGO分期I期 21 10.94±6.68 6.44±1.21 7.49±4.67 II期 14 17.47±4.06* 7.61±0.82* 11.76±3.76*淋巴结转移有11 18.60±6.58* 7.80±0.93* 11.81±5.42* 无24 11.24±5.20 6.50±1.10 8.00±4.01
2.3宫颈癌及CIN患者病变组织与外周血中AGR2的相关性 宫颈癌组患者术前与术后血清中AGR2含量呈正相关(r=0.643,P=0.000);术前、术后血清中AGR2含量均与宫颈组织AGR2含量呈正相关(r=0.505,P=0.002和r=0.379,P=0.025)。
3 讨论
AGR2是非洲爪蟾黏液腺基因XAG-2的人类同源物,定位于人7p21.3,片段长度763bp,是编码一种分泌性蛋白质[4]。研究发现,AGR2在原发性乳腺癌、前列腺癌等肿瘤组织中呈过度表达,与肿瘤的发生发展及预后密切相关[5,6]。AGR2可能是一个新的肿瘤标记物,其对肿瘤的调控机制逐渐受到重视。
目前关于AGR2与宫颈癌方面的研究较少,国内未见相关报道。本资料采用ELISA法检测宫颈癌及CIN患者血清及癌组织中AGR2的表达水平。结果显示,宫颈癌患者术前血清及组织中AGR2水平明显高于CIN组及正常对照组,CIN患者组织中AGR2含量明显高于正常对照组,提示血清AGR2水平与肿瘤的恶性程度相关。此外,宫颈癌及CIN组术后血清AGR2水平较术前下降显著,相关分析显示,宫颈癌组患者术前与术后血清中AGR2含量呈正相关。术前、术后血清中AGR2含量均与宫颈组织AGR2含量呈正相关。表明血清AGR2表达水平增高可能是由于宫颈癌组织过度增高的AGR2释放入血所致,故AGR2血清水平能反映其组织学表达水平。
多项研究表明,AGR2与肿瘤的侵袭转移有关。Alavi等[7]研究认为,AGR2表达水平在预测年轻肺癌患者生存期中具有重要的意义。Li等[8]研究认为,AGR2在胰岛素样生长因子(IGF-1)诱导乳腺癌细胞增殖及转移中起到重要的作用。白小英等[9]研究认为,卵巢上皮癌血清AGR2水平及癌组织中AGR2的阳性表达率均与临床分期及淋巴结转移相关。联合检测血清AGR2和CA125对卵巢上皮癌的早期诊断有参考价值。因此,推测AGR2有可能在一定程度上也反映宫颈癌细胞的增殖及侵袭能力,与宫颈癌的进展相关。本资料结果显示,宫颈癌患者外周血及组织中,肿瘤直径越大,AGR2表达水平越高(P<0.05)。在FIGO分期中,II期患者外周血及组织的AGR2水平比I期明显增高(P<0.01)。有淋巴结转移的宫颈癌患者,其血清及组织中AGR2水平明显高于无淋巴结转移患者(P<0.05)。提示AGR2表达水平在一定程度上反映肿瘤的侵袭及转移潜能。
综上所述,AGR2可能参与CIN及宫颈癌的发展过程,血清AGR2可作为一种肿瘤标志物并可动态反映疾病的进展情况,对早期发现CIN向宫颈癌转化及病情监测等方面具有重要的临床意义。
1 任宝花,刘巍,谭文华,等.AGR2与肿瘤关系研究进展.中国优生与遗传杂志,2014,22(3):134~136.
2 Brychtova V,Vojtesek B,Hrstka R.Anterior gradient 2:a novel player in tumor cell biology. Cancer Lett,2011,304(1):1~7.
3 Herfs M, Parra-Herran C, Howitt BE,et al.Cervical squamocolumnar junction-specific markers define distinct, clinically relevant subsets of low-grade squamous intraepithelial lesions.Am J Surg Pathol,2013,37(9):1311~1318.
4 魏龙刚,邓鸣涛,赵一楠,等.AGR2:一个新的癌症诊断标记.中国细胞生物学学报,2013,35(12):1~9.
5 Lacambra MD, Tsang JY, Ni YB, et al.Anterior Gradient 2 is a Poor Outcome Indicator in Luminal Breast Cancer. Ann Surg Oncol,2015,22(11):3489~3496.
6 Chanda D, Lee JH, Sawant A, et al.Anterior gradient protein-2 is a regulator of cellular adhesion in prostate cancer. PLoS One,2014,9(2):e89940.
7 Alavi M, Mah V, Maresh EL, et al.High expression of AGR2 in lung cancer is predictive of poor survival. BMC Cancer,2015,15(1):655.
8 Li Z, Wu Z, Chen H,et al.Induction of anterior gradient 2 (AGR2)plays a key role in insulin-like growth factor-1 (IGF-1)-induced breast cancer cell proliferation and migration.Med Oncol,2015,32(6):577.
9 白小英,金平,张蕾.AGR2在卵巢上皮性癌患者血清及癌组织中的表达及意义.实用妇产科杂志,2013,29(1):31~35.
Objective To investigate the dynamic change of levels of anterior gradient-2(AGR2) in tissue and serum of cervical cancer preand postoperation patients and the clincal siginificance. Methods The expression of AGR2 was determined by ELISA in pre- and post-operative serum and tissue samples from 35 cervical cancer patients,20 cervical intraepithelial neoplasia(CIN) patients and serum samples from 20 normal women and cervix tissue samples of 20 patients undertaken hysterctomy due to myoma were collected for the control. Results The level of AGR2 in preoperative serum and tissues of cervical cancer were higer than that of CIN and health control group(P<0.01). The level of AGR2 in pre-operative serum and tissues of CIN were higher than that of health control group(P<0.01). The level of AGR2 in post-operative serum and tissues of cervical cancer and CIN were significantly lower than that of pre-operative(P<0.05). The level of AGR2 in serum and tissues of cervical cancer were significantly higher in patients with high FIGO clincal stage,tumor diameter being greater than 4cm,lymph node metastasis and deep myometrial invasion.The level of AGR2 in pre-opertative serum positively correlated to that in post-operative serum of patients with cervical cancer and CIN(r=0.643,P=0.000).The level of AGR2 in pre- and post-operative serum correlated to that in tissue of case group(r=0.505,P=0.002;r=0.379,P=0.025). Conclusion The expression of AGR2 in patients with cervical carcer may be associated with cancer development,metastasis and prognosis. it play an important clincal significance in detecting transform from CIN to cancer and monitoring for cervical cancer.
Cervical cancer AGR2 Cervical intraepithelial neoplasia
442000 湖北省十堰市妇幼保健院
