长双歧杆菌优势菌株的高通量筛选
2016-09-10宗方方陈代杰张骏梁钱志祥张素姬
宗方方,谭 俊,邵 雷,陈代杰,张骏梁,钱志祥,3,张素姬,4
(1.中国医药工业研究总院上海医药工业研究院 创新药物与制药工艺国家重点实验室,上海 201203;2.上海师范大学 生命与环境科学学院,上海 200234;3.中国药科大学工学院,江苏南京 211198;4.中国药科大学 生命科学与技术学院,江苏南京 211198)
长双歧杆菌优势菌株的高通量筛选
宗方方1,2,谭俊1,*,邵雷1,陈代杰1,张骏梁1,钱志祥1,3,张素姬1,4
(1.中国医药工业研究总院上海医药工业研究院 创新药物与制药工艺国家重点实验室,上海 201203;2.上海师范大学 生命与环境科学学院,上海 200234;3.中国药科大学工学院,江苏南京 211198;4.中国药科大学 生命科学与技术学院,江苏南京 211198)
本文通过96孔深孔板微型化培养和酶标仪快速检测,建立了简单、快速、准确且自动化水平较高的双歧杆菌高通量筛选方法。经过高通量筛选获得长双歧杆菌优势菌株BL01,其摇瓶发酵活菌数由5.4×108CFU/mL提高到1.53×109CFU/mL,与原始菌株相比约提高3倍;7 L罐发酵活菌数由3.9×109CFU/mL提高到1.67×1010CFU/mL,约提高4.3倍,且多次传代均能维持在较高活菌水平。此法简单且大大降低筛选成本,对其他微生物菌株的大规模筛选具有重要参考价值。
长双歧杆菌,96孔深孔板,高通量筛选,自然选育
双歧杆菌(Bifidobacterium)是1899年由法国学者Tissier从母乳喂养的婴儿粪便中分离出的一种厌氧的革兰氏阳性杆菌[1]。它是人体消化道内具有益生作用的优势菌群,在促进人体发育、维持和提高免疫力、延缓机体衰老、抗肿瘤等方面起着重要的作用[2-7],双歧杆菌已成为人体健康的重要指标之一[8],有关双歧杆菌的微生态制剂的研究成为一大热点,并广泛应用于食品、保健和医疗等领域[9]。研究表明,维持益生菌功能的最低活菌浓度应高于107CFU/mL[10]。
菌种是发酵技术的源头,菌种发酵水平是决定企业产品能否参与市场竞争的技术保证。现有国内的菌种选育技术从诱变育种、杂交育种发展到代谢工程育种和系统生物学育种,已大大提高了微生物育种的效果,但是,与之配套的高通量筛选技术还处于滞后状态,严重制约了菌种选育研究工作的展开[11-12]。高通量筛选(High throughput screening,HTS)技术是20世纪80年代发展起来的一种用于新化合物开发及目的菌种选育等的高新技术,由于具备微量、高效、灵敏、准确、可重复等特点,引起微生物技术研究者的极大兴趣。双歧杆菌作为用于食品及药品的益生菌,其优势菌群的获得不能经过诱变,只能通过自然选育,而传统的摇瓶选育方法工作量大,费时费力,很难筛选到高活力的优势菌株。扩大筛选量来有效减少随机筛选的盲目性是提高育种效率的一个重要方面,也是菌种选育过程成败的一个关键步骤[13]。因此,使用现有的通用低成本仪器设备,自主开发简便、快速、精准、高效的高通量筛选技术具有重要意义。高通量筛选方法不仅能有效克服传统筛选中的漏筛问题,更具有简单、快速、准确且自动化水平较高的特点,大大降低筛选成本,对其他益生菌等菌株的大规模筛选同样具有重要的参考价值。
1 材料与方法
1.1材料与仪器
长双歧杆菌(Bifidobacterium.longum)中国工业微生物菌种保藏管理中心(CICC6187)。
斜面培养基(g/L):牛肉膏10.0,蛋白胨5.0,酵母粉3.0,D(+)-葡萄糖5.0,可溶性淀粉1.0,氯化钠5.0,无水乙酸钠3.0,L-半胱氨酸盐酸盐0.5,琼脂粉15.0,pH6.8;种子培养基(g/L):牛肉膏10.0,蛋白胨5.0,酵母粉3.0,D(+)-葡萄糖5.0,可溶性淀粉1.0,氯化钠5.0,无水乙酸钠3.0,L-半胱氨酸盐酸盐0.5,pH6.8;发酵培养基(g/L):安琪FP103蛋白胨17.0,安琪FM405酵母粉16.0,D(+)-葡萄糖22.0,氯化钠5.0,无水乙酸钠3.0,L-半胱氨酸盐酸盐0.5,低聚异麦芽糖4.0,pH6.8。
电子天平,PB-10酸度计,8道移液器Sartorius;酶标仪Thermo Scientific;厌氧培养箱Ruskinn 400M;立式压力蒸汽灭菌锅上海博讯实业有限公司医疗设备厂。
1.2实验方法
1.2.1高通量筛选流程菌种的自然分离→高通量初筛→平行复筛→摇瓶验证→罐发酵验证→稳定性考察
1.2.2菌种的自然分离96深孔板每孔种子培养基装液量为1 mL,取1支原始菌株6187的甘油管,等分至96深孔板各孔中。厌氧培养箱中37 ℃静置培养,14 h后检测各孔OD600,选出OD值最高的孔,梯度稀释后涂布平板进行单菌落分离,厌氧培养24 h后,挑选长势较好的单菌落进行高通量初筛。
1.2.2初筛用牙签从平皿上挑选尽可能多的单菌落,至96深孔板中,37 ℃静置厌氧培养14 h,用8道移液枪取样200 μL/孔,酶标仪检测OD600。
1.2.3复筛从初筛菌株中挑选OD值较高的24个孔进行复筛。按照5%(v/v)接种量接入已装有1 mL种子培养基的96孔板中,每组4个平行,37 ℃静置厌氧培养14 h,用8道移液枪取样200 μL/孔,酶标仪检测OD600。
1.2.4摇瓶发酵将优势菌株与原始菌株分别接斜面,37 ℃厌氧活化24 h后,将斜面洗下,接至100 mL发酵培养基中,每隔2 h取样活菌计数,绘制生长曲线。
1.2.5传代稳定性考察将复筛出的长双歧杆菌优势菌株在斜面培养基中连续传代5次,将不同传代次数的菌株分别进行摇瓶发酵实验,并对发酵液进行活菌计数,考察菌种传代稳定性。
1.2.67 L罐发酵将优势菌株与原始菌株于新鲜斜面上活化24 h后,分别接至种子培养基中,37 ℃培养12 h,按照5%(v/v)接种量接至7 L发酵罐(装量5 L)中,设定转速为200 r/min,温度为37 ℃,NaOH调节pH稳定维持在6.0,每2 h取样进行活菌计数。
1.2.7活菌计数将待测样品经梯度稀释后,选择合适的稀释度的菌液,分别取100 μL加到已制备好的固体平板上,然后用无菌涂棒将菌液涂布整个平板表面,每个稀释度涂三个及以上平板,37 ℃厌氧倒置培养,待菌落长出后,计数,并计算出原菌液的含菌数(CFU/mL):每毫升原菌液活菌数=同一稀释度三个平皿菌落平均数×稀释倍数×10
1.2.8数据统计分析实验中每个处理重复三次,采用Excel软件进行数据的统计及误差分析,并作图。
2 结果与分析
2.1长双歧杆菌生长曲线
要想快速、高效地从庞大的菌种库中筛选出优势菌株,不仅要通过高通量培养,技术还要建立与之配套的快速、高效的高通量检测技术[14]。传统的活菌计数方法随着筛选样本量的增多,工作量大大增加,费时费力,不能配合高通量培养实现高通量筛选。本文建立了96深孔板菌种高通量培养方法及酶标仪高通量检测方法,选取培养至对数生长期的样品,于600 nm波长快速检测。OD值反映的是被检测物所吸收的光密度,死亡的菌体仍然会有吸收值,容易影响筛选结果,因此首先要确定合适的取样时间。
图1显示了长双歧杆菌深孔板培养过程中活菌数与OD值的关系:0~12 h活菌数不断增加,OD值也不断提高,两者呈一定对应关系;16 h时活菌数达到最大值,此后活菌数有所下降,但16 h后OD值则处于一个平稳的状态,因此选择14 h作为高通量检测时间,高通量检测方法使得大量样品可同时检测,大大减少了检测误差。
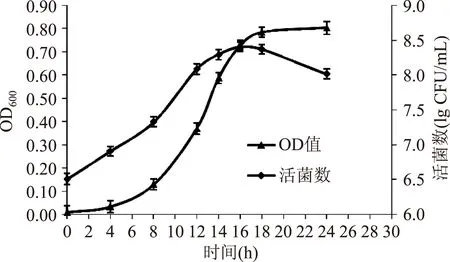
图1 长双歧杆菌生长曲线图Fig.1 Growth curve of bifidobacterium longum

表1 96孔板OD值Table 1 The Optical Density of the 96-deep MTPs
2.2菌种的自然分离
从表1结果可以看出菌株生长存在明显差异,甘油管37 ℃活化16 h后,大部分OD都处于0.4~0.5之间,还有一部分OD值处于0.1~0.2,而长势最好的C8孔OD达到0.607,选择C8孔进行稀释涂布,分离单菌落进行高通量初筛。
2.3菌种的高通量初筛结果
从图2可以看出,挑选的1056个单菌落的生长情况差别较为明显,大部分菌株的OD值处于0.5~0.7之间,只有少数菌株的OD值达到0.7~1.0。

图2 高通量初筛Fig.2 High-throughput preliminary screening
2.4菌种的高通量复筛结果
从图3可以看出,7号孔生长最好,OD值最高为0.768。选择该菌株(编号BL01)进行斜面及甘油管保存。

图3 高通量复筛Fig.3 High-throughput secondary screening
2.5摇瓶发酵验证
从优势菌株BL01与原始菌株6187的生长曲线对比图可以很明显发现(图4),摇瓶发酵情况下,长双歧杆菌在14 h活菌数达到最大,BL01菌株与原始出发菌株6187相比,活菌数由5.4×108CFU/mL提高到1.53×109CFU/mL,约提高3倍。可见,此高通量筛选方法具有可行性。
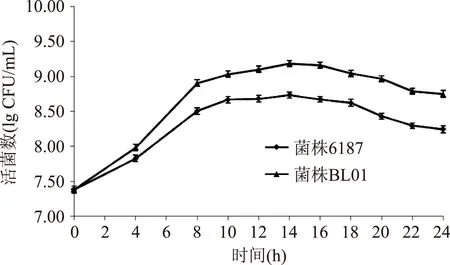
图4 菌株BL01与菌株6187的摇瓶发酵对比Fig.4 CFU comparisons between the strain 6187 and strain BL01 in shake flasks
2.6传代稳定性的考察
将长双歧杆菌优势菌株BL01在斜面培养基中连续传代5次,分别进行摇瓶发酵实验,活菌数计算分别为1.33×109、1.39×109、2.38×109、1.09×109,1.12×109CFU/mL,表明该优势菌株具有比较稳定的遗传性。
2.77 L罐发酵
从7L罐发酵对比图可以很明显看到(图5),长双歧杆菌在14 h活菌数达到最大,BL01菌株与原始出发菌株6187相比,活菌数由3.9×109CFU/mL提高到1.67×1010CFU/mL,约提高4.3倍。进一步证实此高通量筛选方法具有可行性。
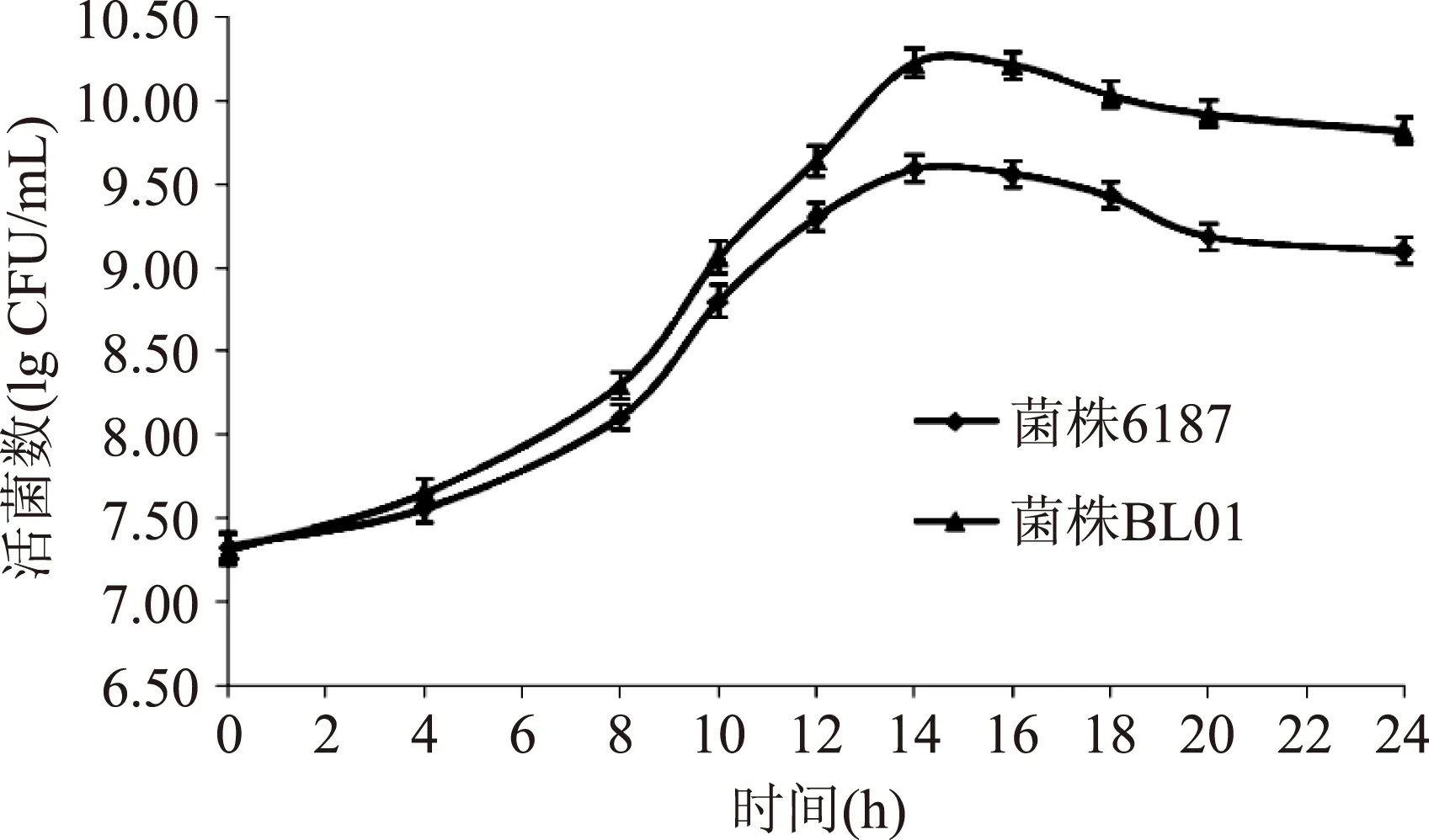
图5 菌株BL01与菌株6187的7 L罐发酵对比Fig.5 CFU comparisons between the strain 6187 and strain BL01 in 7 L bioreactor
3 结论
益生菌产品的优劣与其制备过程中的各个环节,如菌种的选择、发酵过程、冻干过程、保存方法等息息相关,每一环节都要尽量减少活菌数的损失。好的菌株是制备产品的第一步,尤为关键。然而,传统的摇瓶筛选方法,不仅操作繁琐,工作量大,且因通量限制,大部分菌株由于没有筛选机会而流失。本文采用96深孔板微型化培养和酶标仪检测,建立了一种快速有效的双歧杆菌优势菌株的高通量筛选方法:将传统的初筛和复筛缩小在微孔板中进行,先筛选出具有生长优势的混合菌群,再进一步从中分离纯化,高通量检测可快速筛选出优势菌株,很大程度上降低了筛选工作量,给育种工作者减轻了负荷。本文经高通量筛选方法获得的优势菌株,大大提高了发酵活菌数,经过传代实验证明其具有良好的稳定性,为之后的冻干、保存等环节打好坚实的基础。
[1]郝维善. 人类肠道中的重要生理性细菌—双歧杆菌[J]. 中国微生态学杂志,1989,1(1):116-123.
[2]李俊洁,陈庆森. 双歧杆菌调理和改善肠道相关疾病作用的研究进展[J]. 食品科学,2011,32(23):326-332.
[3]吕锡斌,何腊平,张汝娇,等. 双歧杆菌生理功能研究进展[J]. 食品工业科技,2013,34(16):353-358.
[4]蓝景刚,胡宏. 双歧杆菌及其表面分子的免疫增强作用[J]. 中国微生态学杂志,1999,11(3):129-131.
[5]Al-Sheraji SH,Ismail A,Manap MY,et al.
Hypocholesterolaemic effect of yoghurt containing Bifidobacterium pseudocatenμlatum G4 or Bifidobacterium longum BB536[J]. Food Chemistry,2012,135(2):356-361.
[6]Yamazaki S,Kaneko T,Taketomo N,et al. 2-Amino-3-carboxy-1,4-naphthoquinone affects the end-product profile of bifidobacteria through the mediatedoxidation of NAD(P)H[J]. Appl Microbiol Biotechnol,2002,59(1):72-78.
[7]李迎雪,王立生. 双歧杆菌抗肿瘤信号机制的研究[J]. 中国微生态学杂志,2006,18(6):497-498.
[8]Werf MJ,Venema K. Bifidobacteria:genetic modification and the study of their role in the colon[J]. J Agric Food Chem,2001,49(1):378-383.
[9]Alliet P,Scholtens P,Raes M,et al. Effect of prebiotic galacto-oligosaccharide,long-chain fructo-oligosaccharide infant formμla on serum cholesterol and triacylglycerol levels[J]. Nutrition,2007,23(10):719-723.
[10]Homayouni A,Azizi A,Ehsani MR,et al. Effect of microencapsμlation and resistant starch on the probiotic survival and sensory properties of synbiotic ice cream[J]. Food chemistry,2008,111(1):50-55.
[11]孟甜,李玉锋. 现代工业微生物育种技术研究进展[J]. 生命科学仪器,2009(12):3-6.
[12]丁晓兵,李宗伟,刘晓波,等. 原生质体诱变在工业微生物育种中的应用进展[J]. 食品工业科技,2008(7):260-262.
[13]石文娟,谭俊,储炬,等. 红曲色素高产菌株的高通量选育[J]. 中国酿造,2012,31(7):25-28.
[14]谭俊,邓芊,郝玉有,等. 抗生素化学效价的快速高通量分析方法[J]. 中国抗生素杂志,2009(10):606-608.
Developing a high-throughput screening method for dominant strains ofBifidobacterium.longum
ZONG Fang-fang1,2,TAN Jun1,*,SHAO Lei1,CHEN Dai-jie1,ZHANG Jun-liang1,QIAN Zhi-xiang1,3,ZHANG Su-ji1,4
(1.State Key Laboratory of New Drug and Pharmaceutical Process,Shanghai Institute of Pharmaceutical Industry,China State China Pharmaceutical University,Nanjing 211198,China;2.College of Life and Environment Science,Shanghai Normal University,Shanghai 200234,China;3.College of Engineering,China Pharmaceutical University,Nanjing 211198,China;4.College of Life Science and Technology,China Pharmaceutical University,Nanjing 211198,China)
A simple and rapid high-throughput screening(HTS)method was developed through 96-deep MTPs and microplate reader. This new screening approach greatly increased the efficiency of obtaining the dominant strain compared with the conventional method. As a result,the dominant strain BL01 was successfully screened out and the Colony Forming Units was nearly 3-fold higher than that of the original strain in shake flasks,4 times higher than that of the original strain in 7 L bioreactor. The strain BL01 was stable enough for many generations. High-throughput screening method was valuable for many other microbial strains. It is believed that the HTS field continues to be promising and dynamic in the future.
Bifidobacterium.longum;96-deep MTPs;high-throughput screening;natural selection
2016-01-27
宗方方(1991-),女,在读硕士研究生,研究方向:微生物药物,E-mail:elvazong@163.com。
谭俊(1983-),女,助理研究员,研究方向:微生物药物,E-mail:baiyuge1113@163.com。
国家“重大新药创制”科技重大专项(2013ZX09301302,2014ZX09507009-025);国家自然科学基金(81573329)。
TS201.3
A
1002-0306(2016)15-0150-04
10.13386/j.issn1002-0306.2016.15.021
