浸泡发芽处理对燕麦多酚组成及其抗氧化活性的影响
2016-09-10张文斌杨瑞金
赵 霞,张文斌,*,杨瑞金,韩 飞
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.国家粮食局科学研究院,北京 100037)
浸泡发芽处理对燕麦多酚组成及其抗氧化活性的影响
赵霞1,张文斌1,*,杨瑞金1,韩飞2,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.国家粮食局科学研究院,北京 100037)
对燕麦进行浸泡发芽处理,测定其浸泡发芽过程中多酚组成和抗氧化活性的变化情况,并对其相关性进行分析。结果表明:浸泡处理降低了燕麦中游离型多酚的含量,提高了结合型总酚和总黄酮含量,抗氧化性变化不显著;发芽处理能够提高燕麦游离型和结合型多酚含量及抗氧化活性,其中游离型提高最为显著。发芽6 d,游离型总酚含量提高至5.7倍,总黄酮含量提高至3.2倍,且游离型占总酚的比例由原来的45.5%提高到70.3%。液相分析发现游离酚酸总量降低6%,总酚的提高主要体现在蒽酰胺上,其含量从172.41 μg/g提高到1469.02 μg/g。燕麦经浸泡发芽处理后多酚含量与抗氧化性显著相关,且多酚种类对其抗氧化活性有一定影响。
燕麦,浸泡,发芽,多酚,抗氧化活性
燕麦是我国八大粮食作物之一,其蛋白质和脂肪品质及含量均居于谷物之首,是最好的全价营养食品。此外,它作为一种全谷物食品,保留了麸皮和胚乳中的生物活性物质——多酚[1],并在体内表现出抗氧化、抗炎性、抗过敏等功能,有效增强人体免疫防御能力。多酚是指一类在分子结构上具有多个酚羟基的化合物,它具有良好的抗氧化活性,能够清除体内自由基,防止脂质、DNA和蛋白质等大分子的损伤,降低心脑血管疾病、癌症等慢性病的发生机率[2]。燕麦中的多酚有酚酸、黄酮及其特有的燕麦蒽酰胺,以游离态和结合态形式存在[3]。燕麦中的酚酸可分为苯甲酸和肉桂酸两类,常见的有阿魏酸、咖啡酸、对香豆酸、香草酸、对羟基苯甲酸、丁香酸等[4];蒽酰胺是羟基肉桂酸及其衍生物和邻氨基苯甲酸及其衍生物通过酰胺键相连而成的一种酚类化合物,常见有Bp、Bf、Bc[5];而黄酮在燕麦中含量较低,种类较为有限。研究表明,多种生物活性物质的加成协同作用表现出的抗氧化活性要比单一物质更强[6]。
发芽作为一种谷物加工处理方式,能够软化组织结构、提高营养价值、降低抗营养因子的作用[7]。通过发芽处理,籽粒内部的相关酶被激活,引发一系列的生理生化变化[8]。胚乳中的营养物质淀粉被分解为还原糖[9],蛋白质降解,可溶性蛋白含量提高[10];胚发育成根和芽。有研究表明,发芽过程能够显著提高燕麦中多酚的含量[7],但对于具体的多酚在发芽过程中含量的变化情况鲜有报道。本文主要研究各种游离型和结合型酚酸、蒽酰胺及其总酚、总黄酮和抗氧化活性的动态变化情况,以期为燕麦的开发利用提供数据依据。
1 材料与方法
1.1材料与仪器
定莜4号裸燕麦国家粮食局科学研究院粮油营养研究组提供;没食子酸、阿魏酸国药集团化学试剂有限公司;咖啡酸、对羟基苯甲酸、对香豆酸、丁香酸、芥子酸、原儿茶酸、香草酸、芦丁 阿拉丁试剂(上海)有限公司;Bp、Bf、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、2,4,6-三吡啶基-1,3,5-三嗪(TPTZ)、水溶性维生素E(Trolox)、Folin-Ciocalteau试剂Sigma公司;t2、t3发芽燕麦提取浓缩制备制得,并经质谱鉴定;色谱纯乙腈百灵威科技有限公司;其他药品或试剂均为国产分析纯。
A11型粉碎机广州仪科实验技术有限公司;LRH-150型生化培养箱上海一恒科技有限公司;KQ5200DE型超声清洗机昆山市超声仪器有限公司;RV10型旋转蒸发仪广州仪科实验技术有限公司;TGL-16M型冷冻离心机上海卢湘离心机仪器有限公司;723N型可见分光光度计上海精密科学仪器有限公司;DKY-II型恒温回转式摇床上海杜科自动化设备有限公司;L-2000型高效液相色谱仪日本日立公司。
1.2实验方法
1.2.1燕麦浸泡发芽实验浸泡发芽处理参照文献[8]方法进行。燕麦籽粒挑选除杂后,用2%次氯酸钠溶液室温下浸泡15 min进行消毒,去离子水反复冲洗干净,燕麦籽粒于16 ℃培养箱中用去离子水避光浸泡12 h。取出部分样品作为浸泡样,其余样品沥干水分后平铺在自制发芽盘中于16 ℃培养箱中避光连续发芽6 d,每12 h 浇水一次,保持相对湿度95%以上。每隔48 h 取样。所有样品取样后立即冷冻干燥,备用。
1.2.2燕麦多酚的提取参照文献[11-12]方法稍作修改。燕麦籽粒粉碎过60目筛,经脱脂处理后,精确称取2 g样品,用20 mL 80%丙酮溶液20 ℃超声提取30 min,3840×g离心10 min,收集上清液,残渣按上述方法重复提取两次,合并提取液于45 ℃下真空旋转蒸发至干,甲醇复溶,定容至5 mL,即为游离型提取液,密封-80 ℃低温保存。游离型提取后的残渣,用100 mL 2 mol/L NaOH溶液25 ℃摇床振荡提取60 min。用6 mol/L HCl调pH至2~3,然后用乙酸乙酯萃取3次。合并乙酸乙酯萃取液45 ℃下真空旋转蒸发至干,甲醇定容至5 mL,即为结合型提取液,密封-80 ℃低温保存。
1.2.3总酚含量的测定参照文献[13]方法进行。取50 μL提取物于试管中,加1 mL去离子水,和125 μL Folin-Ciocalteau试剂(用前稀释一倍),混匀。静置8 min,加375 μL 7% Na2CO3,补水至2.5 mL,室温避光静置显色2 h,于765 nm下测定吸光值,以甲醇做空白,以没食子酸当量计(μg GAE/g)。
1.2.4总黄酮含量的测定参照文献[13]方法进行。取250 μL 提取物于试管中,加1.25 mL去离子水,75 μL 5% NaNO2溶液,反应6 min,加入150 μL 10% Al(NO3)3·9H2O溶液,反应5 min,加入500 μL 1 mol/L的NaOH,补水至2.5 mL,充分混匀,510 nm下测定吸光值,以芦丁当量计(μg RE/g)。
1.2.5高效液相色谱分析条件采用安捷伦Zorbax SB-C18柱(4.6 mm×150 mm,5 μm),柱温30 ℃,流速0.8 mL/min,进样量10 μL,流动相:A为0.1%甲酸水溶液,B为乙腈。洗脱梯度:0~10 min,97%~95% A;10~35 min,95%~85% A;35~45 min,85%~80% A;45~55 min,80%~60% A;55~60 min,60%~50% A;60~63 min,50%~40% A;63~65 min,40%~97% A。每次进样前平衡10 min。检测波长:280 nm。
1.2.6DPPH自由基清除能力的测定采用文献[13]的方法,适当稀释的提取液0.2 mL加3.8 mL 0.1 mmol/L的DPPH自由基甲醇溶液,漩涡混匀后置避光处30 min,515 nm下测定吸光值,结果以Trolox当量计(μmol TE/g)。
1.2.7ABTS自由基清除能力的测定采用文献[14]的方法,适当稀释的提取液0.15 mL和2.85 mL ABTS+·稀释液,漩涡混匀后置于避光处30 min,734 nm下测定吸光值,以Trolox 当量计(μmol TE/g)。
1.2.8FRAP铁离子还原能力采用文献[13]的方法,适当稀释的提取液0.15 mL和2.85 mL FRAP工作液,漩涡混匀后置于避光处30 min,593 nm下测定吸光值,以Trolox 当量计(μmol TE/g)。
2 结果与分析
2.1燕麦浸泡发芽过程中总酚、总黄酮含量的变化
燕麦浸泡发芽过程中的总酚、总黄酮含量测定结果见图1。浸泡发芽处理后,燕麦中总酚和总黄酮含量的变化趋势基本一致。由图1可以看出,与原样相比,浸泡处理降低了游离型总酚、总黄酮含量,结合型总酚、总黄酮含量经浸泡处理后略有提高。

图1 燕麦浸泡发芽过程中总酚总黄酮的变化趋势Fig.1 Changes of total phenolic content and total flavonoid content in oat during soaking and germination注:A:总酚含量;B:总黄酮含量。
浸泡过程中,部分游离型多酚溶解到水中,并在多酚氧化酶作用下,燕麦籽粒中的游离型总酚、总黄酮含量降低;同时浸泡能够软化燕麦籽粒结构,使得与细胞壁多糖结合的部分结合型多酚更容易通过碱水解提取出来,提高了可提取的结合型总酚、总黄酮的含量。

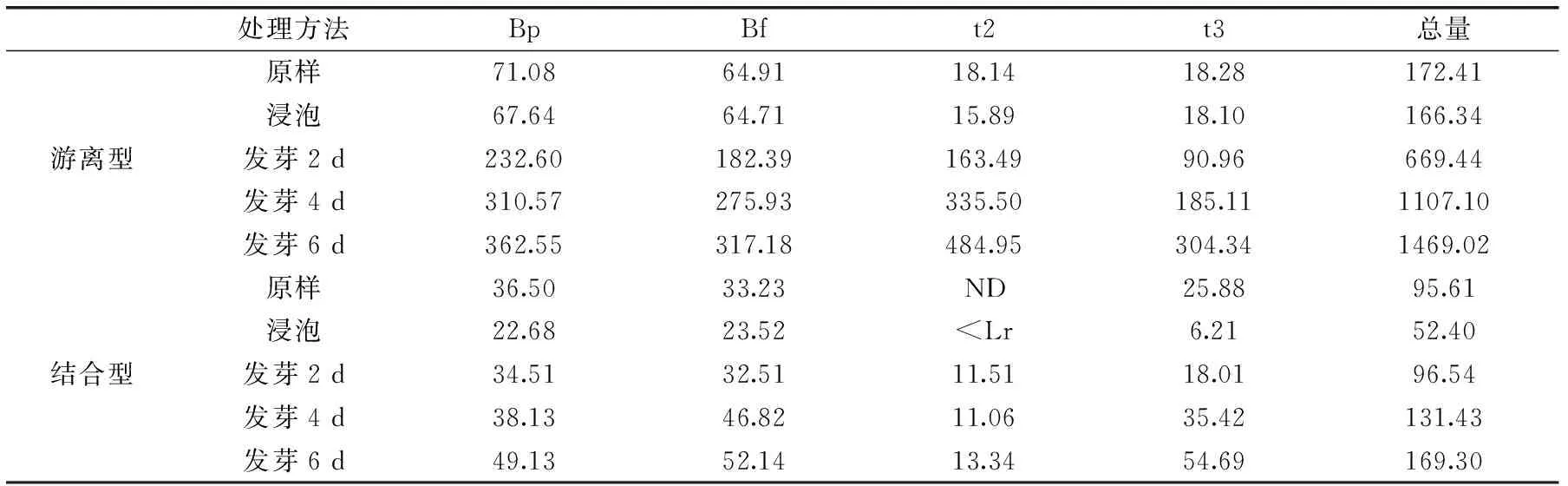
表1 燕麦浸泡发芽过程中游离型和结合型酚酸的含量Table 1 Content of free and bound phenolic acids in oat during soaking and germination
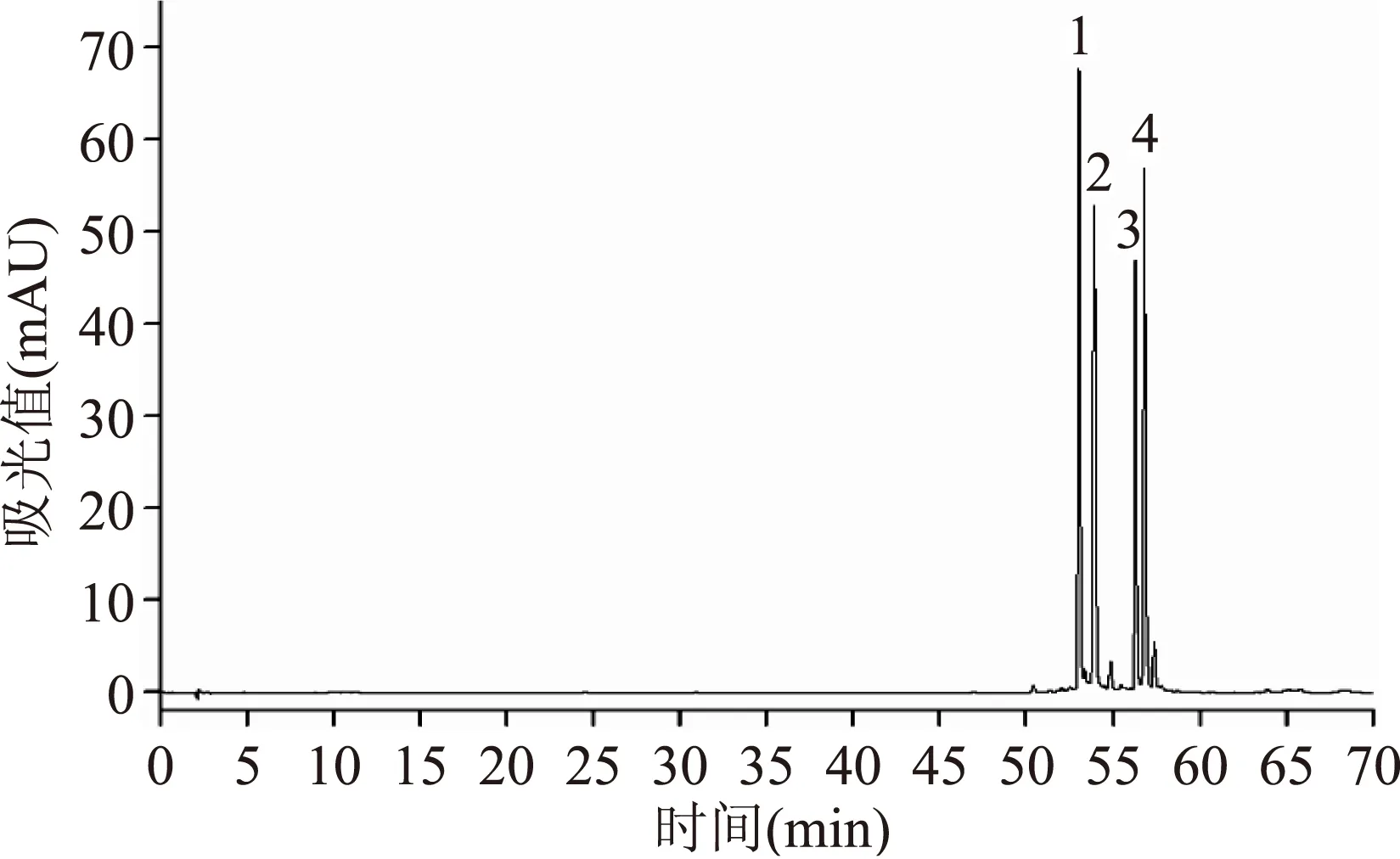
注:ND:未检出; 发芽过程能够显著提高游离型和结合型总酚、总黄酮含量,且随着发芽时间的延长,提高效果更明显。发芽6 d,游离型总酚、总黄酮含量从552.89 μg/g和204.64 μg/g分别提高到3145.05 μg/g和654.57 μg/g,结合型总酚、总黄酮含量从661.50 μg/g和81.47 μg/g分别提高到1325.43 μg/g和180.96 μg/g。游离型总酚含量的提高显著高于结合型。发芽6 d的燕麦中,游离型总酚占总酚比例由原来的45.5%提高到70.3%。 徐建国[15]对燕麦发芽处理3 d,发现燕麦发芽过程中游离酚、结合酚含量均提高,且结合酚依然为主要存在形式。许效群等人[16]对燕麦进行了发芽8 d处理,结果表明燕麦发芽过程中,总酚含量整体呈上升趋势,且发芽6 d为最佳萌发期。这与付晓燕等人[17]的研究结果一致。Xu等人[18]研究表明,短期浸泡处理对总酚含量无显著影响,发芽处理降低了结合型酚酸的含量,提高了游离型和总酚的含量。这与我们的研究结果不一致,可能是由于碱提取时间的不同,得到的结合型酚酸含量有差异[14]。 2.2燕麦浸泡发芽过程中酚酸及蒽酰胺含量的变化 9种酚酸标品在280 nm下的高效液相色谱图见图2。燕麦浸泡发芽过程中游离型和结合型各种酚酸含量的变化情况见表1。经过浸泡处理后,游离型肉桂酸均有所降低,其总量减少27%,而苯甲酸含量略有提高,总酚酸含量减少为原来的80%。与游离型酚酸变化趋势相似,结合型酚酸中苯甲酸类含量提高(23%),肉桂酸类含量降低(10%),总酚酸含量减少9%。 图2 9种酚酸混标溶液的高效液相色谱Fig.2 HPLC chromatogram of standard phenolic substances注:酚酸浓度均为100 μg/mL,1~9依次为没食子酸、 原儿茶酸、对羟基苯甲酸、香草酸、咖啡酸、 丁香酸、对香豆酸、阿魏酸、芥子酸。 发芽过程中游离型苯甲酸的含量有显著提高。发芽6 d后,样品中检测出原样中未检测到的原儿茶酸。但对羟基苯甲酸含量在发芽2 d时含量是原样含量的2倍,随着发芽时间的延长,含量略有降低。对于游离型肉桂酸,咖啡酸、阿魏酸和芥子酸含量在发芽初期即减少至检测不出,但阿魏酸和肉桂酸在发芽6 d含量略有回升。经过发芽处理,6 d后苯甲酸总量为原样的3.5倍,肉桂酸总量降低为原样的15%,酚酸总量降低6%。结合型酚酸经过发芽处理含量均有所上升,其中香草酸和丁香酸在发芽4 d时含量达到最大值。阿魏酸含量提高最为显著。苯甲酸含量为原样的1.9倍,肉桂酸总量为原样的2.7倍,总酚酸含量提高2.6倍。 表2 燕麦浸泡发芽过程中游离型和结合型蒽酰胺的含量Table 2 Content of free and bound avenanthramides in oat during soaking and germination 4种蒽酰胺标品在280 nm下的高效液相色谱图见图3。燕麦浸泡发芽过程中游离型和结合型蒽酰胺含量的变化情况见表2。经过浸泡处理,游离型和结合型蒽酰胺含量均有所降低。发芽处理能够显著提高游离型蒽酰胺的含量,其中t2和t3的提高最为显著。发芽6 d,Bp和Bf含量提高4倍左右,而t2和t3含量分别提高为原样的26.7倍和16.6倍。游离型蒽酰胺总量提高为原样的8.5倍。结合型蒽酰胺经过发芽处理,各种蒽酰胺含量均有所上升,其中发芽2 d检测到原样中未检测到的t2。发芽6 d,总蒽酰胺含量为原样的1.8倍。 图3 4种蒽酰胺混标溶液的高效液相色谱图Fig.3 HPLC chromatogram of standard avenanthramide substances注:蒽酰胺浓度均为100 μg/mL,1~4依次为Bp,Bf,t2,t3。 分析酚酸和蒽酰胺液相数据可知,发芽燕麦中游离型多酚含量的提高主要体现在蒽酰胺含量的增加上,且蒽酰胺含量的提高非常显著。结合型酚酸和蒽酰胺经过发芽处理含量也均有提高。 目前对发芽燕麦中各种酚酸组分具体含量的报道较少。Xu等人[18]对燕麦浸泡发芽过程中的主要多酚含量进行定量分析,发现浸泡处理后没食子酸、咖啡酸、对香豆酸和阿魏酸含量随着浸泡时间的延长而降低,发芽4 d过程中,没食子酸和咖啡酸含量先提高后降低,对香豆酸和阿魏酸含量表现出持续增长的趋势。蒽酰胺含量经过浸泡和发芽处理后含量显著提高,但浸泡初期变化不显著。这一趋势与我们的研究结果有一致的地方,而没食子酸、咖啡酸和2c含量的差异,可能是由于燕麦品种的不同而导致的。付晓燕等人[19]研究了燕麦发芽后游离酚类物质的组成变化,发现发芽处理后游离型酚酸种类含量明显减少,游离型蒽酰胺的种类和相对含量显著提高,这与我们的研究结果有一致的地方。此外,他们还对燕麦蒽酰胺疑似物进行结构鉴定,确定了燕麦中主要蒽酰胺种类为Bc、Bp、Bf、t2和t3。 表3 燕麦中游离型和结合型多酚与抗氧化活性的相关性Table 3 Correlations between antioxidant activities and polyphenol in free and bound fractions of oats 注:**表示在0.01水平上显著相关。 D有研究发现发芽过程中蒽酰胺含量的提高伴随着羟氨基苯甲酸-N-羟基肉桂酸转移酶(HHT)活性的提高和多酚氧化酶(PO)活性的降低[20]。HHT能够催化缩合邻氨基苯甲酸和羟甲基肉桂酸CoA酯形成蒽酰胺[21],多酚氧化酶能够氧化酚酸、蒽酰胺等多酚。 图4 燕麦浸泡发芽过程中抗氧化活性的变化趋势Fig.4 Changes of antioxidant activities during oat soaking and germination 2.3燕麦浸泡发芽过程中抗氧化活性的变化 DPPH自由基清除能力(DPPH+·)、ABTS自由基清除能力(ABTS·)和FRAP铁离子还原能力(FRAP)三种指标用来分析测定燕麦浸泡发芽过程中的抗氧化性变化情况。燕麦中游离型和结合型提取物的抗氧化活性变化情况如图4。分析图表可知,抗氧化活性在浸泡与发芽过程中的变化趋势与总酚、总黄酮的趋势相似。抗氧化活性经过浸泡处理后变化不显著,随着发芽时间的延长,抗氧化活性显著提高,这与付晓燕等人[17]的研究结果一致。浸泡发芽过程中,结合型DPPH·和ABTS自由基清除能力均略高于游离型,而游离型FRAP指标在发芽过程中略高于结合型。这可能是不同抗氧化指标的原理不同导致的。徐建国[22]分别对原粮和发芽提取物进行抗氧化实验,发现发芽样品在质粒DNA损伤的保护作用要优于原粮但在清除羟基自由基实验中效果低于原粮或与其相当。 燕麦中游离型和结合型多酚与抗氧化活性的相关性见表3。分析可知,游离型和结合型总酚、总黄酮和蒽酰胺含量与抗氧化指标存在显著相关性,不同种类的多酚与抗氧化指标间的相关性不尽相同,并在结合型中表现尤为突出,说明多酚的含量也是影响抗氧化活性的因素。 浸泡处理对燕麦中多酚影响较小,燕麦中游离型和结合型肉桂酸含量减少,苯甲酸含量略有提高,但总酚酸、蒽酰胺含量均有所降低。发芽处理显著提高燕麦中游离型和结合型多酚的含量。发芽6 d检测出原样中未检测到的游离型原儿茶酸,苯甲酸含量略有提高,多酚含量的提高主要体现在蒽酰胺上,总蒽酰胺含量由172.41 μg/g提高到1469.02 μg/g;但游离型肉桂酸含量随着发芽过程的进行降低至检测不出。结合型总酚酸提高1.6倍,总蒽酰胺提高1.8倍。同时,浸泡发芽处理后的燕麦多酚与抗氧化性表现出显著的相关性。 [1]Del Rio D,Costa L G,Lean M E,et al. Polyphenols and health:what compounds are involved[J]. Nutrition Metabolism Cardiovascular Disease,2010,20(1):1-6. [2]Adom K K,Liu R H. Antioxidant activity of grains[J]. Journal of Agricultural and Food Chemistry,2002,50(21):6182-6187. [3]Bratt K,Sunnerheim K,Bryngelsson S,et al. Avenanthramides in oats(Avena sativa L.)and structure-antioxidant activity relationships[J]. Journal of Agricultural and Food Chemistry,2003,51(3):594-600. [4]周素梅,申瑞玲. 燕麦的营养及其加工利用[M]. 北京:化学工业出版社,2009:61-62. [5]Yang J,Ou B,Wise M L,et al.Invitrototal antioxidant capacity and anti-inflammatory activity of three common oat-derived avenanthramides[J]. Food Chemistry,2014,160:338-345. [6]Liu R H. Whole grain phytochemicals and health[J]. Journal of Cereal Science,2007,46(3):207-219. [7]闵维. 萌发工艺对燕麦营养品质的影响研究[D]. 杨凌:西北农林科技大学,2014. [8]Tian B,Xie B,Shi J,et al. Physicochemical changes of oat seeds during germination[J]. Food Chemistry,2010,119(3):1195-1200. [9]Faltermaier A,Zarnkow M,Becker T,et al. Common wheat(Triticum aestivum L.):evaluating microstructural changes during the malting process by using confocal laser scanning microscopy and scanning electron microscopy[J]. European Food Research and Technology,2015,241(2):239-252. [10]徐托明,田斌强,孙智达,等. 燕麦发芽过程中三大营养素的变化[J]. 天然产物研究与开发,2011,23(3):534-537,439. [11]Irakli M N,Samanidou V F,Biliaderis C G,et al. Development and validation of an HPLC-method for determination of free and bound phenolic acids in cereals after solid-phase extraction[J]. Food Chemistry,2012,134(3):1624-1632. [12]Ti H,Li Q,Zhang R,et al. Free and bound phenolic profiles and antioxidant activity of milled fractions of different indica rice varieties cultivated in southern China[J]. Food Chemistry,2014,159:166-174. [13]Xu B J,Chang S K C. A comparative study on phenolic profiles and antioxidant activities of legumes as affected by extraction solvents[J]. Journal of Food Science,2007,72(2):S159-S166. [14]Inglett G E,Chen D J,Berhow M,et al. Antioxidant activity of commercial buckwheat flours and their free and bound phenolic compositions[J]. Food Chemistry,2011,125(3):923-929. [15]徐建国. 燕麦发芽过程中淀粉理化特性的变化[J]. 中国粮油学报,2012,27(5):27-30. [16]许效群,霍乃蕊,王彦军. 燕麦芽的最佳萌发期及麦芽总多酚的抗氧化活性[J]. 中国食品学报,2014,14(5):163-168. [17]付晓燕,李海龙,杨超,等. 发芽燕麦不同溶剂提取液抗氧化活性的比较[J]. 食品与发酵工业,2011,37(04):68-72,77. [18]Xu J G,Tian C R,Hu Q P,et al. Dynamic Changes in Phenolic Compounds and Antioxidant Activity in Oats(Avena nuda L.)during Steeping and Germination[J]. Journal of Agricultural and Food Chemistry,2009,57(21):10392-10398. [19]付晓燕,吴茜,李艺书,等. 燕麦发芽前后酚类物质的组成变化及结构鉴定[J]. 中国农业科学,2013,46(17):3669-3679. [20]Skoglund M,Peterson D M,Andersson R,et al. Avenanthramide content and related enzyme activities in oats as affected by steeping and germination[J]. Journal of Cereal Science,2008,48(2):294-303. [21]Ishihara A,Yoshiaki O,Hajime I,et al. Biosynthesis of oat avenanthramide phytoalexins[J]. Phytochemistry,1999,50(2):237-242. [22]徐建国. 燕麦发芽过程中多酚含量及其抗氧化活性的变化[J]. 中国食品学报,2013,13(1):201-205. Polyphenol composition and antioxidant activity of oat as affected by soaking and germination ZHAO Xia1,ZHANG Wen-bin1,*,YANG Rui-jin1,HAN Fei2,* (1.State Key Laboratory of Food Science and Technology and School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2. Academy of State Administration of Grain,No.11 Baiwanzhuang Street,Xicheng District,Beijing 100037,China.) In this study,the effect of soaking and germination on polyphenol composition and antioxidant activities of oat,as well as the correlations of polyphenol content and antioxidant activities were evaluated. Total phenolic content(TPC)and total flavonoid content(TFC)in free fraction were decreased after soaking,while TPC and TFC in bound fraction were increased slightly. Antioxidant activities showed limited change after soaking. Germination increased TPC,TFC and antioxidant activities significantly,especially in free fraction. Free TPC and TFC were increased by 470% and 220% times,respectively,after 6 d germination. The free fraction constituted 45.5% total phenolics before and increased significantly to 70.3% after germination. Specific phenoilc acids and avenanthramides were detected by HPLC. The content of free total phenolic acids were decreased by 6%,and total avenanthramides were increased from 172.41 μg/g to 1469.02 μg/g after 6-day germination. Significant positive correlations were observed between polyphenol content and antioxidant properties of processed oat. oat;soaking;germination;polyphenol;antioxidant activity 2016-01-14 赵霞(1990-),女,硕士研究生,研究方向:食品加工与配料,E-mail:zhaoxia_26@163.com。 张文斌(1979-),男,博士,研究方向:食品加工与配料研究开发,E-mail:wbzhang@jiangnan.edu.cn。 韩飞(1974-),女,博士,副研究员,研究方向:粮油营养及健康特性研究,E-mail:hf@chinagrain.org。 燕麦与豌豆营养健康特性研究与基础数据库的建立(201313011-6-4);“江苏省食品安全与质量控制协同创新中心”项目资助。 TS210.1 A 1002-0306(2016)15-0101-06 10.13386/j.issn1002-0306.2016.15.011


3 结论
