油菜蜂花粉黄酮提取物抗氧化性测定及在色拉米中的应用
2016-09-10杨凤田张雅玮刘成花黄孝闯刘世欣彭增起
杨凤田,张雅玮,李 顺,刘成花,黄孝闯,刘世欣,彭增起
(南京农业大学食品科学与技术学院,食品安全与营养协同创新中心,江苏南京 210095)
油菜蜂花粉黄酮提取物抗氧化性测定及在色拉米中的应用
杨凤田,张雅玮,李顺,刘成花,黄孝闯,刘世欣,彭增起*
(南京农业大学食品科学与技术学院,食品安全与营养协同创新中心,江苏南京 210095)
利用超声波辅助提取油菜蜂花粉黄酮类化合物,以总抗氧化能力、DPPH自由基清除能力和羟基自由基清除能力为指标评价体外抗氧化能力,并将其应用到色拉米肠中评价对脂肪氧化的影响。结果表明,油菜蜂花粉黄酮得率为3.02%,油菜蜂花粉提取物中黄酮含量为604 mg/g。黄酮含量为250 μg/mL的油菜蜂花粉提取物的总抗氧化能力、DPPH自由基清除能力和羟基自由基清除能力分别是维生素E(250 μg/mL)的1.62倍、1.18倍和3.11倍。0.05%油菜蜂花粉黄酮提取物能显著降低色拉米的过氧化值(POV)和硫代巴比妥酸值(TBARS)(p<0.05)。
油菜蜂花粉,黄酮提取物,抗氧化,色拉米,应用
油菜蜂花粉是细小的颗粒状物质,是由蜜蜂采集开花植物的雄性生殖细胞,将其收集到蜂巢中,作为蜂食[1]。花粉中含有丰富的营养物质,包括蛋白质、脂类、维生素、糖类和黄酮类化合物,被称为“微型营养库”[2]。其中的黄酮类化合物具有抗氧化、增强免疫力、防止前列腺疾病、降血脂、保肝护肝、促进睡眠、美容养颜、防止贫血等作用[3-5]。国内外对油菜蜂花粉中的黄酮类化合物研究多集中在提取方法[6]和化学成分的定性分析上[7],而对它的应用性研究较少。
色拉米肠作为一种典型的发酵香肠,由于脂肪含量较高,易发生过氧化[8],因此有必要采用抗氧化剂来抑制其氧化作用。目前使用的化学合成抗氧化剂因存在潜在毒性,其安全性倍受质疑[9]。在追求健康饮食的今天,寻找天然的抗氧化剂成为新的研究趋势[10]。本实验研究油菜蜂花粉黄酮提取物的体外抗氧化活性,同时应用到色拉米中对其抗氧化性进行评价以开发新的植物源抗氧化剂,为油菜蜂花粉的有效利用提供理论依据。
1 材料与方法
1.1材料与仪器
油菜蜂花粉南京老山药业股份有限公司(产地:南京溧水区),50 ℃烘干,粉碎后过60目筛后备用;D101大孔吸附树脂上海源叶生物科技有限公司;原料肉(猪瘦肉、牛肉和猪背膘)和香辛料南京苏果超市有限公司;乳酸菌发酵剂科汉森食品添加剂有限公司;总抗氧化能力(T-AOC)试剂盒南京建成生物工程研究所;1,1-二苯基-2-苦肼基(DPPH)美国sigma公司;无水乙醇,石油醚(30~60 ℃),碘化钾,硫代硫酸钠,硫代巴比妥酸等试剂为分析纯。
中草药粉碎机河北省黄烨科学仪器厂;KQ2200DE型超声波清洗机昆山市超声仪器有限公司;DGG-9240A型电热恒温鼓风干燥箱上海森信实验仪器有限公司;MS104TS电子分析天平上海Mettler-Toledo仪器有限公司;DU730型紫外-可见分光光度计美国Beckman Coulter有限公司;RE-52A型旋转蒸发仪上海亚荣生化仪器有限公司;Scientz-50N冷冻干燥机宁波新芝生物科技股份有限公司。
1.2实验方法
1.2.1提取物样品的制备精确称取油菜蜂花粉2 g加80%的乙醇100 mL,超声提取油菜蜂花粉总黄酮,150 W,30 min,抽滤,石油醚萃取两到三次后旋转蒸发得到粗提物[6]。粗提物加入到D101大孔吸附树脂中做吸附纯化[11]。得到的解析液真空冷冻干燥得到提取物粉末,置于干燥器中备用。
1.2.2色拉米的制作色拉米配方:猪瘦肉50%,牛肉25%,猪背膘25%,亚硝酸钠0.012%,3.5%香辛料(盐、葡萄糖、生姜粉、辣椒粉等)、乳酸菌菌种0.025%、葡萄酒0.5%。
实验分为只添加辅料的对照组和添加0.05%油菜蜂花粉黄酮提取物的处理组。色拉米制作工艺流程如下:

实验选取5个取样点:分别是第0 d(灌肠前),第2 d(发酵结束),第6 d(干燥前期),第9 d(干燥中期),第12 d(干燥结束后的成品)对每个实验组分别取样,每个实验组做三个重复。
1.3测定方法
1.3.1提取物中黄酮含量测定精确称取芦丁标准品0.0105 g,80%乙醇溶解后定容于100 mL容量瓶中,得到0.105 mg/mL芦丁标准品溶液。用移液枪分别吸取标准液0、1、2、3、4、5mL于10 mL容量瓶中,加入5% NaNO2溶液0.4 mL,摇匀;静置6 min后,加入10% Al(NO3)3溶液0.4 mL,摇匀;放置6 min后,再加入4% NaOH溶液4 mL,摇匀;最后用60%的乙醇定容,静止15 min后于510 nm处测定吸光值[12]。芦丁浓度为横坐标,吸光值为纵坐标,绘制标准曲线。黄酮含量表示为mg/g(提取物干粉)。同时计算黄酮得率:
油菜蜂花粉黄酮得率(%)=(蜂花粉中总黄酮的质量/蜂花粉的质量)×100
1.3.2体外抗氧化性的测定采用总抗氧化能力、清除DPPH自由基的能力、清除羟基自由基能力三个方面比较客观的评价油菜蜂花粉黄酮提取物的体外抗氧化能力。
1.3.2.1总抗氧化活性实验方法:样品配制成黄酮浓度分别为25、50、100、150、200、250 μg/mL的溶液[13]。按照总抗氧化能力检测试剂盒(南京建成生物工程研究所)要求准备各工作液,在37 ℃时,每分钟每毫升样液使反应体系的吸光值每增加0.01时,为一个总抗氧化能力单位,其结果表示为U/mL。
1.3.2.2清除DPPH自由基DPPH·作为一种稳定的自由基在乙醇溶液中呈现深紫色,当加入自由基清除剂时,其孤对电子被配对,溶液颜色变浅,可用来检测自由基的清除效果,以此来评价物质的抗氧化能力[14]。样品配制成黄酮浓度分别为25、50、100、150、200、250 μg/mL的提取物溶液。配制0.04 mg/mL DPPH·乙醇溶液,吸取黄酮提取液0.6 mL,加入DPPH·醇溶液3.4 mL,室温下避光放置0.5 h,于517 nm处测吸光度A样品,同时测定3.4mL DPPH·溶液和0.6 mL蒸馏水的混合液的吸光度A0,同样的方法测定维生素E溶液作为对照组[15]。其中自由基清除活性公式为:
自由基清除率(%)=[(1-A样品)/A0]×100
其中A样品是3.4 mL DPPH·和0.6 mL黄酮提取液的吸光值,A0是3.4 mL DPPH·和0.6 mL蒸馏水的吸光值。
1.3.2.3清除羟基自由基羟基自由基是一种重要的活性氧,是由氢氧根失去一个电子形成。羟基自由基是最活泼也最具危害性的自由基,氧化性仅次于氟。因此往往也很难清除[16]。参考刘骏的方法—结晶紫法[17]来评价油菜蜂花粉黄酮提取物的清除羟基自由基的能力。配制黄酮浓度为0.5 mg/mL花粉黄酮提取液和维生素E(0.5 mg/mL)储备液。分别加0.2 mL结晶紫(0.4 mmol/L)、0.6 mL FeSO4溶液(10.0 mmol/L)和0.8 mL H2O2溶液(5.0 mmol/L)于10 mL比色管中,并用磷酸氢二钾-柠檬酸缓冲溶液(pH=4.0)定容至10 mL,摇匀后放置30 min,在580 nm处测其吸光度A0同时测定不加H2O2时580 nm处的吸光度A1,其羟自由基的产生量可以用ΔA=A1-A0。样品液对羟自由基清除率的测定:按照以上步骤在加H2O2之前分别加入1、2、3、4、5 mL样品储备液,测定其吸光度A样,所有测定平行进行三次,取平均值。则样品溶液对羟自由基的清除率为:
自由基清除率(%)=(A样-A0)/(A1-A0)
1.3.3脂肪氧化指标测定
1.3.3.1过氧化值(POV)按照GB/T5009.37-2003《食用植物油卫生标准的分析方法》测定。
1.3.3.2硫代巴比妥酸(thiobarbituric acid,TBA)值参考Faustman等[18]的方法。准确称取5 g肉样品于离心管中,加25 mL 20% TCA和20 mL 蒸馏水,在冰水浴中以9000 r/min 转速用高速匀浆机匀浆60 s,然后在4 ℃,3000×g离心10 min,过滤,滤液用蒸馏水定容到50 mL,然后取2 mL滤液加2 mL 0.02 mol/L TBA在沸水浴中反应20 min,取出用流水冷却5 min,最后用紫外-可见分光光度计测定532 nm波长处的吸光度,空白样为25 mL 20% TCA用蒸馏水定容到50 mL,步骤如上所述。TBA值通过标准曲线来计算,结果表示为 μg丙二醛/g肌肉。
1.4统计分析
所有实验数据用Microsoft Excel进行整理,利用Sigmaplot12.0作图,用SAS 8.2软件进行统计分析。采用邓肯多重比较,p<0.05表示差异显著。
2 结果与讨论
2.1蜂花粉黄酮提取物黄酮含量测定
利用最小二乘法做线性回归,得芦丁浓度与吸光度关系曲线的回归方程y=1.0049x+0.0014(R2=0.9966),芦丁浓度在 0~0.06 mg/mL范围内与吸光度有良好的线性关系。油菜蜂花粉黄酮得率为3.02%。提取物中总黄酮含量为604 mg/g。
2.2油菜蜂花粉黄酮提取物体外抗氧化活性评价
通过一种方法来评价一种物质的抗氧化性是不客观的,本实验采用总抗氧化能力、清除DPPH自由基的能力、清除羟基自由基能力三个方面客观地评价油菜蜂花粉黄酮提取物的体外抗氧化能力。
2.2.1总抗氧化能力分析不同实验组的总抗氧化能力如图1所示。可以看出,油菜蜂花粉黄酮提取物和维生素E随着样品液质量浓度的增加,其总抗氧化能力显著增强(p<0.05)。在25~250 μg/mL的浓度范围内,油菜蜂花粉黄酮提取液的总抗氧化能力为2.13~66.06 U/mL,而维生素E的总抗氧化能力为1.23~40.74 U/mL。在低浓度下(样品液浓度低于150 μg/mL)时,油菜蜂花粉提取物总抗氧化活性略高于维生素E(p>0.05)。当样品液浓度大于150 μg/mL时,油菜蜂花粉的总抗氧化活性显著高于维生素E(p<0.05)。250 μg/mL浓度下,油菜蜂花粉提取物的总抗氧化能力是维生素E的1.62倍。

图1 油菜蜂花粉黄酮提取液的总抗氧化能力Fig.1 Total antioxidant capacity of rape bee pollen flavonoids extract
2.2.2清除DPPH自由基能力分析图2反映的是油菜蜂花粉黄酮提取物和维生素E对DPPH自由基的清除作用。可以看出,在浓度25~250 μg/mL的浓度范围内,油菜蜂花粉黄酮提取物和维生素E均表现出较好的清除DPPH自由基的能力。且随着浓度的增加,当样品液浓度低于150 μg/mL时,油菜蜂花粉黄酮提取物和维生素E对DPPH自由基的清除能力均显著增强(p<0.05)。当质量浓度增加到150 μg/mL时,油菜蜂花粉黄酮提取物对DPPH自由基的清除率增加速度减慢,油菜蜂花粉黄酮提取物清除DPPH自由基能力为22.5%~97.68%,而维生素E清除DPPH自由基能力为21.04%~82.76%。除样品液浓度为50 μg/mL时油菜蜂花粉黄酮提取物和维生素E对DPPH自由基的清除能力差异性不显著(p>0.05),在其他每一个浓度点,油菜蜂花粉黄酮提取物的清除DPPH自由基能力都显著高于维生素E(p<0.05)。250 μg/mL浓度下,油菜蜂花粉提取物的DPPH自由基清除能力是维生素E的1.18倍。
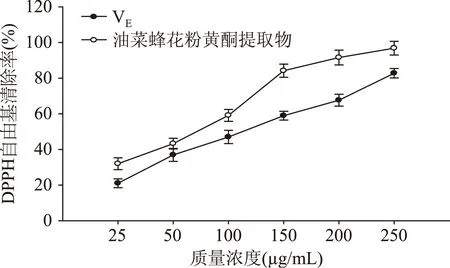
图2 油菜蜂花粉黄酮提取物的清除DPPH自由基能力Fig.2 DPPH free radical scavenging activity of rape bee pollen flavonoids extract
2.2.3清除羟基自由基能力分析不同实验组的清除羟基自由基能力如图3所示。可以看出,样品液在较低浓度时,油菜蜂花粉黄酮提取物就表现出较好的清除羟基自由基能力,而维生素E清除羟基自由基的能力较弱,两个实验组差异性显著(p<0.05)。随着样品液加入量增加,油菜蜂花粉黄酮提取物清除羟基自由基的能力有所增强。油菜蜂花粉黄酮提取物清除羟基自由基的能力为61.45%~93.56%,而维生素E清除羟基自由基的能力为13.23%~30%。250 μg/mL浓度下,油菜蜂花粉提取物的羟基自由基清除能力是维生素E的3.11倍。
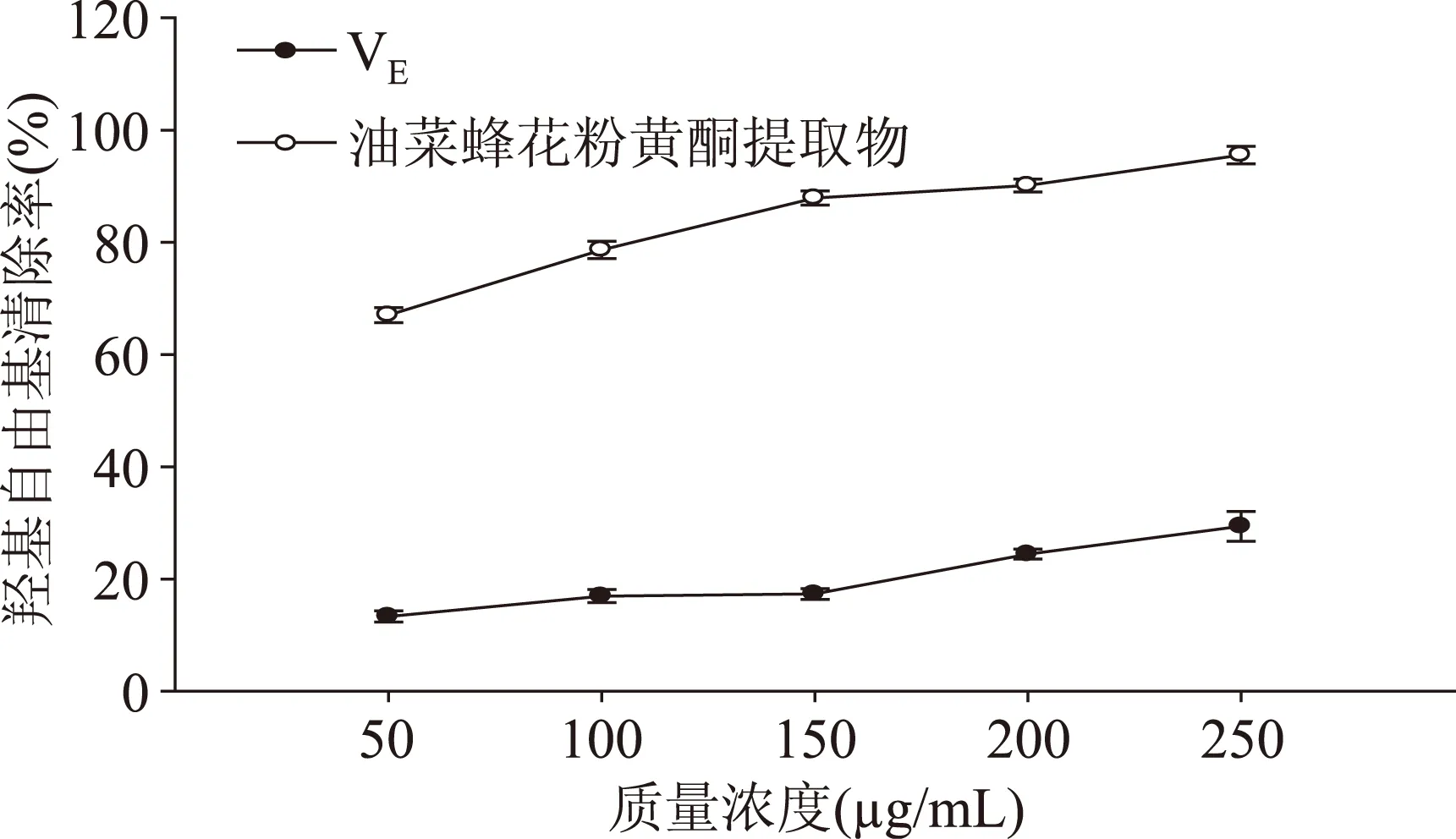
图3 油菜蜂花粉黄酮提取物清除羟基自由基能力Fig.3 Hydroxyl radical scavenging activity of rape bee pollen flavonoids extract
本实验油菜蜂花粉提取物在总抗氧化能力和自由基清除能力的评价体系中,取得了理想的效果,主要是由于油菜蜂花粉黄酮的分子结构中富含活性基团,遇到多种自由基均能提供H+而使自由基的氧化还原点位降低,从而发挥清除自由基的作用[19]。
2.3色拉米加工过程中脂肪氧化指标的测定
2.3.1色拉米加工过程中过氧化值(POV)的变化POV值主要用来衡量脂肪初级氧化产物的量,尤其是脂质氧化产生的氢过氧化物(HPOD)的量[20]。根据王文艳[21]的报道,添加9~12 g/kg的油菜蜂花粉可以较好得延长南京香肠的贮藏期,本实验油菜蜂花粉黄酮得率为3.02%,本实验选择油菜蜂花粉黄酮提取物的添加量为0.05%。由图4可以看出,在整个加工过程中,对照组和处理组POV值前期呈增长趋势,之后有所降低。这是由于脂肪氧化最开始的阶段以一次氧化作为主要氧化反应,生成大量的HPOD,而HPOD的量随着反应时间的增长而增加,当累积到一定程度时,HPOD的量会达到最高值。随后二级氧化继续发生,醛类、醇类、酮类等物质作为二级氧化产物大量生成,此时HPOD的量也就迅速降低,因而POV有所降低。当添加0.05%的油菜蜂花粉黄酮提取物时,处理组的POV与对照组相比明显降低(p<0.05),干燥后成品的POV值相比对照组降低了23%。说明油菜蜂花粉黄酮提取物可以有效地降低色拉米加工过程中的POV值。
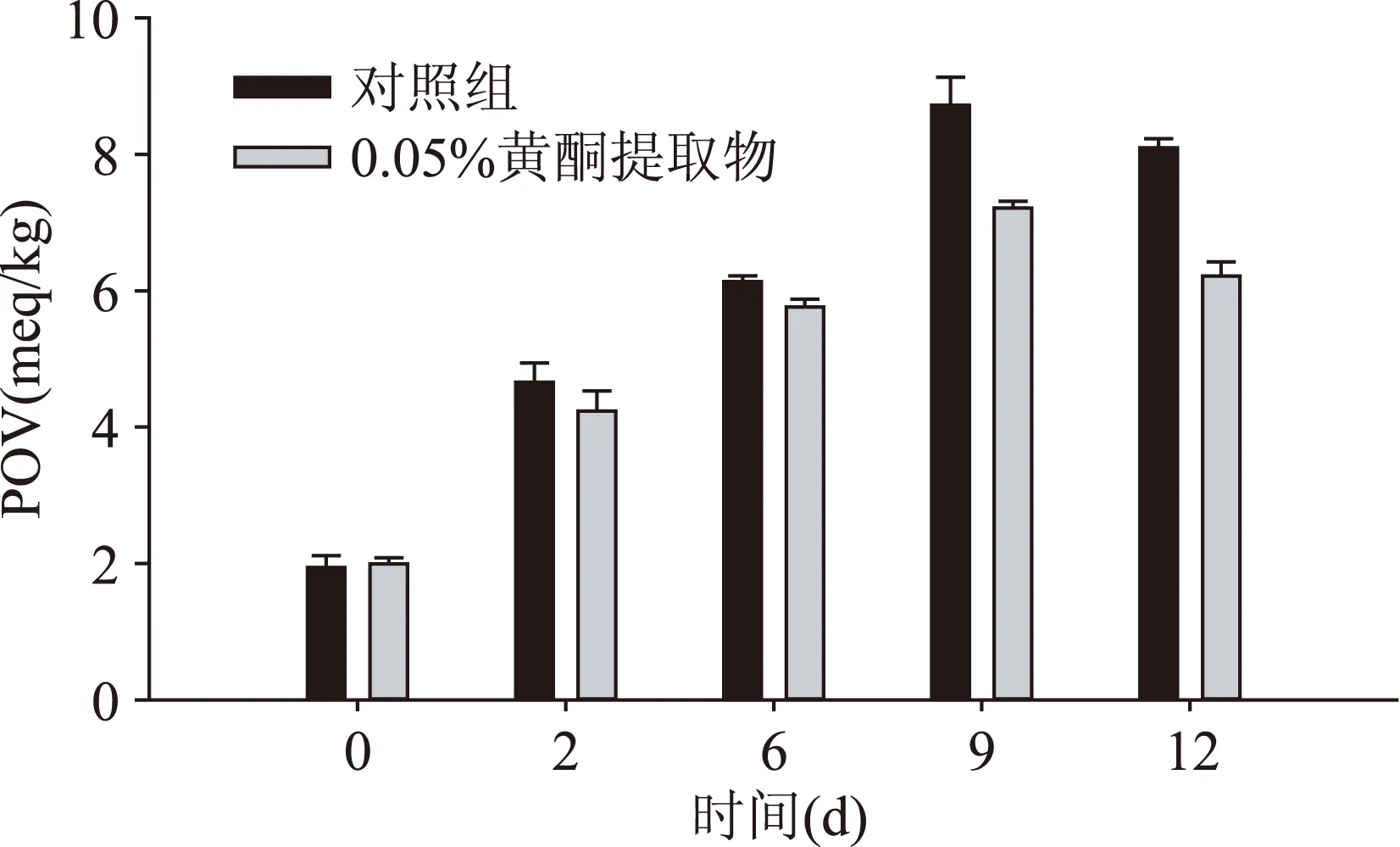
图4 色拉米加工过程中POV值的变化Fig.4 POV value of diffetent salami treatments during processing

图5 色拉米加工过程中TBARS的变化Fig.5 TBARS value of diffetent salami treatments during processing
2.3.2色拉米加工过程中硫代巴比妥酸值(TBARS)的变化TBARS值是评价脂肪二次氧化程度的重要指标,主要反映了脂肪氧化的最终产物丙二醛的含量[22]。由图5可知,对照组和处理组的TBARS值在整个加工过程中都呈现上升趋势,前期上升缓慢,后期上升速度较快。干燥第6 d时,对照组的TBARS为0.571 mg MDA/kg,比添加0.05%的黄酮提取物处理组高出0.198 mg MDA/kg。干燥结束后,对照组的TBARS值为1.321 mg MDA/kg,而添加0.05%的黄酮提取物为0.871 mg MDA/kg。在干燥中后期黄酮提取物可以显著降低色拉米肠的TBARS值(p<0.05)。成品的TBARS值相比对照组降低了34%。油菜蜂花粉中的黄酮可以减缓脂质过氧化,降低色拉米加工过程中的过氧化值,主要是由于含有山奈酚、槲皮素等黄酮类化合物[23]。
3 结论
油菜蜂花粉提取物中黄酮类化合物含量为604 mg/g。油菜蜂花粉黄酮提取物的总抗氧化能力、DPPH自由基和羟基自由基清除能力优于维生素E。添加0.05%油菜蜂花粉黄酮提取物于色拉米中,成品中的POV值降低了23%,TBARS值降低了34%。因此,油菜蜂花粉黄酮提取物可作为优良的天然抗氧化剂使用。
[1]Basim E,Basim H,Özcan M. Antibacterial activities of Turkish pollen and propolis extracts against plant bacterial pathogens[J]. Journal of Food Engineering,2006,77(4):992-996.
[2]Kroyer G,Hegedus N. Evaluation of bioactive properties of pollen extracts as functional dietary food supplement[J]. Innovative Food Science and Emerging Technologies,2001,2(3):171-174
[3]Silva T M.S,Camara C A,da Silva Lina A.C,et al. Chemical composition and free radical scavenging activity of pollen loads from stingless bee Melipona subnitida Ducke[J]. Journal of Food Composition and Analysis,2006,19(6):507-511.

[5]Pascoal A,Rodrigues S,Teixeira A,et al. Biological activities of commercial bee pollens:Antimicrobial,antimutagenic,antioxidant and anti-inflammatory[J]. Food and Chemical Toxicology,2014,63:233-239.
[6]王文艳,彭增起,周光宏. 超声波法提取油菜蜂花粉中黄酮工艺条件的研究[J].食品科技,2006,31(8):121-123.
[7]杨洁,陈纯,邢建军,等. 油菜蜂花粉中黄酮类化合物的提取与鉴定[J]. 食品科学,2010(22):273-278.
[8]Campagnol,Paulo Cezar,Bastianello,et al. The influence of achyrocline satureioides(“ Marcela”)extract on the lipid oxidation of salimi,Food Science and Technology(Campinas)31.1(2011):101-105
[9]Halliwell B,Aeschbach R,Löliger J,et al. The characterization of antioxidants[J]. Food and Chemical Toxicology,1995,33(7):601-617
[10]Heininger K. A unifying hypothesis of Alzheimer’s disease. III. Risk factors[J]. Human Psychopharmacology Clinical and Experimental,2000,15(1):1-70.
[11]杨佳林. 油菜蜂花粉酚类化合物的分离及其抗氧化活性研究[D].北京:中国农业科学院,2010.
[12]Molina-Calle M,Priego-Capote F,de Castro M D L. Development and application of a quantitative method for determination of flavonoids in orange peel:Influence of sample
pretreatment on composition[J]. Talanta,2015,144:349-355.
[13]Yang L C,Li R,Tan J,et al. Polyphenolics composition of the leaves of Zanthoxylum bungeanum Maxim. grown in Hebei,China,and their radical scavenging activities[J]. Journal of Agricultural and Food Chemistry,2013,61(8):1772-1778.
[14]熊双丽,卢飞,史敏娟,等.DPPH自由基清除活性评价方法在抗氧化剂筛选中的研究进展[J].食品工业科技,2012,33(8):380-383.
[15]Zheng X J,Xiao H,Zeng Z,et al. Composition and serum antioxidation of the main flavonoids from fermented vine tea(Ampelopsis grossedentata)[J]. Journal of Functional Foods,2014,9:290-294.
[17]刘骏. 结晶紫分光光度法测定 Fenton 反应产生的羟自由基[J].武汉工业学院学报,2005,24(2):53-55.
[18]Faustman C,Specht S M,Malkus L A,et al. Pigment oxidation in ground veal:Influence of lipid oxidation,iron and zinc.[J]. Meat Science,1992,31(3):351-362.
[19]Ge Q,Ma X. Composition and antioxidant activity of anthocyanins isolated from Yunnan edible rose(An ning)[J]. Food Scienceand Human Wellness,2013,2(2):68-74.
[20]Simic M G,Taylor K A.Free radical mechanisms of oxidation reactions[M].A j St Angelo,M E Bailey,Warmed-over Flavor of Meat.FL,USA:Academic Press.1987,69-72.
[21]王文艳. 油菜蜂花粉及其复合物对南京香肠抗氧化特性的影响研究[D]. 南京.南京农业大学,2006.
[22]Li J,Wang F,Li S,et al. Effects of pepper(Zanthoxylum bungeanum Maxim.)leaf extract on the antioxidant enzyme activities of salted silver carp(Hypophthalmichthys molitrix)during processing[J]. Journal of Functional Foods,2015,18:1179-1190.
[23]Lv H,Wang X,He Y,et al. Identification and quantification of flavonoid aglycones in rape bee pollen from Qinghai-Tibetan Plateau by HPLC-DAD-APCI/MS[J]. Journal of Food Composition and Analysis,2015,38:49-54.
Antioxidation of rape bee pollen flavonoid extracts and application in salami
YANG Feng-tian,ZHANG Ya-wei,LI Shun,LIU Cheng-hua,HUANG Xiao-chuang,LIU Shi-xin,PENG Zeng-qi*
(College of Food Science and Technology,Synergetic Innovation Center of Food Safety and Nutrition,Nanjing Agricultural University,Nanjing 210095,China)
The flavonoid in rape bee pollen was extracted by ultrasound-assisted technology. Theinvitroantioxidant capacity was observed through three antioxidant assays including total antioxidant capacity,DPPH radical scavenging ability and hydroxyl radical scavenging capacity. The rape bee pollen flavonoid extracts were investigated as a natural antioxidant for the lipid stability of the salami.According to the results,the yield of flavonoid was 3.02% in rape bee pollen and 604 mg/g in the extracts. Total antioxidant capacity,DPPH radical scavenging ability and hydroxyl radical scavenging capacity of 250 μg/mL flavonoid extracted from rape bee pollen were respectively 1.62,1.18,3.11 times that of Vitamin E. Addition of 0.05% flavonoid extracts significantly caused a decrease(p<0.05)in the POV values and TBARS values of the salami.
rape bee pollen;flavonoid extract;antioxidant;salami;application
2016-01-14
杨凤田(1990-),女,硕士研究生,研究方向:畜产品加工与质量控制,E-mail:2014808124@njau.edu.cn。
彭增起(1956-),男,博士,教授,畜产品加工与质量控制,E-mail:zqpeng@njau.edu.cn。
TS251.5
A
1002-0306(2016)15-0121-05
10.13386/j.issn1002-0306.2016.15.015
