不同胁迫条件对鲁氏酵母胞内海藻糖积累的影响研究
2016-09-10胡梦蝶刘翠翠
胡梦蝶,陈 雄,李 欣,王 志,代 俊,黄 珍,刘翠翠
(湖北工业大学生物工程学院,发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,湖北武汉 430068)
不同胁迫条件对鲁氏酵母胞内海藻糖积累的影响研究
胡梦蝶,陈雄*,李欣,王志,代俊,黄珍,刘翠翠
(湖北工业大学生物工程学院,发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,湖北武汉 430068)
为了积累鲁氏酱油酵母胞内海藻糖的含量,提高活性干酵母制作过程中的存活率。本文主要探讨了渗透压(NaCl)、温度、乙醇和氧化(H2O2)条件下鲁氏酵母胞内海藻糖的积累规律。实验表明,渗透压胁迫对海藻糖积累没有明显的作用,高浓度NaCl胁迫时海藻糖含量反而降低;添加乙醇和升高温度有利于海藻糖的积累:2%(v/v)乙醇添加9 h后海藻糖的含量达到22.32 mg/gDw,相比对照20.46 mg/gDw提高了9.09%;温度升高6 h后海藻糖含量从17.55 mg/gDw升至24.41 mg/gDw,提高了39.14%;在氧化胁迫初期,H2O2可明显提高鲁氏酵母胞内海藻糖的含量,0.2%(v/v)H2O2浓度下海藻糖含量为14.18 mg/gDw,比对照8.17 mg/gDw增加了73.56%,但是随着氧化胁迫延长,最终海藻糖含量没有明显区别。实验结果为提高鲁氏酵母胞内海藻糖含量从而制成耐储藏活性干酵母具有一定指导意义。
鲁氏酵母,海藻糖,渗透压,温度,乙醇,H2O2
鲁氏酵母是一种耐高渗酵母,是酱油酿造中后期风味物质形成的重要菌株。在酱油酿造过程中,鲁氏酵母能够产生风味物质,如乙醇、高级醇、异戊醇、异丁醇等芳香杂醇类物质[1]。目前我国酱油产量不断增加,导致对酱油酵母的需求量也逐渐增大,酱油活性干酵母的应用前景更加广泛[2]。
海藻糖是一种非还原性的二糖,由葡萄糖以α,α-1,1糖苷键连接而成,广泛存在于各种生物体内,在恶劣环境中能够保护微生物细胞质膜的完整性和蛋白质的稳定性[3]。海藻糖含量与活性干酵母的存活率密切相关[4],是鉴定活性干酵母质量和活性的一个重要指标。研究发现当酵母细胞内海藻糖含量为其干重的2%~3%时,就会对保持压榨鲜酵母细胞的活性起到重要的作用[5-6],胞内海藻糖含量高(13.0%)的酵母,贮存前10 d内发酵活力基本没有变化;而胞内海藻糖含量低(10.2%)的酵母,贮存4 d后发酵活力就开始下降[7]。因此,细胞内海藻糖的含量是鉴定活性干酵母质量和活性的一个重要指标。本文从渗透压、温度、乙醇、氧化胁迫方面比较全面地研究了鲁氏酵母在YEPD培养基中胞内海藻糖的积累情况,实验结果为生产耐储藏酱油活性干酵母提供一定的指导。
1 材料与方法
1.1材料与仪器
鲁氏酵母(Zygosaccharomycesrouxii):湖北工业大学生物工程学院分离保藏菌种,专利保藏号为:CCTCC M 2013310。
YEPD培养基:蛋白胨2%,酵母浸粉1%,葡萄糖2%(固体培养基中加入2%的琼脂),pH5.95。
UV-722型紫外可见光分光光度计上海精密科学仪器有限公司:高压灭菌锅上海博讯实业有限公司医疗设备厂:DZF-6020电热鼓风干燥箱重庆银河实验仪器有限公司。
1.2实验方法
1.2.1菌种活化及培养条件将实验室保藏的鲁氏酵母CCTCC M 2013310接种一环至YEPD斜面活化,恒温培养箱28 ℃培养2 d复苏菌种。将活化好的斜面取一环接种到YEPD液体培养基,30 ℃、180 r/min摇床培养24 h,获得液体种子。实验培养基中接入5%的液体种子,于30 ℃、180 r/min条件下摇床培养24 h。
1.2.2生物量的测定收集5 mL菌液离心(5000 r/min,10 min)去掉上清液,菌体稀释后于波长600 nm处以去离子水为对照进行比色测定,光密度OD600nm=OD读数×稀释倍数[8]。
1.2.3细胞干重的测定取干燥的10 mL离心管,记录空管的质量,取5 mL发酵液于管中,5000 r/min离心10 min,去上清液,洗涤2次后在80 ℃烘干至恒重,用电子天平称重[9]。
1.2.4海藻糖标准曲线的测定称取不同体积的海藻糖标准溶液定容于50 mL容量瓶中(内含4 mL,0.5 mol/L三氯乙酸),吸取l mL试样及空白样(50 mL蒸馏水,内含4 mL,0.5 mol/L三氯乙酸)于已烘干洁净的试管中,加入5 mL硫酸-蒽酮溶液,震荡均匀,在沸水中准确反应10 min,迅速冷却到室温,测定630 nm的吸光度,以空白为对照,海藻糖浓度为横坐标,吸光度为纵坐标[2]。
1.2.5酵母中胞内海藻糖含量的测定准确称取用冰蒸馏水洗涤两次的上述酵母泥约0.1 g于离心管中加入4 mL,0.5 mol/L三氯乙酸,震荡均匀后置于带有冰块的冰水中每15 min震荡一次,1 h后,2500~3000 r/min离心,将上清倒入盛有冰水的50 mL容量瓶中,再用冰水洗涤两次,将上清倒入容量瓶中,然后再用冰水定容。空白样为含有4 mL,0.5 mol/L三氯乙酸的冰水溶液。重复标曲的测定方法计算海藻糖的含量[2]。
1.2.6条件胁迫方法渗透压胁迫:在初始YEPD培养基中分别添加0%、1%、5%、9%的NaCl浓度培养至27 h。温度胁迫:在YEPD培养基中摇瓶培养至18 h时,以30 ℃为对照,实验组分别提高温度至35、40 ℃继续培养至27 h。乙醇胁迫:在YEPD培养基中摇瓶培养至18 h时,以不添加乙醇为对照,实验组分别添加体积比2%、4%、6%的乙醇继续培养至27 h。H2O2胁迫:在YEPD培养基中摇瓶培养至18 h时,以不添加H2O2为对照,实验组分别添加体积比为0.1%、0.2%、0.3%的H2O2继续培养至27 h。所有培养过程均每隔3 h取样检测生物量和胞内海藻糖含量。
2 结果与分析
2.1海藻糖的标准曲线
测定海藻糖的标准回归曲线为Y=0.2191X-0.0031,其中R2=0.9962,呈线性关系。标准曲线见图1。
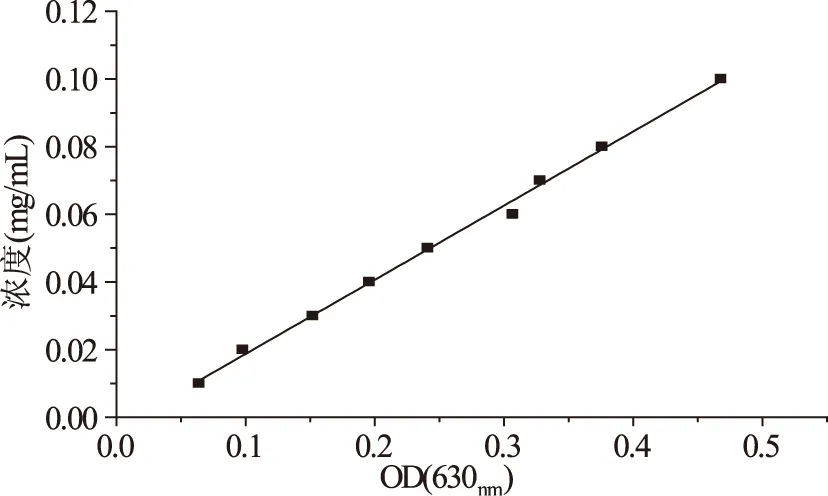
图1 海藻糖的标准曲线Fig.1 Standard curve of trehalose
2.2渗透压对鲁氏酵母胞内海藻糖积累的影响
渗透压对鲁氏酵母生长和胞内海藻糖的影响如图2所示。随着渗透压的增加,鲁氏酵母生物量会有小幅的降低,对应海藻糖的含量也降低,在无NaCl胁迫时胞内海藻糖含量达到15.83 mg/gDw,其他渗透胁迫条件下胞内海藻糖含量大致在10.00 mg/gDw左右,并且随盐浓度增加而下降,分析原因可能是渗透胁迫下鲁氏酵母细胞膜的流动性降低,抑制外界葡萄糖进入细胞,在合成其他物质(甘油)的同时减少合成海藻糖的原料。该结论与Yoshikawa S在对耐盐鲁氏酵母研究中的结果一致,即盐胁迫表现为胞内积累钠离子胁迫和渗透压胁迫,这2种初级胁迫产生活性氧(ROS)造成氧化损伤,此时耐盐酵母细胞能够积累更多的甘油来适应外界的高渗环境[10]。
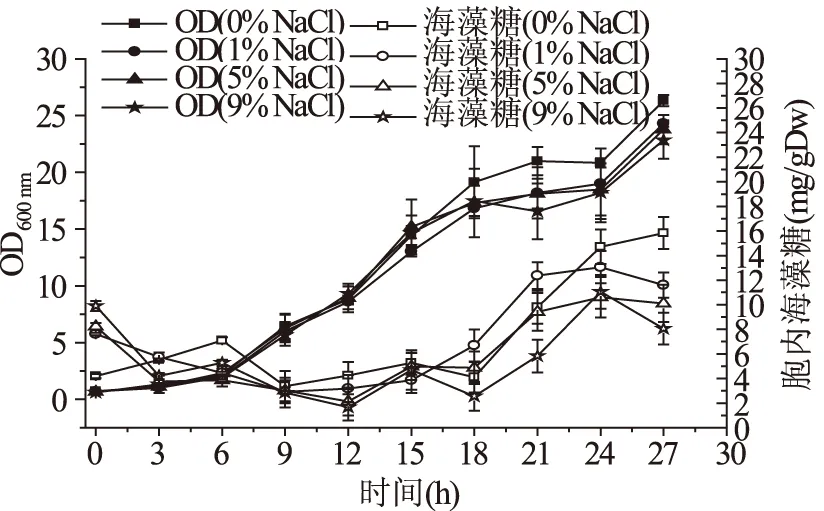
图2 鲁氏酵母在不同NaCl浓度胁迫下生物量和胞内海藻糖的积累Fig.2 The accumulation of trehalose and biomass of Z. rouxii under different NaCl concentration
2.3温度对鲁氏酵母胞内海藻糖积累的影响
温度是影响海藻糖积累的重要因素,升温有利于酵母细胞内海藻糖的积累[11]。在酿酒酵母中,海藻糖开始积累的温度为33~35 ℃[12]。Bell等应用蛋白质印记分析,证实了当酿酒酵母的培养温度从27 ℃上升到40 ℃时,6-磷酸海藻糖合成酶(TPS1)基因产物增加[13]。图3中可以看出30 ℃培养鲁氏酵母,达到稳定期时,其生物量最大为26.21,而35 ℃和40 ℃培养时,鲁氏酵母生物量下降,40 ℃下生物量最低。胞内海藻糖在35 ℃下刺激6 h时达到最大值24.41 mg/gDw,比对照17.55 mg/gDw提高了39.14%。因此,在鲁氏酵母培养过程中,35 ℃比较有利于胞内海藻糖的积累。
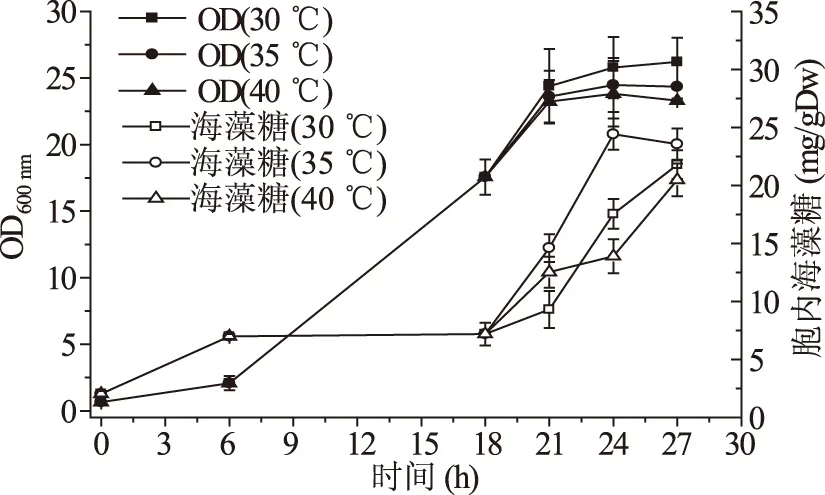
图3 不同温度胁迫下鲁氏酵母生物量和胞内海藻糖的积累Fig.3 The accumulation of trehalose and biomass of Z. rouxii under different temperature
2.4乙醇对鲁氏酵母胞内海藻糖积累的影响
乙醇的积累会抑制微生物细胞的生长和存活能力,影响各种转运系统的功能[14]。高浓度的乙醇甚至破坏细胞膜的完整性,降低质膜的流动性和损害多种离子的渗透性,从而导致跨膜电势的损耗,最终酸化细胞内和液泡的环境[15-16]。图4结果显示在18~24 h内添加乙醇组的生物量均高于对照组,并且随着乙醇浓度的增加,生物量略有降低,在添加2%的乙醇浓度下,生物量最高,达到23.63。在24~27 h内,对照组和添加2%浓度乙醇组生物量仍然在上升,但是添加乙醇浓度为4%和6%的乙醇组生物量明显下降。在18~27 h,2%乙醇组胞内海藻糖积累量最多,在27 h时胞内海藻糖含量达到22.32 mg/gDw,比对照提高了9.09%。

图4 不同浓度乙醇胁迫下鲁氏酵母生物量和胞内海藻糖的积累Fig.4 The accumulation of trehalose and biomass of Z. rouxii under different ethanol concentration
2.5H2O2对鲁氏酵母胞内海藻糖积累的影响
过氧化氢(H2O2)是一种强氧化剂,外源添加H2O2可以直接作用于蛋白质或者跨过细胞膜后进一步与金属离子反应产生自由基,对胞内的蛋白质甚至DNA产生伤害。因此,限制外源H2O2向胞内的扩散是微生物细胞对自身的一种保护,可以有效降低H2O2对微生物的氧化损伤[17]。图5结果表明:添加H2O2后的3 h内(18~21 h)生物量与对照组基本一致,但胞内海藻糖量有明显变化:在0.1%和0.2%的H2O2浓度下,海藻糖含量有一定的增加,在0.2%H2O2浓度下为14.18 mg/gDw,比对照(8.17 mg/gDW)增加73.56%。在H2O2胁迫6 h内(21~24 h)时,0.1%和0.2%的H2O2浓度下生物量与胞内海藻糖含量与对照相比仍有一定的增加。在H2O2胁迫6~9 h(24~27 h),在不同H2O2浓度下,生物量与胞内海藻糖含量与对照相比没有明显差异。因此,在氧化胁迫初期,H2O2可明显提高鲁氏酵母胞内海藻糖的含量。

图5 不同H2O2浓度胁迫下鲁氏酵母生物量和胞内海藻糖的积累Fig.5 The accumulation of trehalose and biomass of Z. rouxii under different H2O2concentration
3 结论
基于细胞内海藻糖的含量是鉴定活性干酵母质量和活性的一个重要指标,本文主要研究了NaCl渗透压、温度、乙醇和H2O2氧化胁迫条件下鲁氏酵母在YEPD培养基中海藻糖的积累特性,实验结果如下:在YEPD基础培养基中,在1%~9% NaCl浓度范围内,随着NaCl浓度的增加,胞内海藻糖含量降低,盐胁迫不利于鲁氏酵母胞内海藻糖的积累;在YEPD基础培养基中,温度提高到35 ℃刺激6 h,鲁氏酵母胞内海藻糖的积累达到最大,在40 ℃培养下海藻糖含量低于在30 ℃时海藻糖的积累量,可能是过高温度影响海藻糖合成酶的活性;在YEPD基础培养基中,2%浓度乙醇的添加会同时促进鲁氏酵母生物量的增加及胞内海藻糖的积累;在YEPD基础培养基中,在H2O2氧化压力的短时胁迫下,0.2%浓度H2O2可明显提高鲁氏酵母胞内海藻糖的含量。
[1]卫永华,齐威,王春玲,等. 耐盐酵母在酱油中的应用及其耐盐机理的研究[J].中国酿造,2012,04:25-28.
[2]张艳艳.酱油活性干酵母的制备及应用[D]. 天津:天津科技大学,2013.
[3]Trevisol E T V,Panek A D,Mannarino S C,et al. The effect of trehalose on the fermentation performance of aged cells of Saccharomyces cerevisiae[J].Applied microbiology and biotechnology,2011,90(2):697-704.
[4]赵志华,岳田利,王燕妮,等. 海藻糖的生物学机制在酿酒活性干酵母(AADY)中的应用[J].食品研究与开发,2006,11:180-184.
[5]雷锦成,李志军,周俊,等. 活性干酵母在酱油中的应用[J].中国酿造,2012,06:162-165.
[6]Fumihiko S,Naoki A,Minoru S,et al.A dual role of intracellular trehalose in the resistance of yeastcells to water stress[J].Cryobiology,1999,39:80-87.
[7]李春磊. 影响高活性干酵母活性保存能力因素的研究[D].2007,山东轻工学院.
[8]Romanos M A,Scorer C A,Clare J J. Foreign gene expression in yeast:a review[J].Yeast,1992,8(6):423-488.
[9]叶勤.发酵过程原理[M].北京:化学工业出版社,2005:108.
[10]Yoshikawa S,Mitsul N,Chikara K I,et al.Effect of salt stress on plas mamembrane perme ability and lipid saturation in the salt
-tolerant yeastZygosaccharomycesrouxii[J].Journal of Fermentation and Bioengineering,1995,80(2):13l-135.
[11]池振明,梁丽琨,朱开玲,等. 酵母海藻糖的代谢与调控研究进展[J].中国海洋大学学报(自然科学版),2006,02:209-214.
[12]Attfield P V. Trehalose accumulates inSaccharomycescerevisiaeduring exposure to agents that induce heat shock response[J].FEBS letters,1987,225(1):259-263.
[13]Bell W,Klaassen P,Ohnacker M,et al. Characterization of the 56-kDa subunit of yeast trehalose-6-phosphate synthase and cloning of its gene reveal its identity with the product of CIF1,a regulator of carbon catabolite inactivation[J].European Journal of Biochemistry,1992,209(3):951-959.
[14]Bai F W,Chen L J,Zhang Z,et al. Continuous ethanol production and evaluation of yeast cell lysis and viability loss under very high gravity medium conditions[J].Journal of Biotechnology,2004,110(3):287-293.
[15]Teixeira M C,Raposo L R,Mira N P,et al. Genome-wide identification ofSaccharomycescerevisiaegenes required for maximal tolerance to ethanol[J].Applied and environmental microbiology,2009,75(18):5761-5772.
[16]Trevisol E T V,Panek A D,Mannarino S C,et al. The effect of trehalose on the fermentation performance of aged cells ofSaccharomycescerevisiae[J].Applied microbiology and biotechnology,2011,90(2):697-704.
[17]孙廷丽,施庆珊,欧阳友生,等. 过氧化氢诱导酿酒酵母细胞膜透性和组成的变化[J].生物工程学报,2009,12:1887-1891.
Intracellular trehalose metabolism characteristics ofZygosaccharomycesrouxiiunder different stresses
HU Meng-die,CHEN Xiong*,LI Xin,WANG Zhi,DAI Jun,HUANG Zhen,LIU Cui-cui
(Key Labortory of Fermentation Engineering(Ministry of Education),Hubei Provincial Cooperative Innovation Center of Industrial Fermentation,College of Bioengineering,Hubei University of Technology,Wuhan 430068,China)
Trehalose content and the resistance of yeast are positively correlated,the content of intracellular trehalose is an important index for assessing the quality and the activity of active dry yeast. The intracellular trehalose synthesis regulation ofZygosaccharomycesrouxiiunder osmotic pressure,temperature,ethanol and H2O2was discussed. The study showed that the osmotic pressure had no obvious effect on trehalose accumulation. Trehalose content was lower under high concentrations of NaCl stress,but adding ethanol and raising temperature were conducive to the accumulation of trehalose:trehalose content was increased by 9.09% from 20.46 mg/gDw to 22.32 mg/gDw at 9 h after ethanol added and trehalose content was increased by 39.14% from 17.55 mg/gDw to 24.41 mg/gDw at 6 h for heating. During the early period under H2O2stress,0.2% H2O2can enhance the accumulation of trehalose remarkablely. Compared with the control content of 8.17 mg/gDw,the trehalose was increased by 73.56% to the content of 14.18 mg/gDw. This result had certain guiding significance for soy sauce fermentation and improving soy sauce storage stability of active dry yeast.
Zygosaccharomycesrouxii;trehalose;osmotic pressure;temperature;ethanol;H2O2
2015-11-19
胡梦蝶(1989-),女,硕士研究生,研究方向:发酵工程,E-mail:13343401589@163.com。
陈雄(1969-),男,博士,教授,研究方向:酿造工程,E-mail:cx163_qx@163.com。
TS201.3
A
1002-0306(2016)11-0130-04
10.13386/j.issn1002-0306.2016.11.019
