岩藻黄素在水、油模型体系中稳定性的研究
2016-09-10陈晓利汪曙晖朱俊向孙潇雯姜进举汪东风
陈晓利,汪曙晖,朱俊向,孙潇雯,姜进举,汪东风,*
(1.中国海洋大学食品科学与工程学院,266003 山东青岛;2.青岛市疾病预防控制中心,266033 山东青岛;3.青岛明月海藻集团,266400 山东青岛)
岩藻黄素在水、油模型体系中稳定性的研究
陈晓利1,汪曙晖2,朱俊向1,孙潇雯1,姜进举3,汪东风1,*
(1.中国海洋大学食品科学与工程学院,266003 山东青岛;2.青岛市疾病预防控制中心,266033 山东青岛;3.青岛明月海藻集团,266400 山东青岛)
研究了温度、抗氧化剂及气体环境对水、油模型体系中岩藻黄素稳定性的影响,并对岩藻黄素的降解动力学进行分析。结果表明,不同贮藏条件下岩藻黄素在油体系中比在水体系中表现出更强的耐贮藏性;岩藻黄素在低温贮藏下相对稳定,随温度升高,降解加快;水溶性抗氧化剂抑制降解效果从高到低依次为:植酸钠>茶多酚>维生素C;脂溶性抗氧化剂抑制降解效果从高到低依次为:特丁基对苯二酚>丁基羟基茴香醚>维生素E>二丁基羟基甲苯>没食子酸丙酯。不同气体贮藏环境实验表明,两种体系中氮气能够抑制岩藻黄素降解,而氧气促进岩藻黄素降解。降解动力学分析结果表明,上述不同条件下岩藻黄素的降解遵循一级反应动力学模型。
岩藻黄素,稳定性,温度,抗氧化剂,氧气,降解动力学
岩藻黄素(fucoxanthin,FUCO)在类胡萝卜素中含量最丰富,它不仅广泛存在于海洋大型藻类中,而且在微藻中也有发现,其产量约占自然界中类胡萝卜总产量的10%[1]。岩藻黄素因它特殊的分子结构[2],使得它具有较强的抗炎、抗癌、减肥和治疗糖尿病等作用[2-3],但也是因为这种结构,使得岩藻黄素易受光、酸、氧和热等外界条件影响,易发生降解或异构化,造成岩藻黄素有益功能基团的丢失。岩藻黄素这种对环境的敏感性及脂溶性极大地限制了岩藻黄素在功能食品及相关医药产品的开发应用,因此对岩藻黄素的稳定性的研究显得尤为重要。
目前对岩藻黄素稳定性的研究相对较少。Zhao等人考察了油体系中加热、空气暴露和光照对岩藻黄素稳定性的影响,发现岩藻黄素的降解和合成反应遵循简单的一级动力学反应,空气暴露和光照均促进岩藻黄素的氧化降解,其研究为岩藻黄素在食用油中的应用提供了必要的背景知识[4]。为了克服岩藻黄素的低水溶性,适应当前食品和医药领域的需求,研究人员开始探索岩藻黄素水溶性制剂制备,如Quan等人用鲸蜡(cetyl palmitate,CP)和卡诺拉菜籽油(canola oil,CO)混合作为固体脂核,制备成岩藻黄素微球,在干燥(0% RH)和湿润(51% RH)条件下观察100 d,微球脂核CP∶CO=50∶50较CP∶CO=0∶100,30∶70表现出较高的岩藻黄素容量,同时氮气处理提高岩藻黄素保存率[5]。除此之外,Ravi和Baskaran制备了岩藻黄素纳米颗粒,发现糖脂(glycolipid,GL)的添加使凝胶粒中岩藻黄素的载量明显增加[6]。虽然对岩藻黄素水溶性制剂的研究已经取得一定程度的进展,但依旧存在岩藻黄素的载量低、可贮藏时间短的问题,还需要进一步探索。
本研究在前人研究的基础上,一方面将岩藻黄素溶解于水模型体系,填补了目前水体系中研究藻黄素稳定性的空缺;另一方面,对比了低温与较高温度下贮藏岩藻黄素的降解情况,同时考察添加抗氧化剂以及气体环境条件对提高水、油模型体系中岩藻黄素稳定性的效果,为岩藻黄素在水溶性与油溶性制剂中应用提供保藏方面的知识。
1 材料与设备
1.1材料与仪器
岩藻黄素实验室自制,从裙带菜中提取分离,参考汪曙晖[7]的制备方法,纯度达85.64%;维生素C(VC)Amresco公司;茶多酚(TP)、二丁基羟基甲苯(BHT)、特丁基对苯二酚(TBHQ)、没食子酸丙酯(PG)北京索莱宝科技有限公司;植酸钠(PS)、维生素E(VE)Sigma公司;丁基羟基茴香醚(BHA)上海源叶生物科技有限公司;玉米胚芽油山东西王食品有限公司;二氯甲烷(分析纯)、石油醚(分析纯)天津市富宇精细化工有限公司;吐温20(化学纯)、乙腈(化学纯)国药集团化学试剂有限公司;丙酮(分析纯)莱阳经济技术开发区精细化工厂;甲醇(分析纯)天津市巴斯夫化工有限公司;无水乙醇(分析纯)天津市永大化学试剂有限公司。
ACCULAB型电子分析天平北京赛多利斯仪器系统有限公司;水浴锅、鼓风干燥箱上海精宏实验设备有限公司;Milli-Q型超纯水系统上海摩速科学器材有限公司;层析柜北京亚星仪器科技有限公司;UV-2102 PC型UV-vis分光光度计尤尼柯仪器有限公司;涡旋振荡器上海沪西分析仪器厂有限公司;氮吹仪天津艾维欧科技发展有限公司。
1.2实验方法
1.2.1FUCO水、油模型体系的制备
1.2.1.1FUCO水模型体系的制备参考Rodriguez等人的文献制备FUCO水模型体系[8]。整个制备过程在避光下进行,最后用锡箔纸包裹血清瓶,备用。
1.2.1.2FUCO油模型体系的制备取适量实验室自制的FUCO于25 mL的血清瓶中,氮气吹干,加入20 mL脱气的玉米胚芽油,漩涡振荡1 min,超声3 min,间歇20 min,重复3次,使得FUCO在油中充分溶解,分散均匀,制得的油模型体系中FUCO浓度为0.05 mg/mL[4]。整个制备过程在避光下进行,最后用锡箔纸包裹血清瓶,备用。
1.2.2水、油模型体系中FUCO的测定定期取含有FUCO的水溶液样品0.25 mL,加入2 mL的丙酮-石油醚(50∶50,v/v)溶液,漩涡振荡15 s,静置30 min分层,重复3次,最后将溶剂收集于10 mL的离心管中,40 ℃下氮气吹干溶剂,溶于无水乙醇,450 nm下测定样品溶液的吸光值,样品处理过程在避光下进行[7]。通过下面公式计算FUCO的含量:
式(1)
式中,A450表示在450 nm处FUCO的吸光值;Mr表示FUCO的相对分子质量,658.91;ε表示FUCO的摩尔吸光系数,84340.48 L·mol-1·cm-1;n表示稀释倍数。
定期取含有FUCO的油溶液样品0.23 g,加入2 mL甲醇-乙腈(60∶40,v/v),漩涡振荡15 s,静置30 min分层,重复三次,最后将溶剂收集于10 mL的离心管中,-38 ℃过夜结晶脂肪酸,过0.45 μm的聚四氟乙烯膜,40 ℃下氮气吹干溶剂,溶于无水乙醇,450 nm下分光光度计测得样品溶液的吸光值,样品处理过程在弱光下进行[4]。根据公式(1)计算FUCO含量。
1.2.3不同条件下FUCO稳定性的研究
1.2.3.1温度与FUCO的稳定性将1.2.1中的FUCO样品置于4、30、50、70、90 ℃条件下避光贮藏,定期取样,按1.2.2测定样品中FUCO的含量,以及考察温度对不同体系中FUCO稳定性的影响。
1.2.3.2抗氧化剂与FUCO的稳定性将VC、PS、TP制备成1 mg/mL的母液,分别在装有FUCO水溶液的血清瓶中添加0.5%(w/v,mg/mL)的抗氧化剂,将BHA、BHT、TBHQ、PG、VE制备成1 mg/mL的母液,分别在装有FUCO油溶液的血清瓶中加入0.5%(w/v,mg/mL)的抗氧化剂,最后将添加有抗氧化剂的水、油样品溶液置于室温下避光贮藏,定期取样,并测定样品中FUCO的含量。
1.2.3.3气密条件与FUCO的稳定性将1.2.1中的FUCO样品分别用氮气和氧气吹除样品瓶中剩余的空气,使得样品瓶中气体全部为氮气和氧气并密封,不做特殊处理的空气密封作为对照组,封口膜缠绕瓶口,隔绝外部环境,最后将样品瓶置于室温下避光贮藏,定期取样,按1.2.2测定样品中FUCO的含量,取样后重新气密贮藏样品溶液。
1.2.4FUCO的降解动力学分析根据水、油体系中FUCO的降解残留量随时间的变化情况,并分别根据式(2)拟合0级、公式(3)拟合1级、式(4)拟合2级降解动力学模型,根据模型的确定系数R2选择降解动力学模型,计算不同条件下FUCO的动力学反应速率常数(k)[9]。
c=c0-kt
式(2)
lnc=lnc0-kt
式(3)
式(4)
式中,c0为样品溶液中FUCO的初始浓度,mg/mL,c为t时刻不同处理样品溶液中FUCO的浓度,mg/mL,k为反应速率常数,h-1。另外,将c0/2代入式(2)、(3)、(4)可计算FUCO降解的半衰期t1/2,h。
2 结果与分析
2.1温度对模拟水、油体系中FUCO稳定性的影响
2.1.1温度对水模型体系中FUCO稳定性的影响含有FUCO的水模型体系分别在4、30、50、70、90 ℃的恒温环境中贮藏,不同温度下FUCO的含量随时间的变化趋势如图1所示。4 ℃贮藏下FUCO相对稳定,降解曲线平缓,30、50 ℃下降解曲线斜率逐步增大,当观察时间为220 h时,降解量分别为2%、29%、79%;继续升高贮藏温度,分别在70 ℃和90 ℃下,贮藏10 h,FUCO的降解量分别为39%和70%,可见高温下FUCO降解剧烈。综上表明,在水模型体系下,4 ℃低温有利于FUCO的贮藏,1个月内相对稳定,室温下适合1周内短期贮藏,高温下不利于FUCO的保存。
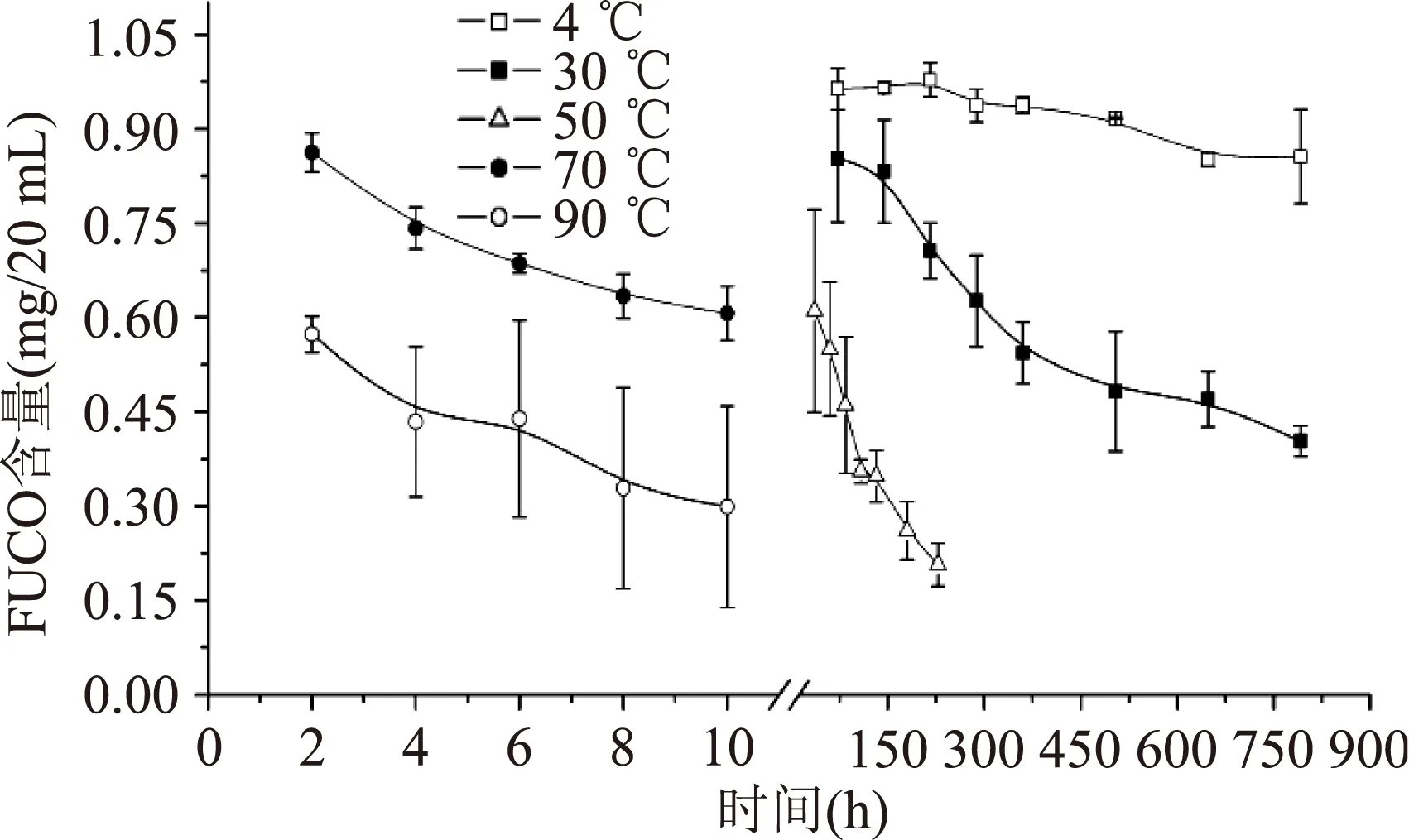
图1 不同贮藏温度对水模型体系中FUCO稳定性的影响Fig.1 Effect of the storage temperature on the stability of fucoxanthin in aqueous model system
2.1.2温度对油模型体系中FUCO稳定性的影响含有FUCO的油模型体系分别在4、30、50、70、90 ℃的恒温环境中贮藏,其中,不同温度下FUCO的含量随时间的变化趋势如图2所示。结果表明,4 ℃下FUCO相对稳定,30 ℃下FUCO缓慢降解,贮藏2088 h,降解量分别为6%、19%;当贮藏温度升至50 ℃时,降解趋势线斜率增大,贮藏2280 h,FUCO降解量达到53%;继续升高贮藏温度,70 ℃和90 ℃下贮藏10 h,FUCO的降解量分别为11%、21%。与2.1.1中水体系下FUCO的稳定性相比,同样的贮藏温度下,FUCO在油体系中更稳定,贮藏期更长,这可能与FUCO的脂溶性特点有关,或是由于油体系中一些天然的抗氧化物质的存在,如维生素E、多酚类及植物甾醇等[4]。
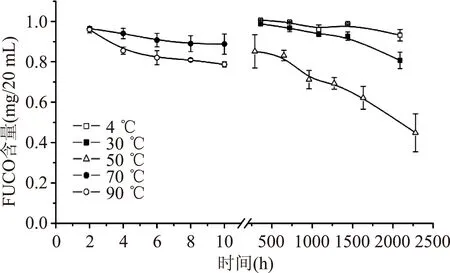
图2 不同贮藏温度对油体系中FUCO降解的影响Fig.2 Effect of the storage temperature on the stability of fucoxanthin in oil model system
2.2抗氧化剂对模拟水、油体系中FUCO稳定性的影响
从图3a中FUCO随时间的降解趋势可知,3种水溶性抗氧化剂对FUCO降解的抑制效果分别为PS>TP>VC。PS对FUCO的降解抑制效果最佳可能是PS除了具有较强的抗氧化性外还可与多价金属离子形成难溶性鳌合物[9],而FUCO同其它类胡萝卜素一样,当暴露在金属环境中易发生降解[3]。TP主要化学成分为儿茶素类(黄烷醇类)、黄酮及黄酮醇类、花青素类、酚酸及缩酚酸类、聚合酚类等化合物的复合体,是比VC具有更强抗氧化性能的天然抗氧化剂[9],能够在贮藏初期表现出对FUCO良好的抑制降解的作用,但随时间延长,TP逐步被分解,降解抑制作用减弱;VC在FUCO水体系模型中并没有表现出抑制FUCO降解的作用,然而在先前的研究中,高浓度的VC(1%,w/v)提高了FUCO的稳定性[10],在本研究中可能大部分VC(0.5%,w/v)在水溶液中已被氧化分解[11]。
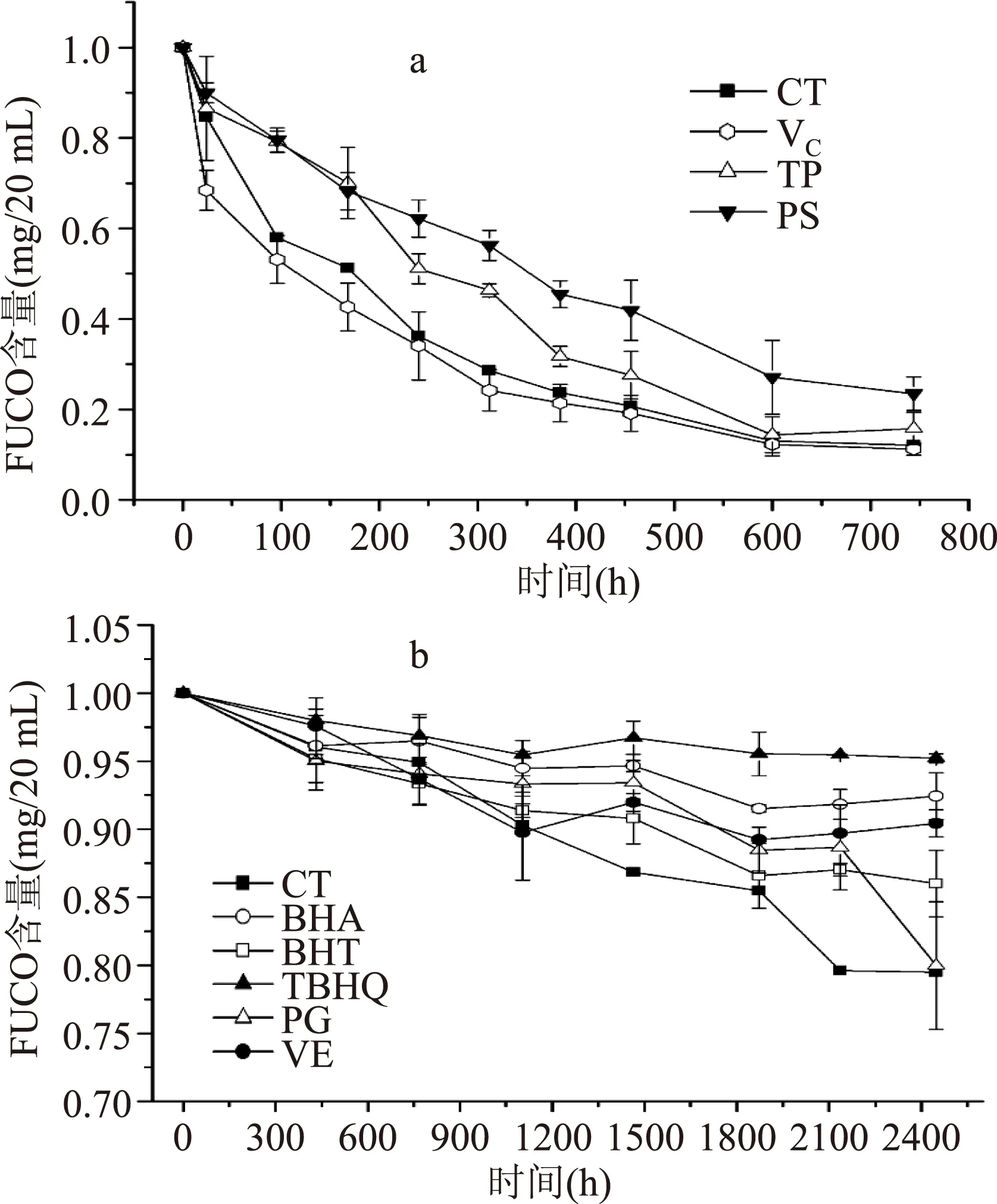
图3 抗氧化剂对水(a)、 油(b)模型体系中FUCO稳定性的影响Fig.3 Effect of the antioxidants on the stability of fucoxanthin in aqueous(a)and oil(b)model systems
在溶解有FUCO的油模型体系中分别添加BHA、BHT、TBHQ、PG和VE油溶性抗氧化剂,室温条件下避光贮藏,FUCO的含量随时间的变化趋势如图3b所示,结果表明,与图3a相比,FUCO在油体系中更稳定,这也与2.1所述的结果一致,通过研究温度对水、油模型体系中FUCO稳定性的影响,同样得到FUCO在油体系中更加稳定。在贮藏2448 h后,对照组降解了20%,而添加了BHA、BHT、TBHQ、PG和VE抗氧化剂组,分别降解了7%、14%、5%、20%和9%,5种油溶性抗氧化剂对FUCO降解的抑制效果分别为TBHQ>BHA>VE>BHT>PG,它们皆属于酚类抗氧化剂,在形成自由基后比较稳定,因此对FUCO起到较好的抗氧化作用[9]。相较于天然抗氧化剂VE,合成抗氧化剂TBHQ对FUCO降解的抑制效果更好,因此,在实际应用中可以通过添加低成本的合成抗氧化剂抑制FUCO降解,从而达到较好的贮藏效果。
2.3气体环境对水、油模型体系中FUCO稳定性的影响
将溶解有FUCO的水模型体系分别用空气、氮气和氧气密封保存,室温条件下避光贮藏,观察FUCO的含量随时间的变化趋势。如图4a所示,经过504 h的贮藏,水模型体系中大部分的FUCO发生降解,氧气环境加剧了FUCO的降解,降解量达到91%,与对照组相比,氮气封存对FUCO降解具有一定的抑制作用。
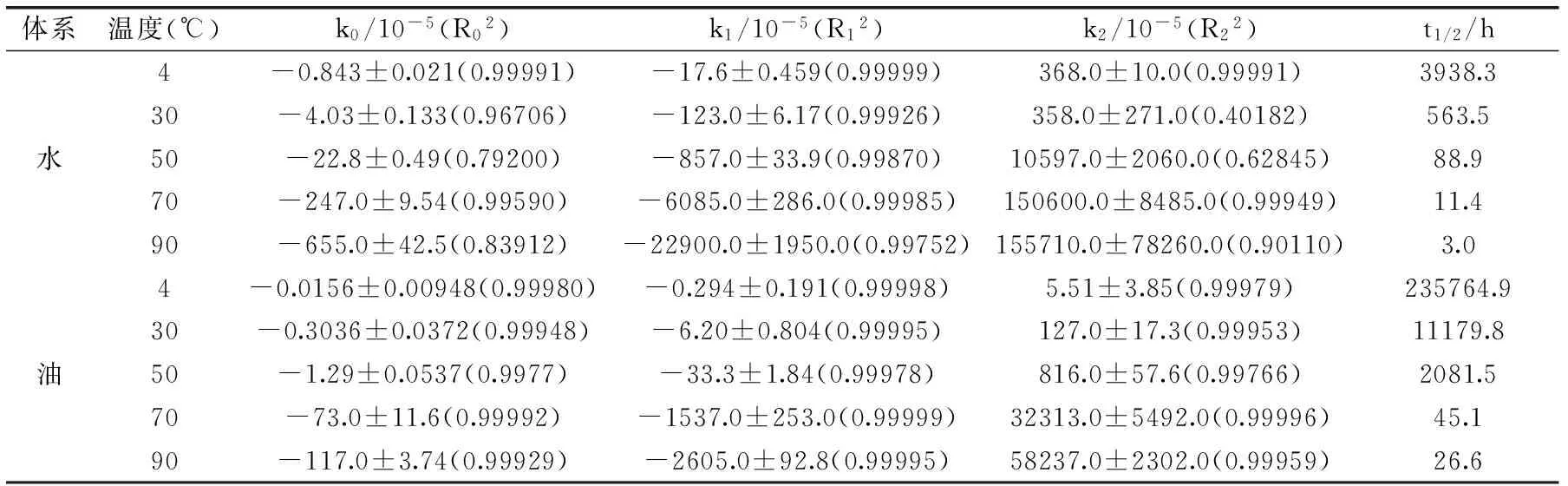
表1 不同贮藏温度下水、油模型体系中FUCO的降解动力学参数Table 1 Degradation Kinetic parameters of fucoxanthin stored in aqueous and oil model systems at different temperatures
注:k0、R02、k1、R12、k2、R22分别为0、1、2级动力学模型的速率常数和决定系数,t1/2为1级动力学模型FUCO的降解半衰期。表2、3同。
将溶解有FUCO的油模型体系分别用空气、氮气和氧气密封保存,室温条件下避光贮藏,观察FUCO的含量随时间的变化趋势。如图4b所示,经过2088 h的贮藏,油模型体系中的FUCO降解缓慢,氮气密封对FUCO降解具有一定程度的抑制作用,然而氧气环境并没有加剧FUCO的降解,与对照组的空气密封曲线贴近,这可能与实验贮藏期较短有关,不同的气密条件对油体系中FUCO的影响可能会随贮藏时间延长而表现出彼此间的差异。
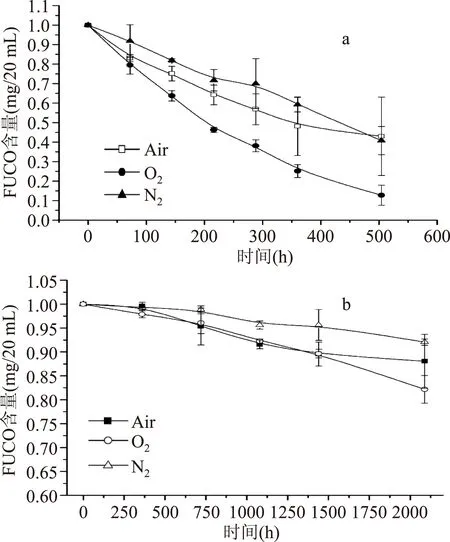
图4 气体环境对水(a)、 油(b)模型体系中FUCO稳定性的影响Fig.4 Effect of the gaseous environment on the stability of fucoxanthin in aqueous(a)and oil(b)model systems
2.4水、油模型体系中FUCO的降解动力学
对不同温度、抗氧化剂和气体环境下FUCO含量的降解进行动力学分析,通过拟合0、1、2级降解动力学方程,将相应的具有重要意义的动力学参数:反应速率常数k、决定系数R2和降解半衰期t1/2总结在表1~表3中。通过比较速率常数k来推断降解反应的快慢,通过比较决定系数R2来评估动力学模型对降解规律的拟合程度,通过观察降解半衰期t1/2清晰对比不同条件下FUCO降解一半所需要的时间。从表1~表3中发现1级动力学模型的线性回归决定系数R12大于0级和2级动力学模型的决定系数R02、R22,且R12>0.997,表明温度、抗氧化剂和气体环境对水、油模型体系中FUCO降解的影响可以用简单的1级动力学模型来描述。

表2 不同气体环境下水、油体系中FUCO的降解动力学参数Table 2 Degradation kinetic parameters of fucoxanthin stored in aqueous and oil model systems at different gaseous environments
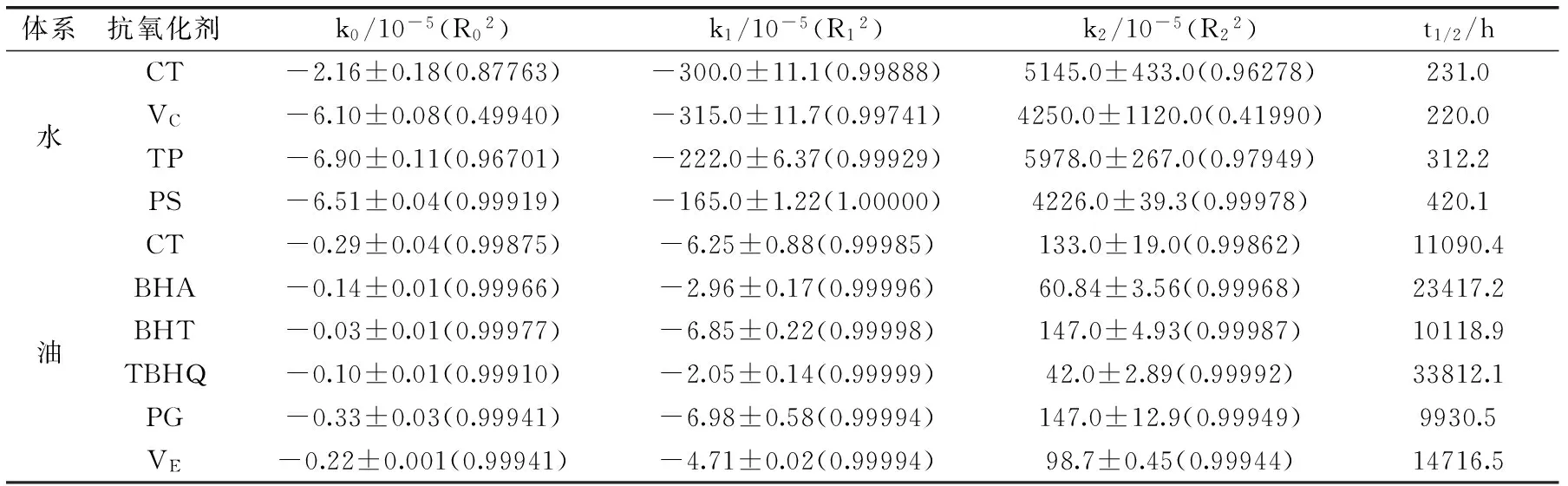
表3 添加抗氧化剂的水、油体系中FUCO的降解动力学参数Table 3 Degradation kinetic parameters of fucoxanthin stored in aqueous and oil model systems with different antioxidants
从3个表中可知,不同体系、不同贮藏条件下FUCO含量的对数与贮藏时间之间呈现良好的线性关系,同一条件下油体系中FUCO的降解速率远小于水体系的降解速率,表明FUCO在油体系中贮藏更加稳定,这与2.1、2.2和2.3结果一致。
由表1可知,水、油体系中FUCO的降解速率常数均随着温度的增加而急剧增大,这与Zhao等人[4]对不同温度(25、37、60、80、100 ℃)卡诺拉菜籽油中FUCO降解及Ahmed等人[12]对不同温度(70、80、90、105 ℃)木瓜汁中类胡萝卜素降解研究结果相同,半衰期随着温度的增加而减小,说明随温度升高,FUCO发生剧烈的降解或异构化。
由表2可知,氮气气密处理使得水、油体系中FUCO的降解速率常数小于空气密闭下FUCO的降解速率常数,而氧气气密下FUCO的降解速率常数最大,可见氮气抑制了FUCO的降解,这种作用在油体系中尤为明显,而氧气加快了FUCO的降解,这种作用在水体系中更加明显。
由表3中可知,在水体系中添加了PS后FUCO的降解速率常数最小,半衰期最大,达420.1 h,明显提高了水体系中FUCO的稳定性,相反,添加了VC后FUCO的降解速率常数大于对照组,可见并没有起到抑制FUCO降解的作用。在油体系中,观察到所有抗氧化剂对FUCO降解均有一定程度的抑制作用,降解速率常数均小于对照组,且TBHQ的抑制降解效果最佳。
3 结论
本文探究了贮藏温度、抗氧化剂及气体环境对水、油模型体系中FUCO稳定性的影响,结果表明温度是影响FUCO贮藏稳定性的主要因素,低温贮藏能够显著提高FUCO的稳定性,随着温度的升高FUCO降解速度加快,不耐贮藏;抗氧化剂的添加对FUCO的降解具有一定的抑制作用,其中对水、油体系中FUCO降解抑制效果最佳的抗氧化剂分别是PS和TBHQ;气密条件对水体系中FUCO稳定性的影响大于对油体系中FUCO稳定性的影响,氧气明显地促进水体系中FUCO的降解,氮气密封贮藏在油、水体系中均能一定程度上提高FUCO的稳定性;经降解动力学分析,水、油模型体系中FUCO的降解遵循一级反应动力学模型。
[1]Norman I,Krinsky,Susan T,et al. Carotenoids in health and disease[M]. CRC Press,2004.
[2]汪曙晖,薛长湖. 岩藻黄素的结构,性质和功能[J]. 食品工业科技,2010(6):408-410.
[3]Peng J,Yuan J P,Wu C F,et al. Fucoxanthin,a marine carotenoid present in brown seaweeds and diatoms:metabolism and bioactivities relevant to human health[J]. Marine Drugs,2011,9(10):1806-1828.
[4]Zhao D,Kim S M,Pan C H,et al. Effects of heating,aerial exposure and illumination on stability of fucoxanthin in canola oil[J]. Food Chemistry,2014,145:505-513.
[5]Quan J,Kim S M,Pan C H,et al. Characterization of fucoxanthin-loaded microspheres composed of cetyl palmitate-based solid lipid core and fish gelatin-gum arabic coacervate shell[J]. Food Research International,2013,50(1):31-37.
[6]Ravi H,Baskaran V. Biodegradable chitosan-glycolipid hybrid nanogels:A novel approach to encapsulate fucoxanthin for improved stability and bioavailability[J]. Food Hydrocolloids,2015,43:717-725.
[7]汪曙晖. 海藻中岩藻黄素的分离鉴定及抗肿瘤活性研究[D]. 青岛:中国海洋大学,2010.
[8]Rodriguez E B,Rodriguez-Amaya D B. Formation of
apocarotenals and epoxycarotenoids fromβ-carotene by chemical reactions and by autoxidation in model systems and processed foods[J]. Food Chemistry,2007,101(2):563-572.
[9]Van Boekel M A J S. Kinetic modeling of food quality:a critical review[J]. Comprehensive Reviews in Food Science and Food Safety,2008,7(1):144-158.
[10]SiewLing H,PooiYi C,KwanKit W,et al. Stability studies of fucoxanthin from Sargassum binderi[J]. Australian Journal of Basic and Applied Sciences,2010,4(10):4580-4584.
[11]李银聪,阚建全,柳中. 食品抗氧化剂作用机理及天然抗氧化剂[J]. 中国食物与营养,2011,17(2):24-26.
[12]Ahmed J,Shivhare U S,Sandhu K S. Thermal degradation kinetics of carotenoids and visual color of papaya puree[J]. Journal of Food Science,2002,67(7):2692-2695.
Study on stability of fucoxanthin in oil and aqueous model system
CHEN Xiao-li1,WANG Shu-hui2,ZHU Jun-xiang1,SUN Xiao-wen1,JIANG Jin-ju3,WANG Dong-feng1,*
(1.Food Science and Engineering School,Ocean University of China,Qingdao 266003,China;2.Qingdao Municipal Center for Disease Control & Prevention,Qingdao 266033,China;3.Qingdao Bright Moon Seaweed Group Co.,Ltd.,Qingdao 266400,China)
The effects of heating,antioxidants and gas environments on the stability of fucoxanthin in the oil and aqueous model system were investigated,and the degradation kinetics models of fucoxanthin were analyzed. The results showed that fucoxanthin was more stable in oil system than that in aqueous system,and fucoxanthin was relatively stable at low temperature storage. The degradation of fucoxanthin was promoted by the increase of heating temperature. In the aqueous model system,treated using three hydrophilic antioxidants,the effects of retard of degradation in descending order were as follows:sodium phytate>tea polyphenols>vitamin C. In the oil system,treated using five hydrophobic antioxidants,the effects of retard of degradation in descending order were as follows:tert-butyl hydroquinone>butylated hydroxy anisole>vitamin E>butylated hydroxytoluene>propyl gallate. In addition,the oxygen promoted the degradation of fucoxanthin,and the nitrogen could achieve preferable storage effect. The degradation of fucoxanthin was found to follow first-order kinetics under above-mentioned conditions through degradation kinetic analysis.
fucoxanthin;stability;temperature;antioxidants;oxygen;degradation kinetics
2016-01-06
陈晓利(1990-),女,硕士研究生,研究方向:水产品安全与质量控制,E-mail:chenxlovo@163.com。
汪东风(1956-),男,博士,教授,研究方向:食品化学与营养,E-mail:wangdf@ouc.edu.cn。
青岛市黄岛区自主创新重大项目(2014-3-11)。
TS201.1
A
1002-0306(2016)14-0298-06
10.13386/j.issn1002-0306.2016.14.051
