开菲尔粒中主要组成菌的分离鉴定及微囊化纯培养混合发酵指标分析
2016-09-10刘克营郭爱珍刘朋龙齐向辉蔡梅红
钟 浩,王 亮,*,刘克营,郭爱珍,胡 曼,刘朋龙,齐向辉,蔡梅红
(1.江苏大学 食品与生物工程学院,江苏镇江 212013;2.新疆天润生物科技股份有限公司,新疆乌鲁木齐 830088)
开菲尔粒中主要组成菌的分离鉴定及微囊化纯培养混合发酵指标分析
钟浩1,王亮1,*,刘克营1,郭爱珍1,胡曼1,刘朋龙2,齐向辉1,蔡梅红1
(1.江苏大学 食品与生物工程学院,江苏镇江 212013;2.新疆天润生物科技股份有限公司,新疆乌鲁木齐 830088)
开菲尔粒是一个复杂的微生物共生体系,包含很多有益生作用的微生物。本文研究了一种开菲尔粒的主要组成菌并制成发酵剂。通过形态学特征初步分离纯化得出:该开菲尔粒样品主要由两株酵母菌、三株乳酸菌以及两株醋酸菌构成。经16S rDNA序列分析进一步确定其种属,得出其分别为Kluyveromycesmarxianus和Pichiakudriavzevii、Lactobacilluspontis和Lactobacilluskefiri、Acetobacterlovaniensis和Acetobactercibinongensis。采用分离出的菌株纯培养微囊化之后进行混合发酵,得到具有优良稳定发酵性能的混合发酵剂,测定结果显示发酵乳的营养成分、挥发性成分和抑菌性与原粒对比十分接近。
开菲尔粒,分离,鉴定,纯培养混合发酵剂
开菲尔(kefir)是起源于高加索地区的一种酒精型发酵乳饮料,几千年前在前苏联、东欧、中东等地流行,向西方的德国、瑞士、意大利等地传播,并在北美和南美等地普及开来[1]。Kefir一词来源于土耳其语“kef”,是爽口、安详美满的意思[2]。已经有多人报道,其具有抑菌[3]及抗肿瘤活性[4],可调节肠道免疫系统[5],保护上皮细胞抵御蜡状芽孢杆菌入侵的生理功能[6]。这些都可能归功于开菲尔粒中复杂的菌相组成,其中包含有大量的益生菌。
关于开菲尔粒中菌种筛选的报道众多,可以看出不同来源、不同环境下的开菲尔粒中微生物组成和比例具有很大的差别[7-8]。开菲尔粒作为开菲尔发酵剂,由多种微生物共生而成,主要包括酵母菌、乳酸菌和醋酸菌。到目前为止,开菲尔粒中微生物的共生机理还没有得到科学的阐述。在大规模生产中,开菲尔粒中微生物的组成和比例严重影响开菲尔的质量。而且不稳定的菌种组成和比例,使开菲尔风味有很大差别[9]。曾友明等将从开菲尔粒中分离得到的乳酸菌和酵母菌按不同比例制成发酵剂,进行混合发酵实验,菌相组成相对复杂的较容易得到口感风味俱佳的开菲尔[10]。虽然这种方法保证了开菲尔的滋味,但是不易于扩大生产,而且菌种的组成和比例不同,开菲尔的风味和营养成分也有很大差异。因此我们对开菲尔粒菌种进行分离鉴定,制成微囊化纯培养混合发酵剂,为之后的开菲尔发酵剂的研制提供依据。
1 材料与方法
1.1材料与仪器
开菲尔粒江苏无锡养菌世家;生牛乳蒙牛乳业(集团)股份有限公司;MRS培养基乳酸菌选择培养基,筛选培养基中加入0.0005% 纳他霉素抑制真菌生长[11];添加0.1%的氯霉素的PDA培养基酵母菌选择培养基;Elliker培养基醋酸菌选择培养基;蔗糖、葡萄糖、半乳糖、乳糖、木糖、L-阿拉伯糖、壳聚糖、明胶、黄原胶、酵母粉、胰蛋白胨、过氧化氢、碘、氯化钙、海藻酸钠、氯化钠、醋酸铅、硫酸铵亚铁、结晶紫、考马斯亮蓝、溴麝香草酚蓝、蒽酮、浓硫酸、无水乙醇、石油醚、乙醚、磺基水杨酸以上分析试剂均为分析纯AR,国药集团化学试剂有限公司;琼脂糖、PCR buffer、dNTP、溴化乙锭、TE缓冲液上海生物技术有限公司。
SW-CJ系列洁净工作台苏州安泰空气技术有限公司;QYC 200全温空气摇床上海福玛实验设备有限公司;FE-20 pH计梅特勒-托利多仪器(上海)有限公司;BPMJ-250F型霉菌培养箱上海一恒科学仪器有限公司;手提式不锈钢压力蒸汽灭菌器上海三申医疗器械有限公司;BSA124S-CW电子天平赛多利斯科学仪器(北京)有限公司;MyCycler型PCR仪、Universal Hood II型凝胶成像仪、PowerPac型DNA电泳仪伯乐生命医学产品有限公司;气相色谱-质谱联用仪HP6890/5973、顶空固相微萃SPMC-57328美国Agilent公司;微量紫外分光光度计北京瑞利分析仪器公司。
1.2实验方法
1.2.1开菲尔粒的活化将实验室保存的开菲尔粒按照3%比例接种到灭菌牛乳中,30 ℃、140 r/min摇瓶培养24 h,用灭过菌的50目筛子过滤分离出活化的开菲尔粒,用无菌水冲洗干净,再将其又加入到新的灭菌乳中30 ℃、140 r/min培养24 h。循环三次后的开菲尔粒供分离使用[12]。
1.2.2菌种的分离和保存取1 mL开菲尔添加到9 mL无菌水中,混匀后用无菌水梯度稀释,吸取105、106、107的开菲尔稀释液各100 μL分别在MRS筛选培养基,PDA培养基,Elliker培养基上均匀涂布,各设三个重复,于30 ℃培养。待菌落长出后,挑取培养基上的优势菌落在相应的平板上划线分离培养,革兰氏染色直至鉴定为纯菌,挑取进行过氧化氢酶实验(用无菌牙签挑取少许单菌落于滴有一滴3% H2O2溶液的干净载玻片上,观察是否有气泡产生,有则为阳性,无则为阴性)。分别移入到相应的斜面培养基上进行培养,培养好后将斜面试管放在4 ℃冰箱中保存。挑取单菌落于相应的液体培养基中培养48 h,吸取1 mL菌液于2 mL冻存管中,然后添加灭菌甘油至终浓度为15%,封口膜密封好之后置于-75 ℃超低温冰箱冻存。
1.2.3菌落形态学鉴定通过观察菌落的大小、形状、颜色和表面形态等特征,初步区分菌种的差异和类别[13]。在添加1%的氯霉素的PDA培养基上挑选出有明显菌落形态,镜检菌体较大的初步认定为酵母菌;筛选MRS培养基表面挑选出有明显菌落形态、革兰氏阳性、H2O2阴性的菌株初定为乳酸菌;在Elliker培养基表面挑选出有明显菌落形态、革兰氏阴性、H2O2阳性的菌株初定为醋酸菌。
1.2.4分子生物学鉴定DNA的提取挑取分离得到的酵母菌、乳酸菌和醋酸菌,分别制成菌悬液,然后进行反复冻融(-80 ℃,2 h,室温融化,重复三次)破坏细胞结构,使细胞的DNA释放出来。
酵母菌和乳酸菌的PCR扩增与检测:
引物:酵母菌ITS1-5.8S-ITS2rDNA测序引物:ITS1:tccgtaggtgaacctgcgg;ITS4:tcctccgcttattgatatgc。乳酸菌和醋酸菌16SrDNA测序引物:27F:agagtttgatcctggctcag;1492R:tacggctaccttgttacgactt。
PCR扩增反应体系:按照以下加样混合:10×PCR buffer,2.5 μL;Taq酶,0.15 μL;dNTP,2 μL;模板DNA,2 μL;上游引物,0.5 μL;下游引物,0.5 μL;双蒸水,17.35 μL。
PCR扩增条件:细菌:预变性95 ℃,5 min;变性95 ℃,1 min;退火55 ℃,1 min;延伸72 ℃,90 s,重复上述3个步骤35个循环,然后延伸72 ℃,10 min,最后10 ℃冷却。酵母菌:预变性95 ℃,5 min;变性95 ℃,1 min;退火55 ℃,2 min;延伸72 ℃,40 s,重复上述3个步骤36个循环,然后延伸72 ℃,10 min,最后16 ℃冷却。
扩增结束后,取2.5 μL PCR产物加入1 μL 10×Loading buffer混合均匀,1%琼脂糖凝胶电泳,利用溴酚蓝作指示剂,检测PCR扩增产物。最后用EB作染色剂,利用数字凝胶成像系统记录实验结果。
PCR扩增产物序列的测定及分析:将扩增成功的PCR产物送往南京金斯瑞生物技术有限公司进行测序,将测得的DNA序列提交GenBank数据库,使用NCBI的BLAST检索系统(http://www. ncbi.nlm.Gov/Blast/)对序列同源性进行对比分析。
1.2.5微囊化混合纯培养发酵剂的制备将分离得到的菌纯培养,分别制成微胶囊[14]。配制含有0.3%黄原胶和5%氯化钙的混合溶液,121 ℃灭菌20 min。然后将准备好的混合液与菌种混合,并慢慢滴入经过灭菌处理的0.8%的海藻酸钠溶液中,形成液芯微胶囊。将微胶囊滤出并用灭菌生理盐水冲洗掉表面的海藻酸钠。然后将微胶囊放入5%的氯化钙溶液中进行固化处理。30 min后,滤出冲洗,再放入0.2%的壳聚糖溶液中浸泡30 min,使微胶囊表面形成一层保护膜,增加微胶囊的抗逆性。最后滤出微胶囊,冲洗,在4 ℃的环境下进行保存。将酵母菌、乳酸菌和醋酸菌制成的微胶囊按照2∶7∶1混合制成发酵剂,按照10%的比例接种到灭菌乳中,30 ℃,120 r/min发酵24 h,取发酵液(命名为M)保存于4 ℃下备用。然后用滤出的发酵剂继续相同条件下发酵,连续发酵10 d。同时用开菲尔原粒做对照实验(命为K)。
1.2.6发酵乳理化特性的测定乳酸菌、酵母菌和醋酸菌的菌落计数方法:参照GB 4789.2-2010;pH的测定:利用pH计进行测定;酸度的测定:参照GB 5413.34-2010;蛋白质含量的测定:利用考马斯亮蓝法测定[15];糖含量的测定:蒽酮比色法[16];脂肪含量的测定:罗紫-哥特里法[17];酒精含量的测定:利用气相色谱法[18]。
持水性(WHC)的测定:取20 mL的发酵乳,8000×g,4 ℃离心15 min。取上清液称重。按以下公式计算持水性:
W1:上清液重量,W2:开菲尔样品重量。
1.2.7GC-MS分析发酵乳中挥发性香气成分发酵乳处理:取5 mL样品注入20 mL的顶空瓶中,45 ℃前处理10 min。将萃取头插入顶空瓶中,45 ℃吸附30 min,于气相进样口解吸附5 min,然后进行气质分析。
气相条件:初始温度40 ℃持续4 min;以5 ℃/min的速率升温至140 ℃,保持10 min;再以5 ℃/min的速率升温至210 ℃,保持12 min;最后以10 ℃/min的速率升温至240 ℃。传输线温度保持250 ℃。检测器温度250 ℃。
质谱条件:电离电压70 eV,离子源温度:250 ℃,扫描范围:29~300 amu,发射电流100 μA,检测电压1.4 kV。
1.2.8抑菌实验取微囊发酵剂发酵10 d后的发酵乳进行抑菌实验。分别用金黄色葡糖球菌和大肠杆菌做指示菌。将100 μL两种指示菌菌悬液均匀涂布接种到LB琼脂培养基上,培养基凝固后,利用灭过菌的打孔器打孔。然后将M和K分别注满到孔中,以200 mg/L氨苄青霉素作为对比,30 ℃培养24 h。用尺子测量抑菌圈直径,通过比较抑菌圈大小来确定两种发酵液的抑菌效果[19]。
1.2.9数据处理方法本文中的数据都是经过平行实验获得的平均值,并使用origin8.5和SPSS16进行数据分析处理(p<0.05为影响显著)。
2 结果与讨论
2.1菌落的形态学分析
通过菌落的形态学分析,初步区别出不同的菌,为下面的分子生物学鉴定奠定基础。在酵母菌分离培养基上,有两种具有不同菌落形态的酵母菌(J1、J2);在乳酸菌的分离培养基上,挑选革兰氏染色紫色和过氧化氢酶实验阴性的菌株初步确定为乳酸菌,通过菌落的观察,有三种不同的乳酸菌(R1、R2、R3);在醋酸菌分离培养基上,通过革兰氏染色红色和过氧化氢酶实验呈阳性分离得到,有两种菌落形态不同的醋酸菌(C1、C2)。

表1 菌落形态特征Table 1 Colony morphology
2.2开菲尔粒中菌种基因序列鉴定结果分析
为了测定酵母菌、乳酸菌和醋酸菌的PCR效果,将PCR产物进行琼脂糖凝胶电泳,结果如图1,每个样做两个平行。在1500 bp和750 bp左右的位置上有清晰的条带,无弥散和非特异性扩增现象,说明PCR结果满足条件。
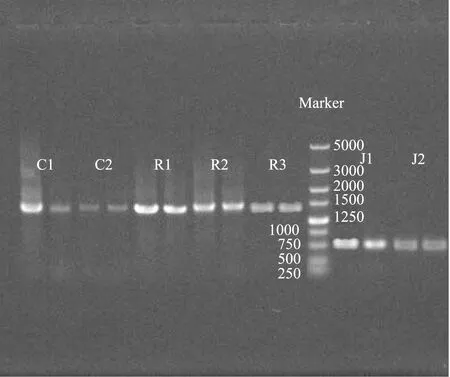
图1 分离菌种的电泳图谱Fig.1 Electrophoretic mapping of separation species
将测序得到的酵母菌、乳酸菌和醋酸菌的基因序列通过BLAST与数据库中的菌株进行相似性分析比较。当相似性大于99%时,该菌种可以直接鉴定到种的水平。从每个种中挑取有代表性的基因序列与模式菌株的序列利用软件MEGA5.10构建系统发育树。

图2 酵母菌基于IST1-5.8S-IST2rDNA序列构建的分子系统发育树Fig .2 Phyogenetic tree based on IST1-5.8S-IST2rDNA sequences and constructed using the neighbor joining method for yeast
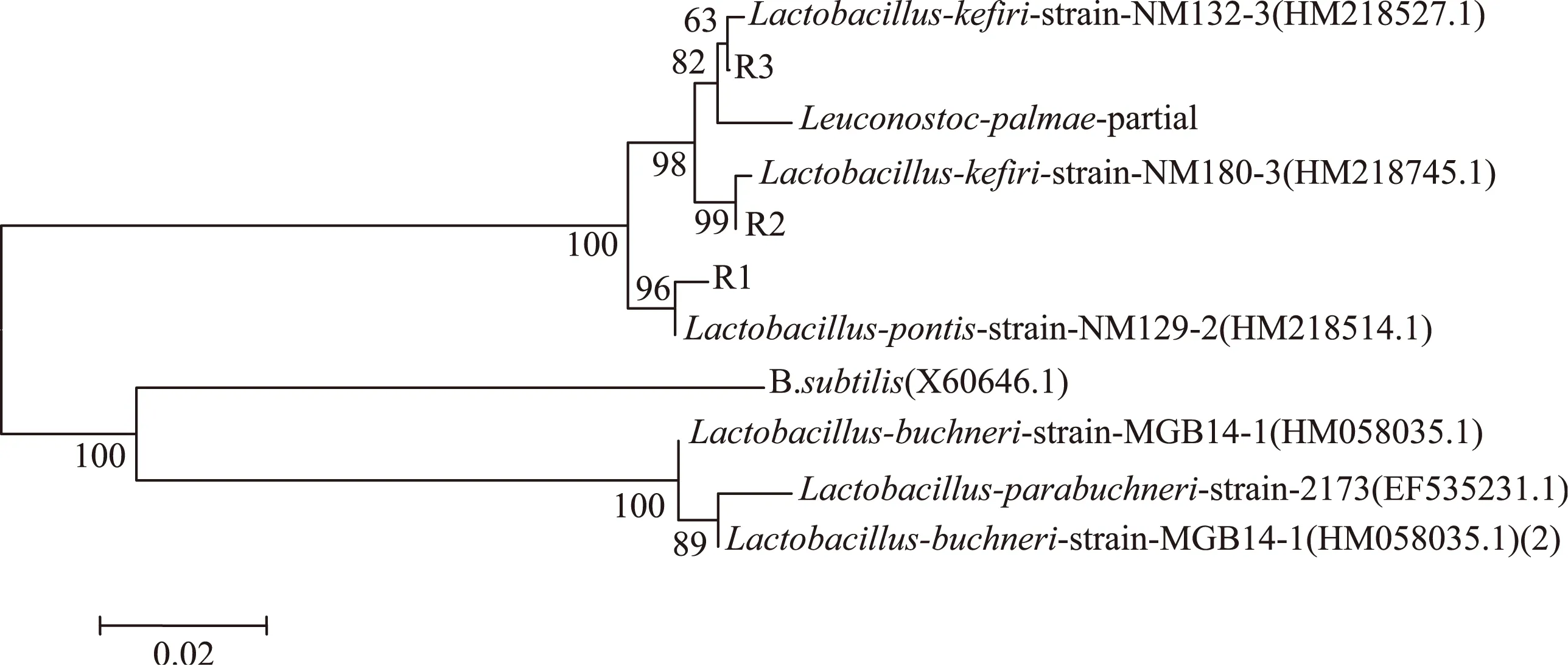
图3 乳酸菌基于16S rDNA序列构建的分子系统发育树Fig. 3 Phyogenetic tree based on 16S rDNA sequences and constructed using the neighbor joining method for lactobacillus

图4 醋酸菌基于16S rDNA序列构建的分子系统发育树Fig .4 Phyogenetic tree based on 16S rDNA sequences and constructed using the neighbor joining method for acetic acid bacteria
从图2可以看出,酵母菌J1和J2分别与Kluyveromycesmarxianusstrain CCT 7735和Pichiakudriavzeviiclone STA 197lsu的距离最近,且相似性都达到99%以上,故J1和J2分别被鉴定为Kluyveromycesmarxianusstrain和Pichiakudriavzeviiclone。从图3可以看出,乳酸菌R1、R2和R3分别与Lactobacilluspontisstrain NM129-2、Lactobacilluskefiristrain NM180-3和Lactobacilluskefiristrain NM132-3的距离非常接近,而且相似性达到99%以上,因此R1被鉴定为Lactobacilluspontisstrain,R2和R3被鉴定为Lactobacilluskefiristrain。从图4可以看出,醋酸菌C1和C2分别与AcetobacterlovaniensisstrainKS7和Acetobactercibinongensisstrain MGB31-7的距离非常接近,而且相似性达到100%,因此醋酸菌C1和C2分别被鉴定为Acetobacterlovaniensisstrain和Acetobactercibinongensisstrain。
2.3微囊发酵剂菌种数量的变化
由图5可知,随着发酵循环数的增加,微胶囊中各菌种的数量逐渐增加。到一定程度后,由于营养物质和生存空间的限制及菌种之间的相互作用,各菌种的数量最后趋于稳定[20]。微胶囊发酵剂中酵母菌、乳酸菌和醋酸菌的初始数量级分别是106、107、105cfu/mL,连续发酵十次后,各菌种的数量级基本稳定在1010、1012、109cfu/mL。可以看出乳酸菌为主要组成菌,而醋酸菌含量相对较少。
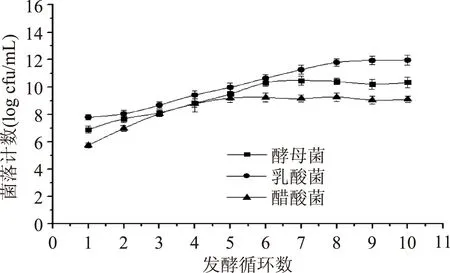
图5 发酵循环数对包埋发酵剂中菌种数量的影响Fig.5 Effect of number of fermentation cycles on the cell counts of bacteria and yeast in entrapped starter cultures
2.4发酵乳中物化指标和营养成分变化的比较
2.4.1发酵乳中持水率的变化由图6可知K和M的持水性逐渐增大,在六个循环发酵后,两者的持水性都基本达到稳定。在前三个循环,M的持水性高于K的持水性,之后被超越。研究发现,由于胞外多糖含有很高的水合能力和蛋白水解活性,因此胞外多糖的含量会影响发酵液的持水性[21]。而发酵剂中菌种的数量和活性会影响胞外多糖的产量,从而影响发酵液的持水性。
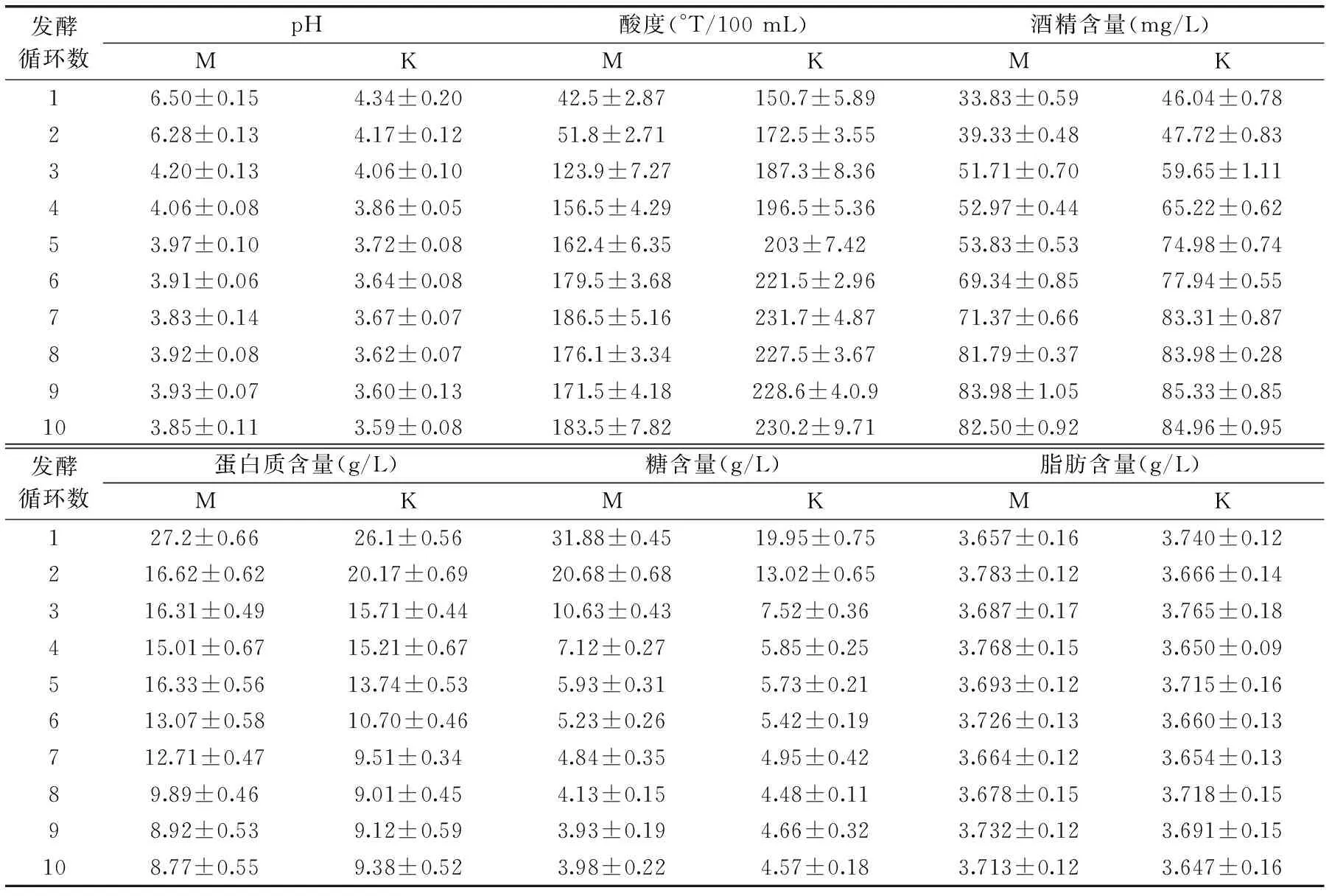
表2 微胶囊发酵剂发酵乳(M)与开菲尔粒发酵生产开菲尔(K)中营养成分的比较Table 2 Effects of number of fermentation cycles on chemical properties in the kefir produced by micro capsule(M)or kefir grains(K)
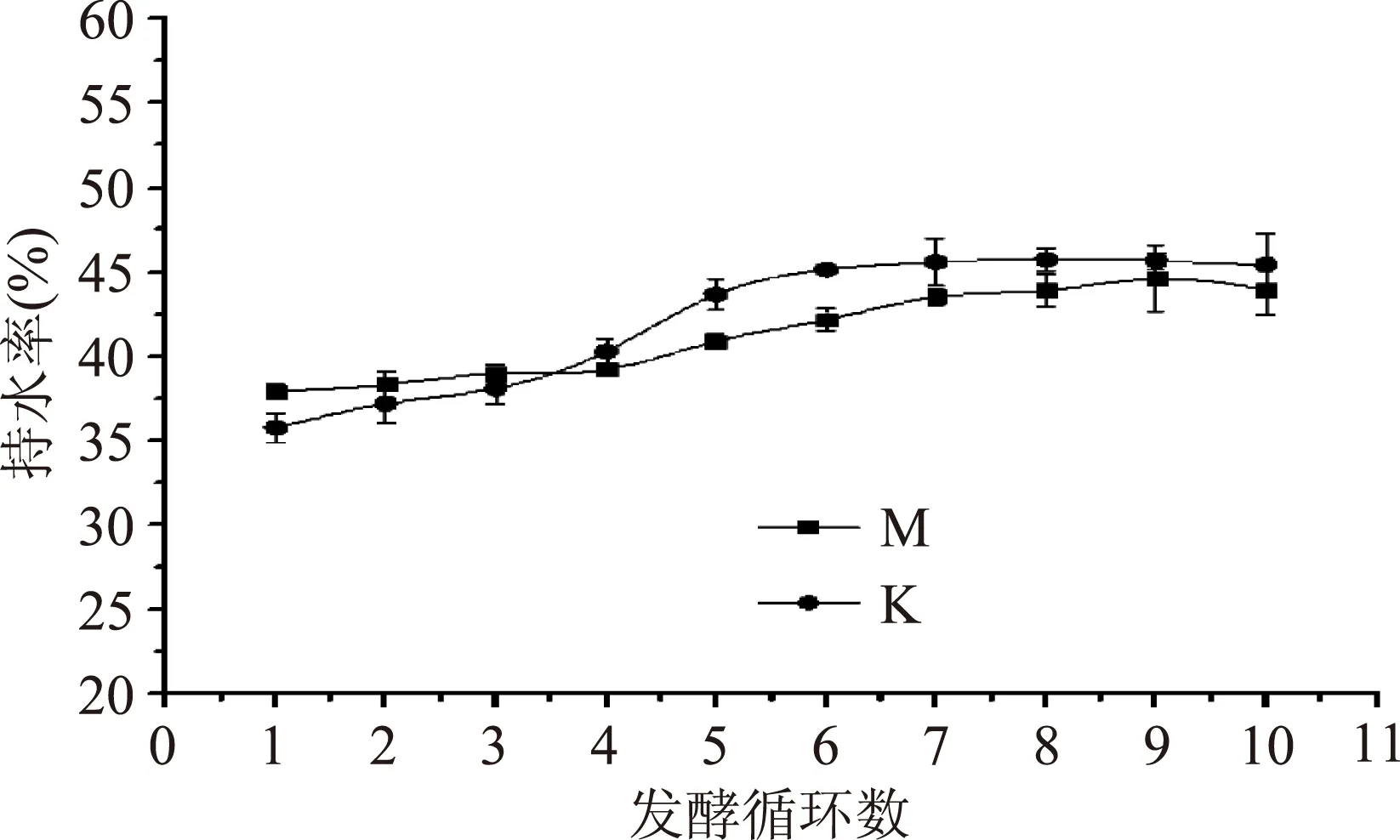
图6 发酵循环对K和M持水性的影响Fig.6 Effect of number of fermentation cycles on WHC of K and M
2.4.2发酵乳中营养成分变化由表2对比可以看出两种发酵乳的pH随着发酵循环数的增加而降低(p<0.05),酸度则是在增加,最后都趋于稳定。前三个循环M的发酵效力明显没有K高,可能是由于微囊发酵剂中囊膜对囊内物质有一定的阻碍作用[22],同时乳酸菌和醋酸菌生长比酵母缓慢,所以产酸相对较慢。
在开菲尔中,乙醇赋予了开菲尔独特的口感和风味,因此,酒精是评价开菲尔的一个重要指标。由表2可以看出,K和M酒精含量的变化是缓慢的,但是随着发酵循环的增加,酒精含量有明显的变化(p<0.05)。在前几个循环的发酵中,M中的酒精含量比K低,第七个循环后酒精含量达到稳定,并与K基本持平。这是因为酒精含量是由酵母菌决定的[23],酵母菌数量随着发酵循环数的增加而增加。另外,随着发酵的进行,微胶囊中酵母菌的活菌数不断增加,从第七个循环开始达到最大量并保持稳定。
除了酒精含量,蛋白质、糖和脂肪含量等因素都是衡量开菲尔品质的重要因素。由表2看出,两种发酵乳中蛋白质和糖的含量都是随着循环数的增加而减少(p<0.05),可能是菌种生长消耗所致。而脂肪含量基本不变(p>0.05),维持在3.7 g/L左右。
2.5微囊化发酵剂发酵乳和开菲尔的挥发性风味成分分析
表3为两种发酵乳的挥发性香气化合物及其相对百分含量。通过比较发现,两种发酵乳都检测出17种挥发性香气成分,而且含有比例基本一样。其中酒精和乙酸乙酯含量最高,酒精是酵母菌的直接代谢产物,而乙酸乙酯是酵母菌胞内酶的代谢产物。另外,对奶香风味产生重要影响的醛和羰基化合物,特别是乙偶姻和乙醛,相对含量也相差不大。研究发现,醇类物质、乙醛和乙偶姻是发酵乳中最重要的风味成分[24],K和M中主要的风味成分基本相同。
2.6抑菌实验结果分析
益生菌能够通过调节免疫、新陈代谢活动及抑制病菌生长等途径来抑制疾病的发生。而开菲尔中包含大量的益生菌,如酵母菌和乳酸菌等。氨苄青霉素、K、M在金黄色葡萄球菌和大肠杆菌平板抑菌圈直径大小分别为1.56 cm和1.85 cm、1.40 cm和1.25 cm、1.40 cm和1.20 cm。结果表明K和M对大肠杆菌和金黄色葡萄球菌都具有明显的抑制效果,这是由于乳酸菌能产酸和细菌素,酵母菌可以产乙醇等抑菌物质,此外,Rodrigues等报道了开菲尔中的胞外多糖有很强的抑菌作用[3]。无论是M还是K,与氨苄青霉素的抑菌效果对比都略有不足。其中K的抑菌效果略好,这可能是因为开菲尔中菌相更复杂且包含很多弱势菌,而本实验仅利用它的优势菌。结果显示微胶囊发酵剂的抑菌效果已经非常接近开菲尔粒,但还是有一定差距。
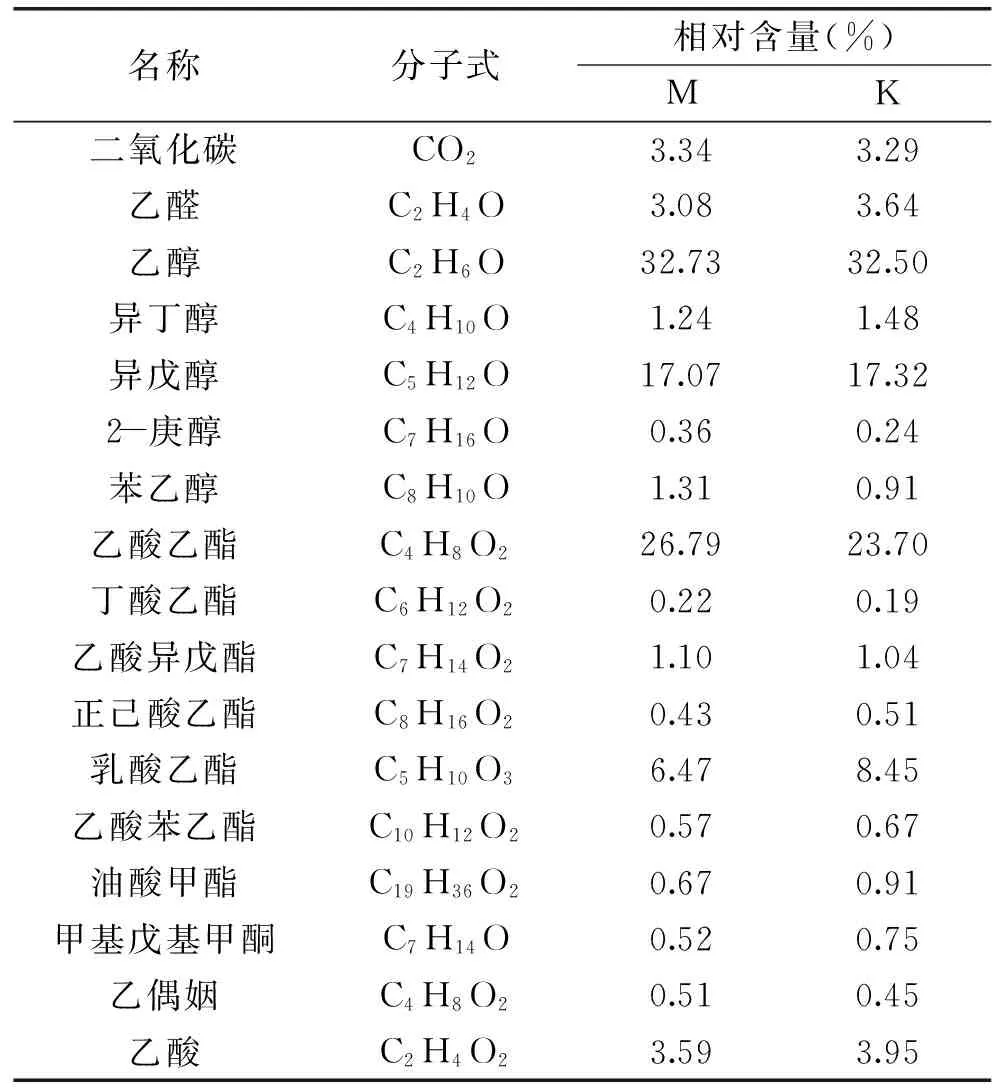
表3 两种发酵乳的挥发性成分比较Table 3 Volatile components of two fermented milk
3 结论
以开菲尔粒为菌种分离源,通过菌落形态学鉴定和分子生物学鉴定,确定了开菲尔粒中的优势菌种分别是酵母菌、乳酸菌和醋酸菌。其中酵母菌包括Kluyveromycesmarxianusstrain和Pichiakudriavzeviiclone,乳酸菌包括Lactobacilluspontisstrain NM129-2和Lactobacilluskefiristrain,醋酸菌包括Acetobacterlovaniensisstrain和Acetobactercibinongensisstrain。其中Acetobactercibinongensis在开菲尔粒中的报道主要集中于PCR-DGGE技术菌相分析过程中[25],而未见从开菲尔粒中分离鉴定得到该菌株的相关报道。
通过微囊化纯培养制成混合发酵剂与开菲尔原粒对比,在蛋白质、糖、脂肪、酒精、挥发性风味成分、抑菌等方面已经与传统开菲尔非常接近,但是在含量和效果等方面还未完全达到。可能需要通过进一步优化接种量和接种比例来获得风味更好的发酵乳。
[1]Otles S,Cagindi Oe. Kefir:A probiotic dairy-composition,nutritional and therapeutic aspects[J]. Pakistan Journal of Nutrition,2003,2(2):54-59.
[2]Sabir F,Beyatli Y,Cokmus C,et al. Assessment of potential probiotic properties oflactobacillusspp.,lactococcusspp.,andpediococcusspp. Strains isolated from kefir[J]. Journal of Food Science,2010,75(9):568-573.
[3]Rodrigues KL,Caputo LRG,Carvalho JCT,et al. Antimicrobial and healing activity of kefir and kefiran extract[J]. International journal of antimicrobial agents,2005,25(5):404-408.
[4]Shiomi M SK,Murofushi M. Antitumor activity in mice of orally administered polysaccharide from kefir grain[J]. Japanese journal of medical science & biology,1982,35(2):75-80.
[5]Vinderola G,Perdigón G,Duarte J,et al. Effects of the oral administration of the exopolysaccharide produced by lactobacillus kefiranofaciens on the gut mucosal immunity[J]. Cytokine,2006,36(5):254-260.
[6]Medrano M,Pérez PF,Abraham AG. Kefiran antagonizes cytopathic effects of bacillus cereus extracellular factors[J]. International journal of food microbiology,2008,122(1):1-7.
[7]Garrote GL,Abraham AG,De Antoni GL. Microbial interactions in kefir:A natural probiotic drink[J]. Biotechnology of Lactic Acid Bacteria:Novel Applications,2010:327-338.
[8]Garrote GL,Abraham AG,DE Antoni GL. Chemical and microbiological characterisation of kefir grains[J]. Journal of dairy research,2001,68(04):639-652.
[9]刘慧,李平兰,张永春,等. 开菲尔的生理功能,特性及其产品开发研究进展[J]. 食品科学,2005,26(5):252-255.
[10]曾友明,曾文兵,冯司亮,等. 开菲尔功能菌组的复合及发酵特性研究[J]. 中国乳品工业,2007,35(3):26-28.
[11]Zhou T,Li B,Peng C,et al. Assessment of the sequential simulated gastrointestinal tolerance of lactic acid bacteria from kefir grains by response surface methodology[J]. Journal of food science,2009,74(6):328-334.
[12]林晓珊,吴虹,杨汝德. 中华开菲尔共生菌的分离与鉴定[J]. 现代食品科技,2009,10:1233-1235.
[13]谷海瀛. 形态学检查方法的标准化及其在细菌鉴定中的作用[J]. 中华检验医学杂志,2006,29(10):951-953.
[14]Zhimin O,Xingyuan S,Hanbing S,et al. Synthesis of duloxetine intermediate(s)-3-chloro-1-(2-thienyl)-1-propanol with liquid-core immobilized candida pseudotropicalis 104[J]. Applied biochemistry and biotechnology,2012,168(8):2297-2308.
[15]Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical biochemistry. 1976,72(1):248-254.
[16]WANG L-m,XIA W-s. Determination of TPS by Improvement of Anthrone-sulfuric Acid Method[J]. Food Science. 2005,7:044.
[17]Heinrich C. Use of the Rose-Gottlieb method for rapid gravimetric fat determination with the Heraeus apparatus[J]. Deutsche Milchwirtschaft. 1970,21(20):797-798.
[18]Papapostolou H,Bosnea LA,Koutinas AA,et al. Fermentation efficiency of thermally dried kefir[J]. Bioresource technology. 2008,99(15):6949-6956.
[19]Jacobsen CN,Nielsen VR,Hayford A,et al. Screening of probiotic activities of forty-seven strains of lactobacillus spp. Byinvitrotechniques and evaluation of the colonization ability of five selected strains in humans[J]. Applied and Environmental Microbiology,1999,65(11):4949-4956.
[20]杨希娟,师俊玲,樊明涛. 西藏灵菇牛乳发酵液中的菌相与物质变化[J]. 中国食品学报,2007,7(4):42-46.
[21]Yu J,Ahmedna M,Goktepe I. Peanut protein concentrate:Production and functional properties as affected by processing[J].Food Chemistry,2007,103(1):121-129.
[22]包永华,董明盛. 液芯海藻酸钙包囊固定化技术[J]. 中国酿造,2008,21:14-17.
[23]Beshkova D,Simova E,Simov Z,et al. Pure cultures for making kefir[J]. Food Microbiology,2002,19(5):537-544.
[24]Ott A,Germond J-E,Chaintreau A. Vicinal diketone formation in yogurt:13c precursors and effect of branched-chain amino acids[J]. Journal of agricultural and food chemistry,2000,48(3):724-731.
[25]Gulitz A J. Analysis of the diversity of water kefir microbiota by culture-dependent and-independent approaches[D]. Universitätsbibliothek der TU München,2013.
Screening of main microorganism from Kefir Grain and analysis of femented milk using mixed microsapsule pure cultures
ZHONG Hao1,WANG Liang1,*,LIU Ke-ying1,GUO Ai-zhen1,HU Man1,LIU Peng-long2,QI Xiang-hui1,CAI Mei-hong1
(1.Jiangsu University,School of Food and Biological Engineering,Zhenjiang 212013,China;2. Xinjiang Ttianrun biotechnology co.,LTD,Urumqi 830088,China)
Kefir grain,as a complex system of microbial symbiosis,contains many useful microorganisms. The research focused on the main microbial composition of kefir grains and the preparation of a microbial starter culture. According to the colony forms and biological properties,the kefir grain samples were consisted of two strains of yeast,three strains of lactic acid bacteria(LAB)and two strains of acetic acid bacteria(AAB). After sequencing the 16S rDNA sequence of the seven strains,it can be concluded that the yeasts were identified asKluyveromycesmarxianusandPichiakudriavzevii,LAB wereLactobacilluspontisandLactobacilluskefiri,AAB wereAcetobacterlovaniensisandAcetobactercibinongensis. Further,the isolated strains were cultivated and microencapsulated. After the microcapsules were mixed and fermented in milk,the performance of the nutrition contents and volatile components and the property of antimicrobial activity were very similar to the original kefir grains.
Kefir grains;isolation;identification;mixed microsapsule pure cultures
2015-08-31
钟浩(1990-),男,硕士,主要从事开菲尔乳品的研究,E-mail:simba90@126.com。
王亮(1966-),男,博士,研究员,主要从事食品微生物方面的研究,E-mail:wangliang_2004wl@163.com。
新疆生产建设兵团工业及高新技术科技攻关与成果转化计划项目(2015AB032);江苏大学高级专业人才科研启动资金(12JDG069)。
TS252.54
A
1002-0306(2016)05-0148-07
10.13386/j.issn1002-0306.2016.05.020
