二甲双胍与2-脱氧-葡萄糖抑制三阴性乳腺癌细胞株的研究
2016-09-10王俊丽李斌琦王英条夏炎春
王俊丽,李斌琦,王英条,夏炎春,杨 峂
二甲双胍与2-脱氧-葡萄糖抑制三阴性乳腺癌细胞株的研究
王俊丽,李斌琦,王英条,夏炎春,杨 峂
目的 探讨二甲双胍和2-脱氧-葡萄糖协同抑制三阴性乳腺癌干细胞及CD44表达。方法 二甲双胍和2-脱氧-葡萄糖分别或联合与三阴性乳腺癌细胞株MDA-MB-231培养,用CCK8检测活细胞的比例,免疫荧光法联合流式细胞仪检测乳腺癌干细胞的比例和 CD44的表达。结果 二甲双胍和 2-脱氧-葡萄糖各自对 MDAMB-231细胞均有抑制作用,对其干细胞无选择性杀伤作用,对CD44的表达有明显抑制,呈时间依赖性;二甲双胍和2-脱氧-葡萄糖联合对乳癌干细胞无选择性杀伤作用,对CD44表达的抑制强于单药的作用。结论 二甲双胍和2-脱氧-葡萄糖单独或联合对三阴性乳腺癌干细胞无选择性杀伤,但是对CD44表达的有抑制作用。
二甲双胍;2-脱氧-葡萄糖;CD44;乳腺癌;肿瘤干细胞
三阴性乳腺癌预后差、生存期短,治疗失败的主要原因是化疗耐药,无法彻底杀灭潜在的微小转移灶。目前认为引起化疗耐药的主要原因是肿瘤组织中的干细胞对化疗不敏感。如果有药物能杀伤乳腺癌干细胞,将有效提高其疗效。常见体外对肿瘤干细胞有杀伤作用的药物包括二甲双胍、2-脱氧-葡萄糖、喹啉及甲硫达嗪等。上述药物对多种肿瘤均有杀伤作用,但同时也存在杀伤效率不高、耐药等问题。二甲双胍是传统的降糖药,2-脱氧-葡萄糖是一种抗病毒药物,相比常见的化疗药物,上述两种药物的毒副反应很低。本研究目的就是探讨是否可以用二甲双胍和2-脱氧-葡萄糖联合作用,更有效的杀伤肿瘤干细胞。现报道如下。
1 资料与方法
1.1 一般资料 乳腺癌细胞株 MDAMB-231购于湘雅医学中心细胞库,二甲双胍和2-脱氧-葡萄糖购于Sigma公司;CD44-FITC抗体和 CD44-Isotype抗体购于BD公司,CD24-APC抗体和CD24-Isotype抗体购于Ebio公司;FBS购于hyclone,DMEM培养基和L-15培养基购于GIBCO,CCK8试剂盒购于同仁化学。
1.2 方法
1.2.1 活细胞比例检测 收集对数生长期的MDA-MB-231细胞,接种96孔板,5×103/孔。分别给予梯度浓度的二甲双胍和2-脱氧-葡萄糖或联合给药,设空白组,作用24、48、72h,以CCK8方法检测。
1.2.2 CCK8检测 各组细胞换液,轻轻吸弃原培养基,加入100l培养基-C CK8混合液(90 l无血清培养基+10 l CCK8溶液),37℃避光孵育1 h。酶标仪450 nm读板,记录OD值,根据各组与空白对照组的比值,计算活细胞比率。
1.2.3 乳腺癌干细胞比例及其CD44表达强度的检测 收集对数生长期的MDAMB-231细胞,接种6孔板,1×105/孔。分别给予梯度浓度的二甲双胍和2-脱氧-葡萄糖,分别于24、48、72 h。收集各组细胞,PBS洗一次,1.5 ml EP管100l PBS重悬细胞,取4管,分别加入CD44抗体、CD44 Isotype抗体、CD24抗体及CD24 Isotype抗体(单染组和同型对照组),另准备一管细胞,不加入任何抗体(阴性对照组);各给药组均同时加入CD44抗体和CD24抗体(双染组)。4℃避光孵育30 min,PBS洗涤两遍,500 l PBS重悬细胞,上机FL-1(FITC通道)和FL-4(APC)通道检测。分别获得细胞CD44 和CD24的荧光强度。根据与对照组荧光强度的比值,计算出CD44的相对表达强度。联合给药组二甲双胍浓度为1mmol/L,2-脱氧-葡萄糖浓度为2mmol/L。
1.3 统计方法 采用SPSS18.0统计软件进行数据分析,计量资料以均数±标准差表示,采用单因素方差分析。<0.05为差异有统计学意义。
2 结果
2.1 二甲双胍和 2-脱氧-葡萄糖对MDA-MB-231细胞均有抑制作用,二甲双胍对乳腺癌细胞株抑制作用呈现时间依赖性,在72 h时出现浓度依赖性。2-脱氧-葡萄糖对乳腺癌细胞株的抑制作用随着浓度的增加而增加,与作用时间长短无明显关系。见表1~2。
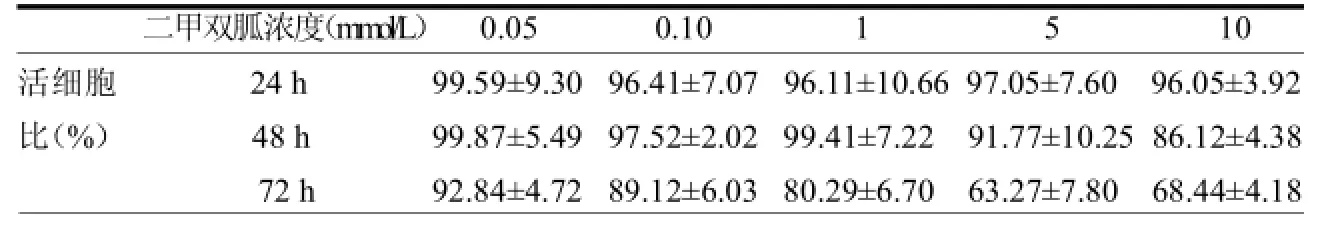
表1 二甲双胍对MDA-MB-231细胞抑制作用

表2 2-脱氧-葡萄糖对MDA-MB-231细胞抑制作用
2.2 二甲双胍和 2-脱氧-葡萄糖对MDA-MB-231干细胞的抑制作用,并非选择性性的杀伤CD44+CD24-的干细胞,两种药物没有降低乳腺癌干细胞的百分比,与对照组差异无统计学意义(>0.05)。见表3~4。

表3 二甲双胍对MDA-MB-231干细胞的影响
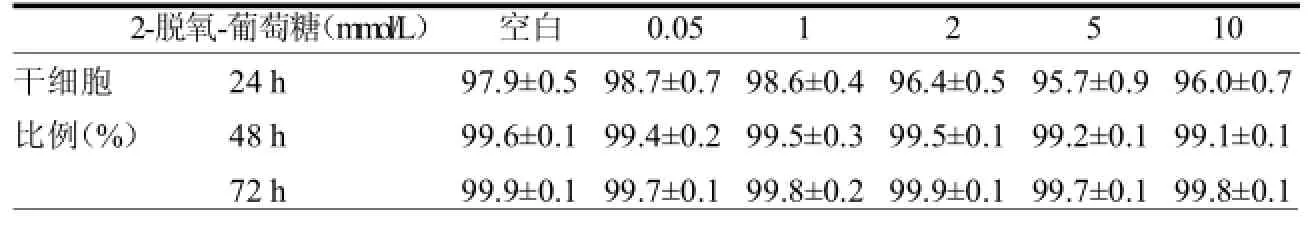
表4 2-脱氧-葡萄糖对MDA-MB-231干细胞的影响
2.3 二甲双胍和 2-脱氧-葡萄糖对MDA-MB-231干细胞的CD44表达有明显的抑制作用(以下CD44表达强度的结果均针对CD44+CD24-细胞群的记录),作用效果呈时间依赖性,与药物浓度相关性较小,72 h各浓度组与对照组差异有统计学意义(<0.05)。见表5~6。
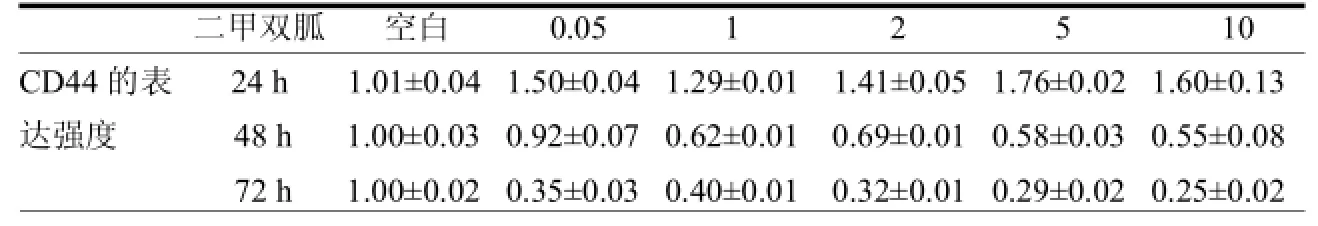
表5 二甲双胍对MDA-MB-231干细胞的CD44表达强度的抑制

表6 2-脱氧-葡萄糖对MDA-MB-231干细胞的CD44表达强度的抑制
2.4 二甲双胍联合 2-脱氧-葡萄糖对MDA-MB-231干细胞的抑制不明显,与对照组差异无统计学意义(>0.05);联合给药对CD44表达的抑制强于每个单药的效果,48、72h时不同浓度和对照差异均有统计学意义(均<0.05)。见表7~8。
3 讨论
寻找非细胞毒性药物来杀伤肿瘤细胞和影响肿瘤细胞的生物学功能是目前研究的热点[1]。研究发现二甲双胍和2-脱氧-葡萄糖对多种肿瘤细胞有杀伤作用。二甲双胍主要通过激活AMP激酶,抑制肿瘤细胞糖酵解所获得的能量;而2-脱氧-葡萄糖主要作用是耗竭细胞内的ATP,从而导致细胞死亡[2-3]。从作用机制上看,笔者提出两者联合使用会有协同效应[4]。
根据Hirsh等[5]的实验发现,二甲双胍可选择性的杀伤乳腺癌干细胞,而MDA-MB-231在所有乳腺癌细胞系中含干细胞比例是最高的[6],因此本文选择MDA-MB-231株作为实验对象。本研究发现,二甲双胍、2-脱氧-葡萄糖单独或联合并不能选择性的杀伤 MDAMB-231的乳腺癌干细胞;通过流式细胞仪观察到 CD44和 CD24抗体结合MDA-MB-231细胞后的荧光强度,发现二甲双胍或2-脱氧-葡萄糖作用细胞后,MDA-MB-231干细胞表面糖蛋白CD44表达的强度明显下降,而且呈时间依赖性。

表7 联合给药对MDA-MB-231干细胞的影响

表8 联合给药对MDA-MB-231干细胞CD44+表达强度的影响
查阅文献发现MDA-MB-231细胞株的干细胞比例差别很大,40%~90%[6-7],本实验MDA-MB-231细胞株的干细胞比例为99%,而Hirsch等[5]使用的MDAMB-231细胞株的干细胞比例为30%。相应的,两者CD44表达强度可能也会有差异。二甲双胍和2-脱氧-葡萄糖可能通过直接抑制CD44的表达而影响乳癌干细胞(CD44+CD24-)的比例。由于本实验采用的MDA-MB-231细胞株CD44表达过高,药物虽然抑制了CD44部分表达,但其抑制率不足以达到判断阳性或阴性的临界值,所以干细胞的比例未发生明显变化。而在某些CD44表达强度较弱的MDA-MB-231细胞株或者其它细胞株如MCF-7(CD44的表达强度约为MDA-MB-231细胞的1/4~1/10)[8],药物对CD44的抑制效果足以达到临界值,表现为干细胞比例降低。本实验设计考虑二甲双胍和2-脱氧-葡萄糖对乳腺癌细胞抑制有较强的协同作用,而试验结果表明两者的协同作用不如预期般显著[9]。上述两种药物实际的作用机制可能与文献报道有差异,需要进一步研究,比如:以往的研究认为二甲双胍和2-脱氧-葡萄糖是通过耗竭细胞内能量杀伤细胞,CD44可以受NF-B、HIF-1等调控[10-11],而本实验发现这两种药物抑制CD44表达,这些机制之间存在着何种联系,通过何种信号途径实现,均需要进一步实验探索。
CD44是一类重要的粘附分子,分布于细胞表面,在乳腺癌、胰腺癌、结肠癌等多种肿瘤表面均有表达,与肿瘤分裂增殖和转移有关。CD44在乳腺癌细胞的表达做为干细胞的重要标志,CD44+CD24-的细胞群被认为具有自我复制和克隆形成的功能,对多种化疗药物耐药,是肿瘤复发和转移的主要原因[12]。如果通过各种方法使该细胞亚群失去CD44的表达,其干细胞的特性也会随之消失[8,13]。因此CD44可能是逆转乳腺癌化疗耐药性的潜在靶点。
[1]Kangwan N, Park JM, Kim EH, et al. Chemoquiescence for ideal cancer treatment and prevention: where are we now?[J]. J Cancer Prev, 2014,19(2):89-96.
[2]Menendez JA, Oliveras-Ferraros C, CufíS, et al. Metformin is synthetically lethal with glucose withdrawal in cancer cells[J]. Cell Cycle, 2012,11(15):2782-2792.
[3]Wu Y, Sarkissyan M, Mcghee E, et al. Combined inhibition of glycolysis and AMPK induces synergistic breast cancer cell killing[J]. Breast Cancer Res Treat, 2015, 151(3):529-539.
[4]Ben Sahra I, Laurent K, Giuliano S, et al. Targeting cancer cell metabolism: the combination of metformin and 2-deoxyglucose induces p53-dependent apoptosis in prostate cancer cells[J]. Cancer Res, 2010,70(6):2465-2475.
[5]Hirsch HA, Iliopoulos D, Tsichlis PN, et al. Metformin selectively targets cancer stem cells, and acts together with chemotherapy to block tumor growth and prolong remission[J]. Cancer Res, 2009,69 (19):7507-7511.
[6]吕新全,Zhenhe Suo,马长路,等.CD44+/ CD24-细胞在乳腺癌组织及细胞系中的数量与分布[J].中华病理学杂志,2009,38 (7):441-444.
[7]Fillmore CM, Kuperwasser C. Human breast cancer cell lines contain stem-like cells that self-renew, give rise to pheno typically diverse progeny and survive chemotherapy[J]. Breast Cancer Res,2008,10(2): R25.
[8]Chang G, Wang J, Zhang H, et al. CD44 targets Na+/H+ exchanger1 to mediate MDA-MB-231 cells’metastasis via the regulation of ERK1/2[J]. Br J Cancer, 2014,110(4): 916-927.
[9]Cheong JH, Park ES, Liang J, et al. Dual inhibition of Tumor Energy Pathway by 2-deoxy glucose and metformin is effective against a broad spectrum of preclinical cancer models[J]. Mol Cancer Ther, 2011, 10(12):2350-2362.
[10]Smith SM, Lyu YL, Cai L. NF- B affects proliferation and invasiveness of breast cancer cells byregulating CD44 expression[J]. PLoS One, 2014, 9(9): e106966.
[11]Krishnamachary B, Penet MF, Nimmagadda S, et al. Hypoxia regulates CD44 and Its Variant Isoforms through HIF-1 in triple negative breast cancer[J]. PLoS One, 2012,7(8): e44078.
[12]Jaggupilli A, Elkord E. Significance of CD44 and CD24 as cancer stem cell markers: an enduring ambiguity[J]. Clin Dev Immunol, 2012,2012: 708036.
[13]Iliopoulos D, Hirsch HA, Wang G, et al. Inducible formation of breast cancer stem cells and their dynamic equilibrium with non-stem cancer cells via IL6 secretion[J]. Proc Natl Acad Sci USA, 2011,108(4): 1397-1402
10.3969/j.issn.1671-0800.2016.06.040
R737.9
A
1671-0800(2016)06-0772-03
2015-12-26
(本文编辑:陈志翔)
宁波市自然科学基金(2013A610224)
315040宁波,中国人民解放军第113医院(王俊丽、李斌琦、王英条、夏炎春);宁波市第二医院(杨峂)
杨峂,Email:tongyang1@ 163.com
