曲妥珠单抗与蒽环类药物同步及序贯应用于乳腺癌辅助治疗的安全性和近期疗效比较
2016-09-10杨彦楠
任 鹏,杨彦楠
曲妥珠单抗与蒽环类药物同步及序贯应用于乳腺癌辅助治疗的安全性和近期疗效比较
任 鹏,杨彦楠
目的 比较曲妥珠单抗与蒽环类药物同步及序贯应用于乳腺癌辅助治疗的安全性和近期疗效。方法 将124例乳腺癌患者分为同步组及序贯组,各62例。两组均在手术后进行辅助化疗,同步组采用曲妥珠单抗联合蒽环类药物同步化疗,序贯组采用曲妥珠单抗联合蒽环类药物序贯化疗,随访并记录两组患者左室射血分数(LVEF)水平变化、心脏毒性事件及肿瘤复发转移发生情况。结果 两组治疗后3、6、12及24个月的LVEF水平均未发生明显变化(均>0.05);且两组间差异均无统计学意义(均>0.05)。同步组心脏毒性事件发生率、复发率、转阴率与序贯组差异均无统计学意义(均>0.05),两组均无死亡病例出现。结论 曲妥珠单抗与蒽环类药物同步应用于乳腺癌辅助化疗,未增加心脏毒性事件的风险。
乳腺肿瘤;药物疗法,联合;曲妥珠单抗;蒽环类药物
表皮生长因子受体2(HER-2)过度表达的乳腺癌患者存在恶性度高、进展快及生存期短等特点,其治疗一直是妇科医师关注的焦点[1]。曲妥珠单抗是一种靶向型化学药物,临床广泛用于HER-2阳性乳腺癌的治疗。研究表明,曲妥珠单抗联合蒽环类药物序贯辅助化疗能有效提高乳腺癌患者的生存期[2]。但关于曲妥珠单抗联合蒽环类药物同步化疗的安全性及疗效尚存在一定的争议。本研究拟比较乳腺癌患者行曲妥珠单抗联合蒽环类药物同步辅助化疗治疗与序贯化疗的效果,报道如下。
1 资料与方法
1.1 一般资料 收集2011年3月至2013年12月浙江省嘉兴市妇幼保健院收治的乳腺癌患者124例,均经病理检查确诊。纳入标准:(1)卡氏功能状态(KPS)评分≥80分;(2)确诊为浸润癌,肿瘤直径≥1.0 cm,腋窝淋巴结阳性;(3)HER-2荧光原位杂交呈阳性;(4)无肿瘤远处转移明显指征;(5)血、尿常规基本正常;(6)左室射血分数(LVEF)≥55%;(7)单侧乳腺癌;(8)患者同意知情。排除标准:(1)既往有化疗治疗史或乳腺癌局部治疗史;(2)有蒽环类药物、曲妥珠单抗治疗史;(3)妊娠、哺乳妇女;(4)依从性差,精神病患者;(5)冠心病、心律失常、心肌梗塞、心绞痛、高血压及糖尿病等疾病患者;(6)过敏体质者。
按照治疗方式的不同将124例患者分为同步组和序贯组,124例患者均行乳腺癌改良根治术或保乳术治疗,同步组术后采用曲妥珠单抗联合蒽环类药物同步辅助化疗,序贯组采用曲妥珠单抗联合蒽环类药物序贯辅助化疗。
1.2 治疗方法 根据美国国家综合癌症乳腺癌治疗指南中建议[3],均予蒽环类药物,根据患者病情及主治医师建议,可采用周疗、2周及3周的化疗方案,必要时可联合紫衫类药物。
同步组:蒽环类药物单独运用时,采用60mg/m2的吡柔比星(浙江海正药业股份有限公司,批准文号:国药准字H20045983,规格:10mg)、90~100mg/m2的表阿霉素(辉瑞制药无锡有限公司,批准文号:国药准字H20000496,规格:10mg);联合紫衫类药物时,采用50 mg/m2的吡柔比星、75 mg/m2的表阿霉素。同步运用曲妥珠单抗(罗氏药业,批准文号:国药准字J20110020,规格:440 mg),初次剂量8mg/kg,然后将剂量改为6 mg/kg,采用3周化疗方案,持续治疗1年。
序贯组:蒽环类药物单独使用或联合紫衫类药物时,采用60 mg/m2的吡柔比星、90~100 mg/m2的表阿霉素。在蒽环类药物下一个疗程开始时,曲妥珠单抗首次给药,治疗方案与同步组相同。
1.3 毒性标准 采用美国癌症研究院通用的毒性标准(NCI-CTC)[4],分为I级,无症状LVEF下降10%~20%;II级,无症状LVEF下降≥20%;III级,出现充血性心功能衰竭。
1.4 观察指标 (1)记录两组患者临床资料,包括年龄、肿瘤直径、肿瘤分期、肿瘤类型、手术方式、联合放疗、联合内分泌治疗、腋窝转移淋巴结、雌激素受体阳性、孕激素受体阳性、增殖指数及化疗方案等;(2)采用超声心动图监测并记录患者治疗前,治疗后3、6、12及24个月LVEF水平的变化;(3)随访24个月,记录心脏毒性事件及复发、远处转移、死亡的发生情况。
1.5 统计方法 数据采用SPSS18.0软件分析,计量资料采用均数±标准差表示,多组间比较采用检验,组间比较采用 检验;计数资料采用2检验;等级资料行秩和检验。<0.05为差异有统计学意义。
2 结果
2.1 两组临床资料比较 两组年龄、肿瘤直径、肿瘤分期、肿瘤类型、手术方式、联合放疗、联合内分泌治疗、腋窝转移淋巴结、雌激素受体阳性、孕激素受体阳性、增殖指数及化疗方案差异均无统计学意义(均>0.05)。见表1。
2.2 LVEF变化 两组治疗后3、6、12、24个月的LVEF水平均未发生明显变化(均>0.05);且两组间差异均无统计学意义(均>0.05)。见表2。
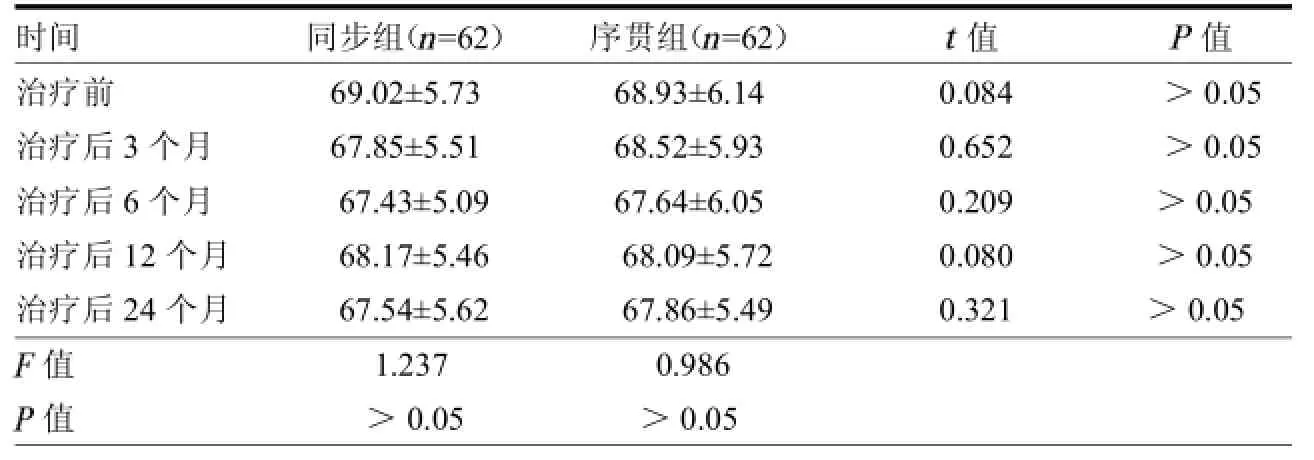
表2 两组LVEF水平变化 %
2.3 心脏毒性事件及复发转移情况同步组出现肿瘤转移2例,其中肝转移1例,肺转移1例;序贯组出现肿瘤转移6例,其中肺转移3例,肝转移2例,骨转移1例。同步组心脏毒性事件发生率(11.29%,1级7例,7/62)、复发率(3.23%,2/62)、转阴率(3.23%,2/62)与序贯组([16.13%,1级9例,2级1例,10/62)(、1.61%,1/62)(、9.68%,3/62)]比较,差异均无统计学意义(2=0.614、0.342、2.209,﹠gt;0.05);两组均无死亡病例出现。
3 讨论
早期乳腺癌临床最常用的治疗方法为外科手术,虽取得了一定的临床疗效,但术后常出现远处转移,导致患者的生存期降低[5]。随着乳腺癌是全身性疾病的认识不断的加深,化疗及内分泌治疗在临床的运用价值逐步提升。HER-2主要参与上皮细胞增殖、分化等过程,其过度表达可使肿瘤恶化程度加重,病程加快,容易导致患者对放疗或内分泌治疗敏感度下降,同时对化疗产生耐药性,增加了治疗的难度[6]。病理研究表明,乳腺癌患者 HER-2过度表达可使拓扑异构酶2A共扩增。而拓扑异构酶2A的基因是蒽环类药物主要靶点之一,因此HER-2过度表达的乳腺癌患者对蒽环类药物敏感性较好[7]。蒽环类药物主要的心脏毒性机理为诱导心肌细胞产生氧化应激,使线粒体及肌浆网肿胀,导致心肌细胞凋亡或坏死。该毒性受到心肌细胞中蒽环类血药浓度的影响,当阿霉素浓度达到550 mg/m2时,出现有症状的心脏毒性事件的发生率为25%。蒽环类药物引起的心脏毒性作用表现为急性或亚急性、慢性或迟发性心脏毒性事件。通常急性心脏毒性事件临床表现为无症状心电图异常,患者服药数小时后症状可自行缓解,但此异常可预示预后的心脏毒性事件。而慢性心脏毒性事件常在化疗后数月后才表现为充血性心力衰竭,其中最主要的症状为LVEF下降[8]。
曲妥珠单抗是以 HER-2为靶点的治疗药物,对HER-2过度表达具有明显的抑制作用,其作用机制了概括为:特异性与HER-2结合,阻断细胞信号传递,抑制上皮细胞增殖;促进HER-2受体降解;通过抗体依赖的细胞介导的细胞毒性作用,提高化疗的细胞毒性,增强免疫细胞攻击力,促进消除肿瘤细胞;抑制血管生长因子活性,缓解肿瘤血管组织生长[9]。HER-2受体不仅在肿瘤细胞中表达,还在心肌细胞作为神经调节蛋白受体表达,神经调节蛋白受体对心肌细胞具有保护作用。故使用曲妥珠单抗时,一方面抑制HER-2受体在肿瘤细胞中过度表达,一方面还抑制了其对心肌的保护作用,导致心肌细胞损伤,增加了心脏事件发生的风险[10]。
曲妥珠单抗的心脏毒性主要表现为无症状LVEF下降直至心力衰竭。有研究结果显示,曲妥珠单抗治疗乳腺癌的随机对照实验中,出现无症状LVEF下降的发生率为5%~18%,出现心力衰竭的发生率为0.5%~3.0%,但无心源性死亡病例[11]。本研究结果显示,124例患者出现无症状 LEVF下降的发生率为11.11%(16/142),无心力衰竭及死亡病例,与上述报道结果基本相似。结果提示,曲妥珠单抗与蒽环类药物同步使用未增加心脏不良事件的风险。蒽环类药物化疗造成的心脏毒性事件主要表现为NCICTCI级,属于剂量依赖性损伤,常不可逆,并且化疗停止后其毒性损伤依然存在。这可能就是序贯组心脏毒性事件与同步组的发生率无明显差异的主要原因。而曲妥珠单抗化疗造成的心脏毒性事件主要表现为NCI-CTC II级,属于不依赖剂量型损伤,通常可逆,药物停用后,心脏毒性可逆转[12]。
许多研究表明,曲妥珠单抗辅助化疗乳腺癌可提高患者无病生存率[13]。有报道结果显示,曲妥珠单抗同步化疗的疗效优于序贯治疗[14]。本研究结果显示,同步组出现复发及转移的发生率低于序贯转移,但差异无统计学意义,两组均无死亡病例出现。结果提示两组同步过程中可能存在协同作用,有助于提高疗效。由于本研究样本量有限,且随访时间较短,现无法确定两者是否存在协同作用。临床还需扩大样本量及延长随访时间,进一步研究探讨。
[1]谢奕彪,边莉,王涛,等.曲妥珠单抗联合蒽环类及紫杉类方案在乳腺癌新辅助化疗中安全性的观察和分析[J].中国癌症杂志,2012,22(5):396-398.
[2]陈道宝,陈波,杨红健,等.蒽环类药物对乳腺癌患者血清ER、VEGF-C、VEGFR-3 及E-cadherin影响研究[J].中国生化药物杂志,2015,8(6):137-139.
[3]沈松杰,徐颖,孙强,等.曲妥珠单抗联合蒽环类药物同步应用于乳腺癌的辅助治疗[J].中华肿瘤杂志,2014,36(2):132-136.
[4]Liu P, Cai Z, Kang JW, et al. Intracellular routing in breast cancer cells of streptavidin-conjugated trastuzumab fab fragments linked to biotinylated doxorubicin-fun-ctionalized metal chelating polymers [J]. Biomacromolecules, 2014, 15(3): 715-725.
[5]宋金洁,王涛,边莉,等.曲妥珠单抗联合蒽环类药物应用于Her-2阳性乳腺癌的新辅助治疗初步临床研究[J].实用肿瘤学杂志,2013,27(2):97-100.
[6]杨桦.蒽环类药物耐药乳腺癌细胞中microRNA差异表达分析[J].重庆医科大学学报,2012,37(1):56-58.
[7]叶新青,蒋奕,刘鹏,等.乳腺癌蒽环类药物化疗疗效与TOPOⅡ 、HER-2的关系[J].诊断病理学杂志,2015,22(1):38-40,44.
[8]Lang I, Bell R, Feng F Y, et al. Trastuzumab retreatment after relapse on adjuvant trastuzumab therapy for human epidermal growth factor receptor 2-positive breast cancer: final results of the Retreatment after Herceptin Adjuvant Trial[J]. Clinical Oncology, 2014, 26(2): 81-89.
[9]刘君,杨艳芳,顾林,等.曲妥珠单抗在HER-2阳性乳腺癌患者新辅助治疗中的应用研究进展[J].中国肿瘤临床,2014,9(16):1065-1068.
[10]张聚良,姚青,陈江浩,等.曲妥珠单抗对HER-2阳性早期乳腺癌外周血循环肿瘤细胞的影响[J].现代肿瘤医学,2013,21(2):279-281.
[11]李伟,潘燕,李学军,等.HER2阳性乳腺癌治疗药物曲妥珠单抗耐药机制及新一代靶向药物研究进展[J].中国临床药理学杂志,2014,30(1):48-51.
[12]张钢龄,张培礼,朱敬军,等.紫杉醇联合卡铂单周新辅助化疗加曲妥珠单抗在HER2阳性乳腺癌的探讨[J].中国中西医结合外科杂志,2015,21(5):463-466.
[13]徐金明,黎可,陈轩,等.曲妥珠单抗对HER2阳性乳腺癌患者术后辅助治疗的临床观察[J].重庆医学,2013,42(9):1025-1026.
[14]殷科,曹永晋.曲妥珠单抗新辅助化疗表皮生长因子受体2阳性乳腺癌的临床疗效及安全性评价[J].中国临床药理学杂志,2015,14(9):725-727.
10.3969/j.issn.1671-0800.2016.06.037
R737.9
A
1671-0800(2016)06-0766-03
2015-07-02
(本文编辑:钟美春)
314000浙江省嘉兴,嘉兴市妇幼保健院(任鹏);武警浙江省总队嘉兴医院(杨彦楠)
任鹏,Email:rpyyn@126.com
