响应面法优化水提地瓜藤中总黄酮工艺
2016-09-09徐君飞彭太兵符秋霞郭姝琼刘喜情民族药用植物资源研究与利用湖南省重点实验室怀化学院生物与食品工程学院湖南怀化418008
徐君飞,彭太兵,符秋霞,郭姝琼,刘喜情(民族药用植物资源研究与利用湖南省重点实验室,怀化学院生物与食品工程学院,湖南怀化418008)
响应面法优化水提地瓜藤中总黄酮工艺
徐君飞,彭太兵,符秋霞,郭姝琼,刘喜情
(民族药用植物资源研究与利用湖南省重点实验室,怀化学院生物与食品工程学院,湖南怀化418008)
利用响应面法优化水提地瓜藤中总黄酮工艺条件,提高总黄酮得率。在单因素试验、Plackett-Burman试验和最陡爬坡试验的基础上,以总黄酮提取量为响应值,利用响应面法研究各因素及其交互作用对地瓜藤中总黄酮提取量的影响,优选提取工艺。水提地瓜藤中总黄酮最佳工艺条件为:料液比1∶50(g/mL),浸提前浸泡50 min,60℃,浸提50 min,在此工艺条件下,地瓜藤中总黄酮的提取量为25.62mg/g。
地瓜藤;总黄酮;水提;响应面法
地瓜藤(Ficus Tikoua Bur.)系桑科榕属植物地瓜的全草,又称霜坡虎、爬地牛奶、钻地龙,味苦、性寒,主要分布于广西、贵州、湖南等地,为苗族常用药材,含有丰富的氨基酸、矿物质、黄酮类化合物,具有清热利湿、活血通络、解毒消肿等作用[1]。
黄酮(flavonoids)是一类具有2-苯基色原酮结构化合物,广泛存在于植物体内,是许多食品和中药材的有效成分,有抗菌、抗病毒、降糖、降血脂、免疫调节等作用[2-4]。
在传统应用过程中,热水是地瓜藤中黄酮提取的最佳溶剂,具有操作简便、成本低廉的优势,作者首次采用非线性数学模型拟合的方式,对水提地瓜藤中总黄酮的工艺条件进行优化,旨在为其试验研究和工业应用提供参考和依据。
1 材料与方法
1.1材料与仪器
地瓜藤:种植于怀化学院生物园,干燥至恒重,粉碎备用;芦丁(色谱纯):北京德威钠生物技术有限公司;其它药品均为分析纯。
FW100高速万能粉碎机:天津市泰斯特仪器有限公司;5804R高速冷冻离心机:Eppendorf公司;UV-2450紫外可见分光光度计:日本岛津公司。
1.2方法
1.2.1地瓜藤中总黄酮提取[5]
精确称取2.00 g地瓜藤粉于100 mL烧杯,加入60 mL蒸馏水,室温搅拌浸泡30 min,升温至70℃搅拌浸提30 min,冷却,10 000 r/min离心3 min,收集滤液于100 mL容量瓶,加蒸馏水稀释至刻度,得样品液。
1.2.2单因素试验
采用单因素试验,依次优化料液比、浸提前浸泡时间、浸提温度、浸提时间等参数[6-7]。
1.2.3Plackett-Burman(PB)试验[8]
在单因素试验基础上,以总黄酮提取量为响应值,采用Design-Expert 8.0.6[9]进行二级水平(低水平“-1”,高水平“1”)PB试验[10]优化料液比(A)、浸提前浸泡时间(B)、浸提温度(C)、浸提时间(D)、浸提次数(E)5个因素,筛选出对试验结果影响显著的因素[11]。PB试验因素水平编码见表1。
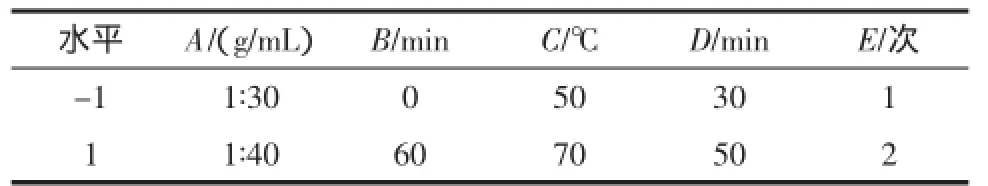
表1 PB试验因素水平编码Table 1 Range and factors of PB design
1.2.4最陡爬坡试验
PB试验通常只能分析各因素对试验结果影响的大小,而不能确定最优点所在的区域[12],因此根据PB试验结果,采用最陡爬坡试验来寻找料液比(A),浸提前浸泡时间(B),浸提时间(D)的最优点所在区域。
1.2.5中心组合设计(Central Composite Design,CCD)试验
CCD试验可用来评价试验指标与各因素之间一阶、二阶或交互作用的非线性关系[13]。在单因素试验、PB试验、最陡爬坡试验的基础上,选取料液比(A),浸提前浸泡时间(B),浸提时间(D)3个对地瓜藤中总黄酮提取量影响显著的因素,采用Design-Expert 8.0.6进行三因素五水平CCD试验设计,试验因素水平编码见表2。
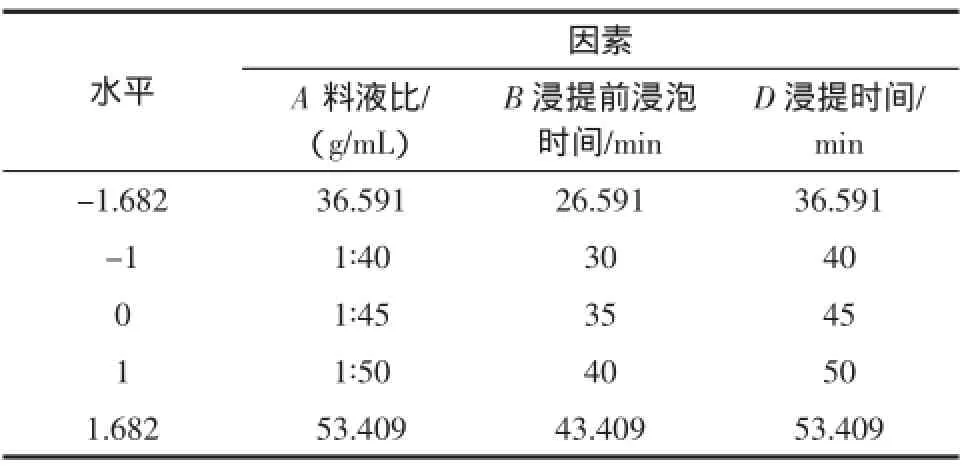
表2 CCD试验设计因素水平编码Table 2 Range and factors of CCD
1.3分析检测方法
采用分光光度法绘制芦丁标准曲线。以芦丁质量浓度(c,μg/mL)为横坐标,吸光度A为纵坐标,绘制标准曲线并建立回归方程,A=4.582 9c-0.012 5,R2= 0.999 1。
2 结果与分析
2.1单因素试验
2.1.1浸提温度对总黄酮提取量的影响
按照方法1.2.1,其它因素条件不变,考察不同浸提温度对提取量的影响,结果见图1。
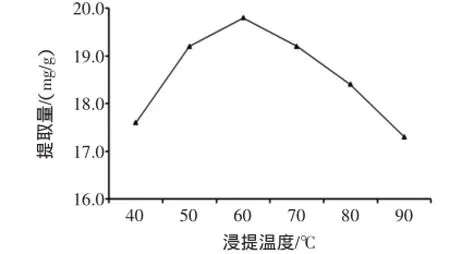
图1 浸提温度对总黄酮提取量的影响Fig.1 Fffect of extraction temperature on extraction yield of total flavonoids
由图1可知,温度由40℃升高至60℃,总黄酮提取量不断增大,当温度为60℃时,总黄酮提取量最大,达19.8 mg/g;继续升温,提取量不升反而快速下降,这可能是由于浸提温度过高,影响黄酮的稳定性,使其受热分解,且随着浸提温度的升高,杂质溶出量加大,增加后续目标物质纯化的难度[14]。因此,选择60℃作为后续试验的参考值。
2.1.2料液比对总黄酮提取量的影响
按照方法1.2.1,其它因素条件不变,考察不同料液比对提取量的影响,结果见图2。

图2 料液比对总黄酮提取量的影响Fig.2 Effect of liquid-solid ratio on extraction yield of total flavonoids
由图2可知,总黄酮提取量随料液比增大而增大,但当料液比超过1∶35(g/mL),总黄酮的提取量增长缓慢,这可能是由于地瓜藤在料液比为1∶35(g/mL)时,总黄酮的溶出量已趋于饱和,且过高的液相浓度会提高生产成本和后续浓缩难度[15]。因此,选用料液比1∶35(g/mL)作为后续试验的参考值。
2.1.3浸提前浸泡时间对总黄酮提取量的影响
按照方法1.2.1,其它因素条件不变,考察浸提前浸泡不同时间对提取量的影响,结果见图3。
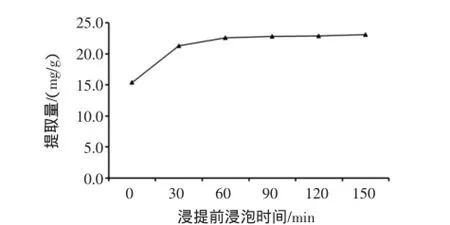
图3 浸提前浸泡时间对总黄酮提取率的影响Fig.3 Effect of soak time before extract on extraction yield of total flavonoids
由图3可知,总黄酮提取量随浸提前浸泡时间的延长而增大,但当浸泡时间超过30 min,总黄酮的提取量增长缓慢。这可能是由于地瓜藤在室温浸泡30 min时,总黄酮的溶出量趋于饱和[16],且延长浸泡时间,影响提取的时效性,因此,选用浸提前浸泡30 min作为后续试验的参考值。
2.1.4浸提时间对总黄酮提取量的影响
按照方法1.2.1,其它因素条件不变,考察不同浸提时间对提取量的影响,结果见图4。
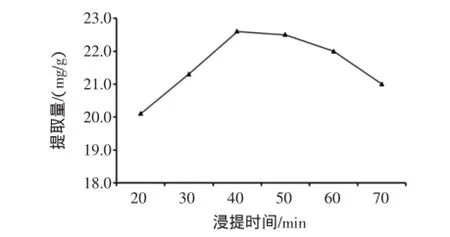
图4 浸提时间对总黄酮提取量的影响Fig.4 Fffect of extract time on extraction yield of total flavonoids
由图4可知,浸提时间由20 min延长至40 min,总黄酮的提取量不断增大,当浸提时间为40 min时,总黄酮的提取量达到最大,为22.6 mg/g,继续延长浸提时间,提取量不升反而快速减小,这可能是由于总黄酮在长时间高温条件下结构破坏、分解,且长时间高温浸提耗能大,杂质溶出量大[17],因此,选用浸提40 min作为后续试验的参考值。
2.2PB试验
按照PB试验设计,共进行12次试验,其中6个空白因素[18],每个试验号重复3次,取均值,试验方案及结果见表3。

表3 PB试验设计及响应值Table 3 PB test design and result
用Minitab l7[19]对表3中结果进行回归模型方差分析,结果见表4。
由表4可知,此次试验所得到的回归拟合方程显著(模型项P<0.05),具有统计学意义。R2=0.996,R2(调整)=0.993,说明变异可以用模型来解释。回归方程系数显著性检验见表5。
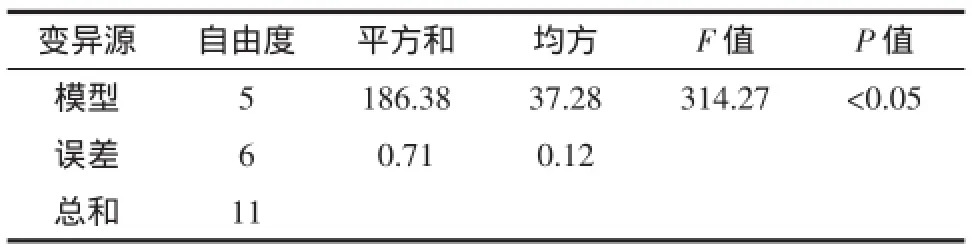
表4 回归模型方差分析Table 4 Analysis of variance of regression equation
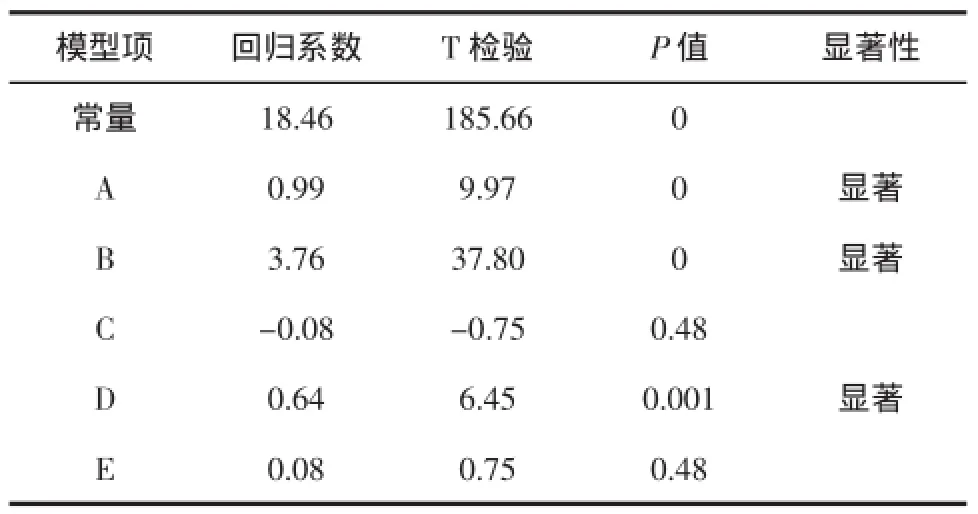
表5 偏回归系数及显著性检验表Table 5 Partial regression coefficients and significance test
由表5可以看出,回归得到多元一次方程为Y= 18.46+0.99A+3.76B-0.08C+0.64D+0.08E,且影响提取量的主要因素为料液比(A)、提取前浸泡时间(B)、提取时间(D)。
2.3最陡爬坡试验
根据PB试验,对A、B、D三因素进行最陡爬坡试验,以试验值的变化方向为爬坡方向,根据各因素效应值与比例来确定变化步长[20]。根据表5中因素估计系数,A、B、D三因素皆为正效应,变化值依次增大。最陡爬坡试验设计和结果如表6。

表6 最陡爬坡试验设计及结果Table 6 Experimental design and results of steepest ascent path
从表6可知,随着爬坡的进行,Y值增加,在处理4处即达到最高点,之后又开始下降,说明在该点对应的条件值时,总黄酮提取量接近了最优点,因此选择这一点作为中心组合设计的中心点。
2.4CCD试验
2.4.1CCD试验设计及结果
选取A、B、D三因素,做三因素五水平响应面分析,共设计20个试验点,其中,6个中心点(以最陡爬坡试验的最优值为中心点[21]),14个析因点,设计方案及结果见表7。

表7 CCD试验设计方案及响应值Table 7 Experiment design and result of CCD
2.4.2回归模型方差分析
利用Design expert 8.0.6对表7数据进行回归拟合,得回归方程:Y=24.30+0.43A+1.05B+0.50D-0.075AB+0.075AD+0.075BD-0.11A2-0.29B2-0.29D2。该模型系数显著性检验见表8所示,模型的方差分析结果如表9所示。

表8 回归系数显著性检验表Table 8 Significance test table of regression coefficient

表9 回归方程方差分析Table 9 Analysis of variance of regression equation
由表8可知,在一次项、二次项中,料液比(A)、浸提前浸泡时间(B)、浸提时间(D)对总黄酮的提取量的影响都达到了显著水平。
从表9中回归方程的方差分析可知,F=134.76>F0.01(9,5),相应的概率值P<0.000 1,该方程模型达到极其显著。失拟性检验分析得失拟不显著,表明该回归方程无失拟因素存在,回归模型与实测值能较好地拟合。通过对试验模型可信分析,得到相关系数R2为0.935 0,说明模型可以解释93.5%试验所得总黄酮含量的变化,表明方程拟合较好。校正后R2为0.984 5,表明总黄酮提取量98.45%的变异分布在方程中,其总变异中仅有1.55%不能由该模型解释。总黄酮提取量(Y)的变异系数较低(0.58),表示试验的精确度高,试验可靠性强,试验操作可信。综上所述,回归方程给总黄酮的提取提供了一个合适的模型。
2.4.3响应曲面的拟合以及最优条件的确定
图5~图7是由多元二次回归方程所作的各因素之间两两相互作用对响应值的影响所得到的响应面图及等高线图。
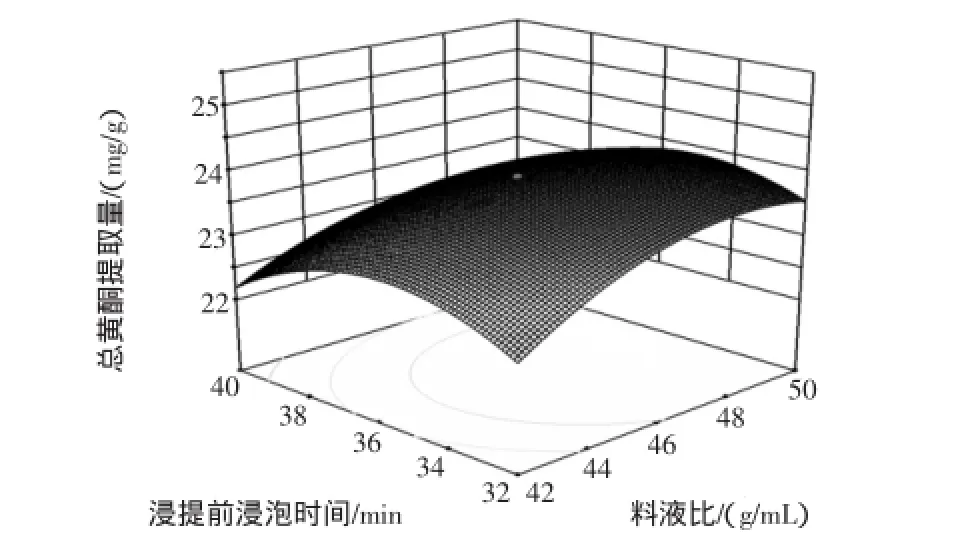
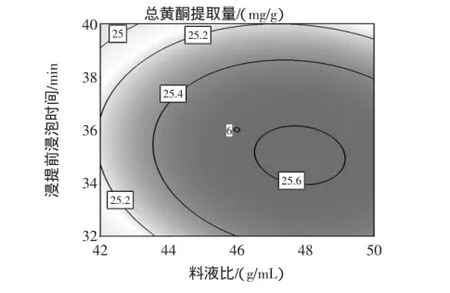
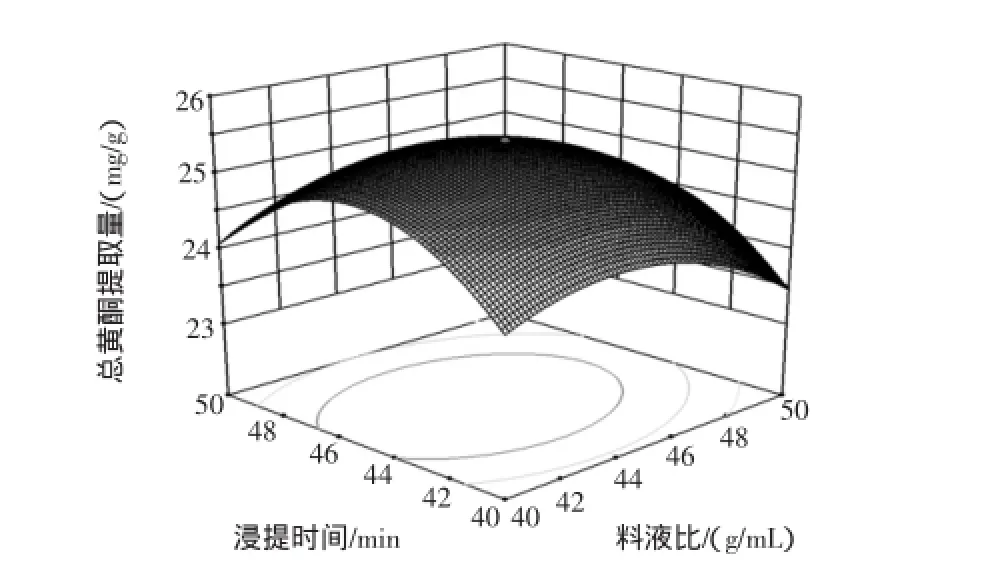

图6 Y=f(A,D)的响应面图和等高线图Fig.6 Response surface and contours of Y=f(A,D)


图7 Y=f(B,D)的响应面图和等高线图Fig.7 Response surface and contours of Y=f(B,D)
由此可见,响应值随料液比(A)、浸提前浸泡时间(B)、浸提时间(D)的增大呈先增后降的趋势,说明3个因素在所选范围内能产生较佳的响应值。
2.5最佳工艺参数及验证试验
通过Design expert 8.0.6优化的工艺条件为:料液比为1∶50(g/mL),浸提前浸泡时间50 min,浸提温度60℃,浸提时间50 min,浸提次数1次,此时总黄酮的理论提取量为25.66 mg/g。为检验响应面法优化结果的可靠性,采用上述优化条件提取地瓜藤中总黄酮,进行3次平行试验,结果表明,在此条件下,地瓜藤中总黄酮的平均提取量为25.62 mg/g,与预测值相符,说明此方程与实际情况拟合良好,因此基于响应面法分析所得的优化提取工艺参数准确可靠,具有实际参考价值。
3 结论
通过单因素试验、PB试验、最陡爬坡试验、CCD试验对水提地瓜藤中总黄酮工艺条件进行优化,得出最佳提取工艺条件为:料液比为1∶50(g/mL),浸提前浸泡50 min,浸提温度60℃,浸提50 min,浸提1次,在此工艺条件下,总黄酮提取量为25.62 mg/g。
地瓜藤的开发进度缓慢,已经造成了大量资源浪费,对于其中活性成分的深入研究,必定为地瓜藤的开发研究提取基础理论数据和参考依据。地瓜藤的广泛开发应用,前景广阔,可大大推动地方经济发展,产生更大的经济效益与社会效益。
[1]郭良君,谭兴起,郑巍,等.地瓜藤化学成分研究[J].中草药,2011,42(9):1709-1711
[2]Bi W,Tian M,Row KH.Evaluation of alcohol-based deep eutectic solvent in extraction and determination of flavonoids with response surface methodology optimization[J].J Chromatogr A,2013,1285(4):22-30
[3]Liu C,Qin K,Qi Y,et al.Optimization of ultrasonic extraction of total flavonoids from Tussilago farfara L.using response surface methodology[J].Pharmazie,2014,69(4):311-315
[4]曹春艳.响应面法优化银杏叶黄酮提取工艺[J].中国食品学报,2014(4):78-86
[5]陈瑛,孙兴力,王文渊.红薯叶中黄酮类化合物的超临界提取研究[J].广州化工,2011,39(6):82-84
[6]Tang B,Lee YJ,Lee YR,et al.Examination of 1-methylimidazole series ionic liquids in the extraction of flavonoids from Chamaecyparis obtuse leaves using a response surface methodology[J].J Chromatogr B Analyt Technol Biomed Life Sci,2013,933(8):8-14
[7]杜娟,崔瑞峰.红薯茎叶中黄酮类化合物的提取工艺[J].食品工程,2013(3):21-23
[8]顾英,韩凤丽,王洪洋.响应面法优化红薯叶类黄酮提取工艺的研究[J].食品工业科技,2012,33(3):286-289
[9]陈况况,帕塔尔,尼牙孜,等.响应面法优化水芹黄酮提取工艺及其成分研究[J].中国食品学报,2014(11):83-89
[10]Ma F,Zhao Y,Gong X,et al.Optimization of quercitrin and total flavonoids extraction from Herba Polygoni Capitati by response surface methodology[J].Pharmacogn Mag,2014,10(Suppl 1):S57-64
[11]Liu Y,Wang H,Cai X.Optimization of the extraction of total flavonoids from Scutellaria baicalensis Georgi using the response surface methodology[J].J Food Sci Technol,2015,52(4):2336-2343
[12]Xu Q,Shen Y,Wang H,et al.Application of response surface methodology to optimise extraction of flavonoids from fructus sophorae[J].Food Chem,2013,138(4):2122-2129
[13]侯学敏,李林霞,张直峰,等.响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J].食品科学,2013,34(6):124-128
[14]黄仁术,胡晓梦,何惠利.大别山野葛根异黄酮超声辅助提取工艺的响应面优化与还原力测定[J].中国药学杂志,2015,50(1):51-57
[15]李光,余霜,陈庆富.正交设计在红薯叶黄酮提取中的应用[J].北方园艺,2012(1):41-42
[16]李佩艳,王锋,尹飞,等.响应面法优化酶法提取红薯叶总黄酮的工艺[J].食品工业科技,2012(1):275-277
[17]李学坤,李莉,田盼盼,等.响应面法优化微波辅助蜗牛酶提取女贞子黄酮[J].化学工程,2014,42(3):6-10
[18]林建原,季丽红.响应面优化银杏叶中黄酮的提取工艺[J].中国食品学报,2013(2):83-90
[19]邹建国,刘飞,刘燕燕,等.响应面法优化微波辅助提取枳壳中总黄酮工艺[J].食品科学,2012,33(2):24-28
[20]熊春华,周苏果,沈忱,等.响应面法优化提取菊米黄酮及抗氧化活性研究[J].中国食品学报,2014(7):118-123
[21]赵海福,魏彦明,董晓宁,等.响应面法优化玉米须中芦丁的提取工艺及检测[J].草业科学,2013,30(6):964-972
Optimization of Water Extraction of Total Flavonoids from Ficus Tikoua Bur.by Response Surface Methodology
XU Jun-fei,PENG Tai-bin,FU Qiu-xia,GUO Shu-qiong,LIU Xi-qing
(Key Laboratory of Hunan Province for Study and Utilization of Ethnic Medicinal Plant Resources,College of Biological and Food Engineering,Huaihua University,Huaihua 418008,Hunan,China)
Optimization of water extraction total flavonoids from Ficus Tikoua Bur.by response surface methodology was studied.Based on the single-factor test analysis,the Plackett-Burman experimental design and steepest ascent design,while take extracted amount of total flavonoids as the response value,response surface method was applied to analyze the influence of various factors and their interaction on the extraction of total flavonoids,select an optimized progress to extract total flavonoids from Ficus Tikoua Bur..The optimal water extraction of total flavonoids from Ficus Tikoua Bur.progress conditions were solid-liquid ratio 1∶50(g/mL);soak time 50 min,extraction temperature 60℃;extraction time 50 min.Under these conditions,extracted amount of total flavonoids from Ficus Tikoua Bur.can reach 25.62 mg/g.
FicusTikouaBur.;totalflavonoids;waterextraction;responsesurfacemethodology
10.3969/j.issn.1005-6521.2016.15.018
湖南省重点建设学科经费资助(2011-42)
徐君飞(1981—),女(汉),讲师,博士,从事农产品加工研究。
2015-08-13
