5-氮杂脱氧胞苷对胶质母细胞瘤细胞U87增殖的影响及其机制探讨
2016-09-09沈军邵雪非徐宗华江晓春徐善水
沈军,邵雪非,徐宗华,江晓春,徐善水
(皖南医学院弋矶山医院,安徽芜湖 241001)
5-氮杂脱氧胞苷对胶质母细胞瘤细胞U87增殖的影响及其机制探讨
沈军,邵雪非,徐宗华,江晓春,徐善水
(皖南医学院弋矶山医院,安徽芜湖 241001)
目的观察5-氮杂脱氧胞苷对胶质母细胞瘤细胞U87增殖的影响,并探讨其可能机制。方法采用不同浓度(0、0.1、0.5、1.0、5、10 μmol/L)5-氮杂脱氧胞苷作用于U87细胞,比较细胞增殖抑制率和Bcl-2腺病毒E1B19kDa相关蛋白3 mRNA(BNIP3 mRNA);将5 μmol/L的5-氮杂脱氧胞苷作用于U87细胞0、1、2、3、4、5、6 d,比较细胞增殖抑制率及BNIP3 mRNA。将5 μmol/L 5-氮杂脱氧胞苷作用于U87细胞4 d,并分别添加和不添加Caspase抑制剂Boc-D-FMK,测算细胞增殖抑制率。结果5-氮杂脱氧胞苷对U87细胞增殖有抑制作用,且呈剂量及时间依赖性(P均<0.05),抑制作用最强的浓度为5 μmol/L,最强的时间点为4 d;Boc-D-FMK并不能抑制由BNIP3所诱导的细胞凋亡,P>0.05。结论5-氮杂脱氧胞苷可抑制U87细胞增殖,其机制可能与BNIP3 mRNA表达上调有关。
5-氮杂脱氧胞苷;胶质母细胞瘤;Bcl-2腺病毒E1B19kDa相关蛋白3
胶质母细胞瘤是中枢神经系统恶性程度最高的神经上皮性肿瘤,其发生发展与抑癌基因、癌基因的改变密切相关[1]。Bcl-2腺病毒E1B19kDa相关蛋白3(BNIP3)是Bcl-2家族中BH3-only亚家族成员之一,具有BH3结构域和跨膜结构域,主要定位于线粒体外膜,通过其跨膜结构域与其他蛋白相互作用而发挥其功能。BNIP3属促凋亡蛋白,其表达异常参与多种肿瘤的发生发展[2,3],表达水平主要与其启动子甲基化状态有关,应用甲基化抑制剂后能明显上调BNIP3表达,而促进肿瘤细胞凋亡。我们前期研究[4]表明,BINP3在胶质母细胞瘤组织及细胞中呈阳性表达。本研究观察了甲基化抑制剂5-氮杂脱氧胞苷对胶质母细胞瘤细胞U87增殖的影响,并探讨其可能机制。
1 材料与方法
1.1细胞、药物及试剂U87细胞购于中科院细胞所;5-氮杂脱氧胞苷、琼脂糖、二甲基亚砜(DMSO)、噻唑蓝购于Sigma公司,进口胎牛血清(FBS)、DMEM培养液购自Gibco公司,Boc-D-FMK购于上海玉搏公司,总RNA提取剂(TRIzol Reagent)购自美国invitrogen公司,逆转录试剂盒购自Fermentas公司,PCR反应体系购自上海Promega公司,DNA Marker,6×loading buffer购自TaKaRa公司,BNIP3引物及内参引物由上海生工公司设计。
1.2U87细胞培养U87细胞按照1×103/mL接种于25 mL培养瓶,5%CO2饱和湿度,37 ℃培养箱培养,倒置相差显微镜下观察细胞形态和生长情况。细胞离心,用营养液吹打均匀后分装进行传代培养,备用。
1.35-氮杂脱氧胞苷对U87细胞增殖影响观察采用MTT法。将1×103/mL的U87细胞悬液接种于96孔板;培养48 h后,分别以0、0.1、0.5、1.0、5、10 μmol/L的5-氮杂脱氧胞苷进行干预,每组设3个复孔。3 d后每孔加入5 mg/mL的MTT 20 μL,继续孵育4 h,离心后吸去上清,每孔加150 μL的DMSO,振荡混匀10 min,使用酶标仪于540 nm波长处测量光密度值(OD值)。根据结果取5-氮杂脱氧胞苷最强作用浓度(5 μmol/L),分别干预0、1、2、3、4、5、6 d,终止培养,每孔加5 mg/mL的MTT 20 μL,继续孵育4 h,离心后吸去上清,每孔加150 μL的DMSO,振荡混匀10 min,酶联免疫检测仪540 nm波长比色。取5-氮杂脱氧胞苷最强作用浓度(5 μmol/L)、最佳作用时间(4 d),分别添加和不添加Boc-D-FMK 20 μM,继续孵育4 h,离心后吸去上清,每孔加150 μL的DMSO,振荡混匀10 min,使用酶联免疫检测仪于540 nm波长处测量光密度值(OD值)。细胞增殖抑制率=(1-实验组OD值/对照组OD值)×100%。
1.45-氮杂脱氧胞苷对U87细胞BNIP3 mRNA表达影响观察实验采取的5-氮杂脱氧胞苷剂量及干预时间同1.3。用TRIzol抽提液提取RNA,RNA以紫外分光光度计重复测量3次浓度和纯度,按样品260~280 nm的OD值确定RNA的质量,A260 nm/A280 nm在1.8~2.0视为总RNA纯度高。逆转录cDNA模板25 μL反应体系;Go Taq Green Master Mix 12.5 μL,Nuclease-Free Water 8.5 μL,上下游引物各1 μL,逆转录cDNA模板2 μL,在冰上操作。引物设计:BNIP3:5′-GGTCAAGTCGGCCGGAAAATAT-3′,5′-CGCCTTCCAATATAGATCCCCAA -3′,198 bp;扩增内参照磷酸甘油脱氢酶(GAPDH):5′-GGTCGGAGTCAACGGATTTG-3′,5′-ATGAGCCC-AGCCTTCTCCAT-3′。PCR反应条件:预变性95 ℃、5 min,94 ℃、30 s,61 ℃、30 s,72 ℃、30 s,共35个循环;72 ℃、10 min。GAPDH反应条件同前。反应体系实验结束后,取6 μL的PCR产物,在1.0 g/100 mL琼脂糖凝胶90 V恒压电泳30 min,在紫外灯照射下利用凝胶成像系统和捷达凝胶分析软件4.0进行拍照和灰度值测定,各实验组呈现出来的BNIP3基因PCR产物灰度值分别除以相对应内参GAPDH基因PCR产物灰度值,从而得到BNIP3 mRNA的相对表达量。
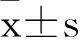
2 结果
2.1各组细胞增殖抑制率比较0、0.1、0.5、1.0、5、10 μmol/L 5-氮杂脱氧胞苷干预后,细胞增殖抑制率分别为0、1.20%±0.56%、8.62%±1.56%、15.91%±2.59%、21.43%±3.24%、19.33%±3.86%,0.1、0.5、1.0、5、10 μmol/L 5-氮杂脱氧胞苷分别与0 μmol/L 5-氮杂脱氧胞苷比较,P均<0.05。5 μmol/L 5-氮杂脱氧胞苷干预0、1、2、3、4、5、6 d,细胞增殖抑制率分别为0、7.51%±1.62%、10.04%±2.63%、15.74%±3.46%、18.26%±3.23%、17.63%±2.87%、16.42%±3.16%,1、2、3、4、5、6 d分别与0 d比较,P均<0.05。添加和不添加Boc-D-FMK的细胞增殖抑制率分别为16.38%±3.12%、15.97%±2.93%,两者比较,P>0.05。
2.2各组细胞BNIP3 mRNA相对表达量比较0、0.1、0.5、1.0、5、10 μmol/L 5-氮杂脱氧胞苷干预后,BNIP3 mRNA相对表达量分别为0.12±0.03、0.23±0.05、0.302±0.06、0.518±0.09、0.735±.011、0.187±0.02,0.1、0.5、1.0、5、10 μmol/L 5-氮杂脱氧胞苷分别与0 μmol/L 5-氮杂脱氧胞苷比较,P均<0.05。5 μmol/L 5-氮杂脱氧胞苷干预0、1、2、3、4、5、6 d,BNIP3 mRNA相对表达量分别为0.451±0.07、0.487±0.07、0.596±0.11、0.782±0.13、0.814±0.15、0.472±0.08、0.563±0.09,1、2、3、4、6 d分别与0 d比较,P均<0.05。
3 讨论
胶质母细胞瘤是星形细胞肿瘤中恶性程度最高的胶质瘤,肿瘤位于皮质下,多数生长于幕上大脑半球各处,呈浸润性生长,常侵犯多个脑叶,并侵犯深部结构,还可经胼胝体波及对侧大脑半球,发生部位以额叶最多见。胶质母细胞瘤病程短,术后易复发,且多数在短期内复发,中位生存期仅27周[5]。近年来,随着术后综合治疗方法的提高,胶质母细胞瘤的预后稍有改善,但其中位生存期也只有12~15个月[6],效果仍不理想。
BNIP3表达升高或沉默均可导致肿瘤发生,其表达水平升高可能与非小细胞型肺癌[7]、乳腺癌[8,9]、前列腺癌[10,11]、胆管癌[12]、唾液腺表性癌[13]及子宫内膜癌[14]等发生发展密切相关,甚至参与了肿瘤的转移[15,16]。但有研究[17~19]表明,BNIP3表达沉默亦可能参与了不同肿瘤的发生发展,如胰腺癌、结直肠癌和胃癌等,主要为消化系统肿瘤。之前我们研究[4]发现,BNIP3不论在胶质母细胞瘤细胞系还是组织标本中,其表达均明显升高,这与Burton等[20]的研究结果一致,而在正常的脑组织中则未检测到其表达。Burton等[21]随后再次研究,认为在胶质母细胞瘤细胞系中,BNIP3虽然表达增加,但其主要位于细胞核内,而且下调了DR5的表达,这都限制了其正常的促进细胞死亡的功能。Chen等[22]则认为在胶质母细胞瘤细胞系中,Mcl-1和BNIP3同时集中存在,而低氧环境下Mcl-1则正好限制了BNIP3介导细胞死亡的功能。
BNIP3表达沉默主要与其启动子区域CpG岛的甲基化状态有关,如去除启动子区域的甲基化状态,则能使其表达水平明显升高,进而促进肿瘤细胞凋亡[23~25]。Abe等[17]研究表明,在含氧量正常的12种胰腺癌细胞系中,BNIP3表达水平各不相同,有50%未检测到BNIP3表达,但采用5-氮杂脱氧胞苷干预后,可重建该基因的表达,并能在低氧情况下介导肿瘤细胞死亡。Murai等[18]发现,BNIP3在结直肠癌、胃癌中表达沉默,但应用5-氮杂脱氧胞苷干预后,可使该基因表达增强,并诱导肿瘤细胞死亡。BNIP3在胶质母细胞瘤中并没有表达沉默,但采用5-氮杂脱氧胞苷干预后,可使BNIP3在胶质母细胞瘤细胞系中表达升高,且呈时间和剂量依赖性。另外发现,5-氮杂脱氧胞苷能明显抑制U87细胞增殖,虽然没有直接检测BNIP3启动子区域的甲基化状态,但结合文献及试验结果,间接证明在胶质母细胞瘤中,BNIP3启动子的甲基化状态限制了其表达,去除其甲基化状态能抑制U87细胞增殖而达到治疗效果。目前,对于BNIP3引起肿瘤细胞死亡的确切机制尚不清楚,可能的机制包括细胞坏死、细胞凋亡和自体吞噬作用[26~28],其功能的实现是半胱天冬酶依赖性还是非依赖性也有争论,我们通过实验发现,BNIP3在多形性胶质细胞瘤中发挥其功能属于半胱天冬酶非依赖性,但具体机制仍需进一步研究。
BNIP3表达升高还可能会增加化疗与放疗的敏感性。Ishiguro等[19]采用5-氮杂脱氧胞苷联合依立替康与单用依立替康分别作用于人结肠癌细胞系,发现前者BNIP3表达明显升高,且其对肿瘤细胞的增殖效应明显优于后者,提示BNIP3可能增加了肿瘤细胞对依立替康的敏感性。Wang等[29]将BNIP3转染至人子宫颈癌细胞系中,转染后的细胞系凋亡率明显增加,随着BNIP3的表达升高,肿瘤细胞对放疗的敏感性也逐渐增强。此外,BNIP3可以与bax形成异二聚体共同促进细胞凋亡[2],同时有研究[30]表明5-氮杂脱氧胞苷也能通过其去甲基化作用调节p53-bax凋亡通路促进肿瘤细胞凋亡,也能通过其去甲基化作用使p14、p16、XAF1等基因表达升高[14]。结合前期研究表明,BNIP3在胶质母细胞瘤中呈阳性表达,5-氮杂脱氧胞苷能明显上调其表达水平而发挥对肿瘤细胞的抑制效应,BNIP3促进细胞凋亡机制是通过Caspase非依赖性。但BNIP3诱导胶质母细胞瘤细胞死亡的机制以及5-氮杂脱氧胞苷对胶质母细胞瘤凋亡通路中其他相关基因的作用机制尚不清楚,需要我们进一步深入研究。
[1] 杨军,刘运海.MDM2启动子309位点多态性与胶质母细胞瘤易感性的关系[J].山东医药,2011,51(29):87-88.
[2] Mellor HR, Harris AL. The role of the hypoxia-inducible BH3-onlyproteins BNIP3 and BNIP3L in cancer[J]. Cancer Metastasis Rev, 2007,26(3-4):553-566.
[3] Graham RM, Thompson JW, Webster KA. Inhibition of the vacuolar ATPase induces Bnip3-dependent death of cancer cells and a reduction in tumor burdenand metastasis[J]. Oncotarget, 2014,5(5):1162-1173.
[4] 沈军,赵亮,程宏伟,等.p53与BNIP3在胶质母细胞瘤中表达及其相关性[J].中华实验外科杂志,2012,29(1):7.
[5] 章露华,林洪,章翔.多形性脑胶质母细胞瘤化疗对预后的评价[J].中华神经外科疾病研究杂志,2010,9(1):86-88.
[6] Omuro A, DeAngelis LM. Glioblastoma and other malignant gliomas: a clinical review[J]. JAMA, 2013,310(17):1842-1850.
[7] Karpathiou G, Sivridis E, Koukourakis M, et al. Autophagy and Bcl-2/BNIP3 death regulatory pathway in non-small cell lung carcinomas[J]. APMIS, 2013,121(7):592-604.
[8] Naushad SM, Prayaga A, Digumarti RR, et al. Bcl-2/adenovirus E1B19kDa-interacting protein 3 (BNIP3) expression is epigenetically regulated by one-carbon metabolism in invasive duct cell carcinoma of breast[J]. Mol Cell Biochem, 2012,361(1-2):189-195.
[9] Vijayalingam S, Pillai SG, Rashmi R, et al. Overexpression of BH3-Only protein BNIP3 leads to enhanced tumor growth[J]. Genes Cancer, 2010,1(9):964-971.
[10] Huang Y, Shen P, Chen X, et al. Transcriptional regulation of BNIP3 by Sp3 in prostate cancer[J]. Prostate, 2015,75(14):1556-1567.
[11] Yoo NJ, Kim MS, Park SW, et al. Expression analysis of caspase-6, caspase-9 and BNIP3 in prostate cancer[J]. Tumori, 2010,96(1):138-142.
[12] Thongchot S, Yongvanit P, Loilome W, et al. High expression of HIF-1α, BNIP3 and PI3KC3: hypoxia-induced autophagy predicts cholangiocarcinoma survival and metastasis[J]. Asian Pac J Cancer Prev, 2014,15(14):5873-5878.
[13] Chen Z, Wu H, Huang S, et al. Expression of BNIP3 and its correlations to hypoxia-induced autophagy and clinicopathological features in salivary adenoid cystic carcinoma[J]. Cancer Biomark, 2015,15(4):467-475.
[14] 牛菲菲,徐红,王飞艳.子宫内膜癌组织中促凋亡线粒体蛋白BNIP3的表达及意义[J].山东医药,2013,53(26):12-14.
[15] Chourasia AH, Tracy K, Frankenberger C, et al. Mitophagy defects arising from BNip3 loss promote mammary tumor progression to metastasis[J]. EMBO Rep, 2015,16(9):1145-1163.
[16] Sun L, Li T, Wei Q, et al. Upregulation of BNIP3 mediated by ERK/HIF-1α pathway induces autophagy and contributes to anoikis resistance of hepatocellular carcinoma cells[J]. Future Oncol, 2014,10(8):1387-1398.
[17] Abe T, Toyota M, Suzuki H, et al. Upregulation of BNIP3 by 5-aza-2′-deoxycytidine sensitizes pancreatic cancer cells to hypoxia-mediated cell death[J]. J Gastroenterol, 2005,40(5):504-510.
[18] Murai M, Toyota M, Suzuki H, et al. Aberrant methylation and silencing of the BNIP3 gene in colorectal and gastric cancer[J]. Clin Cancer Res, 2005,11(3):1021-1027.
[19] Ishiguro M, Iida S, Uetake H, et al. Effect of combined therapy with low-dose 5-aza-2′-deoxycytidine and irinotecan on colon cancer cell line HCT-15[J]. Ann Surg Oncol, 2007,14(5):1752-1762.
[20] Burton TR, Henson ES, Baijal P, et al. The pro-cell death Bcl-2 family member, BNIP3, is localized to the nucleus of human glial cells: implications for glioblastoma multiforme tumor cell survival under hypoxia[J]. Int J Cancer, 2006,118(7):1660-1669.
[21] Burton TR, Henson ES, Azad MB, et al. BNIP3 acts as transcriptional repressor of death receptor-5 expression and prevents TRAIL-induced cell death in gliomas[J]. Cell Death Dis, 2013,4:e587.
[22] Chen Y, Henson ES, Xiao W, et al. Bcl-2 family member Mcl-1 expression is reduced under hypoxia by the E3 ligase FBW7 contributing to BNIP3 induced cell death in glioma cells[J]. Cancer Biol Ther, 2015,[Epub ahead of print].
[23] Hiraki M, Kitajima Y, Nakafusa Y, et al. CpG island methylation of BNIP3 predicts resistance against S-1/CPT-11 combined therapy in colorectal cancer patients[J]. Oncol Rep, 2010,23(1):191-197.
[24] Swiderek E, Kalas W, Wysokinska E, et al. The interplay between epigenetic silencing, oncogenic KRas and HIF-1 regulatory pathways in control of BNIP3 expression in human colorectal cancer cells[J]. Biochem Biophys Res Commun, 2013,441(4):707-712.
[25] Deng Q, Huang CM, Chen N, et al. Chemotherapy and radiotherapy downregulate the activity and expression of DNA methyltransferase and enhance Bcl-2/E1B-19-kDa interacting protein-3-induced apoptosis in human colorectal cancer cells[J]. Chemotherapy, 2012,58(6):445-453.
[26] Quinsay MN, Lee Y, Rikka S, et al. Bnip3 mediates permeabilization of mitochondria and release of cytochrome c via a novel mechanism[J]. J Mol Cell Cardiol, 2010,48(6):1146-1156.
[27] Cosse JP, Rommelaere G, Ninane N, et al. BNIP3 protects HepG2 cells against etoposide-induced cell death under hypoxia by an autophagy-independent pathway[J]. Biochem Pharmacol, 2010,80(8):1160-1169.
[28] 徐冉,魏珑珑,李志强,等.BNIP3在细胞凋亡与自噬中的作用[J].山东医药,2013,53(28):105-108.
[29] Wang Z, Huang CM, Deng Q, et al. Effects of the proapoptotic regulator Bcl2/adenovirus EIB19kDa-interacting protein 3 on radiosensitivity of cervical cancer[J]. Cancer Biother Radiopharm, 2011,26(3):279-286.
[30] 刘小方,姜宏,张翠生,等.5-氮-2-脱氧胞苷调控p53-baX凋亡通路DNA甲基化对胆管癌细胞生长的影响[J].中华实验外科杂志,2010,27(7):876-878.
Effect of 5-aza-deoxycytidine on proliferation of glioblastoma U87 cells and the mechanism
SHEN Jun, SHAO Xuefei, XU Zonghua, JIANG Xiaochun, XU Shanshui
(The First Affiliated Hospital of Wannan Medical College, Wuhu 241001, China)
ObjectiveTo observe the effect of 5-aza-deoxycytidine on the proliferation of glioblastoma U87 cells and to investigate its possible mechanism.MethodsDifferent concentrations of 5-aza-deoxycytidine (5-aza-deo) (0, 0.1, 0.5, 1.0, 5, 10 μmol/L) were used to interfere in the U87 cell line. After 3 days, the inhibition rate of cell proliferation and the BCL2/adenovirus E1B19kDa protein-interacting protein 3 mRNA (BNIP3 mRNA) expression were compared. After 5 μmol/L 5-aza-deo was used to interfere in U87 cell line at variant time (0, 1, 2, 3, 4, 5 and 6 d), the inhibition rate of cell proliferation and the BNIP3 mRNA expression were examined. The inhibition rate of cell proliferation was examined after 5 μmol/L 5-aza-deo was used to treat U87 cells for 4 d with Boc-D-FMK or without Boc-D-FMK. Results5-aza-deo inhibited the U87 cell proliferation which showed a time- and dose-dependent manner (all P<0.05). The concentration with the maximum inhibition was 5 μmol/L. The time of maximum inhibition was the 4th day. Boc-D-FMK did not change the apoptosis of U87 cell induced by BNIP3 (P>0.05). Conclusion5-aza-deo can inhibit the U87 cell proliferation, and its mechanism may be related with the up-regulation of BNIP3 mRNA expression.
5-aza-deoxycytidine; glioblastoma; Bcl-2/adenovirus E1B19kDa protein-interacting protein 3
皖南医学院中青年自然科学基金(WK2014F05)。
沈军(1984-),男,硕士,住院医师,主要研究方向为胶质瘤的基础及临床。E-mail: shenyuanziyan@163.com
10.3969/j.issn.1002-266X.2016.15.003
R739.4
A
1002-266X(2016)15-0008-04
2015-11-20)
