Construction of a Cell Impedance Biosensor Based on Graphene Oxide/Polypyrrole-Indium Tin Oxide Micro-Electrode for Detecting Cell Adhesion and Proliferation*
2016-09-09LIYuanZHANGJingLIAOJuanWANGTiaominLIUBeizhongYUChaoZHANGLinlin
LI Yuan,ZHANG Jing,LIAO Juan,WANG Tiaomin,LIU Beizhong*,YU Chao,ZHANG Linlin
(1.Central Laboratory of Yongchuan Hospital,Chongqing Medical University,Chongqing 402160,China;2.Institute of Life Science,Chongqing Medical University,Chongqing 400016,China)
传感器研究
Construction of a Cell Impedance Biosensor Based on Graphene Oxide/Polypyrrole-Indium Tin Oxide Micro-Electrode for Detecting Cell Adhesion and Proliferation*
LI Yuan1,2,ZHANG Jing1,LIAO Juan1,WANG Tiaomin1,LIU Beizhong1*,YU Chao2,ZHANG Linlin1
(1.Central Laboratory of Yongchuan Hospital,Chongqing Medical University,Chongqing 402160,China;2.Institute of Life Science,Chongqing Medical University,Chongqing 400016,China)
Thispaperdescribesacellimpedancebiosensorbasedongrapheneoxide/polypyrrole-indium tinoxide(GO/ PPy-ITO)microelectrode for detecting cell adhesion and proliferation.The ITO microelectrode was firstly fabricated by etching the insulating layer of photosensitive dry film with lithography technology.Then GO/PPy nanocomposite was deposited on the surface of the ITO microelectrode by one-step electropolymerization to form the GO/PPy-ITO micro⁃electrode.Shape measuring laser microscope and scanning electron microscope were used to characterize the surface roughness and topology of the GO/PPy respectively.The electrochemical properties of the GO/PPy-ITO microelectrode were measured by cyclic voltammetry and electrochemical impedance spectroscopy.Human lung cancer cells A549 adhesion,spreading and proliferation experiments were used to characterize the biocompatibility of the GO/PPy.Used the GO/PPy-ITO microelectrode as sensing electrode,A549 cells adhesion and proliferation were detected by electro⁃chemical impedance spectroscopy.Results showed that the GO/PPy nanocomposite electrodeposited on the surface of the ITO microelectrode had a special structure of smooth surface and abundant micro-pore distribution.Compared with bare ITO microelectrode,GO/PPy-ITO microelectrode had a lower impedance and higher electrochemical activity. Meanwhile,A549cellsculturedonGO/PPy-ITOcouldattach,spreadandproliferatemorerapidlythanpurePPy.Final⁃ly,as the adhesion and proliferation of A549 cells on the surface of GO/PPy-ITO microelectrode would change the im⁃pedance spectrum characteristics of the electrode system,the information on the cell adhesion and proliferation could be obtained by fitting the impedance spectrum data with the equivalent circuit model.Therefore,as the excellent elec⁃trochemical properties and biocompatibility of the GO/PPy-ITO microelectrode,cell-based impedance biosensor basedonthistypeofmicroelectrodecouldbeusedinthefiledsuchascellularpathophysiologyanddrugscreening.
biosensor;electrochemical impedance detection;graphene oxide;polypyrrole;Indium tin oxide;cell proliferation
细胞阻抗生物传感器是一类以活细胞作为敏感原件,以电化学阻抗谱技术作为活细胞响应行为探测技术的新型生物传感器[1]。由于电化学阻抗谱分析技术具有无侵袭性、定性与定量相结合的优点,因此细胞阻抗生物传感器能够无标记、定量地分析细胞粘附、增殖、凋亡等细胞生物学行为[2-4],广泛用于药物筛选[5]、毒物测试[6]及细胞生理参数分析[7]等研究领域。细胞阻抗生物传感器检测的基础在于将活细胞固定或培养在金属材质传感微电极表面,传感电极制备材料包括金[8]、铂[9]或铟锡氧化物[10]。尽管上述电极材料具有良好的导电性和生物相容性,然而发展新型电极材料改善传感电极的电化学性能和生物相容性以提高细胞阻抗生物传感器的检测性能仍是本领域研究热点[11]。
氧化石墨烯GO(Graphene Oxide),作为石墨烯GN(Graphene)的氧化衍生物,除具备GN的特殊结构、电化学性质及催化活性等优点,在GO的底面和边缘还有丰富的含氧基团,比如羟基,环氧化物,羰基,羧基等[12],因此比GN具有更好的水溶性,从而为利用GO构筑各种纳米复合物提供了有利条件。重要的是,Chang等[13]采用细胞毒性实验研究了不同尺度GO对A549细胞的细胞毒性,结果显示GO具有良好的细胞生物相容性;Zhang等[14]通过静电组装技术构建了一种GO/poly-L-lysine复合物,该复合物可作为细胞固定界面,并通过电化学阻抗技术实现白血病K562细胞的数量检测;Guo等[15]将含RGD多肽序列修饰在GO表面改善GO生物仿生能力,并证实其可作为活细胞小分子检测的传感界面。毫无疑问,发展基于GO纳米复合物的传感电极修饰材料是构建新型细胞生物传感器的重要方向。
另一方面,聚吡咯PPy(Polypyrrole),一种重要共轭性导电聚合物,具有本征导电、表面性质可控、良好生物相容性及低电位聚合等优点,广泛用于构建各类分子生物传感器[16]和细胞生物传感器[17]。为提高PPy机械性能和电学性质,将纳米材料,如金颗粒[18]、碳纳米纤维[19]耦合进PPy形成独特的纳米材料/PPy复合物是一个重要策略。鉴于GN和衍生物独特性质,有研究报道将GN或其衍生物与PPy相耦合形成GN/PPy纳米复合物,构建的纳米复合物能够充分体现PPy和GN两种材料的协同效应[20-22]。最近,Zhu等[23]通过在玻碳电极上一步法电沉积合成GO/PPy纳米复合物用于制备更高效的电化学超级电容器。Lü等[24]在石墨毡电极上通过一步法电聚合技术修饰一层GO/PPy纳米复合物,提高了微生物燃料电池阳极的稳定性和发电效率。在上述研究中[23,24],由于GO富含多种功能基团,如-OH和-COOH,在水溶液中Zeta电位约为-50.7 mV,因此可作为吡咯电聚合过程中唯一外部掺杂阴离子并通过一步法电聚合原位合成GO/PPy纳米复合物。一步法电聚合方法简单,易于实施,制备的GO/PPy纳米复合物能够显著提高PPy的电化学性能和机械稳定性。然而,一步法电聚合制备的GO/PPy纳米复合膜与细胞间的相互作用以及作为纳米传感界面用于细胞检测的研究还未见报道。
为此,本文在ITO微电极表面通过一步法电聚合制备GO/PPy纳米复合物,并发展了一种基于GO/ PPy-ITO微电极的细胞阻抗生物传感器初步实现细胞粘附增殖生物学行为信息检测。研究选择ITO材料作为基底电极是由于其兼具导电性和透光性,一方面能够实现GO/PPy原位电聚合和电化学阻抗谱检测,另一方面能够通过光学显微镜观察细胞与GO/PPy纳米复合膜的相互作用[25]。研究首先考察了GO/PPy-ITO微电极表面拓扑形貌,电化学性质及GO/PPy界面的细胞生物相容性。随后以GO/PPy-ITO微电极为传感电极,通过电化学阻抗谱技术和等效电路拟合技术对人肺癌上皮细胞A549在GO/ PPy-ITO电极表面的粘附增殖行为进行检测。
1 方法和材料
1.1ITO微电极加工及GO/PPy纳米复合膜电聚合
ITO微电极的加工采用本课题组前期发展的感光干膜-ITO微电极工艺[26],简要加工流程为:将感光干膜(HQ-6100,长兴化学工业股份有限公司)通过覆膜机(100℃)压贴在ITO导电玻璃(珠海凯为光电科技有限公司)导电膜面,透过掩膜胶片对感光干膜进行紫外光照射30 s,30℃下用1%Na2CO3溶液对感光干膜显影5 min,使未经紫外光照射区域的感光干膜溶解暴露出ITO微电极(电极直径为1.0 mm),去离子水冲洗2次,60℃烘干,紫外照射60 s使感光胶完全固化。
电化学小池装置制备参考文献[26],其示意图和实物图分别如图1(a)、1(b)所示。ITO微电极和测量小池用塑料夹具固定,使ITO微电极置于测量小池底部,整个装置含4个独立测量小池,每个小池直径为8 mm,体积约为500 μL。电化学实验在CS315电化学工作站(武汉科思特仪器有限公司)实施,实验采用三电极系统,其中ITO微电极为工作电极,Ag/AgCl丝为参比电极(直径:0.5 mm,长度:10 mm),铂丝为对电极(直径:1.0 mm,长度:10 mm)。GO水溶液(南京吉仓纳米科技有限公司,直径为30 nm~50 nm)未经任何处理直接用去离子水配置成浓度为2 mg/mL的GO水溶液,超声处理15 min分散。在GO水溶液中加入吡咯单体(Sigma Aldrich),使吡咯浓度为0.5 mol/L,震荡混匀获得预聚合溶液。GO/PPy纳米复合物的制备采用一步法电聚合技术,即在ITO微电极上施加+0.8 V(vs.Ag/AgCl)的极化电位,示意图如图1(c)所示。预实验发现,聚合电荷为4 mC/cm2时可在ITO微电极表面形成均匀稳定的复合物膜,其厚度通过理论公式计算约为1.05 μm[27]。随后,GO/PPy纳米复合物用去离子水冲洗,室温干燥。作为对照,纯PPy膜在含0.1 mol/L KCl和0.5 mol/L吡咯单体水溶液中电聚合形成PPy-ITO微电极,聚合参数同上。GO/PPy纳米复合物的表面粗糙度和拓扑形貌分别通过VK-V150形状测量激光显微镜(基恩士,日本)和S4800扫描电子显微镜(日立,日本)进行表征。
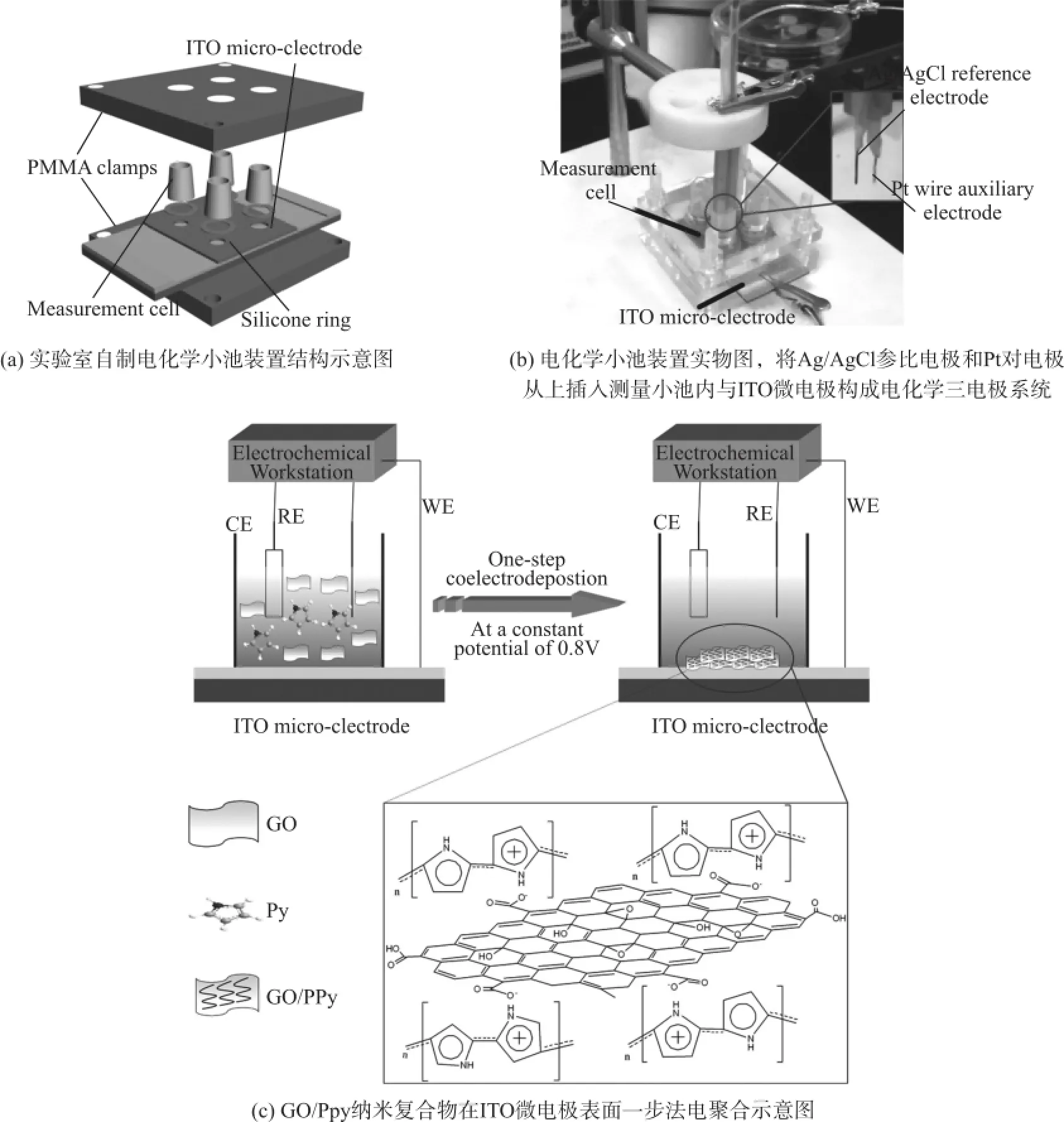
图1 GO/PPy-ITO微电极的制备
1.2电化学性能表征
GO/PPy-ITO微电极电化学性能采用电化学阻抗谱(EIS)和循环伏安法(CV)进行研究。电化学方法采用三电极体系,并在上述相同电化学小池装置中进行。其中,三电极系统以G0/Ppy-ITO微电极为工作电极,以Ag/AgCl丝为参比电极,铂丝为对电极。同时,实验以Ppy-ITO微电极和裸ITO微电极作为对照。EIS和CV测试均在0.01 mol L-1PBS溶液中进行。EIS以幅值为10 mV正弦波作为激励信号,扫描频率范围为1 Hz~100 000 Hz。CV测量扫描电压从+0.5 V~-0.6 V(vs.Ag/AgCl),扫描速度为50 mV/s,扫描循环数设为10。
1.3细胞生物相容性研究
GO/PPy纳米复合膜的细胞生物相容性通过细胞粘附、铺展和增殖实验进行评价。为便于细胞培养实验,首先按照上述相同聚合参数在直径为6 mm的ITO电极上沉积相同厚度的GO/PPy(聚合电量为(150 mC/cm),70%乙醇浸泡5 min消毒,无菌去离子水冲洗,干燥待用。将100 μL A549细胞悬液(5.0×104cells/mL)接种含GO/PPy的测量小池内,放入细胞培养箱(37℃,5%CO2)中静止2 h,细胞粘附形态学通过IX71倒置荧光显微镜(奥林巴斯,日本)观察,CCD进行拍照。细胞接种在GO/PPy表面12 h待细胞完全铺展,PBS冲洗1次后用3.7%甲醛溶液室温固定10 min,用FITC标记的鬼笔环肽(碧云天生物技术研究所)室温孵化60 min对细胞骨架进行染色。细胞的铺展形态学利用IX71倒置荧光显微镜观察和拍照。细胞粘附和铺展实验以纯PPy膜作为对照。
A549细胞在GO/PPy纳米复合膜界面的增殖行为通过Cell Counting Kit(CCK-8试剂盒,碧云天生物技术研究所)实验评价。100 μL的A549细胞悬液(2.0×104cells/mL)分别接种在含GO/PPy、纯PPy的测量小池内,放入细胞培养箱中培养24 h和48 h,随后加入10 μL CCK-8分析液,轻摇混匀,37℃孵育2 h,分别取测量小池内溶液100 μL,多功能酶标仪(Varioskan,Thermo Scientific)测定溶液在450 nm的吸光度,溶液吸光值与细胞数量和活性成正比关系。细胞增殖实验以传统96孔板聚苯乙烯基底作为对照。
1.4A549细胞粘附增殖电化学阻抗检测
将100 μL A549细胞悬液(2.0×104cells/mL)加入含GO/PPy-ITO微电极的测量小池内,室温下静止30 min使细胞均匀沉降到微电极表面后放入细胞培养箱(37℃,5%CO2)培养,分别在2 h、24 h、48 h和72 h后将测量小池取出,PBS冲洗电极去掉死细胞及未粘附细胞。同时,实验以将100 μL A549细胞加载到含PPy-ITO微电极的测量小池作为实验对照,将不含A549细胞的细胞培养液加载到含GO/PPy-ITO微电极的测量小池作为空白对照。随后,在测量小池内加入500 μL 0.01 mol/L PBS作为支持电解质,将铂丝对电极和Ag/AgCl参比电极插入测量小池进行电化学阻抗谱测量。电化学阻抗谱测量在开路电压下对传感电极施加幅值为10mV的正弦波交流检测信号,检测信号扫描频率范围为1 Hz~100 000 Hz,阻抗谱测量数据用ZView 2.0软件NC,USA(Scribner Associates South⁃ern Pines)建立等效电路后进行拟合分析。
2 结果和讨论
2.1GO/PPy-ITO微电极的制备及形态学表征
采用感光干膜作为绝缘层加工出的ITO微电极如图2(a)上所示,其中ITO微电极直径为1 mm。本方法制备ITO微电极简单,降低了加工成本,同时使微电极具有较低的接触电阻[26]。以ITO微电极为工作电极,通过一步法电聚合技术成功在ITO微电极表面沉积一层均匀的黑灰色沉积物,如图2(a)下所示。在本研究中,聚合溶液中只含GO和Py单体,携带负电荷功能基团的GO作为吡咯电聚合过程中唯一的掺杂剂平衡PPy骨架上的正电荷,进而形成GO/PPy纳米复合物[23-24]。同时,研究提示GO和芳香族聚吡咯环间的π-π键作用及氢键结合在GO/PPy纳米复合物形成中也扮演重要作用[23]。如果聚合溶液中只有Py单体,施加相同的聚合电压没有PPy膜形成(数据未给出),提示GO是Py电聚合过程中必须的唯一掺杂剂。
材料表面粗糙度是电极表面PPy涂层最重要的参数之一,同时影响着PPy涂层的细胞生物相容性[28]。大量研究实验显示,电聚合PPy表面粗糙度由掺杂剂类型、Py单体浓度及电聚合参数等决定[27]。图2(c)为GO/PPy纳米复合膜表面三维拓扑形貌和粗糙度。结果显示,GO/PPy纳米复合物比纯PPy膜具有更加平整的表面三维形貌,表面平均粗糙度为0.015 μm,远低于纯PPy表面2.267 μm的表面平均粗糙度。GO/PPy纳米复合膜和纯PPy膜表面粗糙度的差异推测与电聚合过程中的Py成核和生长机制有关[29]。
GO/PPy纳米复合物的表面形貌进一步通过SEM进行观察。图3为一步法电聚合制备的GO/ PPy纳米复合物和纯PPy膜的SEM图像。相比纯PPy(图3(a)、3(b))典型的油菜花结构特征,GO/PPy纳米复合物(图3(c)、3(d))呈现更为平整的表面,该结果与上述表面粗糙度测量结果相符。仔细观察GO/PPy纳米复合物表面(图3(d))发现大量分布的微孔结构。图3(e)为GO/PPy纳米复合物截面SEM图像,该结构与化学方法合成的GO/PPy纳米复合物之间有显著差异[30],与文献[23]报道的通过电聚合途径制备的GO/PPy纳米复合物高度疏松多孔的结构特征相吻合。该结果进一步证实GO/PPy纳米复合物的成功制备。
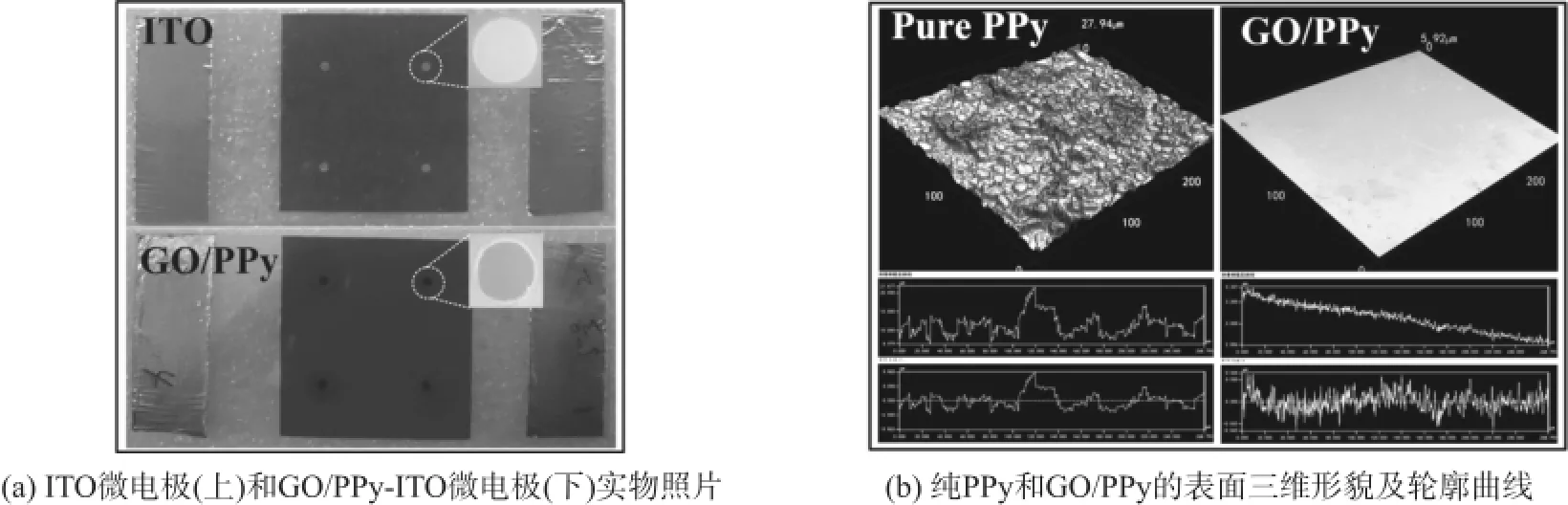
图2 一步法电聚合制备的GO/PPy-ITO微电极
2.2GO/PPy-ITO微电极的电化学性能表征
图4(a)为GO/PPy-ITO微电极、PPy-ITO微电极和裸ITO微电极的频率阻抗曲线。结果显示,在低频段(1 Hz~4.8 kHz),电聚合PPy涂层显著降低ITO微电极的阻抗值。其原因在于PPy涂层增加了电极表面粗糙度和表面积,提高了电极表面双分子层电容,从而降低电极阻抗[31]。在本研究中,GO/PPy-ITO微电极和PPy-ITO微电极之间的频率阻抗特性无明显差异。考虑到GO/PPy-ITO微电极和PPy-ITO微电极间表面拓扑形貌差异明显,因此其原因推测可能与GO和PPy两者间相互协同结果有关。在当前研究中,大多数细胞阻抗生物传感器采用裸传感电极,但由于传感电极在低频范围区间(<10 kHz)的阻抗值较高,因此细胞阻抗检测时只能设定在高频率区间(>10 kHz),以此降低传感电极本征阻抗值,从而提高传感器检测灵敏度。然而,电极表面上细胞作为频率依赖性电学元件,不同的频率范围分布包含不同的细胞信息,如低频率阻抗信号可用于细胞类型判断[32]。因此,基于GO/PPy-ITO微电极的细胞阻抗传感器具有在更宽频率范围内获取细胞信息的潜力。图4(b)为GO/PPy-ITO微电极、PPy-ITO微电极和裸ITO微电极的频率相位角曲线。结果可知,PPy涂层的修饰显著降低了裸ITO微电极的相位角值,其原因在于PPy涂层内包含大量空隙,电解质渗入空隙内使电极更呈电阻特性[31]。同时,GO/PPy-ITO微电极在高频段(>17 Hz)相位角低于PPy-ITO微电极相位角,在1kHz时相位角接近为0,其原因推测与GO/PPy纳米复合物内部分布的大量微孔有关。同时,该结果也提示GO/PPy纳米复合物在高频段(>100 Hz)为电阻性材料,而在低频段(<100 Hz)趋向为电容性材料。
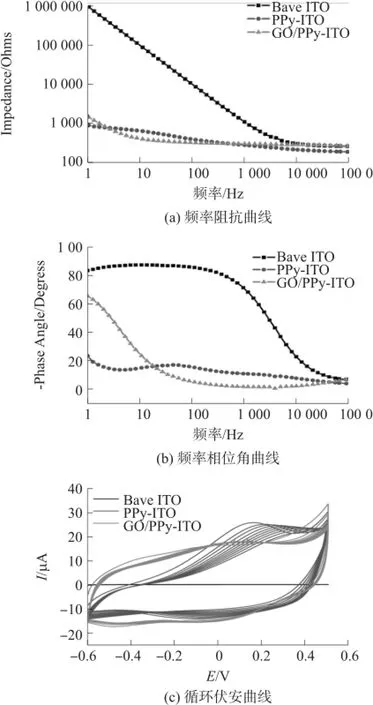
图4 电化学性能表征
另一方面,作为细胞传感电极,除具有低阻抗特性外,高电荷容量也是非常重要的参数。由于电化学循环伏安曲线下面积与电极的充电容量成正比,因此可用电化学循环伏安法对电极的充电容量进行评估。图4(c)为GO/PPy-ITO微电极、PPy-ITO微电极和裸ITO微电极在0.01 M PBS溶液中典型CV曲线。与裸ITO微电极相比,PPy修饰电极能够显著增加电极电荷容量。此外,随着扫描循环数增加,PPy-ITO微电极的氧化峰电流值明显降低且氧化电压右移,10个循环后电容量为循环前的74%,提示PPy-ITO微电极的电活性和导电性降低。相反,GO/PPy-ITO微电极的电荷容量在10循环数后为循环前的95%,提示GO/PPy具有良好的电化学稳定性,其原因推测于GO与PPy骨架紧密耦合形成的特殊结构、电化学机械性能有关[23]。在第10个循环时,GO/PPy-ITO微电极的电容容量为287.12 mC/cm-2,大于PPy-ITO微电极的196.32 mC/cm-2的电容容量。其原因推测可归结于两个方面,一方面为GO掺杂进PPy内增加了涂层内部表面积提高了电荷容量,另一方面GO与PPy间的π-π堆叠有利于加速电荷转移[24]。
2.3GO/PPy纳米复合膜的生物相容性表征
GO/PPy纳米复合膜与细胞相互作用通过细胞粘附、铺展和增殖来表征。图5为A549细胞在GO/PPy膜和PPy膜表面接种2 h时的粘附相差图像和接种12 h时铺展细胞骨架荧光图像。
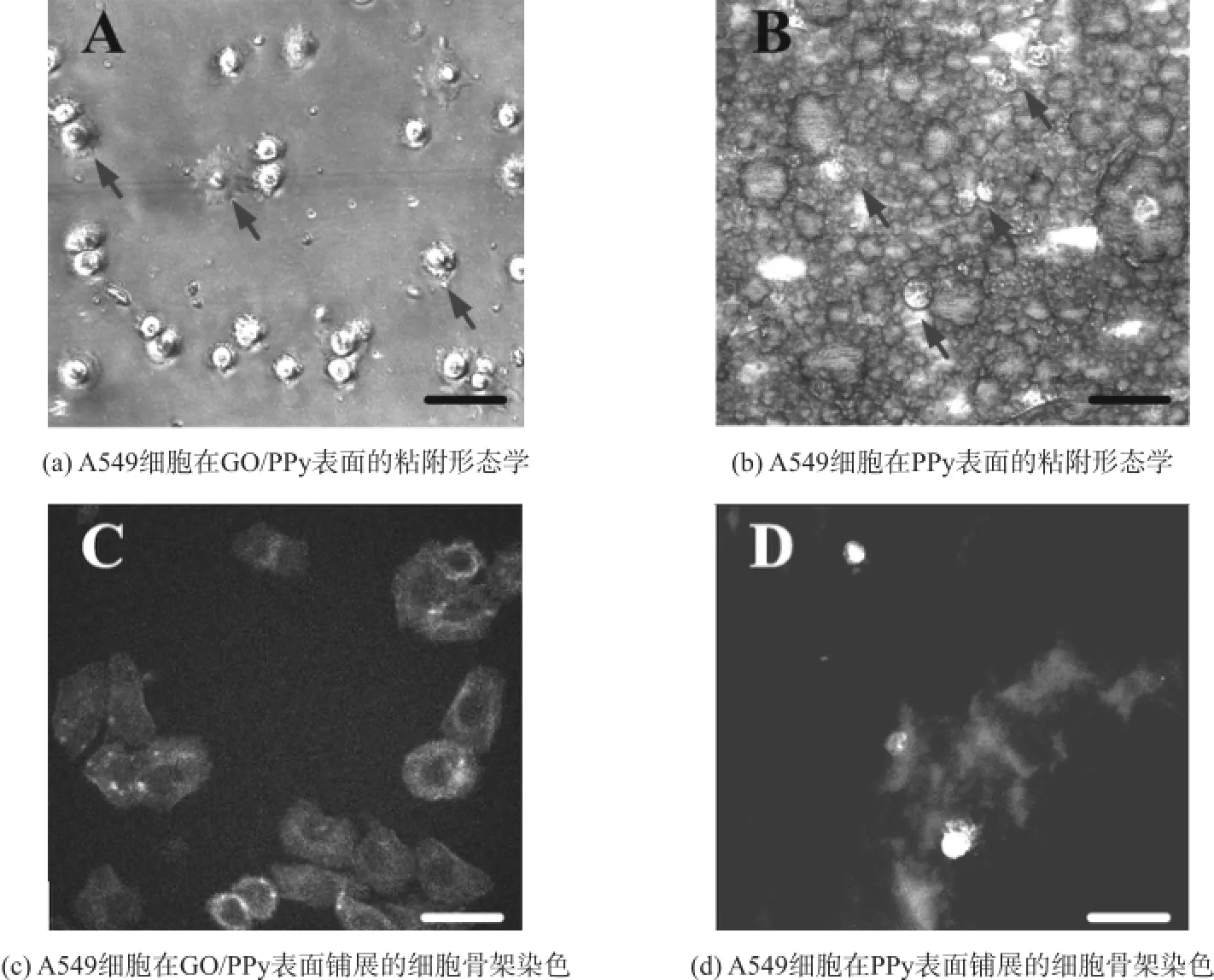
图5 A549细胞粘附和铺展(标尺为20 μm)
细胞粘附图像(图5(a)和5(b))显示接种在GO/PPy膜和PPy膜上的A549细胞均开始伸出伪足和粘附,提示电聚合的PPy膜能够支持A549细胞的粘附,其原因在于PPy膜能够吸附溶液中的蛋白并促进细胞的粘附[33]。同时,仔细观察图5(a)、5(b),发现A549细胞在GO/PPy膜上的铺展比例高于PPy膜,其原因推测与两者表面的物理化学性质存在差异有关,如表面粗糙度、亲水性等。为进一步证实GO/PPy和PPy膜对A549细胞铺展的影响,对接种在GO/PPy和PPy膜上12 h的A549细胞荧光染色细胞骨架进行观察,如图5(c)(D)所示。结果显示A549细胞在GO/PPy膜的数量和铺展状态优于在PPy膜上的铺展。上述结果提示了一步法电聚合制备的GO/PPy膜能够支持A549细胞的粘附和铺展,为细胞增殖提供良好的生物相容性界面。
A549细胞在GO/PPy膜、PPy膜和聚苯乙烯基底上分别接种24 h和48 h时的细胞相对增殖活性通过WST-8比色法进行分析,结果如图6所示。结果可见,A549细胞在GO/PPy膜上的相对细胞增殖活性高于聚苯乙烯和PPy,提示GO/PPy膜对A549细胞增殖具有优秀的细胞相容性。另外,A549细胞在PPy膜的相对细胞增殖率最低,其原因在于培养过程中PPy膜内掺杂的Cl离子溢出抑制了A549细胞增殖[33]。该结果说明一步法电聚合制备的GO/PPy纳米复合膜对A549细胞增殖具有优良的细胞生物相容性。
2.4GO/PPy-ITO微电极上A549细胞粘附增殖行为电化学阻抗谱检测
GO/PPy-ITO微电极上A549细胞的粘附增殖行为采用了电子细胞基底阻抗传感技术ECIS(Electric Cell-Substrate Impedance Sensing)原理进行检测。ECIS技术最早由Giaever和Keesed等[1,34]报道,采用平面金微电极作为检测电极,其基本原理为:当贴壁性细胞在金微电极表面粘附和增殖时,细胞作为一个不良导体元件阻碍电流从微电极流进电解质,使整个电极系统阻抗增大。当进行电化学阻抗谱检测时,部分高频区域的交流电压检测信号能够与细胞质膜发生电容性耦合使电流直接穿过细胞质膜进入电解质;对于大部分低频检测信号,电极电流主要通过细胞-电极间的狭窄通道和细胞-细胞间的间隙进入电解质。由于不同检测频率对应不同的电流路径,而不同电流路径反应不同的阻抗信息,因此通过对测量的电化学阻抗谱数据进行解析可分离并量化不同电路路径对应的阻抗信息,从而间接获取传感电极表面细胞生物学行为信息。在本研究中,以制备的GO/PPy-ITO微电极代替金微电极作为检测电极,A549细胞接种0、2 h、24 h、48 h和72 h时电极系统典型的电化学阻抗谱复平面图如图7(A)左所示,结果显示随着接种时间延长,电极系统阻抗谱特征发生明显改变,主要表现在高频区传荷过程控制的特征半圆直径增大。该结果说明A549细胞的粘附增殖行为导致电极界面上离子电荷转移速度减慢和电子转移阻抗增大,其原因与细胞质膜电容特征和离子导通性有关[35]。同时,空白对照GO/PPy-ITO微电极的阻抗谱特征在培养液中孵育不同时间后未出现传荷控制特征半圆,如图7(A)右所示,说明GO/PPy在培养液环境中具有良好的稳定性,同时提示图7(a)左的阻抗谱特征改变是由细胞粘附增殖引起。图7(b)为接种A549细胞不同时间后相对于接种细胞前电极系统的频率阻抗变化曲线和频率相位角变化曲线。频率阻抗变化曲线显示,在低频区域(1 Hz~10 000 Hz),细胞的粘附和增殖导致电极系统阻抗值增大,而高频区域(10 kHz~100 kHz)电极系统阻抗值变化与检测频率相关,且随着检测频率值增大阻抗值变化减少。此外,频率相位角变化曲线显示细胞在高频区域(10 kHz~100 kHz)出现一个明显的时间常数。根据ECIS原理可知,电化学阻抗谱低频区域主要反应细胞-电极间和细胞-细胞间的信息,高频区域则反应细胞质膜信息,因此根据电极系统电化学阻抗谱特征变化实现对细胞粘附增殖过程进行初步分析。
A549细胞在电极表面粘附增殖行为采用等效电路模型进行量化分析。GO/PPy-ITO微电极可由含Warburg电阻元件的Randles`电路的等效电路进行良好拟合,电极系统初始值见图7(c)。另外,根据细胞接种前后电极系统的阻抗谱特征变化,细胞可等效为一个RC并联电路和一个R元件串联组成[32]。因此,接种细胞后电极系统的等效电路模型由GO/PPy-ITO微电极等效电路和细胞等效电路模型串联而成,如图7(c)示。其中,细胞等效电路中R`s解释为细胞-电极的间隙电阻,Rcell解释为细胞-细胞间电阻,Ccell解释为细胞质膜的电容效应。采用非线性最小二乘法曲线拟合技术对电化学阻抗谱数据进行分析,得到接种不同时间点细胞等效电路各元件拟合结果,如图7(d)所示。结果显示,随着A549细胞在GO/PPy-ITO微电极表面的粘附和增殖,Ccell在2 h~24 h迅速降低,细胞完全铺展至形成生长形成细胞单层(24 h~72 h),Ccell稳定在5.8 nF~6.5 nF,低于A549细胞在PPy-ITO微电极表面的10.2 nF~10.6 nF。该值变化与细胞粘附增殖过程中细胞厚度降低、铺展面积增大、细胞离子通道数量和开闭有关[36]。A549细胞在GO/PPy-ITO表面增殖中的Rcell值持续增大,72 h时Rcell值达到最大,约为1864 Ω,而在PPy-ITO表面在48 h达到最大,约为1 068 Ω。由于Rcell值持续增加反应细胞-细胞间的间隙缩小,细胞融合度增加[37],因此说明A549细胞在GO/PPy表面增殖活性优于PPy表面,该结果与WST-8比色法分析吻合。此外,A549细胞在GO/PPy-ITO表面R`s值在接种48 h后达到最大,约为221 Ω,在72 h时降低为192.5 Ω。R`s值的变化提示在48 h时细胞与GO/PPy-ITO电极间间隙最小,细胞粘附强度最强,细胞的进一步增殖导致细胞与GO/PPy-ITO电极间隙增大,细胞开始脱落[37]。此外,结果还显示A549细胞在PPy-ITO表面接种48 h后R`s值达到160 Ω最大值,低于GO/PPy-ITO测量值,提示A549细胞与GO/PPy表面粘附强度高于PPy。
3 结论
本研究发展一种基于GO/PPy-ITO微电极的细胞阻抗生物传感器,并通过对A549细胞粘附增殖检测对构建的细胞阻抗传感器进行原理性验证。GO/PPy-ITO微电极采用一步法电聚合技术在ITO微电极表面原位沉积GO/PPy纳米复合物制备而成;通过对GO/PPy-ITO微电极的表面粗糙度、拓扑形貌、电化学性能及细胞生物相容性进行详细表征,显示GO/PPy-ITO微电极具有平整的表面形貌、疏松多孔结构特征、优良的电化学活性和稳定性及良好的细胞生物相容性;在此基础上,以制备的GO/PPy-ITO微电极作为传感电极,利用电化学阻抗谱技术和等效电路拟合技术成功对微电极表面上的A549细胞粘附增殖行为学信息进行检测;本研究不但证实了通过简单的一步法电聚合制备的GO/PPy纳米复合物能够作为细胞传感器潜在的纳米传感界面,而且证实了基于GO/PPy-ITO微电极构建的细胞阻抗传感器能够成功实现细胞粘附增殖行为学检测,未来将广泛应用于活细胞分析及药物效应研究中。
[1]Giaever I,Keese C R.Monitoring Fibroblast Behavior in Tissue Culture with an Applied Electric Field[J].Proceedings of the Na⁃tional Academy of Sciences,1984,81(12):3761-3764.
[2]Yu H,Wang J,Liu Q,et al.High Spatial Resolution Impedance Measurement of EIS Sensors for Light Addressable Cell Adhesion Monitoring[J].Biosensors and Bioelectronics,2011,26(6):2822-2827.
[3]Vistejnova L,Dvorakova J,Hasova M,et al.The Comparison of Impedance-Based Method of Cell Proliferation Monitoring with Commonly Used Metabolic-Based Techniques[J].Neuro Endocri⁃nology Letters,2009(1):121-127.
[4]Kiilerich-Pedersen K,Poulsen CR,Jain T,et al.Polymer Based Biosensor for Rapid Electrochemical Detection of Virus Infection of Human Cells[J].Biosensors and Bioelectronics,2011,28(1):386-392.
[5]Gu W,Zhu P,Jiang D,et al.A Novel and Simple Cell-Based Elec⁃trochemical Impedance Biosensor for Evaluating the Combined Toxicity of DON and ZEN[J].Biosensors and Bioelectronics,2015,70:447-454.
[6]苏凯麒,邹玲,王琴,等.基于细胞阻抗传感器的腹泻性毒素检测系统设计与实现[J].传感技术学报,2014,27(3):283-288.
[7]王天星,黎洪波,苏凯麒,等.基于细胞电阻抗传感器的细胞多生理参数分析系统设计[J].传感技术学报,2014,27(12):1589-1595.
[8]Arndt S,Seebach J,Psathaki K,et al.Bioelectrical Impedance As⁃say to Monitor Changes in Cell Shape During Apoptosis[J].Bio⁃sensors and Bioelectronics,2004,19(6):583-594.
[9]Venkatanarayanan A,Keyes T E,Forster R J.Label-Free Imped⁃ance Detection of Cancer Cells[J].Analytical Chemistry,2013,85(4):2216-2222.
[10]Choi C K,English A E,Jun S I,et al.An Endothelial Cell Compat⁃ible Biosensor Fabricated Using Optically Thin Indium Tin Oxide Silicon Nitride Electrodes[J].Biosensors and Bioelectronics,2007,22(11):2585-2590.
[11]Du D,Cai J,Ju H,et al.Construction of a Biomimetic Zwitterionic Interface for Monitoring Cell Proliferation and Apoptosis[J].Lang⁃muir,2005,21(18):8394-8399.
[12]Dreyer D R,Park S,Bielawski C W,et al.The Chemistry of Gra⁃phene Oxide[J].Chemical Society Reviews,2010,39(1):228-240.
[13]Chang Y,Yang ST,Liu J H,et al.In Vitro Toxicity Evaluation of Graphene Oxide on A549 Cells[J].Toxicology Letters,2011,200(3):201-210.
[14]Zhang D,Zhang Y,Zheng L,et al.Graphene Oxide/Poly-L-Lysine Assembled Layer for Adhesion and Electrochemical Impedance Detection of Leukemia K562 Cancer Cells[J].Biosensors and Bio⁃electronics,2013,42:112-118.
[15]Guo C X,Ng S R,Khoo S Y,et al.RGD-Peptide Functionalized Graphene Biomimetic Live-Cell Sensor for Real-Time Detection of Nitric Oxide Molecules[J].ACS Nano,2012,6(8):6944-6951.
[16]Ates M.A Review Study of(Bio)Sensor Systems Based on Con⁃ducting Polymers[J].Materials Science&Engineering C Materi⁃als for Biological Applications,2013,33(4):1853-1859.
[17]Ding L,Hao C,Zhang X J,et al.Carbon Nanofiber Doped Polypyr⁃role Nanoscaffold for Electrochemical Monitoring of Cell Adhe⁃sion and Proliferation[J].Electrochemical Communication,2009,11:760-763.
[18]Chen W,Lu Z,Li C M.Sensitive Human Interleukin 5 Impedimet⁃ric Sensor Based on Polypyrrole-Pyrrolepropylic Acid-Gold Nano⁃composite[J].Analytical Chemistry,2008,80(22):8485-8492.
[19]Roh S H.Electricity Generation from Microbial Fuel Cell with Polypyrrole-Coated Carbon Nanofiber Composite[J].Journal of Nanoscience and Nanotechnology,2015,15(2):1700-1903.
[20]Li S,Shu K,Zhao C,et al.One-Step Synthesis of Graphene/Poly⁃pyrrole Nanofiber Composites SAs Cathode Material for a Biocom⁃patible Zinc/Polymer Battery[J].ACS Applied Materials&Inter⁃faces,2014,6(19):16679-16686.
[21]Sanjib Biswas,Lawrence T Drzal.Multilayered Nanoarchitecture of Graphene Nanosheets and Polypyrrole Nanowires for High Per⁃formance Supercapacitor Electrodes[J].Chemistry of Materials,2010,22(20):5667-5671
[22]Mini P A,Balakrishnan A,Nair S V,et al.Highly Super Capaci⁃tive Electrodes Made of Graphene/Poly(Pyrrole)[J].Chemical Communications(Cambridge,England),2011,47(20):5753-5.
[23]Chengzhou Zhu,Junfeng Zhai,Dan Wen,et al.Graphene Oxide/ Polypyrrole Nanocomposites:One-Step Electrochemical Doping,Coating and Synergistic Effect for Energy Storage[J].Journal of Materials Chemistry,2012,22:6300-6306.
[24]LüZhisheng,Chen Yanfeng,Wei Hengchen,et al.One-Step Elec⁃trosynthesis of Polypyrrole/Graphene Oxide Compositesfor Micro⁃bial Fuel Cell Application[J].Electrochimica Acta,2013,111:366-373
[25]Guo M,Chen J,Zhang Y,et al.Enhanced Adhesion/Spreading and Proliferation of Mammalian Cells on Electropolymerized Por⁃phyrin Film for Biosensing Applications[J].Biosensors and Bio⁃electronics,2008,23(6):865-871.
[26]李远,胡帆,廖娟,等.一种基于感光干膜-铟锡氧化物电极的简易细胞阻抗传感器实现细胞形态学和阻抗信息同时检测[J].传感技术学报,2015,28(6):779-786.
[27]Patois T,Lakard B,Monney S,et al.Characterization of the Surface Properties of Polypyrrole Films:Influence of Electrodeposition Pa⁃rameters[J].Synthetic Metals,2011,161(21/22):2498-2505.
[28]Castano H,O’Rear E A,McFetridge P S,et al.Polypyrrole ThinFilms Formed by Admicellar Polymerization Support the Osteo⁃genic Differentiation of Mesenchymal Stem Cells[J].Macromolec⁃ular Bioscience,2004,4(8):785-794.
[29]Li X,Sun J,He G,et al.Macroporous Polypyrrole-TiO2Compos⁃ites with Improved Photoactivity and Electrochemical Sensitivity[J].Journal of Colloid and Interface Science,2013,411:34-40.
[30]Zhang L L,Zhao S,Tian X N,et al.Layered Graphene Oxide Nanostructures with Sandwiched Conducting Polymers as Superca⁃pacitor Electrodes[J].Langmuir,2010,26(22):17624-17628.
[31]Cui X Y,Hetke J F,Wiler J A,et al.Electrochemical Deposition and Characterization of Conducting Polymer Polypyrrole/PSS on Multichannel Neural Probes[J].Sensors and Actuators A:Physi⁃cal,2001,93(1):8-18.
[32]Affar S K,David R S C,Mathis R,et al.Development of a Con⁃ducting Polymer Cell Impedance Sensor[J].mailto:a.karimul⁃lah.1@research.gla.ac.ukSensorsandActuatorsB:Chemical, 2013,176:667-674.
[33]Gelmi A,Ljunggren M K,Rafat M,et al.Influence of Conductive Polymer Doping on the Viability of Cardiac Progenitor Cells[J]. Journal of Materials Chemistry,2014,24(2):3860-3867.
[34]Giaever I,Keese C R.Micromotion of Mammalian Cells Measured Electrically[J].Proceedings of the National Academy of Sciences of the United States of America,1991,88(17):7896-7900.
[35]Ateh D D,Waterworth A,Walker D,et al.Impedimetric Sensing of Cells on Polypyrrole-Based Conducting Polymers[J].Journal of Biomedical Materials Research:Part A,2007,83(2):391-400.
[36]Hong J,Kandasamy K,Marimuthu M,et al.Electrical Cell-Sub⁃strate Impedance Sensing As a Non-Invasive Tool for Cancer Cell Study[J].Analyst,2011,136(2):237-245.
[37]Benson K,Cramer S,Galla H J.Impedance-Based Cell Monitor⁃ing Barrier Properties and Beyond[J].Fluids and Barriers of the CNS,2013,10(1):5-16.
李远(1985-),男,重庆医科大学,博士研究生,主要研究方向为微流控芯片及细胞生物传感器,liyuan_1985999@ 163.com;

刘北忠(1970-),男,重庆医科大学,教授,博士生导师,主要研究方向为生物医学微纳米技术与系统、肿瘤分子诊疗靶点筛选等,lbzemail@163.com。
EEACC:7230J10.3969/j.issn.1004-1699.2016.06.001
基于氧化石墨烯/聚吡咯-铟锡氧化物微电极的细胞阻抗生物传感器构建及细胞粘附增殖行为检测*
李远1,2,张晶1,廖娟1,王条敏1,刘北忠1*,于超2,张玲玲1
(1.重庆医科大学附属永川医院中心实验室,重庆402160;2.重庆医科大学生命科学研究院,重庆400016)
构建一种基于氧化石墨烯/聚吡咯-铟锡氧化物GO/PPy-ITO(Graphene Oxide/Polypyrrole-Indium Tin Oxide)微电极的细胞阻抗生物传感器并用于细胞粘附增殖行为学检测。ITO微电极采用光刻技术对感光干膜绝缘层蚀刻而成,通过一步法电聚合技术在ITO微电极表面沉积GO/PPy纳米复合膜制备GO/PPy-ITO微电极;形状测量激光显微镜和扫描电子显微镜分别对GO/ PPy表面粗糙度和拓扑形貌进行表征;电化学循环伏安法及阻抗谱表征GO/PPy-ITO微电极的电化学性质;人肺癌细胞株A549粘附、铺展和增殖实验考察GO/PPy界面的生物相容性;以GO/PPy-ITO微电极作为传感电极,利用电化学阻抗谱技术对A549细胞的粘附增殖行为进行检测。结果显示,ITO微电极表面上电沉积的GO/PPy纳米复合物表面平整,分布大量的微孔结构;电化学实验结果显示GO/PPy-ITO微电极比裸ITO微电极具有更低的阻抗特征和更高的电化学活性;GO/PPy比纯PPy膜更能促进A549细胞粘附、铺展和增殖;GO/PPy-ITO微电极表面A549细胞的粘附增殖行为改变电极系统的阻抗谱特征,通过对阻抗谱数据进行等效电路拟合分析获得细胞粘附增殖行为学信息。本文发展的GO/PPy-ITO微电极兼具优良的电化学性质和细胞生物相容性,基于该电极系统构建的细胞阻抗生物传感器可用于细胞病理生理学行为、药物筛选等研究领域。
2015-12-07修改日期:2016-02-02
生物传感器;电化学阻抗检测;氧化石墨烯;聚吡咯;铟锡氧化物;细胞增殖
TP212.3
A
1004-1699(2016)06-0787-10
项目来源:重庆市科委自然科学基金计划资助项目(CSTC2012JJA10046);重庆市永川区创新能力建设平台项目(YCSTC,2014bf5001);重庆医科大学附属永川医院院级研究项目(YJZD201302,YJZQN201534)资助
猜你喜欢
杂志排行
传感技术学报的其它文章
- Acetone Gas Sensor Based on Al-Doped ZnO and Influence of Ultraviolet Excitation on Gas-Sensing Properties*
- Research of Fusion Classification of EEG Features for Multi-Class Motor Imagery*
- An Improved Method for Noninvasive Detection of Blood Glucose of Conservation of Energy Metabolism*
- Genetic Algorithms of Electromagnet in Longitudinal Wave Electromagnetic Utrasonic Dtection for Auminum Pate*
- Simulation and Experimental Investigation of Thickness Measurement Using Pulsed Eddy Current Technique*
- Development of a High-Precision Silicon Piezoresistive Pressure Transmitter Based on Array Measurement and Data Fusion*
