现代商品仔猪肾细胞系SDPK-D的培育
2016-09-08胡鸿惠于文涛黄健强南文金吴静波韶关学院资产与实验室管理处动物疫病实验室广东韶关512005
胡鸿惠,于文涛,黄健强,南文金,吴静波(韶关学院资产与实验室管理处动物疫病实验室,广东韶关512005)
现代商品仔猪肾细胞系SDPK-D的培育
胡鸿惠,于文涛,黄健强,南文金,吴静波
(韶关学院资产与实验室管理处动物疫病实验室,广东韶关512005)
将胰酶消化法和差速贴壁等方法相结合,分离纯化仔猪肾上皮细胞,在体外进行传代培养,成功得到一株可以连续传代的细胞株SDPK-D.SDPK-D是首次针对现代商品猪培育的新的传代细胞系,将为相关病毒的分离培养提供新的细胞系选择.
仔猪肾细胞;原代培养;传代培养;细胞
目前,广泛用于动物病毒培养的细胞系主要是引进外国建立的细胞株,这些旧的细胞系在应用中出现了不少问题,研究的发展迫切期待新的、敏感性更高、适应性更好细胞系的诞生.一方面,常用传统细胞系已经过几十年的传代,发生了一些变异,如细胞形态、核型、生产速率、产酸率等,导致对病毒的敏感性发生了变化.另一方面,动物病毒在新的生物环境下不断的发生变异,对已有细胞系的敏感性下降,造成培养难度加大,培养的病毒滴度低等.本研究选择当前饲养面广、饲养量大的现代杂交商品猪仔猪为原始材料,利用细胞培养技术筛选培育出一株仔猪肾细胞系,命名为SDPK-D.该SDPK-D细胞系是针对现代商品猪特意培育的新的细胞系,将为相关动物病毒的分离培养提供新的选择.
1 材料与方法
1.1主要材料与仪器
材料:新生仔猪来自韶关某猪场;1640培养基购自GIBCO公司;水解乳蛋白购自BIOSHARP;胰蛋白酶购自AMRESCO公司;青、链霉素购自哈尔滨制药六厂;胎牛血清购自天杭生物科技有限公司;DNA提取试剂、PCR扩增酶试剂、DNA分子量标准等购自大连宝生物有限公司;检测引物由大连宝生物有限公司合成.
仪器:AC2-4S1Ⅱ型生物安全柜,Esco公司;DMI 3000B倒置显微镜,Leica公司;311恒温CO2培养箱,Thermo公司;SKFG-01B鼓风干燥箱,上海精风仪器厂;PTC-200 DNA扩增仪,MJ公司;CLASSICUVF超纯水仪器,ELGA公司;MLS-3750全自动高压灭菌锅,三洋公司.
1.2仔猪肾细胞的原代培养
取初生至几天龄仔猪,颈动脉放血致死,用7%新洁尔灭溶液进行消毒,在生物安全柜中进行无菌操作,取下仔猪的左右肾,剥离肾包膜,将纤维组织较多的髓质部弃去,把皮质部剪成直径约为2 mm的小块,用各含1 μ/mL青霉素和链霉素的PBS液冲洗3~4次,将血凝块和红细胞等除去,继续将皮质小块剪碎成尽可能小的组织块,再次冲洗3~4次.向其中加入0.25%胰酶溶液,于37℃水浴消化,至发现组织块上有白色絮状物时弃去胰酶,加入含10%血清的水解乳蛋白-Hanks液终止消化,用6层纱布进行过滤,将滤液分装在玻璃细胞培养瓶中,置于37℃、5%CO2培养箱中培养.次日起,视酸碱度改变决定换液量,细胞生长少的瓶,进行半量营养液,细胞生长多的瓶则全部换新营养液,一般营养液维持在pH 7.1~7.2的范围[1-2].
1.3仔猪肾细胞的传代培养
当细胞生长铺满培养瓶底达到80%以上的面积,进行传代培养.将瓶塞打开,用玻璃吸管吸去旧的营养液,加入约5 mL灭菌PBS液冲洗细胞表面3次,清除残存营养液,然后继续用玻璃吸管吸取.最后加入0.5 mL 0.25%胰酶,加塞,静置观察,让细胞层逐步脱落.当部分或大部分细胞已脱落时,打开瓶塞,加入10 mL营养液,用吸管作5~20次冲散操作,制成细胞悬液.用吸管取一半含有细胞的营养液的细胞悬液转移到一个新的细胞瓶作为传代,另一半量则留在原瓶中.新、旧瓶加盖后,放置于37℃、5%CO2培养箱中继续培养.
每次传代后,在37℃、5%CO2培养箱中静置培养30~50 min,然后镜下观察细胞贴壁情况,取出并轻微振荡细胞瓶,用吸管将未贴壁细胞悬液吸出接种到另一个培养瓶内,继续放入培养箱内培养.每次传代均如此处理,纯化上皮细胞,直至在显微镜下观察细胞形态接近上皮样,而非杂乱的多形态细胞.
1.4仔猪肾细胞系生长曲线和细胞活率的测定
用含9%牛血清营养液培养细胞,待细胞长至对数生长期,胰酶消化制成细胞悬液,稀释10倍后进行计数.根据计数结果,将细胞悬液稀释到2×104个/mL.然后将稀释好的细胞悬液接种到24孔培养板内,放于37℃、5%CO2培养箱内培养.培养开始后,每24 h收集3孔细胞,原液计数,求3个孔细胞数的平均值,直至第8组结束.以培养时间(天)为横坐标,细胞数目(个)为纵坐标,绘制细胞的生长曲线,并计算出细胞的倍增时间.取细胞达到增长峰值前一天所计算得到的细胞总数(Y),接种细胞数量(X)及生长时间(T)进行计算,倍增时间=T/A(式中:A=log2Y/X).
取处于生长对数期的培养细胞进行台盼蓝染色,计算活细胞和死细胞数量,总细胞数不少于500个,细胞活率=活细胞数/(活细胞数+死细胞数).
1.5细菌检测
配置无菌肉汤培养基,在无菌条件下分别接种细胞悬液和大肠杆菌质控菌株,放置于37℃生化培养箱培养24 h,观察.随后继续放置24 h,观察细菌生长情况.
1.6支原体检测
利用支原体 16S rRNA基因通用引物进行 PCR扩增.通用引物序列为:16S rRNA-forward:5'-GAACGGGTGAGTAACACGT-3';16S rRNA-reverse:5'-GGTGTTCTTCCTAATATCTACG-3'.PCR反应体系为20 μL,其中2×Taq Mixture10 μL,Primers(10 μmol/L)各0.8 μL,支原体DNA模板3.0 μL,去离子水5.4 μL.PCR反应程序如下:94℃预变性10 min;94℃变性1 min,60℃退火1 min,72℃延伸1 min,30个循环;72℃延伸10 min.
2 结果
2.1原代培养细胞形态变化
原代细胞悬液接种细胞瓶后的8~12h可见部分贴壁,贴壁的细胞周围有上皮细胞生长;贴壁后2d左右,显微镜下可以观察到有少量成纤维细胞成放射状生长;3~5d贴壁生长的细胞逐渐增多,且趋于汇合,并呈界限明显或者不明显的片状、放射状、流水状生长状况.原代培养的细胞形态较多样,有呈梭形、三角形、立方形、不规则形等.
2.2传代细胞培育过程中的形态变化
在本细胞系的培育过程中,细胞形态出现了三个阶段的变化.第一阶段,最初的培养物中有一般原代细胞培养物中见到的近方形的、排列比较紧密的类上皮细胞,疏松的纺锤状或星状的纤维母细胞(见图1和2);第二阶段,细胞代次停留在第7~10代之间.肉眼可以看见圆形的互不相连的类上皮细胞集落,在显微镜下细胞呈一定的平行排列.第三阶段,为第15代左右,个别细胞培养瓶出现比其他细胞显得发亮、生长较快的新型细胞.新型细胞的排列无定向,细胞集落相遇后继续生长,逐步融合在一起,这些细胞逐步代替了其他细胞,最后连成一片的类上皮型细胞培养物了.随后的培育过程中,细胞形态稳定,绝大部分呈现梭形、多角形,且细胞大小均匀,生长速度较快,第三至四天可以形成细胞蔟,第五天基本达到90%覆盖单层(见图3和4).
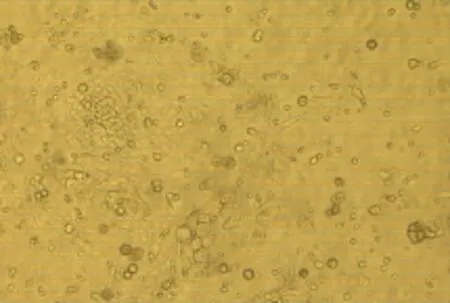
图1 原代细胞培养40h形态(×400)
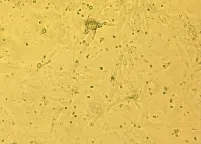
图2 原代细胞培养第五天细胞形态(×400)
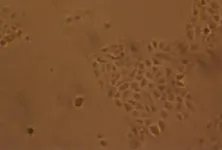
图3 第20代细胞40h形态(×400)

图4 第20代细胞第五天形态(×400)
2.3传代细胞培育过程中速度变化
以SDPK-D细胞各代次每瓶第一次传代所需平均日数为细胞生长速度的指标,即日数越多生长越慢,第1~5代细胞生长速度与初分离出的细胞生长速度相对较快,到了第6代生长速度变慢,这时大部分细胞瓶内的大部分细胞都相继发生死亡,能作传代的细胞与第一次传代所需时间比第5代增加了.到第8代左右可以分为两个发展很不同的方向,其中出现一个细胞瓶以上皮细胞为优势群的新型细胞生长速度较慢,另一个细胞瓶以成纤维细胞为优势群的细胞生长速度较快.随后细胞继代均能顺利进行,而且其生长速度保持稳定.从第15代开始,细胞形态和大小等基本处于平稳状态.
2.4细胞生长曲线的测定和活率
本实验选择了第33代细胞为生长曲线测定目标.连续8天进行细胞计数,结果见表1.测定细胞倍增时间为40.5 h,细胞活率能达到97.55%.根据细胞计数结果,绘制该第33代培养物生长曲线图(见图5).

表1 SDPK-D生长细胞计数
2.5细菌检测和支原体检测
进行的细菌检测结果表明,培育细胞悬液组,无细菌、真菌污染,在不含双抗的培养基中,细胞生长状况良好,培养基保持明亮清澈;而阳性对照组,培养基变浑浊,在显微镜下观察可以见到明显的细菌活动.
进行的支原体检测结果表明,细胞中均未检测出支原体核酸,见图6.
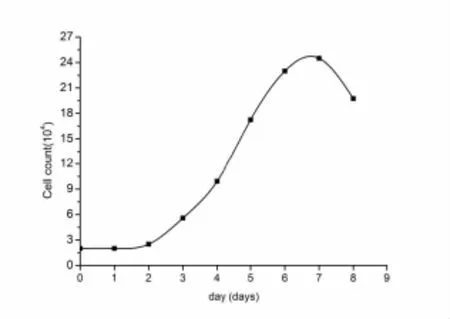
图5 SDPK-D细胞生长曲线图
3 讨论
传统的肾上皮细胞的分离方法包括组织块法、消化法等.一般情况下,组织块法较难控制成纤维细胞的生长,已经被淘汰.现在学者们大多采用消化法,而常用的用来消化的生物酶有胰酶、胶原酶,胶原酶又分为Ⅰ型、Ⅱ型、Ⅲ型、Ⅳ型、Ⅴ型和肝细胞专用胶原酶[3].研究采用胰酶消化以及差速贴壁相结合的方法分离纯化猪肾上皮细胞,取得了较好的效果.
从原代细胞中选育、分离培养出高纯度的肾上皮细是本研究的目的.选择培育肾上皮细胞为目标,朝着两个方向对细胞进行选育.第一是在形态上选择类上皮细胞样的细胞为主,第二是选择的细胞具有良好的贴壁性.原代细胞株顺利地转变为传代细胞系的相关报道极少,一般需要加以特别的培育[4].生物的变异是通过许多世代交替实现的一种缓慢的、且不可避免的动态过程.只要能使细胞存活并且进行繁殖就能使其发生变异而成为传代细胞系.通常采用的传代细胞系培育途径,就是等待原代细胞株传代到生长显著衰退之前停止继代,只作经常换液,等待出现逐步占优势的变异细胞生势下降到极点,再出现回升是原代细胞株发生变异而成为传代细胞系主要标志[5].本实验培育传代细胞系至第33代的研究工作就集中在这8、9个月里.细胞历经传代变异,达到形态、生长速度基本稳定.
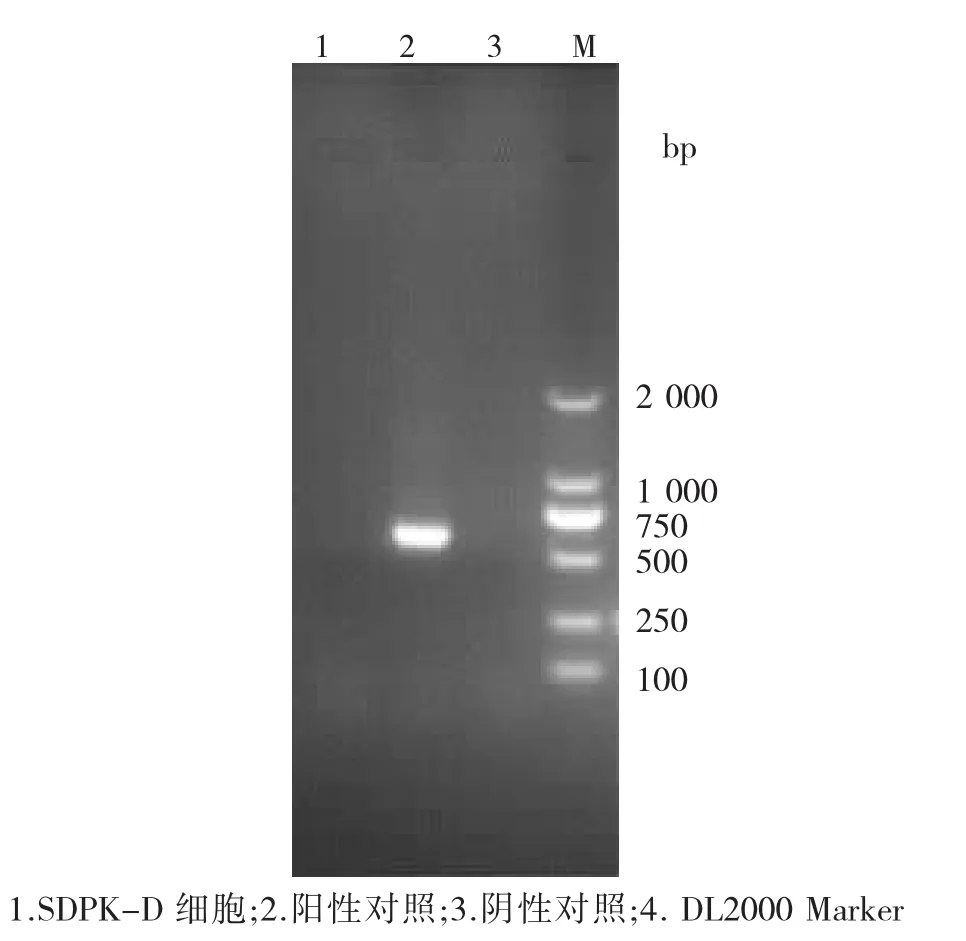
图6 支原体检测结果
细胞系育成的过程中,虽然没有作详细的测量,大部分细胞瓶内的细胞均生长很慢而最终死亡,在生势衰退的原代细胞株的细胞群体中出现了生长速度稳定、贴壁性好的细胞群体.通过有目的的选育上皮细胞,同时采取两个办法:一是传代时保留原瓶,二是做原代培养时使用水解乳蛋白液-Hanks液为培养基进行小瓶培养.在第8代细胞培养物中,有一些变异的细胞,形态类上皮样,成一块生长,细胞贴壁型明显优于其他部位的细胞,但数量不大,生长较慢.因为细胞的贴壁性非常重要,只有足够数量的细胞迅速贴在培养瓶内壁上,才会开始积极代谢而合成非必需氨基酸等有用物质.而原瓶内已存在未脱落的细胞,它们可以马上生产有用的代谢产物,水解乳蛋白液Hanks液中的葡萄糖和磷酸盐起反应产生了促进贴壁的物质,玻璃材质的细胞瓶内壁有利于细胞的贴附[4].该细胞系从第15代到33代的细胞均处于较稳定的状况,而第33代细胞生长曲线的测定也证实了本试验做出的判段.
无菌操作对于细胞培养至关重要,在细胞培养过程中应该高度重视无菌原则,尤其注意以下几个方面,一是相关试剂的配置要符合无菌操作要求,二是所有器皿均必须认真清洗和充分消毒,三是所有样品进入无菌间和生物安全柜前都应该用75%的酒精棉球或新洁尔灭擦拭,实验过程中每一步操作都应严格遵循实验原则和无菌要求[6].
4 展望
一般情况下,从动物体分离的细胞,一般能够继续增殖,但传代次数很有限,最终会死亡.在一定的条件或者特殊情况下,极少数细胞株能够发生变异,成为能不断传代的细胞,继而发展培育成为传代细胞系,一方面,将继续培育和观察SDPK-D细胞的生长情况与状况.另一方面,对体外培育目的细胞,除了做一般的形态学观察,还需要进一步作免疫组化鉴定以求辨认细胞内特定抗原,比如角蛋白、波形蛋白等.继续将对培育的SDPK-D细胞系再做关于染色体核型、细胞类型等进一步的鉴定工作.同时将开展相关实验证明该传代细胞系能否感染病毒,和对不同病毒的敏感性差异等鉴定和应用工作,以求获得一株具有新适应性、稳定传代的细胞系应用于相关研究,为兽用生物制品的研发提供新的、更有优势的素材.
[1]王东,吴雄飞,金锡御.大鼠肾小管上皮细胞的原代培养及传代[J].中华实验外科杂志,1999,3(2):179-180.
[2]鄂征.组织培养和分子细胞学技术[M].北京:北京出版社,1994.
[3]司徒镇强,吴军正.细胞培养[M].北京:世界图书出版公司,2001.
[4]刘福安.幼猪肾BPK(Ⅳ)传代细胞系培育的研究[J].中国兽医杂志,1979(10):1-4.
[5]周峰,杜贤进,董长垣,等.原代肾上皮细胞改良培养方法[J].中国组织工程研究与临床康复,2009,13(11):2101-2104.
[6]王献伟,卢晟盛,卢克焕.新生广西巴马小型猪肾成纤维细胞体外培养体系的建立[J].中国兽医学报,2011,31(10):1526-1532.
Cultivation of a Modern Commercial Piglet Kidney Cell Line
HU Hong-hui,YU Wen-tao,HUANG Jian-qiang,NAN Wen-jin,WU Jing-bo
(Animal Disease Lab,Assets and Lab Department,Shaoguan University,Shaoguan 512005,Guangdong,China)
By trypsin digestion and differential velocity adherent combination method,the experiment separated and purificated some porcine kidney epithelial cells,and continuously subcultured them in vitro.At last,it got a strain named SDPK-D which could be serially passaged.SDPK-D is a new cultivated cell line from modern commercial pig for the first time,providing a new selection for the isolation and culture of virus.
piglet kidney cell;primary culture;subculture;cell
S8
A
1007-5348(2016)06-0053-05
(责任编辑:闫文龙)
2016-05-10
广东省协同创新平台项目(YJK-2014-52-16);韶关市科技计划项目(2013CX/NO6,韶科[2015]72号).
胡鸿惠(1982-),女,湖南郴州人,韶关学院资产与实验室管理处动物疫病实验室助理研究员,硕士;研究方向:动物生产与疾病控制.
