基于中药指纹图谱结合化学模式识别的清开灵软/硬胶囊的成分分析
2016-09-08滕会会杜守颖李鹏跃田志浩
滕会会 杜守颖 白 洁 陆 洋 李鹏跃 张 晴 杜 秋 王 振 田志浩
基于中药指纹图谱结合化学模式识别的清开灵软/硬胶囊的成分分析
滕会会杜守颖白洁陆洋李鹏跃张晴杜秋王振田志浩
目的 对清开灵软/硬胶囊化学成分进行全面整体分析。方法 采用HPLC-DAD建立5种指标性成分含量测定及指纹图谱方法;通过模式识别技术进行整体分析,并寻找出两者差异最大的化学成分。结果 两者胆酸、猪去氧胆酸和黄芩苷含量差异较小,绿原酸和栀子苷含量差异较大;PCA分析得到59个化学成分浓度在软胶囊中高,40个化学成分浓度在硬胶囊中高,PLS分析得到对两者差异性贡献度最大的16个成分。结论 清开灵软/硬胶囊化学成分存在明显的差异;多成分定量结合指纹图谱与化学模式识别技术可用于化学成分的全面分析。
化学模式识别; HPLC指纹图谱; 清开灵软/硬胶囊; 含量测定
清开灵作为纯中药复方制剂,具有清热解毒、化痰通络、醒神开窍的功效,目前被制成多种剂型[1],由于清开灵注射剂不良反应多[2],口服制剂越来越受青睐。当前临床应用广泛的两种口服制剂——硬胶囊和软胶囊,两者虽然处方相同,但制备工艺明显有别[1],这使得两种制剂的化学成分可能存在差异。而化学成分不同,其相互间的促进或抑制作用及对酶活性的影响等均有一定差异,从而导致不同制剂在吸收、代谢、排泄以及作用机理和不良反应上存在一定差异[3-5],临床使用也随之调
中药指纹图谱技术是一种表征中药所含成分与其质量关系的有效手段,但目前采用相似度评价,不能对所含成分进行立体多维的整体分析,而化学模式识别能实现中药多维信息的综合分析,已广泛应用于中药材及中成药的研究[7-11]。因此,本实验以清开灵软/硬胶囊为研究对象,对比两者指标性成分含量,进一步采用HPLC-DAD建立清开灵软硬胶囊指纹图谱,再结合模式识别方法对清开灵软/硬胶囊化学成分进行整体性分析,为进一步谱效关系、体内吸收、代谢等深入研究奠定基础,也为不同剂型比较研究提供一种新手段。
1 仪器与试药
日本岛津高效液相色谱仪(LC-20AD泵,SIL-20A自 动 进 样 器,SPD-M20A检 测 器);KQ5200DA型数控超声波清洗器(昆山市超声仪器有限公司),分析天平(赛多利斯仪器系统有限公司);G20型医用离心机(北京白洋医疗机械有限公司)。
黄芩苷对照品(中国食品药品检定研究院,批号:110715-201318);栀子苷对照品(中国食品药品检定研究院,批号:110749-201115);绿原酸对照品(中国食品药品检定研究院,批号:110753-201314);胆酸对照品(中国食品药品检定研究院,批号:100078-201415);猪去氧胆酸对照品(中国食品药品检定研究院,批号:100087-201411);甲醇、乙腈(Fisher公司,色谱纯);磷酸(TED公司,色谱纯);哇哈哈纯净水(杭州娃哈哈集团有限公司);清开灵软胶囊(神威药业集团有限公司,批号:14072411,15052042,15051641,15051941,15051841,15051942,15052041,15052241,15051741,15052111,15052141,每粒0.4 g,含黄芩苷20 mg),清开灵硬胶囊(广州白云山明兴制药有限公司,批号:141208,140607,548902,549009,141001,140711,141041,549010,141143,150142,140512,每粒 0.25 g,含黄芩苷10 mg)。
2 实验方法与结果
2.1胆酸、猪去氧胆酸、绿原酸、栀子苷、黄芩苷5种指标性成分含量测定
线性关系考察、精密度、稳定性、重复性及加样回收率均参照2015版《中华人民共和国药典》四部(药品质量标准分析方法验证指导原则9101),结果均符合要求。样品含量测定结果表明胆酸、栀子苷、黄芩苷含量均在药典含量限定范围内。按临床口服剂量(软胶囊口服1粒/次,硬胶囊口服2粒/次)计算结果表明软/硬胶囊中绿原酸和栀子苷含量差异较大,胆酸、猪去氧胆酸和黄芩苷含量差异较小。
2.2清开灵软/硬胶囊指纹图谱研究
2.2.1色谱条件 Phenomenex Luna RP C18色谱柱(250 mm×4.6 mm,5 μm);流动相(A)0.4%磷酸的水溶液-(B)甲醇-乙腈(体积比为4∶1),梯度洗脱;流速 1.0 mL/min;柱温:30℃;进样量为5 μL;检测波长254 nm。梯度洗脱程序:0~15分钟,5% ~30%B;15~22分钟,30% ~35%B;22~40分钟,35% ~40%B;40~43分钟,40%B;43~55分钟,40%~81%B;55~60分钟,81%~90% B;60~65分钟90%B。整。虽然有文献对两者的氨基酸成分进行过报道[6],但缺乏两制剂间化学成分的整体性研究。对不同制剂的化学成分进行整体性分析,可以为不同制剂的体内吸收、代谢等深入研究奠定基础,在阐明中医的方药理论、揭示中药的配伍规律和作用机制、优化制剂工艺、制订质控标准等方面均具有重要意义。
2.2.2溶液的配制 软胶囊供试品的制备:取1.2 g硅藻土置于蒸发皿中,精密称定,再取软胶囊内容物0.4 g,精密称定于上述蒸发皿中,研匀后,将其全部转入锥形瓶中,精密加入70%甲醇25 mL,密塞,称定重量,超声 70分钟(功率200 W,频率40 KHz),再称定重量,用70%甲醇补足减失的重量,摇匀,吸取5 mL以10000 rpm离心10分钟,上清液经0.45 μm微孔滤膜过滤,取续滤液,即得。
硬胶囊供试品的制备:取清开灵硬胶囊内容物0.5 g,精密称定,将其全部转入锥形瓶中,精密加入70%甲醇25 mL,密塞,称定重量,超声70分钟(功率200 W,频率40 KHz),再称定重量,用70%甲醇补足减失的重量,摇匀,吸取5 mL以10000 rpm离心10分钟,上清液经0.45 μm微孔滤膜过滤,取续滤液,即得。
黄芩苷对照品溶液的配制:称量黄芩苷对照品适量,加 70%甲醇超声溶解,配制成含黄芩苷100 μg/mL的对照品溶液。
2.2.3指纹图谱分析方法及数据处理方法 中药色谱指纹图谱相似度评价系统(2004A版)进行指纹图谱分析。多元数据分析和建模均由SIMCA-P11.5软件及SPSS 16.0来完成。
2.2.4清开灵软/硬胶囊指纹图谱方法学考察 精密度、稳定性、重复性考察均参照《中药注射剂指纹图谱研究的技术要求(暂行)》,以黄芩苷色谱峰作为参照峰,统计各共有峰的相对保留时间和相对保留面积,计算RSD值,共有峰相对保留时间及相对保留面积的RSD值均小于3%,符合指纹图谱研究技术的要求。
2.2.5样品测定 取11批清开灵软胶囊,11批清开灵硬胶囊,分别按2.2.2项下对应的方法制备各供试液并按2.2.1项下色谱条件进样检测,并用中药指纹图谱相似度计算软件进行分析,考虑到黄芩苷峰面积过大,会影响相似度计算的准确性,因此在相似度计算时将其剔除。结果标示出了清开灵软胶囊21个共有峰(如图1),共有峰面积所占总面积比例为87.18%。标示出了清开灵硬胶囊16个共有峰(如图2),共有峰面积所占总面积比例为84.40%。所得11批次清开灵软胶囊的相似度为0.994、0.993、0.995、0.992、0.92、0.998、0.992、0.994、0.989、0.992、0.976;11批硬胶囊相似度结果为0.992、0.973、0.995、0.944、0.989、0.977、0.981、0.946、0.994、0.975、0.991。说明清开灵软硬胶囊各自批次之间具有高度相似性,同时由软/硬胶囊的HPLC对比色谱图可直观得到,两者之间化学成分种类及峰面积大小均有一定差异(如图3,箭头标出),为了更加形象和确切地说明清开灵软/硬胶囊的成分差异,拟采用模式识别技术对其进行整体性分析,判别两者之间的差异。
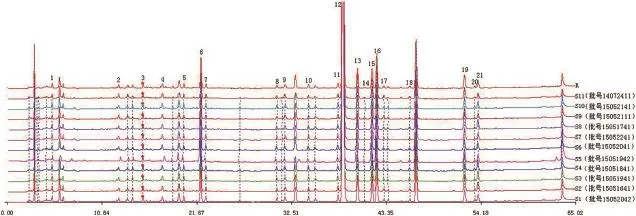
图1 11批清开灵软胶囊指纹图谱
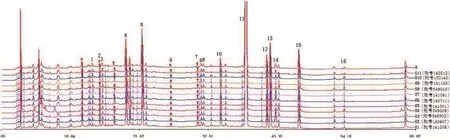
图2 11批清开灵硬胶囊指纹图谱
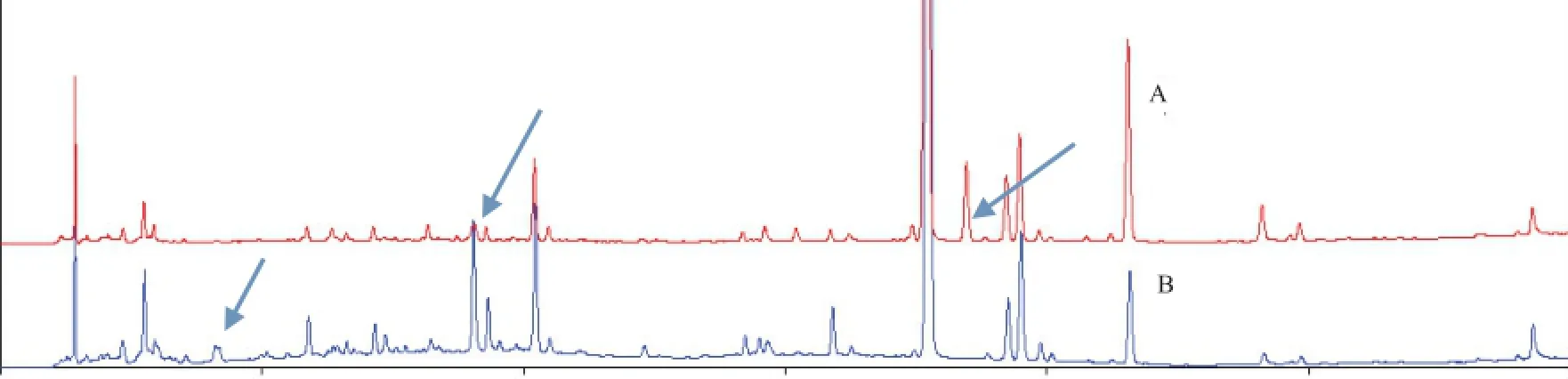
图3 清开灵软/硬胶囊HPLC色谱对比图(A为软胶囊,B为硬胶囊)
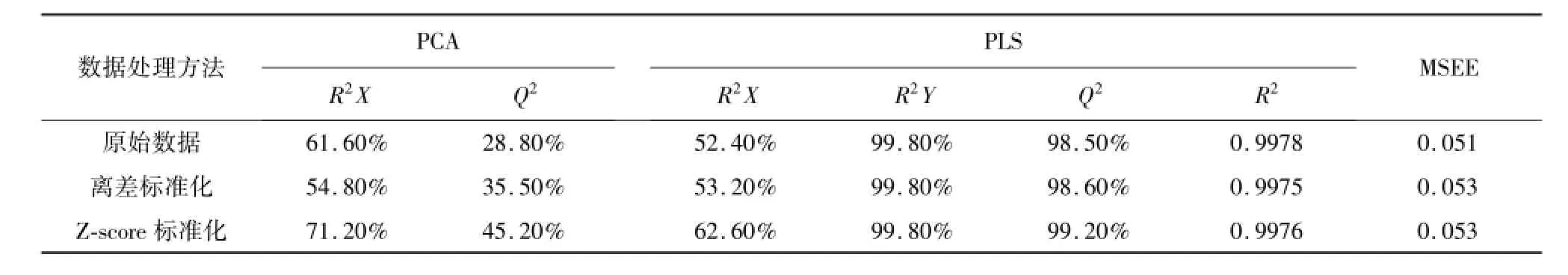
表1 三种数据导入所得PCA、PLS模型的相关参数
2.3色谱峰的峰匹配及数据转化
通过中药色谱指纹图谱相似度评价系统,将10个较大峰进行保留时间对比,把清开灵软/硬胶囊各11批的图谱进行峰匹配,数据导出后经原始数据、离差标准化及Z-score标准化三种方式处理,导入到SIMCA-P 11.5软件中,比较所建模型的各相关参数,结果见表1。由表1可得,数据经Z-score标准化处理后,在PCA模型及PLS模型中各相关参数最优,因此在接下来建模中对数据进行Z-score标准化预处理。
2.4基于PCA模型对清开灵软/硬胶囊进行整体性评价
通过将数据导入SIMCA-P中,得3个主成分模型,模型的R2X=0.712,Q2=0.452,说明模型的解释能力较高,符合实验要求。分别绘制出PCA得分图(见图4)、PCA得分与载荷汇总图(见图5)。
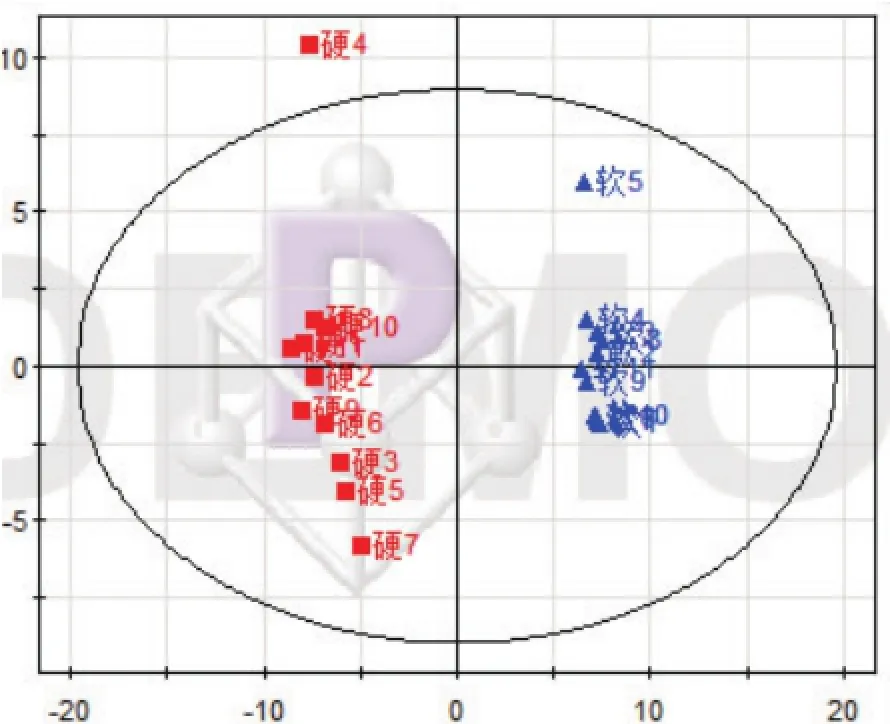
图4 PCA得分图(■为硬胶囊,▲为软胶囊)
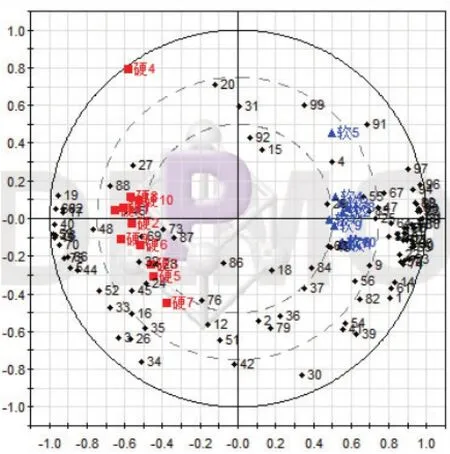
图5 PCA得分与载荷汇总图(■为硬胶囊,▲为软胶囊)
由得分图(图4)结果可知,软硬胶囊11批次各自聚集在一起,说明各自批次间具有高度相似性,与指纹图谱相似性计算结果一致,而两剂型组分别分布在得分图左右象限各两边,说明两组之间存在明显差异,硬胶囊中第四个样品超出95%置信区间,但对比其色谱图发现差异不大,因此将其保留,这也说明硬胶囊与软胶囊相比,其离散程度更大,提示硬胶囊的生产工艺可能不如软胶囊稳定。由得分与载荷汇总图(图5)可知,总变量的整体分布趋势大致集中在左右象限对应的软硬胶囊样本各两边,有少数分布在原点附近,根据PCA相似相近的原理,变量距离哪个样本近表明其在相应的样本中含量越高,距离越远表明其含量越低或不存在于该样本中,而两剂型组间变量分布各自集中在左右象限两端且相互距离较远,说明软/硬胶囊两种制剂的化学成分在种类或含量上存在较大差异,这种差异有可能由不同的生产工艺及原料来源不同导致。绿原酸(峰号59)、栀子苷(峰号66)和黄芩苷(峰号82)在22个样本中的分布比例图(图6)显示绿原酸与栀子苷在软硬胶囊中含量差异较大(为一折线),黄芩苷含量差异较小(为一直线),这与HPLC含量测定结果相一致(由于黄芩苷含量较绿原酸、栀子苷含量高很多倍,因此将绿原酸、栀子苷分布比例图放大)。
2.5清开灵软/硬胶囊组间差异化学成分的筛选
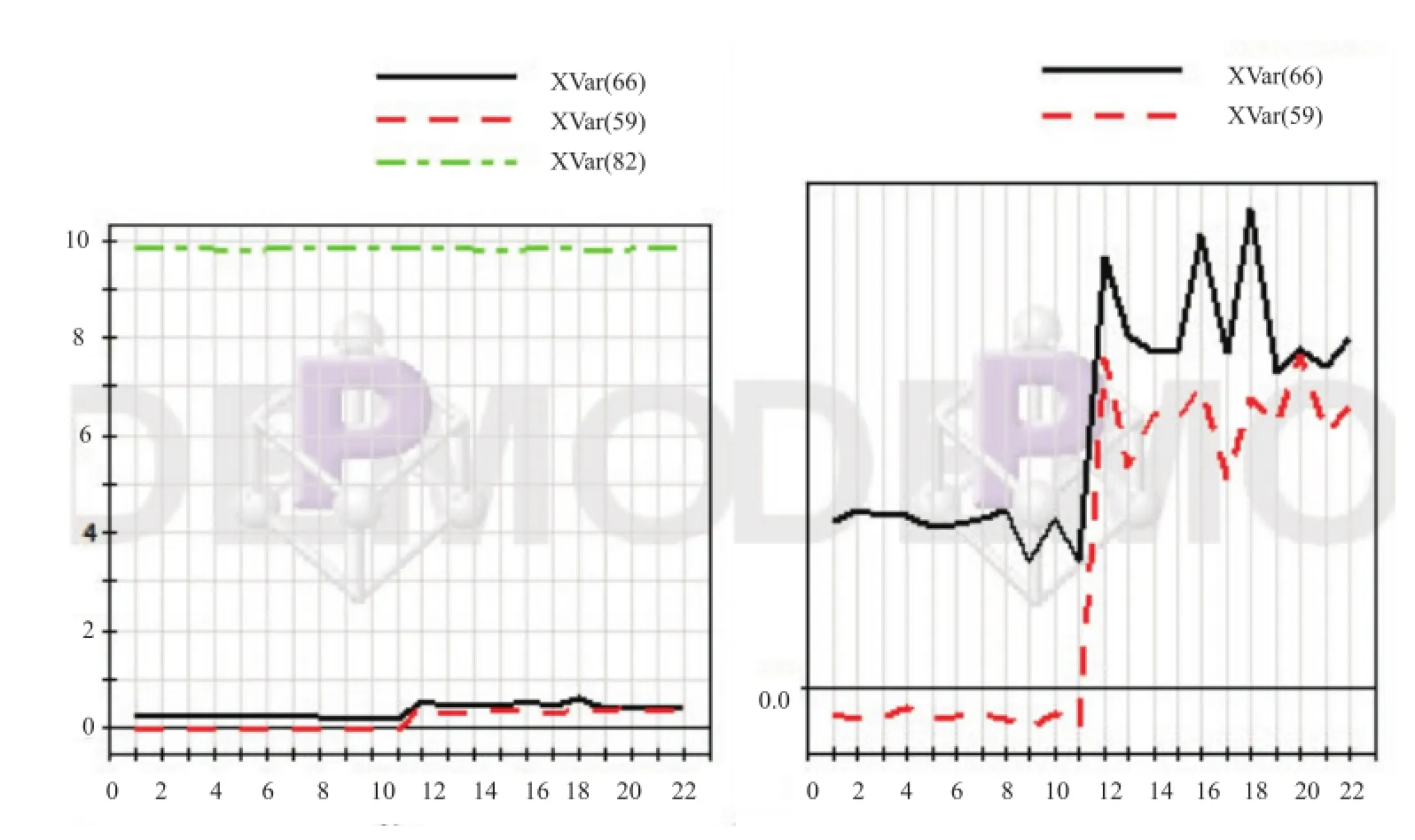
图6 分布比例图(左为绿原酸、栀子苷、黄芩苷分布比例图,右为绿原酸、栀子苷放大比例图)
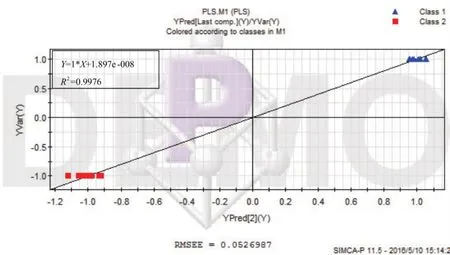
图7 PLS模型中预测值与观测值拟合曲线
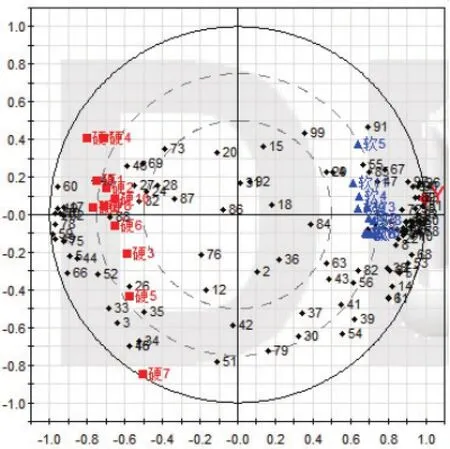
图8 PLS得分与载荷汇总图(■为硬胶囊,▲为软胶囊)
为考察引起两种制剂间差异的化学成分具体有哪些,进行PLS建模分析。通过将数据导入SIMCA-P中,得2个主成分,模型的R2X为0.626,R2Y为0.998,Q2为0.992,能够解释62.6%的X变量,解释99.8%的Y变量,交叉有效性为99.2%,解释指标及预测指标均较高,模型拟合较好。分别绘制出预测值与观测值拟合曲线图(图7)、得分与汇总图(图8)、各化合物系数图(图9)、和各化合物VIP值图(图10)。
由图7可见PLS模型的预测值与观测值基本一致,R2=0.9976,RMSEE=0.0527,模型较好,能够很好地通过模型预测Y。
由图8可见,与PCA模型类似,软硬胶囊两组分布在得分与载荷图左右象限,说明两剂型具有明显差异。由图9可得,59个峰对应的化学成分浓度在软胶囊中高,40个峰对应的化学成分浓度在硬胶囊中高。其中除峰号82、41、56、18、39、63、84、43、15、54、36、2、92、30、31、86、37、20、73、28、76、79、42、24、69、87、32、12、46、27共30个峰没有较大差异(如图9灰色部分)外,其余峰对应的化学成分均存在较大差异。由图10可得,共53个峰(图10中标绿部分)VIP值均大于1,说明这53个峰对应的化学成分对软硬胶囊两组间差异贡献较大。通过将第一主成分loading值、系数分布及VIP值(阈值>1)相关参数总值|r|对比,再结合色谱峰比对及T检验(阈值P<0.05),结果见表2,由表可得,共16个峰的总值|r|均大于1,色谱峰对比得到其保留时间及峰响应强度,t检验P值均小于0.0001,说明组间存在显著差异,因此最终确定峰号17、19、40、48、59、60、66、70、75、77、78、81、83、90、94、97共16个峰对应的化学成分是引起组间差异的主要化学成分,即为潜在标志物,其中59、66号峰鉴定为绿原酸及栀子苷。
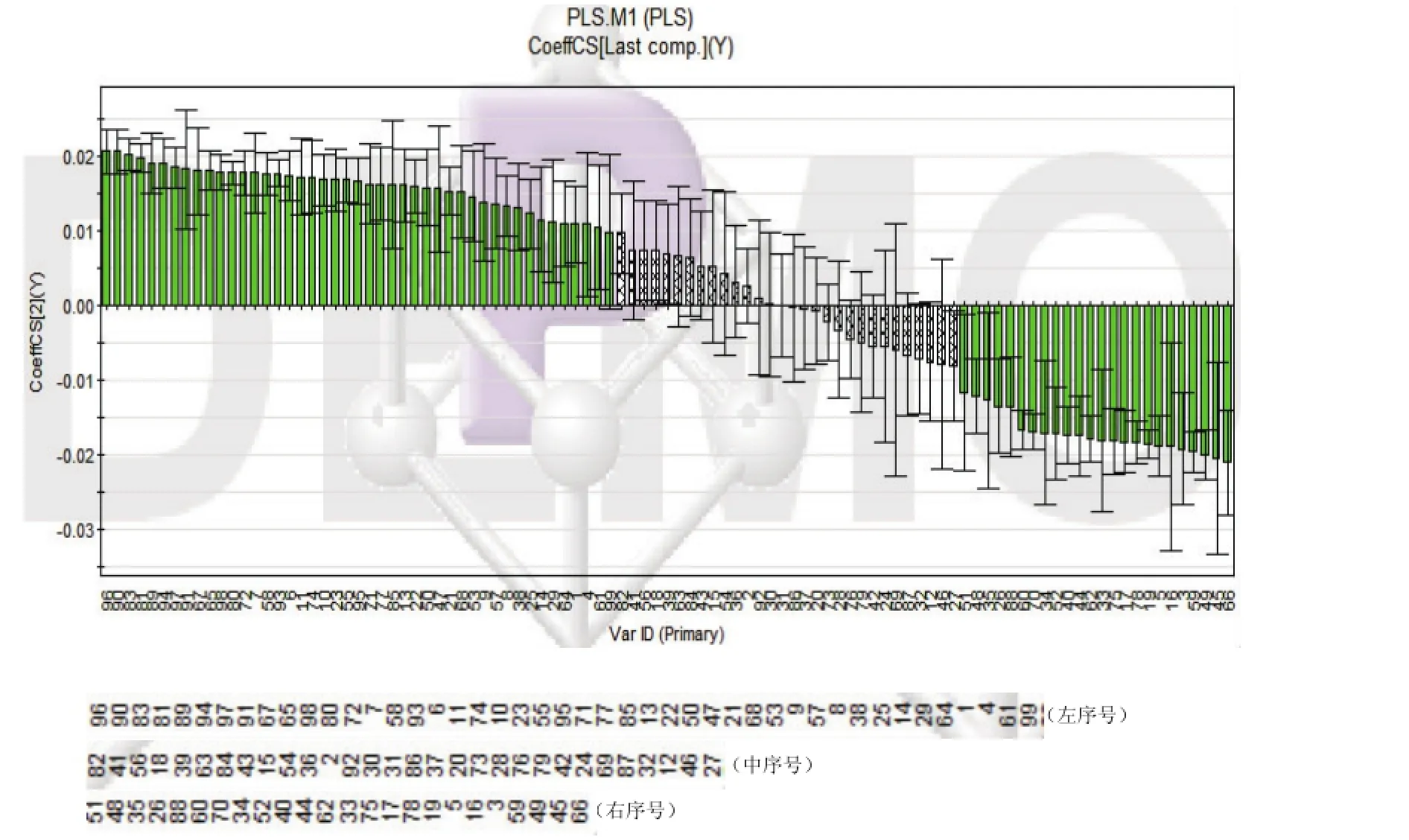
图9 PLS中各化学成分的系数结果
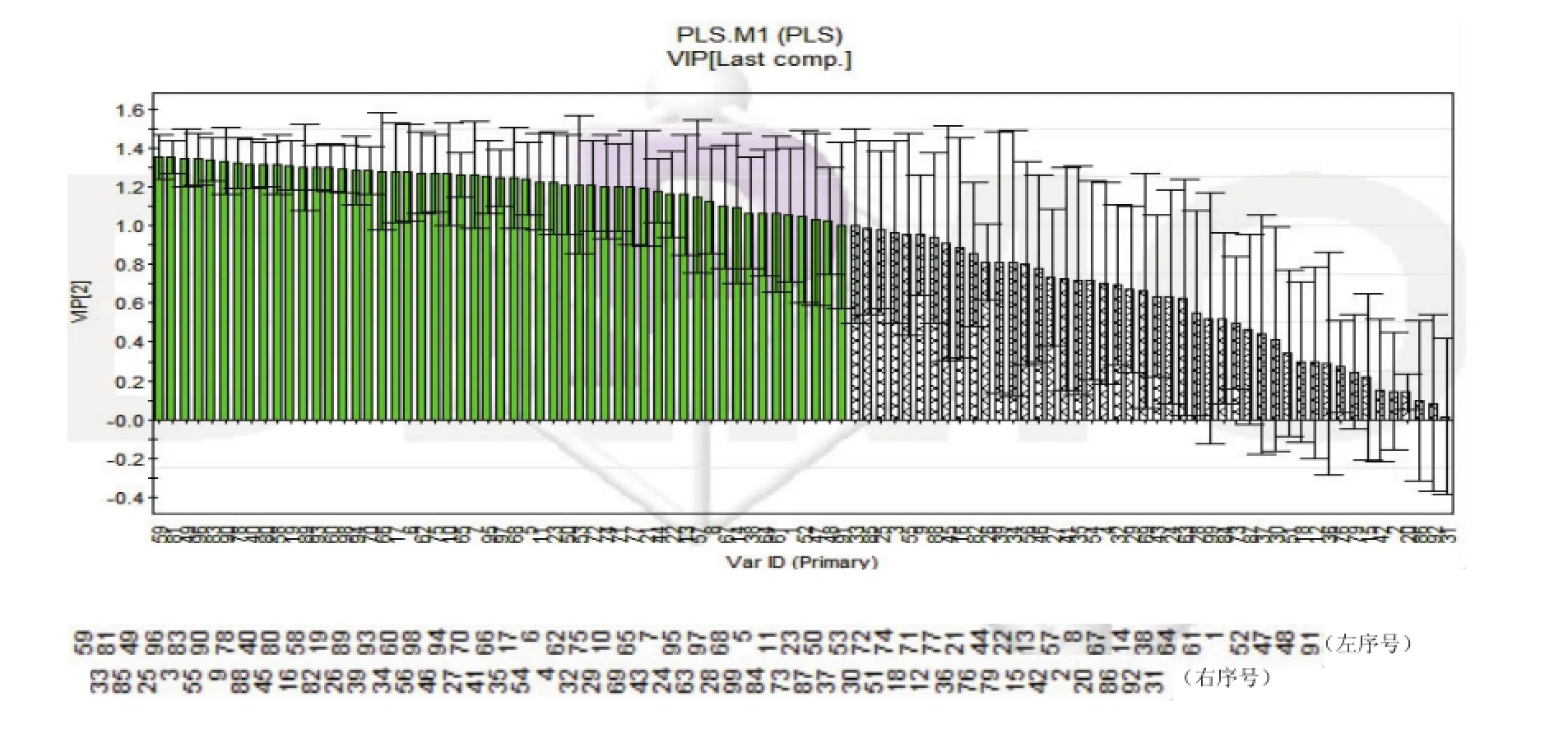
图10 PLS中各化合物的VIP值
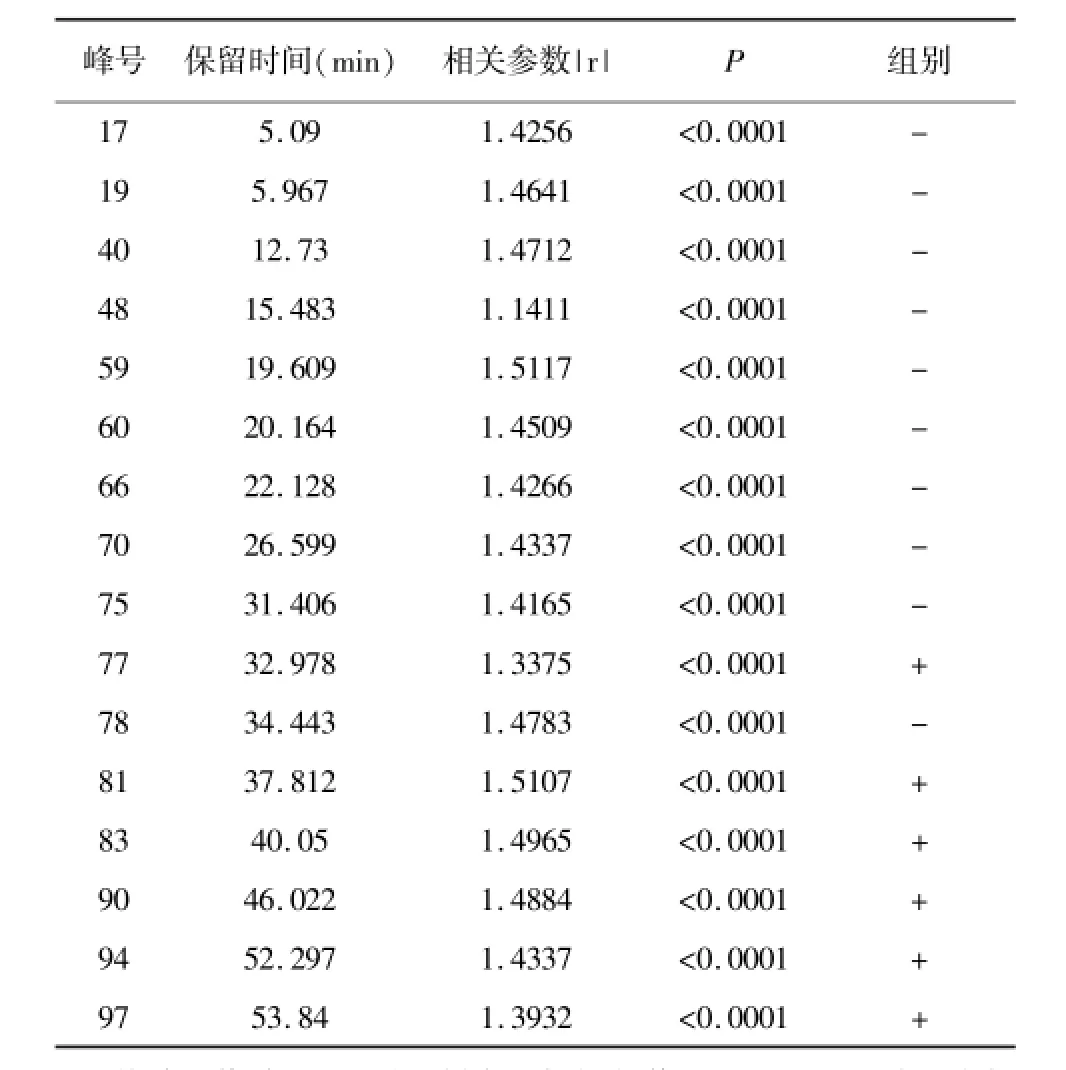
表2 潜在标志物的各相关参数
3 讨论
本实验采用HPLC-DAD法建立清开灵软/硬胶囊指纹图谱并同时测定绿原酸、栀子苷、黄芩苷三种成分,在192 nm下同时测定胆酸和猪去氧胆酸2个有效成分,相比较通用的单个成分测定及胆酸成分的HPLC-ELSD测定,方法简便、准确、可靠,可以实现5种成分的快速定量分析,多成分定量结合指纹图谱可为清开灵软/硬胶囊的质量评价提供实验数据基础。
由清开灵软/硬胶囊指纹图谱相似度计算结果可得出清开灵软/硬胶囊各自批次之间没有较大差异性,而PCA及PLS分析得出清开灵软硬胶囊两种剂型存在明显差异,说明两者之间差异主要不是来自于批次本身,而是由于不同厂家原料来源及生产工艺不同所导致。硬胶囊与软胶囊相比,其离散程度更大,由于在硬胶囊的生产工艺中,缺少醇沉的纯化工艺,由此造成的批间差异要大于软胶囊,也提示硬胶囊的生产工艺不如软胶囊稳定。5个指标性成分的含量测定结果表明两者之间的化学成分含量有一定的差异,其中通过PCA模型对绿原酸、栀子苷、黄芩苷三种指标性成分对应的色谱峰提取分析,所得结果与指标性成分含量测定结果一致,2种方法得到相互印证,也从侧面反映出所建模型的可行性。最后通过进一步归纳,分析得出59个化学成分浓度在软胶囊中高,40个化学成分浓度在硬胶囊中高,得到对两者差异性贡献度最大的16个成分(其中两个成分鉴定为绿原酸和栀子苷),即为潜在的标志物,说明两者化学成分差异较大。
本实验基于多成分定量结合中药指纹图谱与化学模式识别技术成功地对清开灵软/硬胶囊化学成分进行了初步研究,该分析及数据处理方法能实现成分的整体分析,同时能得出不同剂型间的成分差异,提示该方法能运用于中药及中药材的成分分析及质量控制研究。由于时间原因,未对存在差异的化合物(标志物)进行结构鉴定,笔者团队后续将会进行深入研究。
[1] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:1524-1532.
[2] 项海燕.清开灵注射液的不良反应与临床合理应用探讨[J].中国实验方剂学杂志,2010,16(15):199-200.
[3] 钟月平.不同剂型的清开灵药物研究[J].中国现代药物应用,2009,3(19):192-194.
[4] 谭蓉.P-糖蛋白与中药及其化学成分的相互作用[J].中国医院药学杂志,2009,29(23):2028-2029.
[5] 雷蕾,王新洲,杨策,等.基于文献报道的中药化学成分与CYP450s相互作用研究[J].世界科学技术-中医药现代化,2015,17(1):16-20.
[6] 刘潇潇,周颖仪,杨立伟,等.清开灵系列制剂的氨基酸色谱指纹图谱[J].中成药,2014,36(12):2537-2542.
[7] Tang D,Yang D,Tang A,et al.Simultaneous chemical fingerprint and quantitative analysis of Ginkgo biloba extract by HPLC-DAD[J].Analytical and bioanalytical chemistry,2010,396(8):3087-3095.
[8] 韦卓纯,姚志红,王其意,等.UPLC结合化学计量学方法的肿节风指纹图谱研究[J].中草药,2015,46(6):895-900.
[9] 苗琦,罗光明,罗扬婧,等.栀子多波长HPLC指纹图谱及化学模式识别研究[J].中草药,2014,45(21):3159-3164.
[10] 刘颖,王青,王放,等.苦碟子注射液HPLC指纹图谱与化学模式识别分析[J].中国药学杂志,2013,48(24):2097-2101.
[11] 刘江,陈兴福,邹元锋.基于中药指纹图谱多维信息的化学模式识别研究进展[J].中国中药杂志,2012,37(8):1081-1088.
(本文编辑:董历华)
Composition analysis of Qingkailing hard and soft capsule based on fingerprint combined with chemical pattern recognition
TENG Hui-hui,DU Shou-ying,BAI Jie,et al. School of Chinese Pharmacy,Beijing University of Chinese Medicine,Beijing 100102,China
DU Shou-ying,E-mail:dushouying@263.net
Objective To realize the comprehensive overall analysis on the Qingkailing hard and soft capsule chemical composition.Methods HPLC-DAD method was used to establish five indexes determination of component content and fingerprint method.Chemical pattern recognition technology was used for the overall analysis,and the biggest difference in chemical composition between hard and soft capsule was found out.Results The content of baicalin and hyodeoxycholic acid and cholic acid had no significant differences,but obvious differences were found in contents between chlorogenic acid and geniposide.PCA analysis got 59 chemical components concentration highly included in soft capsule,40 high chemical concentration in hard capsule.PLS analysis obtained 16 largest differences chemical compositions.Conclusion Qingkailing Soft/hard capsules chemical composition existed obvious differences.Multicomponent quantitative methods combined with fingerprint and chemical pattern recognition technology can be used for the comprehensive analysis of chemical composition.
Chemical pattern recognition; HPLC fingerprint; Qingkailing hard and soft capsule; Content determination
R284
A
10.3969/j.issn.1674-1749.2016.06.007
北京市科技新星计划(xx2015A048);证候与方剂基础研究北京市重点实验室(BZ0102)
100102 北京中医药大学中药学院[滕会会(硕士研究生)、杜守颖、白洁、陆洋、李鹏跃、张晴(硕士研究生)、杜秋(硕士研究生)、王振(硕士研究生)、田志浩(博士研究生)]
滕会会(1988-),女,2013级在读硕士研究生。研究方向:中药新剂型与新技术研究。E-mail:h15810377850@163.com
杜守颖(1960-),女,博士,教授,博士生导师。研究方向:中药新剂型与制剂关键技术。E-mail:dushouying@263.net
2015-09-30)
