TW-37调节NF-κB信号通路抑制体外胰腺癌细胞转移的实验研究
2016-09-08吴隆超王琳娜刘瑞东王晓丽田文霞李兴涛张俊
吴隆超 王琳娜 刘瑞东 王晓丽 田文霞 李兴涛 张俊
TW-37调节NF-κB信号通路抑制体外胰腺癌细胞转移的实验研究
吴隆超王琳娜刘瑞东王晓丽田文霞李兴涛张俊
目的观察TW-37干预对胰腺癌细胞增殖、凋亡、侵袭及血管生成的影响,探讨其可能机制。方法应用TW-37干预胰腺癌细胞株BxPC3和HPAC,以转染NF-κB p65 cDNA(p65 cDNA)、靶向NF-κB p65的siRNA(siRNA-p65)细胞及未干预细胞作为对照组。采用MTT和ELISA法检测细胞增殖和细胞凋亡;应用Transwell小室检测细胞侵袭能力;采用体外人脐静脉内皮细胞(HUVECs)成管实验观察细胞培养上清对血管生成的影响;ELISA法检测细胞NF-κB活性;蛋白质印迹法检测细胞NF-κB靶向调节蛋白VEGF、MMP-9表达。结果TW-37呈浓度和时间依赖性抑制BxPC3、HPAC细胞的增殖,诱导两株细胞的凋亡(A405值1.29±0.21比0.09±0.01,1.07±0.18比0.08±0.01),抑制细胞NF-κB活性及NF-κB p65、VEGF、MMP-9蛋白表达,差异均有统计学意义(P值均<0.05)。对照组、0.75 μmol/L TW-37干预组的穿膜细胞数分别为(46.7±5.24)、(10.3±1.26)个/200倍视野;HUVECs形成的血管数分别为(39.4±4.36)、(7.84±1.25)个/200倍视野,差异均有统计学意义(P值均为0.001)。转染p65 cDNA 的两株细胞的NF-κB活性较对照组显著增加,用TW-37干预后NF-κB活性下降;转染siRNA-p65的两株细胞的NF-κB活性较对照组显著下降,用TW-37干预后NF-κB活性进一步下降,差异均有统计学意义(P<0.05或<0.01)。转染p65 cDNA对两株细胞凋亡无明显影响,用TW-37干预后凋亡略有变化;转染siRNA-p65的两株细胞凋亡显著增加,用TW-37干预后又进一步增加,差异均有统计学意义(P值均<0.01)。结论TW-37通过NF-κB抑制胰腺癌细胞增殖、侵袭和血管生成,诱导细胞凋亡。
胰腺肿瘤;生长;肿瘤转移;病理性血管生成;TW-37
μmol/L TW-37 group (P=0.001). The number of tube formation was (39.4±4.36) and (7.84±1.25)/×200, (P=0.001). NF-κB activity was increased by p65 cDNA transfection, and decreased by TW-37 treatment in both of the two cell lines (P<0.05). However, NF-κB activity was decreased by p65 siRNA transfection, and greatly decreased by TW-37 treatment in both two cell lines (P<0.05 orP<0.01). Transfection of p65 cDNA did not significantly affect cell apoptosis. Transfection of p65 siRNA increased cell apoptosis, and greatly increased by TW-37 treatment in both two cell lines (allP<0.01). ConclusionsTW-37 could inhibit the proliferation, invasion and angiogenesis in pancreatic cancer cells by regulating NF-κB signal pathway.
胰腺癌是极易侵袭和转移的恶性肿瘤,传统的治疗手段疗效差,因此基因治疗胰腺癌是目前研究的热点[1]。Bcl-2在胰腺癌组织过度表达,激活NF-κB,发挥抗凋亡和促胰腺癌细胞转移作用[2-3]。文献报道[4],应用RNA干扰技术抑制胰腺癌细胞Bcl-2表达能显著抑制胰腺癌细胞的生长和侵袭能力,提示Bcl-2可能是胰腺癌基因治疗的有效靶点。TW-37是近年来发现的Bcl-2的小分子抑制剂,它对多种肿瘤细胞的生长和转移都有明显的抑制作用[5]。本研究观察TW-37对胰腺癌细胞生长、转移和血管生成的影响,探讨TW-37的作用机制。
材料与方法
一、蛋白质印迹法检测细胞Bcl-2、NF-κBp65、MMP-9、VEGF蛋白表达
胰腺癌AsPC1、BxPC3、HPAC和PANC1细胞购自中科院上海细胞研究所。收集各组细胞,使用Epigentek公司的蛋白提取试剂盒提取细胞总蛋白并分离核蛋白,按照试剂盒说明书操作。采用蛋白质印迹法检测细胞Bcl-2、NF-κB p65(p65)、MMP-9、VEGF蛋白表达,以GAPDH为内参。鼠抗人p65、Bcl-2 、MMP-9、VEGF一抗工作浓度分别为1∶200、1∶150、1∶200、1∶200,碱性磷酸酶标记的山羊抗兔IgG工作浓度1∶5 000。应用北京赛智创业科技有限公司 ChampGelTM3-4软件进行图像定量分析。
二、电泳迁移率改变分析(EMSA)法检测NF-κB活性
取siRNA-p65、p65 cDNA转染24 h后的BxPC3细胞,再应用0.25、0.75 μmol/L TW-37(上海赛鑫生物科技有限公司)干预48 h,同时设单纯转染组、单纯TW-37干预组及未转染未干预的对照组。用预冷的PBS(pH7.2)反复冲洗以收集细胞,常规离心后再用PBS洗1次。加缓冲液A 100 μl重悬细胞,置冰浴15 min,再加10% NP 40 μl,涡动10 s,4℃ 3 000 g离心5 min,取上清液(胞质提取物),移至新试管,分别加pH7.9的HEPEs(10 mmol/L)及终浓度为40、150 μmol/L的KCl,冰浴孵育30 min,13 000 g离心30 min。收集上清液(胞质蛋白),Lowery法定量蛋白后置-80℃备用。沉淀用低渗缓冲液洗后重悬于适量低盐缓冲液中,然后逐滴加入等量高渗缓冲液,4℃孵育30 min,间歇震荡,最后4℃ 13 000 g离心30 min,收集上清液(核蛋白),Lowery法定量蛋白后置-80℃备用。探针NF-κB寡核苷酸序列为5′-AGTTGAGGGGACTTTCCCAGGC-3′及5′-GCCTGGGAAATCCCCTCAACT-3′,由生工生物工程有限公司合成,应用T4多聚核酸酶(Roche Applied Science公司)将4 μl γ-[32P]-ATP(上海岚派生物科技有限公司)标记到双链寡核苷酸上,按说明书操作。每个反应体系含Nuclease-Free Water 5 μl,EMSA/Gel-Shift结合缓冲液(5X) 2 μl,细胞核蛋白2 μl,l μl标记的寡核苷酸探针,混合后经含40%甘油的凝胶电泳分离,然后压片,置-70℃曝光12 h后显影。以不加细胞核蛋白作为对照组。
三、ELISA法检测p65蛋白的结合活性
取亲和素包被的96孔ELISA板,加33 nmol/L生物素化dsDNA(含NF-κB p65亚基结合的共有序列),室温孵1 h。洗涤后用含3%脱脂牛奶的转录因子缓冲液封闭1 h,洗涤后每孔分别加50 μl各组核蛋白提取液,室温下孵育1 h,洗涤后加入兔抗人NF-κB抗体,室温下孵育1 h,洗涤后加HRP标记的羊抗兔IgG(BD Transduction Labs),室温下孵育30 min,洗涤后加100 μl TMB显色,上酶标仪检测各孔在波长450 nm的吸光度值(A450值)。根据标准品的A450值绘制标准曲线,计算NF-κB亚单位p65的结合活性。
四、MTT 法检测细胞增殖
AsPC1、BxPC3、HPAC和PANC1细胞采用RPMI 1640培养基+10%灭活小牛血清常规传代。取对数生长期细胞,以每孔5×103个细胞密度接种于96孔培养板,培养24 h后每孔分别加入0.25、0.5、0.75 μmol/L TW-37继续培养24、48、72 h,以无血清DMEM代替TW-37作为对照组。培养到时间点后加入0.5 mg/ml MTT 20 μl (Sigma公司)继续孵育2 h,离心弃上清,加入DMS 0.2 ml,吹打后上酶标仪测各孔570 nm处的吸光度值(A570值)。每样本设3个复孔,每个实验重复3次,取均值。绘制细胞生长曲线。
五、ELISA法检测细胞凋亡
取上述各组对数生长期细胞,1 000 r/min离心10 min,取上清(细胞释放的单/低聚核小体片段)20 μl加入链霉亲合素包被的培养板孔中,另加入80 μl免疫反应试剂(抗-DNA-POD、抗组蛋白-生物素及温育缓冲液以1∶1∶18混合),室温置摇床上(250 r/min) 孵育2 h,弃上清,用300 μl温育缓冲液洗涤3次后加入100 μl底物缓冲液,室温置摇床上孵育10~20 min,呈现适中的黄色时上酶标仪检测各孔在波长405 nm的吸光度值(A405值),参考波长492 nm。
六、Transwell小室检测细胞侵袭能力
用无血清DMEM培养基稀释Matrigel,取60 μl稀释的Matrigel铺在Transwell小室的隔膜上待其凝固。取上述各组细胞,用无FBS的DMEM培养基洗涤3次后重悬于无FBS的DMEM培养液,调整细胞密度为1×106/ml。Transwell上室加200 μl细胞悬液,下室加含10% FBS的DMEM培养液500 μl,小室置37℃、5% CO2孵育48 h。取出隔膜,用棉签轻轻擦去未穿膜细胞后用丙酮固定,0.1%结晶紫染色。于显微镜下取5个200倍视野,计算穿膜细胞数。每组细胞用3个小室,实验重复3次,取均值。
七、人脐静脉内皮细胞(HUVECs)成管实验
人脐静脉上皮细胞株HUVECs购自ATCC,常规培养于F12K介质。应用0.75 μmol/L TW-37干预BxPC3 细胞24 h,收集培养液,离心并转移于新鲜的试管,置-20℃保存。取对数生长期HUVECs细胞 ,以5×104个细胞接种于16孔培养板,每孔加上述离心液10 μl,培养6 h。显微镜下取3~5个200倍视野,利用Imagel软件分析血管数目。
八、质粒构建及细胞转染
靶向p65的siRNA(siRNA-p65,No:sc-29410)及阴性对照siRNA(siRNA-NC)均购自美国Santa Cruz Biotechnology公司。委托北京辉骏生物公司将各siRNA插入pcDNA.3.1,并经测序证实质粒构建成功。插入p65 cDNA的质粒pcDNA.3.1 p65 cDNA由福建医科大学附属第一医院神经内科何忠义博士惠赠。
BxPC3 细胞常规培养并传代。取对数生长期细胞接种于6孔板中,每孔3×105个细胞,加入无抗生素培养基2 ml,待细胞生长至40%~60%融合时应用Lipofectamine LTX转染试剂盒将siRNA转染细胞,按照说明书操作。
转染细胞按上述方法进行NF-κB活性及细胞凋亡的检测。
九、统计学处理
结 果
一、不同胰腺癌细胞株Bcl-2、NF-κB表达水平
胰腺癌BxPC3细胞Bcl-2蛋白高表达,其次为HPAC细胞,AsPC1细胞表达较少,PANC1细胞表达极少; NF-κB蛋白表达量从高到低依次为PANC1、HPAC、BxPC3、AsPC1细胞(图1)。由于BxPC3和HPAC细胞Bcl-2表达量较高,因此以BxPC3和HPAC细胞作为研究对象。
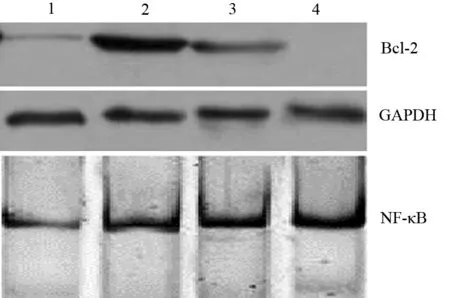
图1 AsPC1(1)、BxPC3(2)、HPAC(3)、PANC1(4)细胞Bcl-2及NF-κB表达
二、TW-37干预对BxPC3、HPAC细胞增殖和凋亡的影响
TW-37干预后,BxPC3和HPAC细胞的增殖呈浓度和时间依赖性下降(P<0.05或<0.01,图2)。0.25、0.5、0.75 μmol/L TW-37干预72 h,BxPC3细胞凋亡的A405值分别为0.43±0.06、0.76±0.13、1.29±0.21,显著高于未干预细胞的0.09±0.01; HPAC细胞凋亡的A405值分别为0.38±0.07、0.64±0.12、1.07±0.18,显著高于未干预细胞的0.08±0.01,差异均有统计学意义(P<0.05或<0.01)。
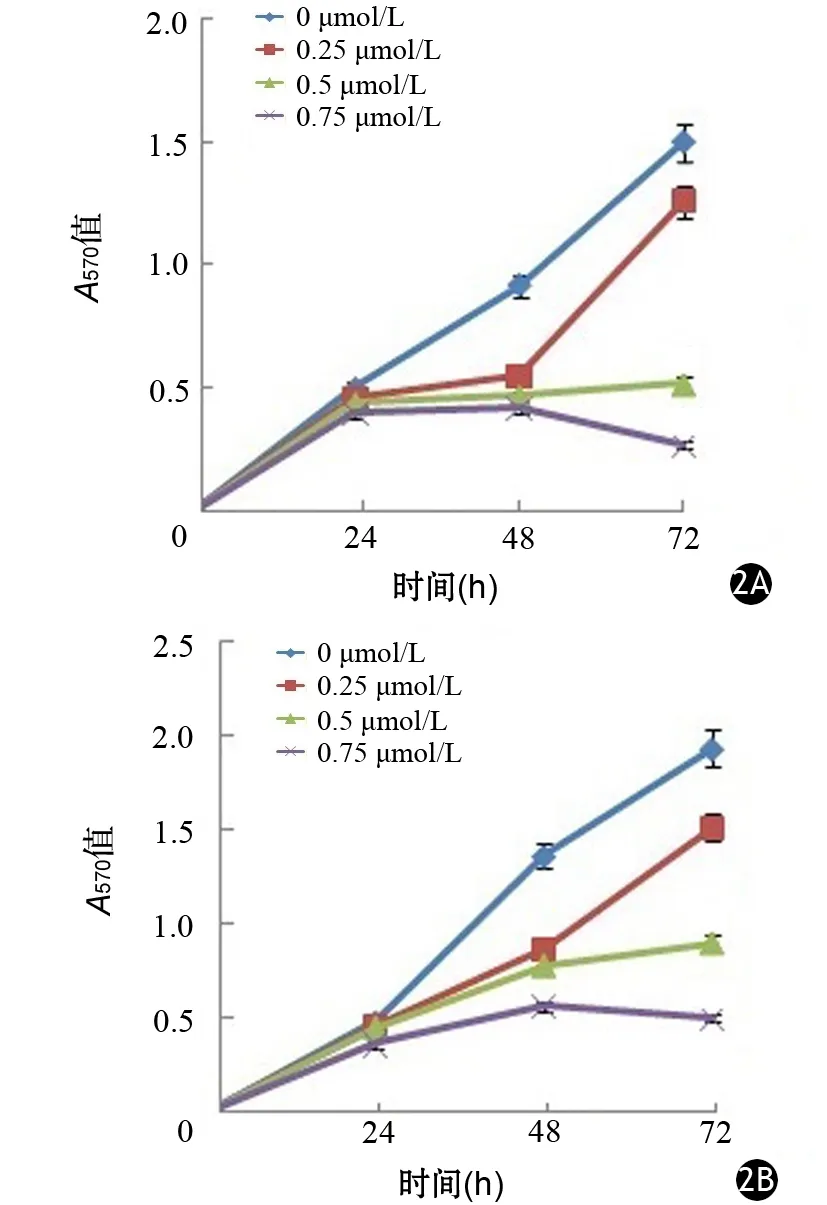
图2 不同浓度TW-37对BxPC3(2A)、HPAC细胞(2B)增殖的影响
三、TW-37干预对BxPC3、HPAC细胞NF-κB活性及相关蛋白表达的影响
TW-37以时间和剂量依赖性抑制BxPC3、HPAC细胞NF-κB的活性;呈浓度依赖性抑制BxPC3、HPAC细胞p65及VEGF和MMP-9蛋白的表达(P值均<0.05,图3)。
四、TW-37 干预对转染的BxPC3细胞侵袭能力的影响
对照组及0.25、0.75 μmol/L TW-37干预组的穿膜细胞数分别为(46.7±5.24)、(24.7±3.8)、(10.3±1.26)个/200倍视野,细胞的侵袭能力随TW-37浓度的增加而下降(图4),各组间差异有统计学意义(t=4.74,P=0.001)。
五、TW-37干预对HUVECs血管形成的影响
对照组、0.75 μmol/L TW-37干预24 h组的培养上清加入HUVECs培养液中所形成的血管数分别为(39.4±4.36)、(7.84±1.25)个/200倍视野,两组间差异有统计学意义(t=5.257,P=0.001,图5)。
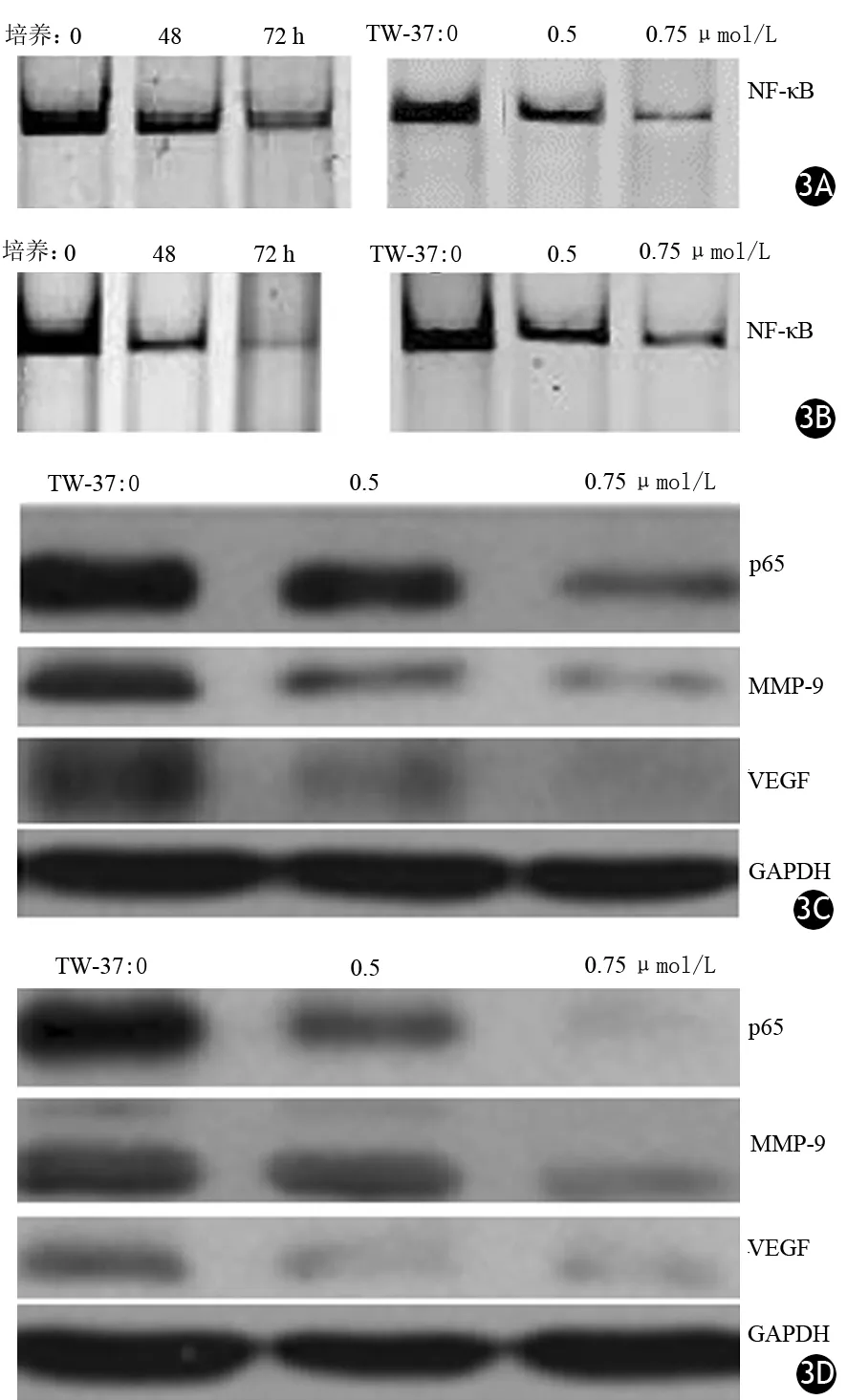
图3 TW-37干预后BxPC3、HPAC细胞NF-κB(3A、3B)及p65、MMP-9、VEGF(3C、3D)的表达

图4 对照组(4A)及0.25、0.75 μmol/L TW-37干预组(4B、4C)穿膜细胞(×200)
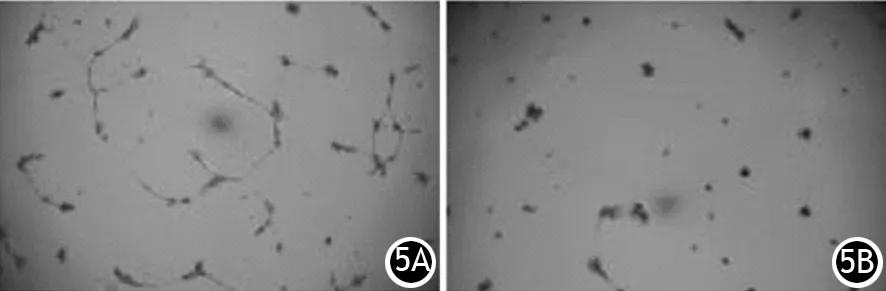
图5 对照组(5A)、0.75Tμmol/L TW-37干预组(5B)HUVECs血管形成(×200)
六、TW-37干预对转染细胞NF-κB活性及细胞凋亡的影响(表1)
单纯TW-37干预的BxPC3和HPAC细胞的NF-κB活性较对照组显著下降;转染p65 cDNA 的两株细胞的NF-κB活性较对照组显著增加;p65 cDNA转染后再用TW-37干预的两株细胞的NF-κB活性较单转染p65 cDNA组细胞下降;转染siRNA-p65的两组细胞的NF-κB活性较对照组下降,siRNA-p65转染后用TW-37干预的两组细胞的NF-κB活性又较单siRNA-p65转染组细胞进一步下降,差异均有统计学意义(P值<0.05或<0.01)。
单纯TW-37干预可诱导BxPC3和HPAC细胞凋亡,与对照组的差异有统计学意义(P<0.05);单纯p65 cDNA转染对两组细胞凋亡无明显影响,但p65 cDNA转染后再用TW-37干预的BxPC3细胞较单p65 cDNA转染增加,而HPAC细胞凋亡是减少,差异有统计学意义(P<0.05);转染siRNA-p65的两组细胞凋亡显著增加,转染siRNA-p65后再用TW-37干预的两组细胞凋亡又较单siRNA-p65转染组细胞显著增加,差异均有统计学意义(P值均<0.01)。
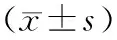
表1 各组BxPC3、HPAC细胞的NF-κB活性及细胞凋亡的变化
注:与对照组比较,aP<0.05,bP<0.01;与siRNA-p65转染组比较,cP<0.05
讨 论
Bcl-2通路在包括胰腺癌在内的恶性肿瘤发生和发展中起重要作用[5]。激活Bcl-2可促进肿瘤细胞生长并抑制细胞凋亡,同时可提高细胞的侵袭能力[6]。Garcea等[2]报道,过度表达Bcl-2的胰腺癌患者的生存率明显下降,因此靶向Bcl-2的治疗很可能成为胰腺癌治疗的有效方式。TW-37是最近发现的小分子的Bcl-2表达抑制物,体内、外实验研究均证实它能显著抑制多种肿瘤细胞生长[7-9]。
NF-κB p65是肿瘤治疗的重要靶向基因,激活NF-κB能调节VEGF和MMP-9等多个下游基因的表达,参与调节癌细胞的迁移[10]。
此外,Bcl-2与NF-κB均参与细胞生长和凋亡的调节。抑制Bcl-2表达能抑制胰腺癌细胞内NF-κB 活性,表明NF-κB可能是Bcl-2的靶点[11]。
本研究结果显示,BxPC3、HPAC细胞有不同程度的Bcl-2基因表达,均过表达NF-κB。TW-37干预后不仅能抑制癌细胞的增殖,还能诱导癌细胞凋亡,与Azmi等[12]在前列腺癌的研究结果相一致。结果还显示,TW-37干预能抑制癌细胞NF-κB活化,且对转染siRNA-p65细胞的NF-κB活性抑制作用更显著,而细胞凋亡增加,提示TW-37可能通过抑制NF-κB活性、NF-κB p65及Bcl-2表达而抑制细胞增殖和诱导细胞凋亡。本研究结果同时还显示, TW-37干预能抑制体外胰腺癌细胞的侵袭能力,减少 HUVECs的血管形成,提示TW-37可能是治疗胰腺癌的有效分子。
[1]Chiorean EG, Coveler AL. Pancreatic cancer: optimizing treatment options, new, and emerging targeted therapies[J]. Drug Des Devel Ther, 2015,9(7):3529-3545.DOI: 10.2147/DDDT.S60328.
[2]Garcea G, Neal CP, Pattenden CJ, et al. Molecular prognostic markers in pancreatic cancer: a systematic review[J].Eur J Cancer, 2005,41(15):2213-2236.
[3]Fahy BN, Schlieman MG, Mortenson MM,et al. Targeting BCL-2 overexpression in various human malignancies through NF-kappaB inhibition by the proteasome inhibitor bortezomib[J].Cancer Chemother Pharmacol, 2005, 56(7):46-54.
[4]Okamoto K, Murawaki Y.The therapeutic potential of RNA interference: novel approaches for cancer treatment[J].Curr Pharm Biotechnol, 2012,13(11):2235-2247.
[5]Masood A,Azmi AS,Mohammad RM.Small molecule inhibitors of bcl-2 family proteins for pancreatic cancer therapy[J].Cancers, 2011,3(2):1527-1549. DOI: 10.3390/cancers3021527.
[6]Ansari D, Rosendahl A, Elebro J, et al. Systematic review of immunohistochemical biomarkers to identify prognostic subgroups of patients with pancreatic cancer[J].Br J Surg, 2011, 98(8):1041-1055. DOI: 10.1002/bjs.7574.
[7]Mortenson MM, Galante JG, Gilad O, et al.BCL-2 functions as an activator of the AKT signaling pathway in pancreatic cancer[J].J Cell Biochem, 2007,102(5):1171-1179.
[8]Wang H, Zhang Z, Wei X, et al. Small-molecule inhibitor of Bcl-2 (TW-37) suppresses growth and enhances cisplatin-induced apoptosis in ovarian cancer cells[J].J Ovarian Res, 2015,8(1):3-8. DOI: 10.1186/s13048-015-0130-x.
[9]Ashimori N, Zeitlin BD, Zhang Z, et al.TW-37, a small-molecule inhibitor of Bcl-2, mediates S-phase cell cycle arrest and suppresses head and neck tumor angiogenesis[J].Mol Cancer Ther, 2009,8(4):893-903 DOI: 10.1158/1535-7163.MCT-08-1078.
[10]Mortenson MM, Galante JG, Gilad O, et al.BCL-2 functions as an activator of the NF-kappaB signaling pathway in pancreatic cancer[J]. J Cell Biochem, 2007,102:1171-1179.
[11]Al-Katib AM, Sun Y, Goustin AS,et al.SMI of Bcl-2 TW-37 is active across a spectrum of B-cell tumors irrespective of their proliferative and differentiation status[J].J Hematol Oncol, 2009,16(2):8-16. DOI: 10.1186/1756-8722-2-8.
[12]Azmi AS, Wang Z, Burikhanov R,et al.Critical role of prostate apoptosis response-4 in determining the sensitivity of pancreatic cancer cells to small-molecule inhibitor-induced apoptosis[J].Mol Cancer Ther, 2008,7(9):2884-2893.
(本文编辑:吕芳萍)
TW-37 inhibited metastasis in pancreatic cancer via regulating NF-κB signal in vitro
WuLongchao,WangLinna,LiuRuidong,WangXiaoli,TianWenxia,LiXingtao,ZhangJun.
DepartnentofGeneralSurgery,People′sHospitalofPenglai,Penglai265600,China
Correspondingauthor:ZhangJun,Email:yanxiangnj@126.com
ObjectiveTo study the effect and mechanisms of TW-37 on cell proliferation, apoptosis, invasion and angiogenesis in pancreatic cancer cells in vitro and further explore the potential mechanism. MethodsBxPC3 and HPAC cells were pretreated with TW-37 using untransfected or transfected with NF-κB p65 cDNA(p65 cDNA)or NF-κB p65 siRNA(siRNA-p65)cells as controls. Cell viability was determined by MTT assay. Cell apoptosis was assessed by enzyme-linked immunosorbent assay (ELISA). Cell invasion and angiogenesis was detected by Transwell and endothelial tube formation assay of HUVECs. ELISA assay was used to measure the activity of NF-κB, and its target proteins of MMP-9 and VEGF were detected by western blot. ResultsTW-37 suppressed cell growth and induced apoptosis (A405:1.29±0.21vs0.09±0.01,1.07±0.18vs0.08±0.01),inhibited NF-κB activity and protein expression of NF-κB p65, VEGF and MMP-9(allP<0.05)in a dose- and time-dependent manner. The number of cells that invaded across the matrigel in the transwell chamber was (46.7±5.24) and (10.3±1.26)/×200 in BxPC3 control and 0.75
Pancreatic neoplasms;Growth;Neoplasm metastasis;Neovascularization, pathologic;TW-37
10.3760/cma.j.issn.1674-1935.2016.04.006
265600山东蓬莱,蓬莱市人民医院普外科(吴隆超);山东省青岛疗养院检验科(王琳娜);莱芜市人民医院检验科(刘瑞东、王晓丽、田文霞、李兴涛);浙江省人民医院肿瘤外科(张俊)
张俊,Email: yanxiangnj@126.com
2015-07-20)
