天鹅源丙型副伤寒沙门菌感染实验小鼠的组织病理学及抗原分布
2016-09-07冉丹丹陈冬平
罗 薇,冉丹丹,陈冬平,刘 群
(西南民族大学生命科学与技术学院,成都 610041)
天鹅源丙型副伤寒沙门菌感染实验小鼠的组织病理学及抗原分布
罗薇,冉丹丹,陈冬平,刘群
(西南民族大学生命科学与技术学院,成都 610041)
为了研究天鹅源丙型副伤寒沙门菌感染致实验小鼠的组织病理学变化和其菌体抗原的组织分布,奠定菌株致病机制的研究基础,采用天鹅源丙型副伤寒沙门菌株口腔灌服感染实验小鼠,在感染后不同时点采集小鼠11个组织脏器制备石蜡切片,进行HE染色和免疫酶组织化学染色,对感染小鼠的组织病变及菌体抗原的分布进行观察。感染小鼠的心、肝、脾、肺、肾、肠道、脑等组织在感染3~6 h后开始出现炎性反应,直至感染后14 d;感染鼠回肠组织有显著的坏死、脱落及炎性损伤,右心室呈现脱落的血栓栓子,肺泡壁增厚、血管充血、水肿、炎性细胞浸润和支气管肺炎,多脏器变性、坏死、炎性细胞浸润,多脏器组织可见“伤寒小结”。感染3 h,除脑外,其他被检脏器皆检出细菌抗原,除感染途径肠道细菌抗原含量极高,脾、心、肺、肝的阳性信号也很强,且主要存在组织的细胞质中。研究结果提示天鹅源丙型副伤寒沙门菌能感染实验小鼠,侵嗜小鼠多个脏器,长时间不同程度地引起多脏器变性、坏死及炎性反应。
天鹅源丙型副伤寒沙门菌;病理变化;抗原分布
沙门菌是肠杆菌科中一类重要的食源性人畜共患病原菌,血清型种类繁多,绝大多数血清型能在人和动物间交叉感染,人一旦摄入了含有大量沙门菌的动物源性食品,会造成感染性腹泻和食物中毒,在世界各地的食物中毒中,沙门菌引起的中毒病例占首位或第二位,每年皆有不同程度的沙门菌中毒事件的报道。2012年美国部分州暴发活禽引发的沙门菌疫情,造成该地区517人感染,据认为感染者接触带沙门菌鸡鸭可能是疫情暴发的原因[1]。1994—2005年,我国共报道了57 612起食物中毒事件,22.2%归因于沙门菌[2]。王晓泉等2003—2005年在江苏部分地区分离的117株沙门菌中有81株来自动物源食品[3];胡杰等2006—2012年对广西规模场、活禽市场以及农村散养鸡进行沙门菌感染情况调查,结果显示,活禽市场鸡沙门菌感染阳性率为20.81%~33.2%,且伤寒沙门菌的阳性率为22.52%[4]。丙型副伤寒是由丙型副伤寒沙门菌引起的经消化道传播的人类急性传染病,临床表现为急性胃肠炎或脓毒血症。近年,丙型副伤寒沙门菌引起人类食物中毒案例报道有所增多,其病原感染引发的问题多限于疾病发生的流行报告及其病例的临床诊治[5-6],也有少量与病原结构和功能等相关研究[7-11],其致病机制、系统组织病变等问题却少有涉及。作者以实验小鼠为感染对象,建立丙型副伤寒沙门菌感染的实验病理模型,对感染鼠的动态组织病理变化和细菌抗原定位进行观察,以期了解天鹅源丙型副伤寒沙门菌对试验小鼠的致病机制,为阐明动物源丙型副伤寒沙门菌对人类的致病机制奠定基础。
1 材料与方法
1.1菌株
丙型副伤寒沙门菌DT4株:源自成都邛崃地区大雁、天鹅驯养基地外表健康的成年白天鹅肛拭子,采用常规细菌分离、鉴定方法鉴定为丙型副伤寒沙门菌,四川医学疾控中心鉴定确认,西南民族大学动物医学实验室保存。
1.2实验动物
20~22 g健康昆明系SPF小白鼠,购自中医研究院。实验鼠饲养于消毒的鼠笼内,饲料、垫料、饮用水均采用常规方法进行沙门菌检测,结果阴性。
1.3主要试剂
Rabbit Anti-Salmonella tropina、免疫组化SP 染色试剂盒、3,3-二氨基联苯胺 (DAB) 染色试剂盒均购自北京中衫金桥生物技术公司。
1.4丙型副伤寒沙门菌感染小鼠模型的建立及样品采取
将实验小鼠随机分为感染组(45只)和对照组(45只),感染组每只口服0.5 mL菌液(3.6×109CFU),对照组每只口服0.5 mL灭菌生理盐水。攻毒后,观察小鼠临床症状,并于感染后3 h、6 h、12 h、24 h、36 h、48 h、72 h、96 h、168 h和14 d等10个时间点各剖杀3只感染组小鼠(频死者、发病者优先)和3只对照组小鼠,观察组织器官病变情况,采集其心、肝、脾、肺、肾和肠道(十二指肠、空肠、回肠、盲肠、大肠)、脑等组织脏器,分别置于4% 多聚甲醛中固定。
1.5组织切片的制作及HE染色观察
将置于4% 多聚甲醛中固定24 h的被采样本,进行常规脱水、浸蜡、包埋,按常规的石蜡制片方法制作组织切片,用Nikon显微镜进行组织切片观察,SPOTADVANCE拍照、图像处理。
1.6免疫组化染色观察
同“1.5”制作组织切片,进行免疫组化染色及检测,具体步骤参照ABC检测试剂盒、超敏即用型二歩法(非生物素)检测试剂盒PV9003说明书进行,用Nikon ECLIPSE 6200 显微数码图像采集系统观察采集图像,并用ImagePro-Plus 6.0图像分析软件测量其阳性颗粒累积光密度值(IOD)。
2 结 果
2.1感染小鼠的临床症状
感染后6 h小鼠开始聚拢扎堆、嗜睡;感染后12 h小鼠出现精神萎靡,被毛蓬松,采食量和饮水量明显减少;36 h小鼠开始出现死亡。5 d后存活小鼠精神状态好转,逐渐恢复常态生活。阴性对照组小鼠未见明显变化。
2.2感染小鼠病理剖检变化
感染后24 h部分实验鼠肝可见白色坏死点。感染后12 h肺可见点状出血,24 h呈现斑片状淤血、出血灶,随时间推移出血程度逐渐加重,但在感染后7 d剖检观察见出血面积减少。肠道感染6 h前未见明显眼观变化,感染后12 h肠壁变薄呈透明状,有点状出血,肠腔内有多量黄色黏液状内容物,感染后36 h肠黏膜坏死脱落;感染后14 d剖检6只存活鼠,其中2只肠腔明显扩张,肠腔内充盈有多量的水样内容物及气体。其他脏器未见明显病变。
2.3感染小鼠的组织病理学变化
感染小鼠心、肝、脾、肺、肾、肠道、脑均有不同程度的病理变化。
2.3.1心感染后3 h,肌间小血管淤血,右心室可见若干脱落的血栓栓子;感染后6 h,除3 h病变外(图1A),心内膜表面的内皮及其心外膜内皮下均有多量红细胞及炎性细胞,肌间质有少量炎性细胞浸润;感染后24 h,肌间小血管淤血、出血,有炎性细胞浸润及絮状纤维蛋白;感染后36~48 h,心肌纤维先是颗粒变性,为空泡样变,病变持续至感染后96 h;在感染后7、14 d右心室仍有多个脱落的血栓栓子。
2.3.2肝感染后3~12 h,肝小叶间静脉血管扩张、淤血;感染后24~96 h肝细胞肿胀、空泡变,肝小叶内可见多量网状细胞聚集形成的“伤寒小结”(图1B);14 d分布在汇管区的小血管周围的“伤寒小结”依旧可见,三只存活实验鼠两只有肝脂肪变。
2.3.3脾感染后6 h,脾组织疏松,红髓、白髓结构比较清楚,脾窦隙内可见大单核细胞和多核巨噬细胞;感染后12 h,红髓髓窦扩张、红细胞增多;感染后36~72 h,红髓髓窦红细胞数量明显增多;感染后96 h,脾白髓有较多的多核巨噬细胞、大单核细胞、网状内皮细胞(图1C);感染后7~14 d,脾白髓面积增大,但淋巴小结结构不显。
2.3.4肺感染后3~24 h,随时间推移肺组织病理变化渐渐加重,肺泡壁增厚血管充血、水肿、炎性细胞浸润,一些支气管周围、血管周围和部分肺泡内也出现了相似的病理变化(图1D);感染后48 h,除上述病变尚存外,一些病灶中心的细支气管管腔内充满有炎性渗出物,其中以中性粒细胞为主,此外,还混有脱落的气管黏膜上皮细胞及纤维蛋白,病灶周围有代偿性肺气肿;96 h,肺的大部分正常组织结构被病变组织取代(图1E);感染后7、14 d,存活鼠肺仍有支气管肺炎病灶存在。
2.3.5肾感染后6 h,肾近曲小管上皮细胞肿胀,致使管腔狭窄,肾远曲小管、集合管上皮细胞空泡变明显增多,管腔中有粉染絮状纤维蛋白渗出物,小叶间血管扩张、充血;随着感染时间延长,病变程度加剧,48 h,除上述病变外,肾小球血管丛体积增大,血管丛间有逸出红细胞和炎性细胞浸润;感染后72~96 h,病变肾小球增多,肾小管上皮细胞浊肿、空泡变性程度加重,小叶间血管充血、出血(图1F);感染后7 d、14 d 存活鼠仍可见肾、脏组织的病变。
2.3.6肠道按肠段介绍如下:
十二指肠:病变程度不严重,感染后3~96 h,肠黏膜有局灶性病变,肠绒毛断裂(图1G),固有层毛细血管充血、出血,炎性细胞浸润;感染后7、14 d,残存的肠绒毛固有层仍可见浸润的炎性细胞和“伤寒小结”。
空肠:病变程度与十二指肠相近,感染后3~96 h,部分肠绒毛断裂、脱落,肠腔有纤维蛋白渗出物和少量的红细胞,可见“伤寒结节”;感染后7、14 d,存活鼠肠固有层及黏膜下结缔组织仍见有浸润的炎性细胞。
回肠:其组织病变较十二指肠、空肠严重,感染后3 h,部分肠绒毛断裂、脱落,肠腔黏膜面附着有多量絮状纤维蛋白渗出物及炎性细胞;感染后12~96 h,组织病变程度加重,肠黏膜面可见较多的红细胞、炎性细胞和纤维蛋白渗出物,肠绒毛损伤、脱落明显增多,(图1H),固有层、黏膜下层结缔组织炎性细胞明显增多,血管扩张充血、出血,可见“伤寒小结”;7、14 d,存活鼠仍有组织病变。
结肠:组织病变较轻。感染后3 h~14 d,结肠黏膜有脱落,肠腔内见有炎性渗出物,固有层炎性细胞数量增多,可见“伤寒小结”(图1I)。
2.3.7 脑在感染后的6 h~14 d,脑组织有局域性的神经纤维结构疏松,呈筛网状的脱髓鞘改变,血管扩张充血、出血,部分血管周边及脑组织有多量炎性细胞浸润,有些小胶质细胞成灶状聚集。
2.4感染小鼠脏器组织中细菌抗原的分布
Image Pro-Plus 6.0软件分析的多脏器组织免疫组化结果显示,不同时间感染鼠的各器官组织检测到的细菌抗原累积光密度(IOD)的信号强度不同,同一时间点不同器官组织检测到细菌抗原的信号强度也有很大的差异(图2、图3)。
2.4.1心小鼠心从感染后3 h的弱阳性到48 h强阳性信号,随后阳性信号逐渐减弱,直至14 d仍可检出较强的阳性信号。阳性信号颗粒主要出现在心肌纤维细胞胞质中,少数细胞核也有阳性反应(图4A);3只平行小鼠感染强度未见明显差异。
A.感染后6 h,右心室多个脱落的血栓栓子;B.感染后24 h肝细胞空泡变,小叶间血管扩张充血,可见“伤寒小结”(图中箭头所示);C.感染后96 h,脾窦隙内的多核巨噬细胞、大单核细胞;D.感染后24 h,肺泡壁增厚血管充血、水肿、炎性细胞浸润;E.感染后96 h,支气管肺炎;F.感染后72 h,肾小管上皮细胞肿胀、肾小球血管丛体积增大;G.感染后3 h,十二指肠绒毛断裂;H.感染后12 h,回肠绒毛断裂、脱落,肠黏膜面覆盖有红细胞、炎细胞和纤维蛋白渗出物;I.感染后12 h,结肠肠皱襞刷状缘及皱襞组织脱落,固有层炎细胞浸润” A.6 h after being challenged,several fall-off thromboemblus in ventriculus dexter;B.24 h after being challenged,physalides,eclasis and hyperemia in interlobular blood vessel,typhoid nodule were observed (Indicated by the arrows in the figure);C.96 h after being challenged,a large number of multinucleated giant cells and macromonocyte in space of sinus lienis were observed;D.24 h after being challenged,alveolar wall thickening of the blood vessel hyperemia,edema,inflammatory cells infiltration were observed;E.96 h after being challenged,bronchopneumonia were observed;F.72 h after being infected,swelling of renal cells and capillary bundle volume increase were observed;G.3 h after being challenged,break of duodenum villi was observed;H.12 h after being challenged,break and fall-off ileum villi and red blood cells,inflammatory cells and exudation focus of fibraesanguis in intestinal mucosa were observed;I.12 h after being challenged,fall-off of brush border of colon and plica tissue and lamina propria inflammatory cells infiltration were observed图1 小鼠人工感染丙型副伤寒沙门菌株后的病理组织学变化(200×)Fig.1 Pathological changes of the main organs of the mice challenged by S.Paratyphi C(200×)
2.4.2肝小鼠感染24 h后肝可见中等强度的阳性信号,随着时间推移,阳性信号逐渐增强,96 h阳性信号强度达到高峰,之后阳性信号减弱,14 d仍然可检测到中等强度的阳性信号。阳性信号颗粒主要分布于肝细胞质(图4B);3只平行小鼠感染强度未见明显差异。

图2 免疫组化检测感染鼠各时间点各脏器中IOD动态变化Fig.2 Changes ofIOD of IHC staining different organs at different time
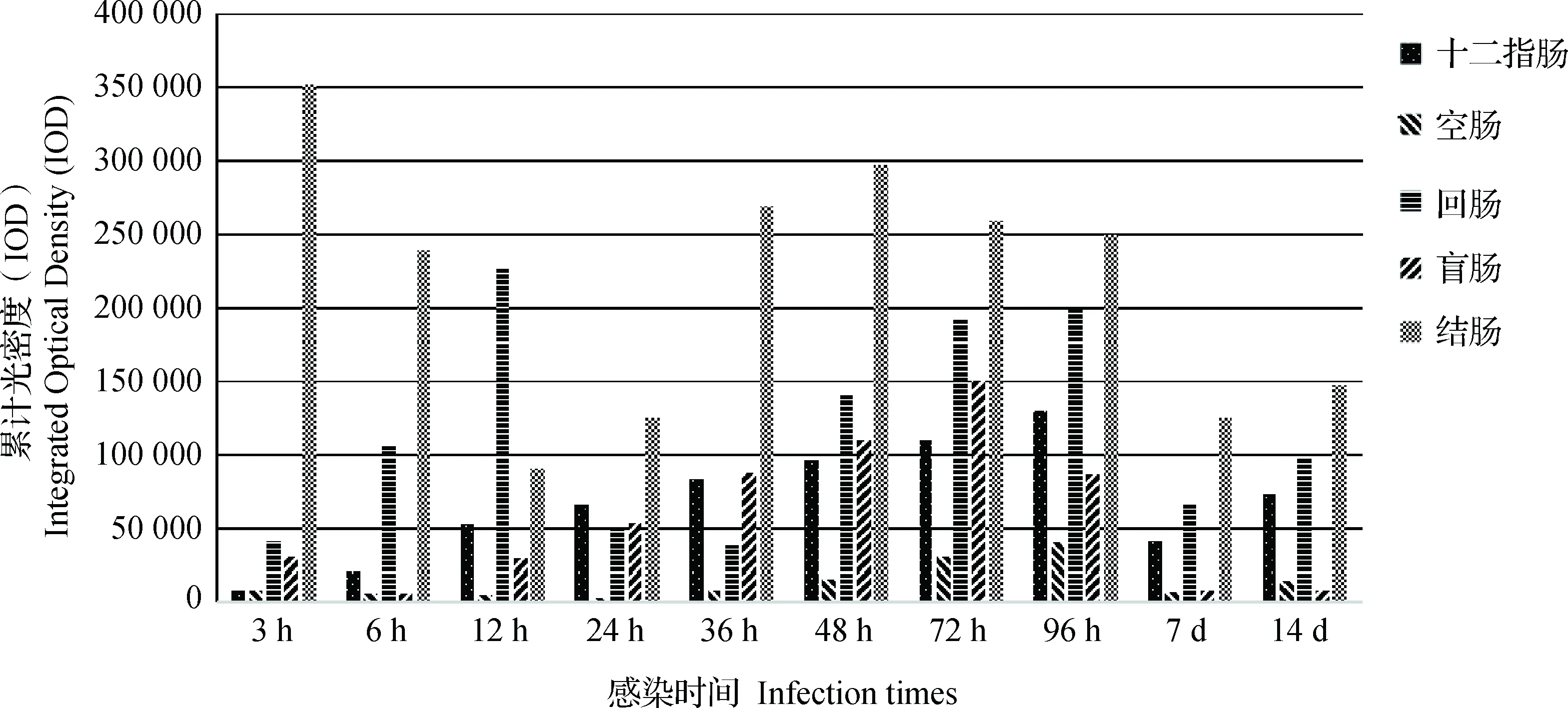
图3 免疫组化检测感染鼠各时间点肠道中阳性累积光密度值动态变化Fig.3 Changes of IHC staining IOD in different intestine sections at different time
2.4.3脾感染后3 h脾中可检测到弱阳性信号;感染后12 h便可检测到强阳性信号,信号随感染时间延长而不断增强,96 h达到最强,之后阳性信号强度减退,但在14 d仍然可检测到强阳性信号。感染组3只平行小鼠免疫组化检测到的脾组织阳性信号强度无明显差异,阳性颗粒在红髓区、白髓区的淋巴细胞胞质内均有出现,其中红髓区阳性信号相对较强,且红髓区边缘部位阳性细胞分布更密集(图4C)。
2.4.4肺感染后3 h肺中可以检测到弱阳性信号;12 h检测到中等强度的阳性信号,96 h达到最强,之后阳性信号开始减退,但14 d仍可检测到强阳性信号。在相同感染时间,感染组的3只平行鼠肺阳性信号强度差异不明显。阳性信号颗粒主要分布于肺泡壁毛细血管上皮、支气管黏膜上皮细胞、支气管腔和肺泡中的炎性渗出物、血管中的血细胞(图4D、E)。
2.4.5肾感染后6、12 h肾能检测到弱阳性信号;96 h阳性信号达到最强,7 d开始阳性信号减弱,感染后的14 d仍可检测到弱阳性信号。阳性信号颗粒主要分布在肾小管上皮细胞胞质和肾小球毛细血管基质细胞质中(图4F)。3只平行鼠肾的阳性信号强度有部分差异。
2.4.6肠道按肠段分别介绍如下:
十二指肠:感染后3 h十二指肠中检测到中等阳性信号,96 h达到最强(图4G),7、14 d十二指肠中检测到的阳性信号且依旧很强。感染组的3只平行鼠的阳性信号强度未见明显差异。阳性颗粒主要分布在肠绒毛上皮细胞和肠腺上皮细胞。
空肠:感染3 h可检测到较强阳性信号,12、24 h阳性信号有所减弱,感染后36~72 h阳性信号快速增强,感染后96 h阳性信号达到最强,直至感染后14 d仍然可检测到强阳性信号,且强度大于第7天。感染组3只平行鼠空肠阳性信号强度差异不明显。阳性信号主要分布在肠绒毛上皮细胞和肠腺上皮细胞胞质内。
回肠:感染后3 h回肠中可检测到强阳性信号;感染后12 h阳性信号达到最强,24、36 h阳性信号有所减弱,但仍为强阳性信号(图4H),感染后72、96 h阳性信号再次达到最强,直至感染后14 d仍可检测到强阳性信号。阳性信号颗粒主要分布在肠绒毛上皮细胞和肠腺上皮细胞胞质内(图4H)。
结肠:小鼠感染后3 h检测到极强阳性信号;除感染后的12~24 h和7~14 d两个时段阳性信号有所减弱(但信号为强阳性)外,结肠中的阳性信号在检测阶段一直持续高强;阳性颗粒主要分布在肠黏膜上皮和肠腺上皮细胞胞质内(图4I)。
脑:小鼠感染后6 h脑组织检测到弱阳性信号,一直持续到感染后72 h。阳性信号主要见于神经细胞、胶质细胞的细胞质。
3 讨 论
沙门菌病一直是困扰全球的问题。研究资料表明,绝大多数沙门菌血清型宿主范围广泛,但少数血清型有严格的宿主特异性,如引起肠热症的伤寒沙门菌、甲型副伤寒沙门菌、乙型沙门菌和丙型沙门菌,这些病原被认为主要是人类的病原菌,极少能从动物中分离到[12]。2008—2011年研究者在对四川成都周边天鹅、大雁驯养基地沙门菌进行流行病学调查时发现,从594份外表健康的天鹅、大雁肛拭子中分离出的37株沙门菌中,经血清学检验确认丙型副伤寒沙门菌有9株。沙门菌被认为可在人类与动物间通过直接或间接途径传播,引起肠道和全身感染性疾病[13]。丙型副伤寒沙门菌引起的丙型副伤寒是经消化道传播的人类急性传染病,临床表现为急性胃肠炎或脓毒血症。
小白鼠为啮齿类哺乳动物,因其组织结构、生理功能与人类有许多相似之处,加之易于实验操作、观察,是人类临床实验中常被选用实验动物[14-16]。源自外表健康天鹅携带的丙型副伤寒沙门菌在动物和人的传染病的流行病学中有无价值,对人类有无致病性、病理损伤如何,我们并不了解。本研究以口服感染禽源丙型副伤寒沙门菌方式建立的小鼠感染模型,很好的模拟了食源沙门菌的自然感染状态。通过观察小鼠在感染病原后不同时段组织器官细菌抗原IOD,提示丙型副伤寒沙门菌主要在肠道繁殖,且主要在回肠、盲肠和大肠(结肠)等部位增殖;但组织病理变化却显示,被病原侵袭的肠组织以回肠损伤明显,在感染后3 h已呈现出程度不同炎性变化,肠绒毛断裂、脱落,病变持续存在直至14 d仍有损伤、充血、出血及炎性细胞浸润,而其他肠段尤其是大肠和盲肠的损伤则较轻。有研究表明,沙门菌主要在肠道生长繁殖,病原菌将其含有甘露醇的细胞受体先黏附于回肠黏膜上的特殊上皮细胞“M细胞”表面,引发细胞肌动蛋白重排、内在化,细菌在吞噬细胞内繁殖后释放于上皮下区,被固有层巨噬细胞吞噬[17]。这也就不难解释观察到的回肠损伤显著的问题。伤寒类沙门菌在宿主体内可形成Vi抗原,以抵抗吞噬细胞的杀伤,阻挡补体、抗体的破坏作用,被巨噬细胞吞噬的伤寒类菌通过淋巴液到达肠系膜淋巴结;部分沙门菌经胸导管入血形成菌血症,菌随血流入肝、脾、胆囊等器官,引起组织病理损伤,引发临床前驱症状,病原在脏器繁殖后再次入血造成二次菌血症[18]。IOD检测发现,经口服途径感染的病原体抗原,在感染后的3 h已不同程度地出现在被观察的脏器组织中,心、肝、脾、肺、肾组织中的菌体抗原主要分布在细胞胞质,结肠、回肠、十二指肠中的病原抗原高于空肠、盲肠,脾、肝、心、肺组织中的抗原检出量明显高于肾。除肾细菌抗原IOD阳性信号始终较弱外,其他被检测的脏器组织的阳性信号在感染的不同时段强度有所差异,且呈正态分布。对试验鼠的器官组织切片、HE染色及病理学观察显示:天鹅源丙型副伤寒沙门菌感染小鼠所呈现出的组织脏器损伤是一种泛嗜性的,随着病原感染时间推移,绝大部分的损伤都有不同程度的加重,甚至在攻毒后的14 d组织损伤仍然存在,与一些学者[19-20]所描述的沙门菌所致的肠组织病变相似。在作者的试验中,感染鼠多个器官组织皆有程度不同的血管扩张、充血、炎性细胞浸润等炎性反应和细胞的变性、坏死等组织病变。值得一提的是,感染后3 h,右心腔内可见若干脱落的纤维蛋白血栓栓子,提示少量感染病原(如肝细菌抗原OID 1 105.27±172.80)的内毒素进入血液,就可造成血管内皮细胞的损伤。肺病原感染后3 h(肺OID 1 179.06±167.77),肺泡壁增厚血管充血、水肿、炎性细胞浸润,一些支气管周围、血管周围和部分肺泡内也出现了相似的病理变化;48 h后,肺内沙门菌抗原(OID)达到92 299.92±5 667.39,除3 h可见的病理变化外,一些病灶中心的细支气管管腔内充满有炎性渗出物,其中以中性粒细胞为主,此外,还混有脱落的气管黏膜上皮细胞及纤维蛋白。另外,在被检的肝、脾、十二指肠、空肠、回肠、大肠等多个器官可观察到有具有诊断意义的“伤寒小结”。
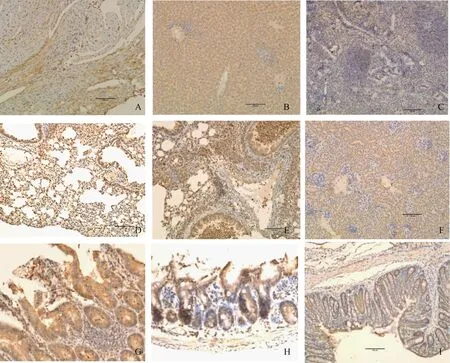
A.感染后24 h抗原分布在心肌细胞胞质,强阳性;B.感染后24 h抗原分布于肝细胞胞质,强阳性;C.感染后24 h脾,抗原在红髓、白髓区的淋巴细胞胞质内,红髓区阳性信号相对较强;D.感染后24 h,主要分布于肺泡壁毛细血管上皮,强阳性;E.感染后96 h,抗原分布于肺泡壁毛细血管上皮、支气管黏膜上皮细胞、支气管腔和肺泡中的炎性渗出物、血管中的血细胞团,强阳性;F.感染后24 h,抗原分布在肾小管上皮细胞胞质,肾小球毛细血管基质,阳性;G.感染后96 h,抗原分布于十二指肠肠绒毛上皮细胞和肠腺上皮细胞,强阳性;H.感染后48 h,抗原分布在回肠绒毛上皮细胞和肠腺上皮细胞胞质;I.感染后36 h,抗原分布在结肠黏膜上皮细胞和肠腺上皮细胞胞质A.24 h after being challenged,antigen mainly existed in cytolymph of cardiac muscle cell (strongly positive);B.24 h after being challenged,antigen existed in cytolymph of liver (strongly positive);C.24 h after being challenged,antigen existed in cytolymph of leukomonocyte in red pulp and white pulp of spleen,and positive signal in red pulp was stronger;D.24 h after being challenged,antigen was dispersed in lung,antigen located in lung epithelial cells cytoplasm (strongly positive);E.96 h after being challenged,antigen existed in the epithelium of alveolar walls blood capillary,bronchial mucosa epithelial cells,inflammatory exudate in bronchial and alveolar cavity,the clumps of cells in the blood vessels(strongly positive);F.24 h after being challenged,antigen existed in renal tubular epithelial cell plasma and glomerular capillary matrix,positive;G.96 h after being challenged,antigen existed in villi of duodenum and epithelium of enteraden (strongly positive);H.48 h after being challenged,antigen existed in villi of ileum and cytolymph of enteraden epithelium;I.36 h after being challenged,antigen existed in colonic mucosa epithelial cells and intestinal epithelial cell cytoplasm(strongly positive)图4 感染小鼠组织中丙型副伤寒沙门菌株的免疫组化染色(200×)Fig.4 Salmonella Paratyphi C in tissues of the challenged mice with immuno-histochemistrydouble staining(200×)
由此可见,自外表健康白天鹅肛拭子分离鉴定的丙型副伤寒沙门菌,经口服途径感染研究模型选用的实验小鼠,病原既可直接作用于肠道引起肠组织结构坏死、脱落及炎性损伤,还可快速突破肠壁屏障进入宿主循环系统,作用于多个脏器组织引起广泛病变,持续损伤。值得关注的发现,口服天鹅源丙型副伤寒沙门菌的实验鼠的右心腔被观察到有多个脱落的纤维素性血栓栓子;呼吸系统在感染后3 h呈现出肺泡壁增厚、血管充血、水肿、炎性细胞浸润;感染后48 h可见支气管肺炎;肾组织内的病原抗原尽管始终处于被检脏器组织最低值,在感染后48 h除肾小管损伤也见有肾小球肾小球血管丛体积增大,血管丛间有逸出红细胞和炎性细胞浸润;暗示源于外表健康的天鹅源丙型副伤寒沙门菌的口服感染实验小鼠不仅引起肠道损伤,还可侵袭全身多个器官组织并产生严重的致病作用,其对人类是否有相似的器官组织损伤和/或致病性尚需证实。
[1]NAKAO J H,PRINGLR J,JONES R W,et al.‘One Health’ investigation:outbreak of humanSalmonellaBraenderup infections traced to a mail-order hatchery-United States,2012-2013[J].EpidemiolInfect,2015,10(143):2178-2186.
[2]朱丽娜.成都地区大雁、天鹅源沙门氏菌病原特性及丙型副伤寒沙门氏菌的分子生物学特性研究[D].成都:西南民族大学,2011.
ZHU L N.Pathogenic Characteristics of Salmonella from Cygnus and Anser indicus in Chengdu area and molecular biological characteristics ofSalmonellaParatyphiC[D].Chengdu:South-west University for Nationalities,2011.(in Chinese)
[3]胡杰,张步娴,屈素洁,等.2006-2012年广西鸡沙门氏菌感染情况调查[J].上海畜牧兽医通讯,2013(6):4-6.
HU J,ZHANG B X,QU S J,et al.ChickenSalmonellainfection investigation in guangxi in 2006-2012[J].ShanghaiJournalofAnimalHusbandryandVeterinaryMedicine,2013(6):4-6.(in Chinese)
[4]王晓泉,焦新安,刘晓文,等.江苏部分地区食源性和人源沙门氏菌的多重耐药性研究[J].微生物学报,2007,47(2):221-227.
WANG X Q,JIAO X A,LIU X W,et al.Characterization of multidrug-resistantSalmonellaisolated from meats and human samples in some regions of Jiangsu[J].ActaMicrobiologicaSinica,2007,47(2):221-227.(in Chinese)
[5]朱翔.一起丙型副伤寒沙门菌引起的食物中毒调查[J].浙江预防医学,2011,12:49-50.
ZHU X.A food poisoning investigation caused by C paratyphoidSalmonella[J].ZhejiangJournalofPreventiveMedicine,2011,23(12):49-50.(in Chinese)
[6]戴婧.一起由丙型副伤寒沙门氏菌引起食物中毒的报告[J].青海医药杂志,2012,7:71-72.
DAI J.A food poisoning report caused by C ParatyphoidSalmonella[J].QinghaiMedicalJournal,2012,42(7):71-72.(in Chinese)
[7]DE JONG H K,PARRY C M,VAN DER POLL T,et al.Host-pathogen interaction in invasive Salmonellosis[J].PLoSPathon,2012,8(10):e1002933
[8]SWEARINGEN M C,PORWOLLIK S,DESAI P T,et al.Virulence of 32Salmonellastrains in mice[J].PLoSOne,2012,7(4):e36043
[9]SETHSMITH H M.SPI-7:Salmonella’s Vi-encoding pathogenicity island[J].JInfectDevCtries,2008,2(4):267-271.
[10]GAL-MOR O,BOYEL E C,GRASSL G A.Same species,different diseases:how and why typhoidal and non-typhoidalSalmonellaentericaserovarsdiffer[J].FrontMicrobiol,2014,5(4):1-10.
[11]NYE K J,FALLON D,FRODSHAM D,et al.An evaluation of the performance of XLD,DCA,MLCB,and ABC agars as direct plating media for the isolation ofSalmonellaentericafrom faeces[J].JClinPathol, 2002,55(4):286-288.
[12]贾文祥.医学微生物学[M].北京:人民卫生出版社,2001.
JIA W X.Medical microbiology[M].Beijing:People’s Medical Publishing House,2001.(in Chinese)
[13]BARTHEL M,HAPFELMEIER S,QUINTANILLA-MARTíNEZ L,et al.Pretreatment of mice with streptomycin provides aSalmonellaentericserovar Typhimurium colitis model that allows analysis of both pathogen and host[J].InfectImmun,2003,71(5):2839-2858.
[14]GREGORY S G,SEKHON M,SCHEIN J,et al.A physical map of the mouse genome[J].Nature,2002,418(6899):743-750.
[15]GRASSL G A,FINLAY B B.Pathogenesis of entericSalmonellainfections[J].CurrOpinGastroenterol,2008,24(1):22-26.
[16]SANTOS R L,ZHANG S,TSOLIS R M,et al.Animal models ofSalmonellainfection:enteritis versus typhoid fever[J].MicrobesInfect,2001,3(4):1335-1344.
[17]CLARK M A,JEPSON M A,SIMMONS N L,et al.Preferential interaction ofSalmonellatyphimuriumwith mouse Peyer’s patch M cell[J].ResMicrobiol,1994,145(7):543-552.
[18]CLARK M A,JEPSON M A,SIMMONS N L,et al.Preferential andSalmonellapathogenicity island 1 regulate M-cell invasion and epithelial destruction by thphimurium[J].InfectImmun,1998,66(2):724-731.
[19]颜彬.肠炎沙门氏菌实验感染鸭病理学及免疫组化与免疫荧光抗原定位方法的建立和应用研究[D].雅安:四川农业大学,2008.
YAN B.Pathological development and application of antigens locazilition with immunoperoxidase and immunofluorescent assay in ducklings experimentally infected withSalmonellaenteritidis[D].Ya′an:Sichuan Agricultural University,2008.(in Chinese)
[20]汪敏.肠炎沙门氏菌实验性感染雏鸡的研究[D].重庆:西南大学,2009.
WANG M.Study on the experimentalS.enteritidisinfect in chickens[D].Chongqing:South-West University,2009.(in Chinese)
(编辑白永平)
Histopathology and Antigen Distribution in the Mice Infected withSalmonellaParatyphiC Separated from Swan
LUO Wei,RAN Dan-dan,CHEN Dong-ping,LIU Qun
(CollegeofLifeScienceandTechnology,SouthwestMinzuUniversity,Chengdu610041,China)
To learn histopathology of the mice infected withSalmonellaParatyphiC,clarify antigen distribution in tissue of the mice,and lay the groundwork of pathogenic mechanism,mice were infected withSalmonellaParatyphiC by drench.After being infected,11 tissues of the mice were sampled,embedded in paraffin,and dyed by HE and immune enzymatic technique.Three to six hours post challenge,inflammatory reaction were observed in heart,liver,spleen,lung, kidney,intestinal tract and brain,and lasted until 14 d post challenge.Necrosis,fall-off and inflammatory injury occurred in ileum,thrombus were found in ventriculus dexter.Alveolar walls were thickened,and vascular congestion,edema and inflammatory cells infiltration were observed.Chronic fibrous pneumonia,alveobronchiolitis,acute glomerulonephritis,and denaturation,necrosis,inflammatory injury and typhoid nodule in several organs were observed.Three hours after being challenged,antigen was detected in the sampled organs except brain.Besides extremely high quantity of antigen in the intestinal tract (infection route),the strongest positive signal were also detected in spleen,heart,lung and liver,which mainly existed in cytoplasm of the tissues.These results indicate thatSalmonellaParatyphiC separated from swan can infect mice,encroach many organs of mice,and lead to denaturation,necrosis and inflammatory injury in the organs to different extent in long time.
SalmonellaParatyphiC separated from swan;pathological change;antigen distribution
10.11843/j.issn.0366-6964.2016.08.018
2016-03-09
四川省应用基础研究计划项目(2013JY0045)
罗薇(1960-),女,教授,硕导,主要从事动物传染病诊治研究
S852.612
A
0366-6964(2016)08-1667-09
