新型离子液体-CO2吸收制冷工质对选择及吸收特性
2016-09-07武卫东
武卫东 吴 俊 王 振 张 华
(上海理工大学制冷与低温工程研究所 上海 200093)
新型离子液体-CO2吸收制冷工质对选择及吸收特性
武卫东吴 俊王 振张 华
(上海理工大学制冷与低温工程研究所上海200093)
离子液体(ILs)-CO2作为一种新型吸收制冷工质对,ILs种类的选择对其工质对性能及吸收式制冷循环特性至关重要。ILs对CO2的吸收性能与ILs种类、阳离子结构、体系温度及CO2分压有直接关系。本文建立了一套ILs吸收CO2的实验台,并以低粘度、较优吸收性能为原则初选了4种咪唑双三氟甲磺酰亚胺盐ILs([emim][Tf2N]、[bmim][Tf2N]、[hmim][Tf2N]和[omim][Tf2N])为研究对象。在温度298.15 K、313.15 K及328.00 K,压力2.0~5.0 MPa条件下,分别测定了CO2在以上4种ILs中的溶解特性。结果表明:咪唑双三氟甲磺酰亚胺盐ILs对CO2有较好的吸收性能;CO2在同族ILs中的溶解度随阳离子烷基链长度的增加而增大,其在4种ILs中的溶解度顺序为:[emim][Tf2N]<[bmim][Tf2N]<[hmim][Tf2N]<[omim][Tf2N];随着温度和压力的逐渐升高,CO2溶解度的变化幅度逐渐减小。本文还给出了3种温度下CO2在[omim][Tf2N]中的溶解度与压力的关联式。
吸收式制冷循环;吸收制冷工质对;吸收特性;离子液体;CO2
近年来,随着能源紧缺与环境问题的日益严峻,可以利用低品位热能的吸收式制冷技术引起了人们的广泛关注[1]。传统吸收式制冷系统(如H2O/LiBr和NH3/H2O)存在低温结晶、高温腐蚀、体积庞大等缺点,在实际应用中受到了较大的限制[2]。因此,开展能够克服这一系列缺陷的新型吸收制冷工质对研究具有重要的理论和实践意义。
CO2作为自然工质,因具有良好的化学稳定性、安全无毒且单位制冷量大等优点而备受人们的青睐。将其用于吸收式制冷,有助于系统的小型化、高效化,具有潜在的环保与经济效益[3]。目前,将CO2用作吸收式制冷的研究甚少,制约其发展的主要因素是吸收剂的选择。
离子液体(ILs)是一种在100 ℃以下呈液体状态,含有裸离子、配位离子和超分子离子,不含挥发性液体溶剂的体系[4]。因其具有溶解能力强、比热容相对较小、化学稳定性和热稳定性好等一系列优点而被视为新型绿色吸收剂[5]。赵杰等[6]将ILs作为吸收式制冷吸收剂时,具有无结晶、无腐蚀、压力适中等优势。Blanchard L A等[7]在1999年最早报道了CO2可大量溶解于1-丁基-3-甲基咪唑六氟磷酸盐([bmim]PF6),而ILs几乎不溶于CO2。Lynnette A等[8]发现CO2在较高浓度时,ILs的膨胀率很小,依然能保持其溶剂强度。赵佳美[9]将ILs与环保制冷剂CO2组成吸收制冷工质对应用于吸收式制冷系统,不仅可以在较高压力下工作,且有利于系统的小型化,具有潜在的应用前景。Sen M等[10]发现CO2在ILs中的溶解度数据是确定吸收剂中制冷剂浓度的重要参数,且对吸收和解析过程起着重要作用。郑霄龙[11]将CO2-[bmim][Tf2N]工质对应用于传统吸收式制冷系统中,经理论计算,其COP可达0.3863,依据能量梯级利用原理进行系统优化,其COP可达0.69,但并没有进行实验验证。黄宇等[3]将CO2-[bmim][PF6]工质对应用于吸收式制冷系统中,发现CO2在[bmim][PF6]中较小的溶解度是限制其循环热力系数提升的因素之一。Martin A等[12]也得出了相同的结论。Holbrey J D等[13]发现由于ILs性质可调,其种类可达1018。而且不同的ILs对CO2吸收的溶解度可能相差很大[14]。因此,选择合适种类的ILs(如对CO2具有高溶解度)对ILs-CO2工质对在吸收式制冷系统的高效应用起着关键影响作用。
Yuan X L等[15]发现通过ILs阴阳离子结构对其吸收性能的影响可以实现对ILs的初选。而溶解度特性是ILs作为CO2吸收剂性能优异与否的重要评判依据,目前相关研究非常缺乏。同时,体系温度及CO2分压对工质对吸收特性也具有重要影响[16]。鉴于此,本文首先初选了能够较好吸收CO2的ILs,并具体研究了ILs种类、阳离子结构、体系温度及CO2分压对ILs吸收CO2性能的影响,为筛选能够较好吸收CO2,从而更好应用于吸收式制冷系统的ILs提供一定参考。
1 实验
1.1 离子液体的选择
CO2在ILs中的溶解度与其阴阳离子的种类有关。Dong Kun等[17]发现咪唑类阳离子上存在C-2活泼氢,可与CO2分子之间部分形成氢键,促进其对CO2的吸收。Maiti A[18]研究了阴离子种类对CO2溶解特性的影响,发现CO2溶解度按照[Tf2N]>[PF6]>[TfO]>[BF4]>[DCA]>[NO3]的顺序递减。Freire M G等[19]发现含有[Tf2N]阴离子的ILs具有疏水性。Ahosseini A等[20-21]发现当阴离子为[Tf2N]时,ILs的粘度最小,且ILs的粘度越低,CO2的分散性越高,能够越快被其吸收。基于以上研究成果,本文初选了黏度较低、吸收性能较好且近年来应用比较广泛的4种咪唑双三氟甲磺酰亚胺盐ILs(即1-乙基-3甲基咪唑双三氟甲磺酰亚胺盐([emim][Tf2N])、1-丁基-3甲基咪唑双三氟甲磺酰亚胺盐([bmim][Tf2N])、1-己基-3甲基咪唑双三氟甲磺酰亚胺盐([hmim][Tf2N])和1-辛基-3甲基咪唑双三氟甲磺酰亚胺盐([omim][Tf2N]))为研究对象,并在借鉴前人研究[22-23]的基础上,搭建了一套离子液体吸收CO2的实验装置,测定了压力2.0~5.0 MPa和温度298.15 K、313.15 K及328.00 K条件下CO2在以上4种ILs中的溶解特性。
1.2 实验材料
本文所用4种ILs的基本信息如表1所示。

表1 实验材料
1.3 实验装置
本实验装置主要由高压反应釜、高压储气罐、供输气装置、恒温水浴系统及数据测量与采集系统组成。图1为实验系统示意图。其中,高压反应釜是该实验系统的核心部件,由316 L不锈钢加工而成,有效容积为200 mL,设计承压10 MPa,设计工作温度为-20~100 ℃;高压储气罐的设计要求与高压反应釜基本一致,有效容积为600 mL;F38型恒温水浴的显示分辨率为0.01 ℃,温度稳定性为±0.05 ℃;Pt100铂电阻温度传感器的精度为±0.15 ℃,量程为-200~200 ℃;NS型压力传感器的精度为0.1%,量程为0~6 MPa;34970A型数据采集仪的基本直流电压精度为0.004%,数模转换位数是6.5位。
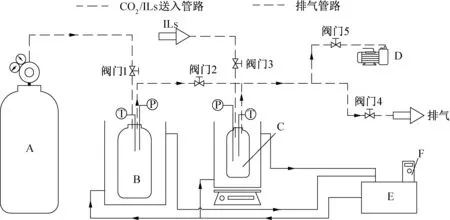
A CO2储气罐 B缓冲罐C高压反应釜D真空泵E恒温水浴F数据采集仪图1 实验系统示意图Fig.1 Schematic diagram of the experimental system
实验前对系统进行真空与保压测试。在4 h真空测试与18 h的保压测试中,系统的压力未见明显的升高与降低,系统的气密性满足实验要求。
1.4 实验步骤
1)如图1所示(下同),打开阀门1、阀门2、阀门5,启动真空泵,对系统抽真空,并记下此时压力读数作为零点。
2)关闭阀门2、阀门5。打开恒温水浴,当温度达到设定温度后,将ILs置于200 mL进液瓶,利用压差,旋开阀门3往反应釜中进液60 mL,关闭阀门3,待压力稳定后记录此时反应釜的压力p0,该压力即为离子液体的饱和蒸汽压。
3)打开CO2钢瓶处的气体减压阀,使储气罐达到一定压力,关闭阀门1,记录此时储气罐的压力p1。
4)打开阀门2,待反应釜内的压力保持不变时关闭阀门2,记录此时储气罐内的压力p2,反应釜内部压力pEC。
1.5 实验数据处理
参考Fischer K等[22]和王占丽等[23]的溶解度计算方法,根据储气罐、反应釜及充注ILs的体积、恒温水浴温度以及吸收前后反应釜内压力的变化和储气罐内压力的变化便可计算出ILs充注量nIL、ILs吸收CO2的量nCO2以及CO2的摩尔分率(溶解度)x,分别如公式(1)~公式(3)所示。
(1)
nCO2=[VGR×(p1-p2)-(VEC-VIL)×
(pEC-p0)]/RT
(2)
(3)
式中:VGR为储气罐的容积,mL;VEC为反应釜的容积,mL;VIL为注入的ILs的体积,mL;ρ为ILs的密度,g/cm3;M为ILs的分子量;x为摩尔分率。
1.6 系统不确定度分析
该实验系统的不确定度主要来自测量仪表引起的不确定度。依据Moffat R J[25]提出的不确定度分析方法,CO2溶解度的相对不确定度传递方程可表达如下:
(4)

对于[emim][Tf2N],参数p1、p2、pEC、p0、VIL和T的最大相对不确定度分别为0.16%、0.19%、0.30%、0.44%、1.67%和0.60%。经计算可得到CO2在[emim][Tf2N]中的溶解度的最大相对不确定度为5.86%,同理,可得到CO2在[bmim][Tf2N]、[hmim][Tf2N]和[omim][Tf2N]中的溶解度的最大相对不确定度分别为5.97%、6.13%和6.34%。
2 系统可靠性校验
为了检验本实验装置所测数据的可靠性,对照文献[24],测定了298.15 K时CO2在[emim][Tf2N]中的溶解度,并将二者数据分别进行拟合后进行了对比,结果如图2所示。

图2 温度298.15 K时,CO2在[emim][Tf2N]中溶解度的实验值与文献值对比Fig.2 Comparison of experimental and literature data about CO2 solubility in [emim][Tf2N] at 298.15 K
从图2中可以看出,CO2在ILs中的溶解度随压力的变化趋势与文献值基本相符。表2所示为2.0~5.0 MPa压力范围内,相同工况下,实验值与文献值的对比及相对偏差,表中xexp和xlit分别为将CO2分压代入实验拟合方程和文献值拟合方程中计算得到的CO2溶解度,RD%和AARD%分别表示实验值与文献值的相对偏差和平均相对偏差。从表中计算结果可以看出,其平均相对误差为±5.74%,说明该实验装置和计算方法可行。

表2 在298.15 K时,CO2在[emim][Tf2N]中溶解度的实验值与文献值的相对偏差
3 结果与分析
采用本实验装置,按照上述实验步骤,分别测定了在313.15 K,298.15 K,328.00 K三种不同温度下,CO2在4种ILs中的摩尔溶解度随CO2分压(压力范围2.0~5.0 MPa)的变化,并对其数据进行拟合,结果如图3、图4及图5所示。其中,图3中除了文中4种ILs的CO2溶解度(数据)拟合曲线外的散点数据是文献中CO2在其他吸收剂中的溶解度。

图3 313.15 K时,CO2在4种咪唑基离子液体及其他吸收剂中溶解度对比Fig.3 Comparison of CO2 solubility in four imidazole ionic liquids and other absorbents at 313.15 K
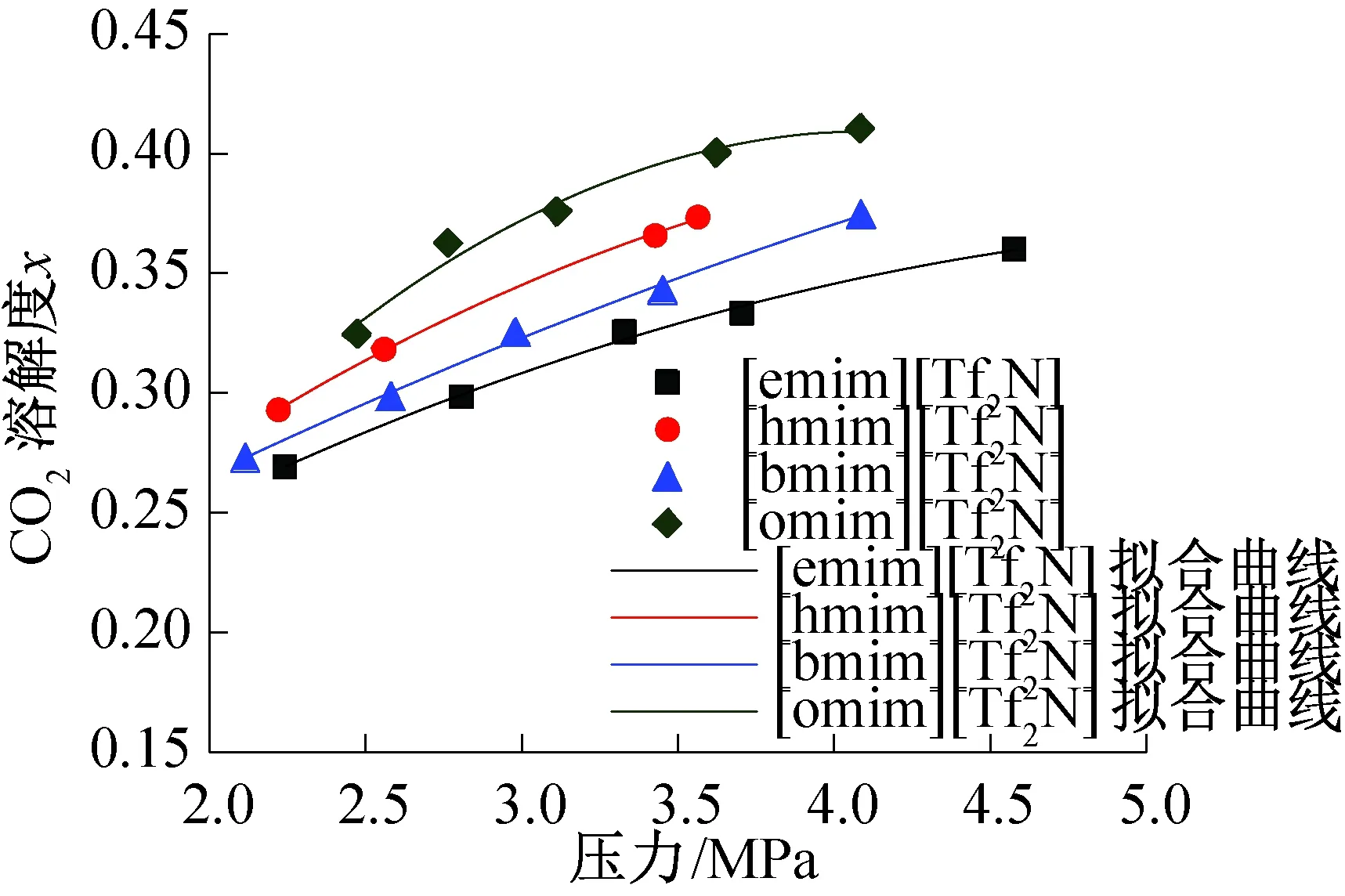
图5 温度328.00 K时,CO2在4种离子液体中的溶解度Fig.5 CO2 solubility in the four ionic liquids at 328.00 K
3.1 CO2在4种咪唑基离子液体及其他吸收剂中溶解度的对比
在相同温度(313.15 K)下,选取了一些其他ILs[9,15,26],与文中4种咪唑双三氟甲磺酰亚胺盐ILs对CO2的吸收性能进行了对比,结果如图3所示。从图中可以看出,当ILs的阳离子为[hmim]+时,CO2气体在其中的溶解度大小顺序为:[hmim][Tf2N]>[hmim][BF4]>[hmim][MeSO4];同样,可以发现[emim][Tf2N]对CO2的吸收性能比[emim][EtSO4]好,[bmim][Tf2N]对CO2的吸收性能比[bmim][NO3]好,说明当ILs的阴离子为[Tf2N]时,ILs对CO2的吸收最好,这与Maiti[18]得出的结论相一致。与N-丁基四氟硼酸盐([N-bupy][BF4])及羟基氨ILs(HEF、HEA、HEAA)相比,发现其对CO2的吸收性能远远弱于文中4种咪唑双三氟甲磺酰亚胺盐ILs。另外,由图3、图4及图5可以看出,在温度298.15 K、313.15 K、328.00 K,压力2.0~5.0 MPa条件下,CO2气体在4种ILs中的溶解度最大时达到0.545,最小时为0.269。说明咪唑双三氟甲磺酰亚胺盐ILs对CO2有较好的吸收性能。
3.2 阳离子结构对离子液体吸收CO2性能的影响
由图3、图4及图5可以看出,在相同工况下,CO2气体在上述4种离子液体中的溶解度有所不同,按其大小顺序排列,则[omim][Tf2N]>[hmim][Tf2N]>[bmim][Tf2N]>[emim][Tf2N]。而依据Breure等[27]的方法,4种ILs的结构划分如表3所示。可以发现,[omim][Tf2N]的烷基链上有1个CH3和7个CH2,烷基链最长;而[emim][Tf2N]的烷基链上有1个CH3和1个CH2,烷基链最短。说明CO2在ILs中的溶解度与ILs的阳离子结构有关,且离子液体咪唑环上的烷基链越长,与CO2的相互作用就越强,则CO2溶解度就越大。

表3 4种离子液体的结构划分
3.3 温度和压力对离子液体吸收CO2性能的影响
由图3、图4及图5可以看出,在相同温度或压力工况下,CO2在4种ILs中的溶解度变化趋势分别随压力或温度是一致的。例如,对于[omim][Tf2N],其不同温度下的拟合方程如表4所示,可以看出,CO2溶解度与CO2分压的线性相关性较好。选定不同压力值,在不同温度下,根据拟合方程计算出CO2溶解度,结果如表5所示。可以看出,在体系温度为298.15 K时,当压力从3.0 MPa增至3.5 MPa,CO2在[omim][Tf2N]中的溶解度由0.493增至0.522,增加了5.88%;当压力从3.5 MPa增至4.0 MPa,CO2在[omim][Tf2N]中的溶解度由0.522增至0.543,增加了4.02%。说明在相同温度下,CO2在ILs中的溶解度随体系压力的升高而升高,并且在压力较小时,增长率较大,随着压力的升高,溶解度的增长速率变得平缓。当CO2分压为3.5 MPa时,体系温度从298.15 K增至313.15 K,CO2在[omim][Tf2N]中的溶解度由0.522降至0.436,降低了16.50%;体系温度从313.15 K增至328.00 K,CO2在[omim][Tf2N]中的溶解度由0.436降至0.398,降低了8.72%。说明在同一压力下,CO2在ILs中的溶解度随体系温度的升高而降低,并且在温度较低时,溶解度的减小速率较快,随着温度的上升,溶解度的减小速率逐渐变平缓。

表4 不同温度下[omim][Tf2N]的拟合方程

表5 不同温度、压力下,CO2在[omim][Tf2N]中的溶解度
4 结论
本文基于搭建的ILs吸收CO2实验台,研究了在温度298.15 K、313.15 K及328.00 K,压力2.0~5.0 MPa条件下CO2在4种低粘度性咪唑基ILs,即[emim][Tf2N]、[bmim][Tf2N]、[hmim][Tf2N]和[omim][Tf2N]中的溶解特性,为筛选能够较好吸收CO2,从而能够更好的应用于吸收式制冷系统的ILs提供一定参考。 得出以下结论:
1)在上述条件下,CO2气体在所研究4种ILs中的溶解度最大时达到0.545,最小时为0.269。将其与其他类ILs(如四氟硼酸盐及羟基氨ILs)在相同温度下对CO2的吸收性能进行对比,发现咪唑双三氟甲磺酰亚胺盐ILs对CO2气体有较好的吸收性能。
2)在相同工况下,CO2气体在上述4种ILs中的溶解度是不同的,若按其溶解度的大小顺序排列,则[omim][Tf2N]>[hmim][Tf2N]> [bmim][Tf2N]> [emim][Tf2N],表明CO2气体的溶解度随着ILs咪唑环上的烷基链的增长而增大。
3)在一定范围内,压力一定时,CO2在4种咪唑双三氟甲磺酰亚胺盐ILs中的溶解度随着温度的升高而减小,并且溶解度的减小速率逐渐变平缓;温度一定时,随着压力的升高,CO2在4种咪唑双三氟甲磺酰亚胺盐ILs中的溶解度在增大,并且溶解度的增长速率逐渐变平缓。
本文受教育部留学回国人员科研启动基金和上海市自然科学基金(14ZR1429000)项目资助。(The project was supported by the Scientific Research Foundation for the Returned Overseas Chinese Scholars, State Education Ministry and the Natural Science Foundation of Shanghai (No. 14ZR1429000).)
[1]戴永庆, 耿慧彬, 蔡小荣. 溴化锂吸收式制冷技术的回顾与展望[J]. 制冷技术, 2001, 21(1): 21-24. (DAI Yongqing, GENG Huibin, CAI Xiaorong. Review and prospects of lthium bromide absorption refrigeration technology[J]. Refrigeration, 2001, 21(1): 21-24.)
[2]陈曙辉, 陈光明, 郑飞. 吸收式制冷工质的发展[J]. 制冷学报, 1998, 19(2): 45-52. (CHEN Shuhui, CHEN Guangming, ZHENG Fei. Development of working pair in absorption refrigeration[J]. Journal of Refrigeration, 1998, 19(2): 45-52.)
[3]黄宇, 杨琴, 罗二仓, 等. 一种二氧化碳-离子液体吸收式制冷系统性能的分析研究[J]. 低温与超导, 2009, 37(6):47-52. (HUANG Yu, YANG Qin, LUO Ercang, et al. Analysis on absorption refrigeration by using ionic liquid and carbon dioxide[J]. Cryogenics and Superconductivity, 2009, 37(6): 47-52.)
[4]Macfarlane D R, Seddon K R. Ionic liquids——progress on the fundamental issues[J]. Australian Journal of Chemistry, 2007, 38(23): 3-5.
[5]Crowhurst L, Mawdslev P R, Perez-Arlandis J M, et al. Solvent-solute interactions in ionic liquids[J]. Physical Chemistry Chemical Physics, 2003, 632(5): 2790-2794.
[6]赵杰, 梁世强, 张珍, 等. 离子液体在吸收式制冷中的应用研究进展[C]// 中国制冷学会2009年学术年会论文集. 天津: 中国制冷学会, 2009: 241-245.
[7]Blanchard L A, Hancu D, Beckman E J, et al. Green processing using ionic liquids and CO2[J]. Nature, 1999, 399(6731): 28-29.
[8]Lynnette A, Blanchard L A, Gu Z, et al. High-pressure phase behavior of ionic liquids/CO2systems[J]. The Journal of Physical Chemistry B, 2001, 105(12): 2437-2444.
[9]赵佳美. 新型吸收制冷工质对CO2-[emim][Tf2N]热力学性质理论研究[D]. 内蒙古: 内蒙古科技大学, 2014.
[10] Sen M, Paolucci S. Using carbon dioxide and ionic liquids for absorption refrigeration[C]//7th IIR Gustav Lorentzen Conference on Natural Working Fluids. Trondheim, Norway: Joint Conference of the International Institute of Refrigeration Commissions, 2006.
[11] 郑霄龙. 低品位热驱动跨临界CO2-[emim][Tf2N]吸收式制冷循环特性理论研究[D]. 内蒙古: 内蒙古科技大学, 2014.
[12] Martin A, Bermejo M D. Thermodynamic analysis of absorption refrigeration cycles using ionic liquid+CO2pairs[J]. The Journal of Supercritical Fluids, 2010, 55(2): 852-859.
[13] Holbrey J D, Seddon K R. The phase behaviour of 1-alkyl-3-methylimidazolium tetrafluoroborates; ionic liquids and ionic liquid crystals[J]. Journal of the Chemical Society, Dalton Transactions, 1999, 13(13): 2133-2139.
[14] Anthony J L, Anderson J L, Maginn E J, et al. Anion effects on gas solubility in ionic liquids[J]. The Journal of Physical Chemistry B, 2005, 109(13): 6366-6374.
[15] Yuan X L, Zhang S J, Liu J, et al. Solubilities of CO2in hydroxyl ammonium ionic liquids at elevated pressures[J]. Fluid Phase Equilibria, 2007, 257(2): 195-200.
[16] Shariati A, Peters C J. High-pressure phase equilibria of systems with ionic liquids[J]. Journal of Supercritical Fluids, 2005, 34(2):171-176.
[17] Dong Kun, Zhang Suojiang, Wang Daxi, et al. Hydrogen bonds in imidazolium ionic liquids[J]. The Journal of Physical Chemistry A, 2006, 110(31): 9775-9782.
[18] Maiti A. Theoretical screening of ionic liquid solvents for carbon capture[J]. Chem. Sus. Chem., 2009, 2(7): 628-631.
[19] Freire M G, Sontos L, Fernandes A M. An overview of the mutual solubilities of water-imidazolium-based ionic liquids systems[J]. Fluid Phase Equilibria, 2007, 261(1/2): 449-454.
[20] Ahosseini A, Ortega E, Sensenich B, et al. Viscosity of n-alkyl-3-methyl-imidazolium bis (trifluoromethylsulf-onyl) amide ionic liquids saturated with compressed CO2[J]. Fluid Phase Equilibria, 2009, 286(1): 72-78.
[21] Ahosseini A, Scurto A M. Viscosity of imidazolium-based ionic liquids at elevated pressures: cation and anion effects[J]. International Journal of Thermophysics, 2008, 29(4): 1222-1243.
[22] Fischer K, Wilken M. Experimental determination of oxygen and nitrogen solubility in organic solvents up to 10 MPa at temperatures between 298 K and 398 K[J]. Journal of Chemical Thermodynamic, 2001, 33(10): 1285-1308.
[23] 王占丽, 徐凡, 刑小林, 等. 功能化离子液体-MDEA复配体系吸收CO2[J]. 化工进展, 2013, 32(2): 394-399. (WANG Zhanli, XU Fan, XING Xiaolin, et al. Absorption of CO2in aqueous mixtures of functionalized ionic liquids and MDEA[J]. Chemical Industry and Engineering Progress, 2013, 32(2): 394-399.)
[24] Makino T, Kanakubo M, Masuda Y, et al. CO2absorption properties, densities, viscosities, and electrical conductivities of ethylimidazolium and 1-ethyl-3-methylimidazolium ionic liquids[J]. Fluid Phase Equilibria, 2014, 362(2): 300-306.
[25] Moffat R J. Describing the uncertainties in experimental results[J]. Experimental Thermal and Fluid Science, 1988, 1(1): 3-17.
[26] Yim J H, Lim J S. CO2solubility measurement in 1-hexyl-3-methylimidazolium ([HMIM]) cation based ionic liquids[J]. Fluid Phase Equilibria, 2013, 352(12): 67-74.
[27] Breure B, Bottini S B, Geert-Jan W, et al. Thermodynamic modeling of the phase behavior of binary systems of ionic liquids and carbon dioxide with the group contribution equation of state[J]. The Journal of Physical Chemistry B, 2007, 111(51): 14265-14270.
About the author
Wu Weidong, male, associate professor, Institute of Refrigeration and Cryogenic Engineering, University of Shanghai for Science and Technology, +86 13917527018, E-mail: usstwwd@163.com. Research fields: new technology of refrigeration.
Selection of Ionic Liquids and Absorption Properties of Ionic Liquids-CO2Working Pairs
Wu WeidongWu JunWang ZhenZhang Hua
(University of Shanghai for Science and Technology, Institute of Refrigeration and Cryogenic Engineering, Shanghai, 200093, China)
The selection of ionic liquids (ILs) is crucial to the performance of new absorption working pairs (ILs-CO2) and cycle characteristics of absorption refrigeration. The properties of ILs absorbing CO2are affected directly by ILs′s species, cation structure, temperature and CO2partial pressure. In this paper, an experimental system was designed and built to measure CO2solubility in the ILs. On the principle of low viscosity and better absorption performance, four imidazole bis trifluoromethanesulfonimide ILs ([emim][Tf2N], [bmim][Tf2N], [hmim][Tf2N] and [omim][Tf2N]) were selected and the CO2solubility in them was measured within 2.0 MPa to 5.0 MPa at 298.15 K, 313.15 K and 328.00 K, respectively. The results show that imidazole bis trifluoromethanesulfonimide ILs have a better performance of absorbing CO2; the longer the alkyl chain of the same family ILs is, the larger the solubility is, and the CO2solubility increases in the order of [emim][Tf2N]<[bmim][Tf2N]<[hmim][Tf2N]<[omim][Tf2N]; the rangeability of CO2solubility decreases as the temperature and pressure gradually increase. The correlations of pressure and CO2solubility in [omim][Tf2N] at three temperatures are also given.
absorption refrigeration; absorption working pairs; absorption performance; ionic liquid; CO2
0253- 4339(2016) 03- 0022- 07
10.3969/j.issn.0253- 4339.2016.03.022
国家自然科学基金(50606027)资助项目。(The project was supported by the National Natural Science Foundation of China (No. 50606027).)
2015年8月27日
TB61+2; TB61+6
A
武卫东,男,副教授,上海理工大学制冷与低温工程研究所,13917527018, E-mail:usstwwd@163.com。研究方向:制冷新技术。
