利用X射线衍射和拉曼光谱法对KCl和NaCl混合溶液微观结构的研究
2016-09-06袁俊生刘子禹李申予
袁俊生 刘子禹 李 非 李申予
(1河北工业大学海洋科学与工程学院,天津300130;2河北工业大学化工学院,天津300130;3教育部海水资源高效利用技术工程研究中心,天津300130)
利用X射线衍射和拉曼光谱法对KCl和NaCl混合溶液微观结构的研究
袁俊生1,3,*刘子禹2,3李非1,3李申予1,3
(1河北工业大学海洋科学与工程学院,天津300130;2河北工业大学化工学院,天津300130;3教育部海水资源高效利用技术工程研究中心,天津300130)
利用X射线衍射法和拉曼光谱法系统研究了25°C下,0-26%质量分数浓度范围内KCl和NaCl混合溶液的结构。通过分析X射线衍射法所得的混合溶液的差值结构函数F(Q)以及差值对分布函数G(r)发现,混合溶液组分中的K+的水化层半径及其水化数均大于Na+,从而揭示出常温下NaCl在水中的溶解度大于KCl的原因。在拉曼光谱的研究中,观察到溶液中水分子的四面体氢键受破坏程度随KCl浓度的增加和NaCl浓度的减少,先增大后减小,并结合X射线衍射法的结果,推断混合溶液中Na+对水溶液中氢键结构的破坏程度比K+严重,且加入适量的K+会使Na+由结构缔造者转变为打破结构者,对水溶液结构的破坏增强。
X射线衍射;拉曼光谱;KCl;NaCl;溶液结构
1 引言
溶液结构的研究有助于人们对化学反应的发生以及宏观性质上特征的理解与指导1,其研究结果能够指导化工分离过程,实现多物质混合溶液的分离、提纯,而这些都需要基于物质的溶解特性的深入了解来实现,因此开展混合溶液的溶液结构研究意义重大。
以钾盐溶液为例,早在20世纪50年代,Brady 和Krause2就应用X射线衍射法对KOH和KCl各自的浓溶液的结构进行过研究,结果表明,KOH溶液中钾离子的尺寸与水分子的尺寸相接近,并替代水分子进入水分子形成的网络结构,对原来的结构不产生显著影响;KCl溶液中的氯离子对溶剂水起到破坏作用。之后,陆续有科学家对其它钾盐溶液进行过研究,包括KF3、KI4等。Neilson和Skipper5以重水为溶剂,开展对4 mol∙L-1KCl水溶液结构的研究,结果表明钾离子在重水溶液中的配位作用很弱。如今,随着计算机技术的不断进步,越来越多的科学家开始探索用计算机模拟手段对溶液结构进行研究,比如量子力学或分子力学模拟6,7、Car-Parrinello分子模拟8,9、逆蒙特卡洛10-13等。在这些研究中仅限于单一钾盐溶液的计算机模拟,溶液中水分子与钾离子的数量比从48: 1到499:1不等,相应水溶液体系是钾离子与水分子构建的模型亦或是氯化钾与水分子构建的模型,得到的钾离子周围水分子配位数从6.2到6.8不等。
不仅如此,利用X射线衍射法也主要局限于对单一钾盐水溶液的研究。Palinkas等14通过对298 K 下2和4 mol∙L-1的LiCl、NaCl、KCl、CsCl溶液的研究发现Cl-
的水合作用与溶液的浓度以及抗衡阳离子的类型没有关系。Ohtaki和Fukushima15开展298 K下接近饱和或过饱和的NaCl(6.18 mol∙L-1)、KCl(4.56 mol∙L-1)、KF(16.15 mol∙L-1)、CsF(31.96 mol∙L-1)溶液结构的研究发现,溶液中有高度排列的簇和离子对出现,且它们可能是晶体中晶核形成的原因。Nikologorskaya等16的研究对象为298 K下的KX(X=F,Cl,Br,I)电解质水溶液,其中,KX与H2O的摩尔比为1:15。研究结果表明,随着阴离子半径的增加,溶液中离子的存在形式由接触离子对的形式向单独的阴阳离子水化作用转变。
本课题组针对水溶液结构开展了KCl、NaCl等单一溶液溶解特性的研究,对于不同浓度盐溶液中离子对水分子微观结构的影响已取得一定的成果17,18。研究发现,对于KCl水溶液,随着溶质浓度的升高,在一定浓度下出现接触离子对,离子水化数逐渐减小。而NaCl水溶液中水分子的四面体氢键网络的破坏程度随着浓度的升高逐渐加重,离子水化数也随之减小。
基于目前对钾盐水溶液结构的研究主要针对于单一水溶液,而混合钾盐溶液部分则涉及较少的现状,笔者开展了KCl和NaCl混合溶液的0-26%浓度范围的系统研究,同时使用X射线衍射法与拉曼光谱法,以期通过两种方法的结合最大程度获取混合体系内部的结构信息,进而为KCl和NaCl混合溶液中两者对水溶液微观结构的影响做出相应的阐明。
2 实验部分
2.1混合水溶液样品的制备
配制溶液用KCl、NaCl为优级纯(GR)试剂(KCl、NaCl含量均不低于99.99%),由天津市光复精细化工研究所生产。实验所用水由国产品牌优普公司所生产的超纯水机(UPHW-I-90T)制得,室温条件下其电阻率为18.25 MΩ∙cm。采用质量法分别配制不同组分的混合水溶液,各溶液浓度和摩尔比,见表1。
2.2测试条件
2.2.1X射线衍射法
实验室衍射装置采用的是德国BRUKER公司所生产的X射线衍射仪(型号:D8 Focus)。为配合溶液样品的测试,对该衍射仪进行了改造,以配合毛细管平台的搭建,详细改造说明可参考文献17。需要特别说明的是,此测试方法为毛细管透射法,因其具有背景低的优点,有利于背景的扣除。

表1 KCl和NaCl混合水溶液的质量分数(w)和摩尔比Table 1 Mass fractions(w)and mole ratio of KCl and NaCl aqueous solutions
在25°C下,对所有水溶液样品进行测定。X射线光源为钼靶(Mo,λ=0.07107 nm);管电压:40 kV,管电流:40 mA,入射狭缝:0.1 mm,防散射狭缝:8 mm,光路中加锆(Zr)滤波片,数据采集步长:0.3°,步速:40 s∙step-1,2θ扫描范围:5°-150°。
2.2.2拉曼光谱法
非偏振拉曼光谱由共聚焦显微拉曼光谱仪测得,仪器型号为DXR激光显微拉曼光谱仪(由美国Thermo Fisher Company制造)。激光的激发波长为532 nm,操作功率为10 mW。分光计的入射狭缝为50 μm,用于收集信号。仪器的分辨率为1 cm-1。每个拉曼光谱采集用5 s,显微镜采用50倍的物镜。光谱扫描波数的范围为2800-3800 cm-1,便于观察OH伸缩振动的变化。所有水溶液样品的拉曼光谱均在25°C下测得,还测定了相同条件下纯水的拉曼光谱。
2.3数据处理的原理及方法
经X射线衍射仪测定后所得的强度数据包括相干散射、非相干散射、多重散射以及背景散射,然而只有相干散射包含着溶液的结构信息。需要对散射强度数据进行相关处理,所用到的是PDFgetX3软件19。通过该软件可以进行背景、非相干散射、多重散射的扣除,从而得到包含结构信息的被称之为全散射结构函数的函数S(Q)。随之依据方程(1)进行傅里叶变换得到差值对分布函数G(r)。

其中,F(Q)=Q[S(Q)-1],F(Q)为差值结构函数。ρ0为数密度,g(r)代表原子对分布函数,Q代表衍射矢量,r为原子间的距离。
拉曼光谱数据由Thermo Scientific OMNIC程序进行处理,进行了基线校正,并通过超额拉曼光谱理论20对数据进行分析。
3 结果与讨论
3.1X射线衍射
3.1.1差值结构函数F(Q)
选取适当的参数值,应用PDFgetX3对混合水溶液的X射线衍射数据进行处理,得到的差值结构函数如图1所示。
由文献21可知,图1中Q=25 nm-1附近存在的双峰通常会出现在纯水和水溶液的结构函数中,并且它与液体中的氢键网络相关。观察图1可直观发现在Q=25 nm-1附近出现的峰皆为平顶峰,没有发现在KCl或者NaCl单一体系17,18低浓度溶液中出现的明显双峰,这应该是由于KCl和NaCl浓度升高都能起到令该双峰消失的作用,对液体中的氢键网络破坏比较严重。另外还发现,出现在Q= 50 nm-1附近的峰随着KCl浓度的升高和NaCl浓度的降低明显向坐标轴右侧移动。由于KCl单一体系的差值结构函数中,出现在Q=50 nm-1附近的峰随着KCl浓度的升高明显的向坐标轴左侧移动18,而对于NaCl单一体系,该处峰随着NaCl浓度的降低明显的向坐标轴右侧移动17。因此,混合水溶液的结构函数受KCl和NaCl综合作用的影响,而NaCl对Q=50 nm-1附近峰的影响要稍强于KCl。

图1 KCl-NaCl溶液体系的差值结构函数F(Q)Fig.1 Reduced structure functions F(Q)for KCl-NaCl solutions

图2 KCl-NaCl溶液体系的差值对分布函数G(r)Fig.2 Reduced pair distribution functions G(r)for KCl-NaCl solutions
3.1.2差值对分布函数G(r)
为了获得溶液微观结构的直接信息,将差值结构函数进行傅里叶变换得到相应的差值对分布函数G(r),如图2所示。
由图2可知,不同组成的KCl和NaCl混合水溶液的微观结构差异明显,并且随着浓度的变化呈现出一定的规律性。当水溶液中NaCl浓度最高时,相应的差值结构函数的主峰位于0.32 nm,并且在约0.24 nm有一稍弱的肩峰,随着混合水溶液中NaCl浓度的降低和KCl浓度的升高,主峰峰位逐渐向坐标轴左侧移动,最终当KCl浓度最高时移动至大概0.28 nm,在主峰移动的同时,出现在0.24 nm处的肩峰逐渐变弱,直至消失。
为了便于更直接的观察,利用peekfit软件对不同组成的KCl、NaCl混合水溶液的差值对分布函数G(r)在0.2-0.4 nm范围内的曲线分别进行高斯拟合21-23,拟合时均选择线性基线,且拟合标准相同,拟合后曲线如图3所示。从图3中的实验峰线与重叠峰线的重合程度可以看出,拟合度较高。同时,拟合后各峰的归属及其参数(峰面积、峰高、峰位)详见表2。而这些峰归属的判定依据详见表37,15,24-26。
结合表2及表3,图3中混合组成A中出现在0.2635 nm的峰,与通过X射线衍射15以及中子衍射20的方法获得的结果相接近,可以归属为Na+-Cl-接触离子对的作用。出现在图3组成G中0.3104 nm处的峰,根据与文献15中的数据对比,推测为K+-Cl-
接触离子对的作用。Na+-Cl-与K+-Cl-
接触离子对分别只在混合组成A、G中出现,其他组成则并未出现以上两种接触离子对。混合组成A为纯NaCl溶液,且接近饱和,观察其他组成,可知加入KCl之后并未出现该接触离子对,由此推断KCl的加入破坏了Na+-Cl-接触离子对的形成。同样的,NaCl的加入也使得K+-Cl-接触离子对的形成遭到破坏。

图3 KCl-NaCl溶液体系的差值对分布函数G(r)及其拟合峰Fig.3 Reduced pair distribution functions G(r)and fitting peaks for KCl-NaCl solutions
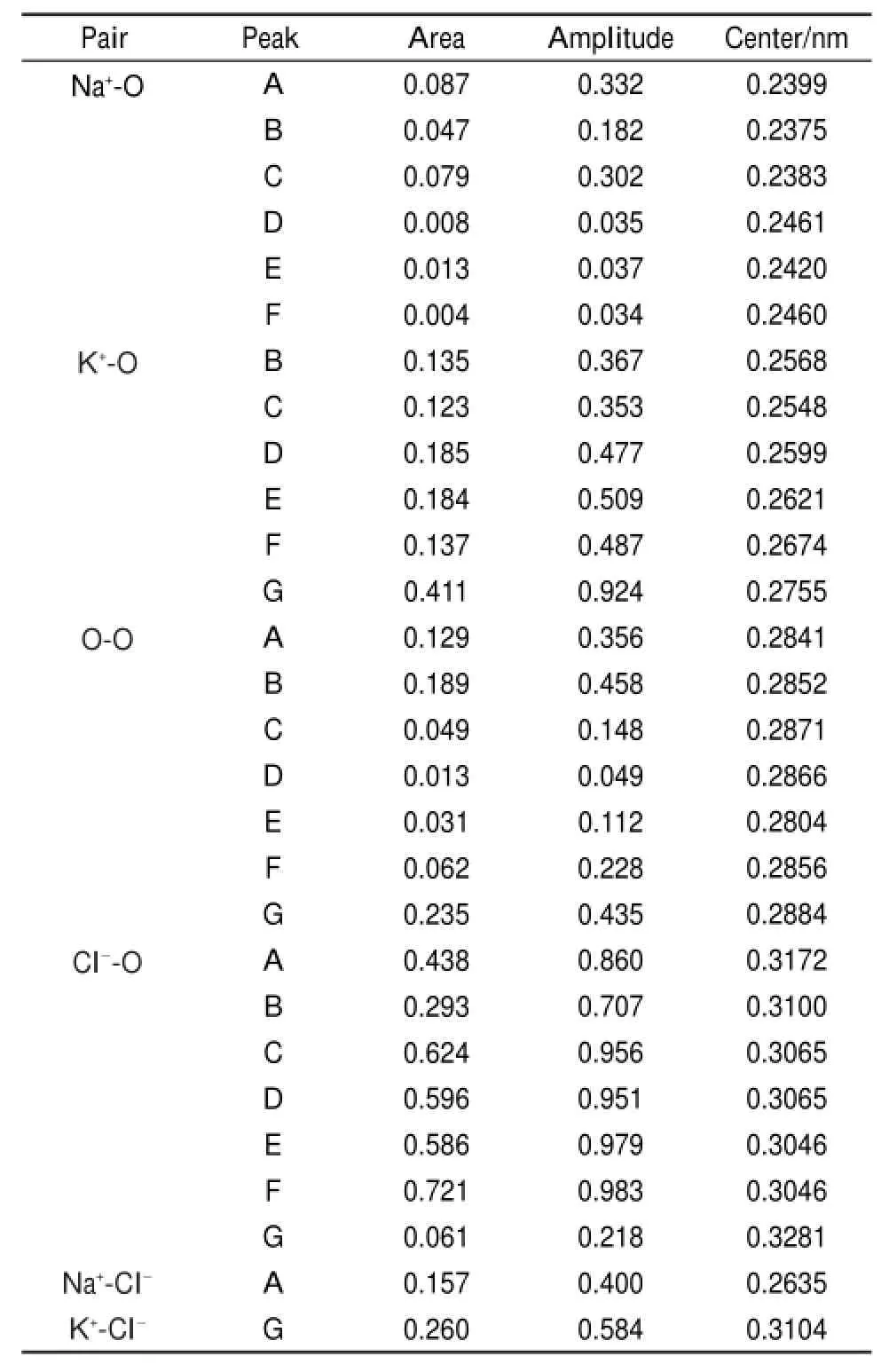
表2 KCl-NaCl混合溶液多峰拟合峰的参数Table 2 Multi-peak fitting parameters of KCl-NaCl solutions
七个组分中Cl--O的作用在图3中均有所体现,变化最为明显的为组成G。组成G的峰位最大,峰面积最小,说明在该组成下Cl-的水化半径增大,和与其作用的水分子的距离增大,水化层中水分子数减少,且相较于其他组分的水化数,减少幅度较大。即KCl溶液中加入NaCl后,NaCl破坏了K+-Cl-接触离子对,水化层中的抗衡离子消失,从而使水分子重新进入Cl-的水化层代替K+的位置。分别位于混合组成A、B、C、D、E、F中0.2399、0.2375、0.2383、0.2461、0.2420、0.2460 nm的峰与表3中Na+-O的间距相近,故将这些峰推断为Na+-O的作用峰。对比这些组成中Na+-O峰中心以及峰面积的变化,可以发现Na+与水分子间的距离呈波动增加的趋势,而Na+第一水化层中的水分子呈波动减小的趋势,说明Na+对水分子的扰动作用在逐渐减弱。
相较之下,B、C、D、E、F、G六个组成中出现在0.26及0.27 nm附近的峰,与文献7,25中通过实验及模拟的方法所得数据接近,可解释为K+与水分子中O的距离。K+-O峰位逐渐增加,而且峰面积整体也呈增加的趋势,说明K+的第一水化层的半径在增大的同时,水化层内的水分子数也在增加,且在G组分时两者均达到最大,与A组分Na+的水化层相比,水化半径及水化数均在其之上,这与文献7中发现的K+水化层中水分子的定位分布比Na+中的水分子要大而广的结果相一致。这也为常温下KCl的摩尔浓度为何小于NaCl做出了合理的解释。作为能反映水分子间氢键作用的O―O峰,峰中心变化不明显,但该峰的峰面积整体呈先减小后增大的趋势,说明随着K+的增加,Na+的减少,氢键被加入离子的破坏程度先增大后减小。从而进一步说明Na+对水分子结构的影响要强于K+。

表3 不同键对的距离Table 3 Distance of different bond pairs
3.2拉曼光谱
应用拉曼光谱法对KCl和NaCl混合水溶液体系的微观结构进行了研究,相应的拉曼光谱如图4所示。
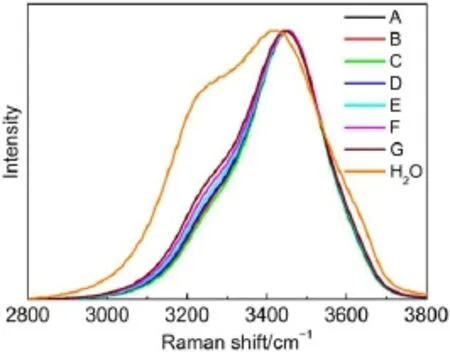
图4 纯水以及不同浓度KCl-NaCl混合水溶液体系的拉曼光谱Fig.4 Raman spectra of pure water and KCl-NaCl solutions with different concentrations
观察KCl和混合水溶液的拉曼光谱可知,混合水溶液体系的拉曼光谱比纯水的宽度要窄好多,并且主峰峰位也明显的更靠坐标轴的右侧,说明KCl以及NaCl的加入,使得水分子内的氢键作用发生改变。但是不同组成的混合水溶液之间的主峰峰位差异不大;不同组成的混合水溶液之间的差异在于,3200-3300 cm-1波数范围内的肩峰出现了先收缩后扩展的现象,而这种现象与混合溶液中Cl-
的含量先增加后减少的现象似乎存在着一定的关联,推测可能是Cl-含量的增加会使3200-3300 cm-1波数范围内的肩峰收缩,含量减少则使肩峰展宽。
为进一步深入研究,还应用到了超额拉曼光谱的理论。超额拉曼光谱如图5所示。图5中(a)为整体超额拉曼光谱图,(b,c)分别为3575-3700和3425-3575 cm-1范围内的局部放大图。图5(a)中有两个负峰和一个正峰,负峰代表水团的破坏程度,面积越大代表水中的团簇结构破坏越严重。首先观察3200 cm-1波数附近最大负峰的变化规律,通过经验可知,该峰位反映的是四面体氢键类型(DDAA)。当混合水溶液中的KCl浓度升高,NaCl浓度降低时,该负峰的峰值位置一直是在3220 cm-1波数,没有发生变化,不过在上述混合溶液组成变化的过程中,该峰的强度和面积出现了先增大后减小的现象,且在混合组成C处发生转折,说明水溶液中四面体氢键受破坏的程度先增大后减小。
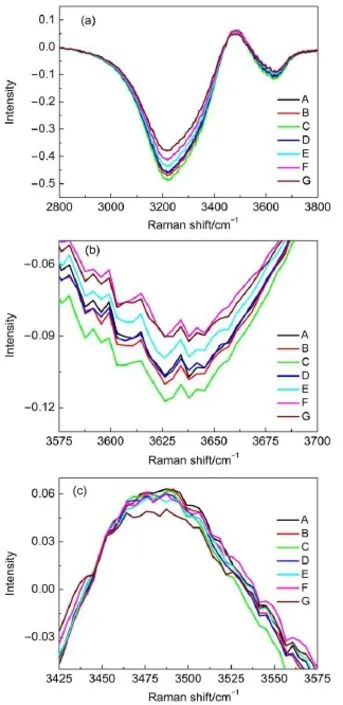
图5 不同浓度KCl-NaCl混合水溶液体系的超额拉曼光谱Fig.5 Excess Raman spectra of aqueous KCl-NaCl solutions at various concentrations
出现在3640 cm-1波数处的第二个负峰,当混合水溶液的组成发生变化时,该峰峰位也没有发生变化,峰的强度出现了微小的变化,通过局部放大图5(b)可知,其峰强和峰面积的变化规律同最大负峰,也呈现出先增大后变小的趋势,且出现转折的混合水溶液的组成与最大负峰相一致,只是变化幅度略小;另外,出现在3640 cm-1波数处的负峰应该代表的是混合水溶液中自由O―H伸缩振动受影响的程度,其变化也与最大负峰相一致。对单一KCl和NaCl的研究18,27结果表明,两者对水溶液中四面体氢键以及自由O―H伸缩振动的影响均随着浓度的增加而逐渐增强,且相同含量的NaCl的影响要强于KCl。而对于两者的混合体系,随组分中的KCl增加和NaCl减少,呈现先增大后减小的趋势,说明水分子氢键的破坏程度随溶质总量的变化先增大后减小。
混合水溶液的超额拉曼光谱中唯一的正峰出现在3480 cm-1波数处,有学者认为超额拉曼光谱中的正峰代表溶剂与阴离子的相互作用28,相对于本实验,则为Cl-与水分子的作用。为了确定该位置的峰强是否随着溶液的组成发生变化,将该峰也进行了局部放大,由图5(c)中的局部放大图可以看出,该峰峰强除组成G时强度变化最为明显外,整体变化趋势不明显,只有略微波动。在组成G时,Cl-与水分子间的作用相对较弱,说明混合溶液中有且只有KCl时,Cl-与水分子的作用强度最小。
通过拉曼光谱法发现混合溶液在组成C处对水分子氢键网络的破坏程度最大,之后逐渐减弱。X射线衍射法研究的结果表明,随着K+的增加,Na+的减少,O-O的作用先减小后增大,且转折点为组成D,说明离子对氢键的破坏作用先增大后减小。从整体来看,两种方法所得结论均为混合溶液对水分子氢键的破坏程度先增大后减小。从以上两种研究方法所得的结论来看,这两种方法相结合对于解读水溶液的微观结构还是比较可靠的。
综合两种研究方法推断,Na+对水溶液的结构破坏程度比K+严重。文献6,29中,把半径小的离子称为结构缔造者,促进水分子团簇的缔合;半径大的离子称为打破结构者,破坏水原有的结构。其中Na+属于结构缔造者,K+属于打破结构者。而本实验结果显示,混合之后离子的性质发生改变,适量K+的加入使Na+对于水溶液结构的破坏作用增强。笔者认为,实验结论之间之所以存在一定的差异,是由于文献中的研究对象为单一水溶液,而本实验的研究对象为混合水溶液,且混合离子间产生的相互作用使得离子性质发生变化。
4 结论
利用X射线衍射法和拉曼光谱法对不同组成的KCl-NaCl混合溶液的微观结构进行了研究。通过X射线衍射法研究了混合溶液中键长、水化数的变化,结果表明,随着混合组成中K+的增加,Na+的减少,Na+和K+的键长均呈增加趋势,Na+第一水化层中的水分子数波动减小,K+第一水化层中的水分子数波动增加;O-O的峰面积先减小后增大,离子对氢键的破坏作用先增大后减小。采用拉曼光谱分析了混合盐溶液对水分子氢键的破坏作用,结果表明,混合溶液对水溶液中氢键的破坏作用先增大后减小,其破坏程度的整体变化与X射线衍射法所得结论一致;当混合溶液中有且只有KCl时,Cl-与水分子的作用强度最小。
综合两种研究方法发现,当NaCl中引入适量的KCl后,Na+由结构缔造者转变为打破结构者,且在混合组成中Na+对水溶液结构的破坏程度要强于K+。
References
(1)Smirnova,P.R.;Grechinb,O.V.;Trostina,V.N.Russ.J.Phys. Chem.A 2014,88,250.doi:10.1134/S0036024414020253
(2)Brady,G.W.;Krause,J.T.J.Phys.Chem.1957,27,304.doi: 10.1063/1.1743691
(3)Terekhova,D.S.;Ryss,A.I.;Radchenko,I.V.J.Struct.Chem. 1969,10,807.doi:10.1007/BF00743973
(4)Fishkis,M.Y.;Soboleva,T.E.J.Struct.Chem.1974,15,175.
doi:10.1007/BF00746552
(5)Neilson,G.W.;Skipper,N.Chem.Phys.Lett.1985,114,35.
doi:10.1016/0009-2614(85)85050-8
(6)Tongraar,A.;Liedl,K.R.;Rode,B.M.J.Phys.Chem.A 1998, 102,10340.doi:10.1021/jp982270y
(7)Azam,S.S.;Hofer,T.S.;Randolf,B.R.;Rode,B.M.J.Phys. Chem.A 2009,113,1827.doi:10.1021/jp8093462
(8)Ramaniah,L.M.;Bernasconi,M.;Parrinello,M.J.Chem. Phys.1999,111,1587.doi:10.1063/1.479418
(9)Liu,Y.;Lu,H.G.;Wu,Y.B.;Hu,T.P.;Li,Q.L.J.Chem. Phys.2010,132,124503.doi:10.1063/1.3369624
(10)Harsányi,I.;Bopp,P.A.;Vrhovšek,A.;Pusztai,L.J.Mol.Liq. 2011,158,61.doi:10.1016/j.molliq.2010.10.010
(11)Gereben,O.;Pusztai,L.J.Non-Cryst.Solids 2015,407,213. doi:10.1016/j.jnoncrysol.2014.08.047
(12)Mile,V.;Gereben,O.;Kohara,S.;Pusztai,L.J.Phys.Chem.B 2012,116,9758.doi:10.1021/jp301595m
(13)Mile,V.;Pusztai,L.;Dominguez,H.;Pizi,O.J.Phys.Chem.B 2009,113,10760.doi:10.1021/jp900092g
(14)Palinkas,G.;Radnai,T.;Hajdu,F.Zeitschrift Für Naturforschung A 1980,35,107.doi:10.1515/zna-1980-0121
(15)Ohtaki,H.;Fukushima,N.J.Solution Chem.1992,21,23.
doi:10.1007/BF00648978
(16)Nikologorskaya,E.L.;Kuznetsov,V.V.;Grechin,O.V.; Trostin,V.N.Russ.J.Inorg.Chem.2000,45,1759. doi:10.1134/S1070363207120043
(17)Li,F.;Han,Z.;Li,D.C.;Li,S.Y.;Yuan,J.S.Chin.J.Anal. Lab.2014,33,1072.[李非,韩镇,李栋婵,李申予,袁俊生.分析试验室,2014,33,1072.]doi:10.13595/j.cnki. issn1000-0720.2014.0253
(18)Li,F.;Yuan,J.S.;Li,D.C.;Li,S.Y.;Han,Z.J.Mol.Struct.2015,1081,38.doi:10.1016/j.molstruc.2014.09.062
(19)Juha′s,P.;Davis,T.;Farrow,C.L.;Billinge,S.J.L.J.Appl. Cryst.2013,43,560.doi:10.1107/S0021889813005190
(20)Li,Q.Z.;Wu,G.S.;Yu,Z.W.J.Am.Chem.Soc.2006,128, 1438.doi:10.1021/ja0569149
(21)Feng,W.S.;Fang,Y.;Xu,J.X.;Fang,C.H.;Jia,Q.J.;Wang, H.H.;Jiang,X.M.Acta Phys.-Chim.Sin.2008,24(3),497.[冯望生,房艳,徐继香,房春晖,贾全杰,王焕华,姜晓明.物理化学学报,2008,24(3),497.]doi:10.3866/PKU. WHXB20080326
(22)Fu,L.X-ray Study of the Structure of Liquid Water.Ph.D. Dissertation,Stanford University,American,2009.
(23)Zhou,Y.Q.Structure and Properties ofAqueous Sodium Borate Solutions.Ph.D.Dissertation,Qinghai Institute of Salt Lakes,ChineseAcademy of Sciences,Xining,2010.[周永全.硼酸钠水溶液结构及性质[D].西宁:中国科学院青海盐湖研究所,2010.]
(24)Megyes,T.;Bálint,S.;Grósz,T.;Radnai,T.;Bakó,I.J.Chem. Phys.2008,128,044501 doi:10.1063/1.2821956
(25)Ohtomo,N.;Arakawa,K.Bull.Chem.Soc.Jpn.1980,53, 1789.doi:10.1246/bcsj.53.1789
(26)Mancinelli,R.;Botti,A.;Bruni,F.;Ricci,M.A.J.Phys. Chem.B 2007,111,13570.doi:10.1021/jp075913v
(27)Li,F.Study on the Structure of Potassium SaltAqueous Solutions.Ph.D.Dissertation,Hebei University of Technology,Tianjin,2015.[李非.钾盐水溶液结构研究[D].天津:河北工业大学,2015.]
(28)Wang,C.C.;Lin,K.;Hu,N.Y.;Zhou,X.G.;Liu,S.L.Acta Phys.-Chim.Sin.2012,28,1823.[王陈琛,林珂,胡乃银,周晓国,刘世林.物理化学学报,2012,28,1823.]doi: 10.3866/PKU.WHXB201205154
(29)Impey,R.W.;Madden,P.A.;McDonald,I.R.J.Phys.Chem. 1983,87,5071.doi:10.1021/j150643a008
Study of the Hydrated Structure of KCl and NaCl Mixed Solutions Using X-ray Diffraction and Raman Spectroscopy
YUAN Jun-Sheng1,3,*LIU Zi-Yu2,3LI Fei1,3LI Shen-Yu1,3
(1School of Marine Science and Engineering,Hebei University of Technology,Tianjin 300130,P.R.China;2School of Chemical Engineering and Technology,Hebei University of Technology,Tianjin 300130,P.R.China;3Engineering Research Center of Seawater Utilization Technology of Ministry of Education,Tianjin 300130,P.R.China)
Research on the hydrated structure of KCl and NaCl mixed solutions with a concentration range between 0 and 26%was conducted using X-ray diffraction and Raman spectroscopy at 25°C.Their reduced structure functions,F(Q),and reduced pair distribution functions,G(r),obtained from X-ray diffraction indicate that compared with Na+,the hydration numbers and shell radii of the hydrated K+ions are larger.This explains why the solubility of NaCl is higher than that of KCl at 25°C.According to the Raman spectroscopy,the tetrahedral hydrogen bonds of water molecules will be destroyed with the increase in KCl concentration and the decrease in NaCl concentration.The extent of the bond destruction has systematic variations;for example, increasing at first and then decreasing.These results show that the destruction of the hydrogen bond structure resulting from Na+is more serious than from K+.Also,with the appropriate K+content in the NaCl solution,Na+will behave as a structure breaker instead of a structure maker,which enhances the destructiveness of the solution structure.
X-ray diffraction;Raman spectroscopy;Potassium chloride;Sodium chloride; Solution structure
December 11,2015;Revised:February 17,2016;Published on Web:February 18,2016.
O641
10.3866/PKU.WHXB201602184
*Corresponding author.Email:jsyuan2012@126.com;Tel:+86-22-60204598.
The project was supported by the Basic Research Project ofApplied Basic Research Plan of Hebei Province,China(13963103D),Program for Changjiang Scholars and Innovative Research Team in University,China(IRT14R14),and National Key Technology R&D Program,China (2015BAB09B00).
河北省重点基础研究项目(13963103D),长江学者和创新团队发展计划(IRT14R14)和国家科技支撑计划项目(2015BAB09B00)资助
