基于散射信号的超分辨光学相减显微镜
2016-09-06于建强赵立波李德胜朱建华袁景和方晓红
周 前 于建强 赵立波 李德胜 吴 魁 朱建华 袁景和,* 方晓红
(1四川大学物理学系,成都610064;2高能量密度物理及技术教育部重点实验室,成都610064;3中国科学院化学研究所分子纳米结构与纳米技术实验室,北京100190;4北方工业大学理学院,北京100144;5中国科学院化学研究所高分子物理与化学实验室,北京100190;6中国科学院化学研究所活体分析化学实验室,北京100190)
基于散射信号的超分辨光学相减显微镜
周前1,2,3于建强4赵立波3李德胜5吴魁6朱建华1,2袁景和3,*方晓红3
(1四川大学物理学系,成都610064;2高能量密度物理及技术教育部重点实验室,成都610064;3中国科学院化学研究所分子纳米结构与纳米技术实验室,北京100190;4北方工业大学理学院,北京100144;5中国科学院化学研究所高分子
物理与化学实验室,北京100190;6中国科学院化学研究所活体分析化学实验室,北京100190)
现有的光学超分辨显微成像技术主要依赖于特殊的荧光标记物,其对于大多数非荧光样品的超分辨成像就变得无能为力。因此我们提出将光学相减显微技术应用到非荧光样品的成像当中,利用普通共聚焦光斑和面包圈型光斑分别激发样品的散射光成像,从而得到样品同一区域的两幅图像,再通过图像相减的方法提高了图像空间分辨率。不同于一般的超分辨成像方法,这种光学相减显微镜不需要特殊的样品预处理过程,同时两次成像的激发光强度可以保持在一个较低水平,避免了样品损伤的影响。随后金纳米小球和有机聚合物微丝的散射成像实验证明了光学相减显微镜可以将空间分辨率提高到215 nm(0.33λ,1λ=650 nm),并且通过探测散射信号得到更多的样品细节信息。
超分辨显微镜;图像相减;非荧光成像;光散射成像
1 引言
几个世纪以来,光学显微镜的发展极大地提高了人们对细胞结构和细胞功能的认识,但由于光学衍射极限的存在,光学显微镜空间分辨率通常在数百纳米左右,这使得其在细胞器和分子水平的细胞生物学探测中受到了极大的限制。近来,一些基于荧光探针的超分辨光学显微镜打破了光学衍射极限的限制,其中包括随机光学重构显微技术(STORM)1、光活化定位显微技术(PALM)2、受激辐射耗尽显微技术(STED)3,4等,这些成像技术依赖特殊的荧光分子基团,无法实现非荧光样品的超分辨成像。于此同时也出现了一些非荧光超分辨成像的方法,例如Wang等5利用样品分子的电子吸收过饱和效应,在空间上调制了激发光斑点扩展函数,从而提高了非荧光样品成像分辨率。Ye等6设计了一种平面超薄透镜组,入射电场在透镜组相平面处几乎只有纵向分量,从而减少了光斑横向面积,提高光学空间分辨率。但这些方法往往利用了特殊的分子能级结构或光学体系,在适用性和实现难度上都有很大限制。而另一方面光学相减显微技术(optical subtraction microscopy)通过不同条件下两次成像相减的方法提高成像的空间分辨率,自理论上提出以来7,其主要用于简单快捷地提高荧光成像的空间分辨率和信噪比8-10上。虽然无法达到之前几种荧光超分辨技术数十个纳米的空间分辨水平,但光学相减显微镜对激发光和样品并无特殊要求,这使得将其应用到非荧光样品成像成为可能。
我们提出利用光学相减显微技术,通过两次光散射成像相减的方法来获得非荧光样品的超分辨图像,通过普通共聚焦光斑激发的散射成像作为被减图像,再使用面包圈型光斑激发同一区域的散射成像作为减数图像,两者相减来获得超分辨成像。因为无需特殊的荧光分子基团,不必考虑荧光激发和发射光谱对波长的限制,所以两次散射成像可以使用同一激发波长。另外光学相减显微成像技术相比于其他超分辨技术拥有几个优势:首先,激发光功率可以减低到普通共聚焦显微镜的水平,不同于STED显微技术使用高功率激光激发的情况,减小样品损伤和潜在的光漂白现象。其次,被减图像和减数图像都通过共聚焦扫描的方式获得,其成像速度远远快于STORM和PALM显微技术。另外,采用样品分子普遍存在的散射光作为信号源,具有广泛的适用性。最后,在整个成像过程中只使用同一波长的激发光,并且两幅图像的采集相互独立,不存在时间同步的问题,这简化了整个系统的结构。实际上这个工作证明了光学相减显微技术可以被看作一种新型的结构光照明成像方法,同时应用到荧光和非荧光的超分辨成像当中。
2 基本原理和实现方法
2.1光学相减显微镜的基本原理
在共聚焦成像中,显微镜的点扩展函数PSF (the point-spread function)可以被描述为

其中 p(x,y)是共聚焦系统针孔的尺寸,⊗是卷积运算符。PSFi(x,y)和PSFj(x,y)分别代表了激发物镜和收集物镜的点扩展函数,对于倒置共聚焦显微镜,激发物镜同时用作收集物镜,因此PSFi(x,y)=PSFj(x,y)=PSFl(x,y),PSFl(x,y)是倒置共聚焦显微镜所使用物镜的点扩展函数,于是整个系统的点扩展函数又可以被描述为:
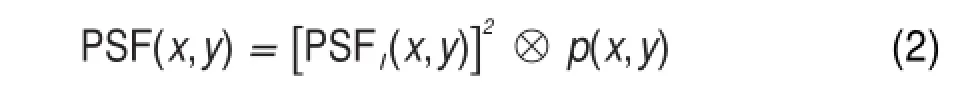
则像平面中光场强度分布I(x,y)被描述为

Iscat(x,y)代表了在焦平面的散射信号强度分布,满足以下关系:Iscat(x,y)=σ(x,y)Ie(x,y),其中σ(x,y)为散射截面,Ie(x,y)为外界激发光强分布。至此共聚焦光斑激发(confocal excitation)的散射图像Ic(即相减显微镜当中的被减图像)和面包圈型光斑激发(doughnut excitation)的散射图像Id(即相减显微镜当中的减数图像)可以通过公式(2)和(3)进行计算。它们各自的点扩展函数 PSF(x,y)分别写成PSFc(x,y)和PSFd(x,y),并可以通过矢量衍射理论计算出来11-13。
对于我们的光学相减显微镜,两幅图像的激发波长都设定为λ=650 nm,并且以圆偏振光进入物镜后口消除各向异性对成像的影响,物镜数值口径(NA)为1.4。对于一个独立点的散射成像,其Ic和Id的计算结果分别为图1的(a)和(b),图1(c)则表示了两者相减得到的相减图像(Is)的横截面。
在像平面中相减图像的强度分布Is可以由以下式获得:
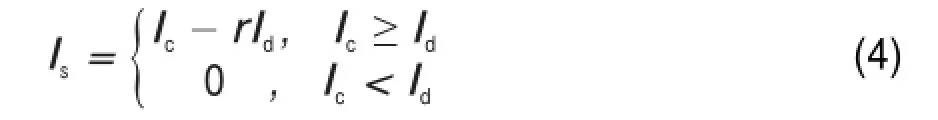
其中r为一个可调参数,如图1(c)所示,在被减图像Ic中单点的半高宽(FWHM)约为314 nm,而随着r值的增加,即减数图像权重增大时,相减图像的空间分辨率也随之提高。当r=1时,Is的横截面的半高宽为240 nm,当r=2时,其减小至207 nm。理论上空间分辨率可以随r值增大而无限提高,但实际实验中受到面包圈型光斑中心光强无法完全为零,加上成像噪声的影响,当r过大时,会导致被减图像信号完全被减数图像淹没的情况,从而损失大量原有的图像细节,为了保证相减图像具有较高的信噪比,实验中r值通常事先设定为,并在此基础上适当改变r值,通过计算不同r值条件下的相减图像信噪比,来确定相减图像信噪比达到最佳状态时r值的大小。

图1 单点的相减成像模拟结果Fig.1 Simulated subtraction imaging of an isolated scattering point(a)Ic:confocal excitation image intensity;(b)Id:doughnut excitation image intensity,λ=650 nm in(a)and(b);(c)normalized line intensity profiles of Ic,Idand subtraction image Is,when r=1 and r=2, r is a controllable parameter based on the signal to noise ratio of subtraction image.
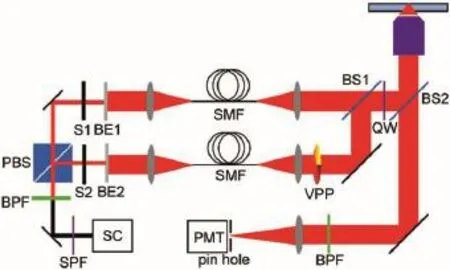
图2 超分辨光学相减显微镜的示意图Fig.2 Schematic diagram of the super resolution subtraction microscopeSC:super continuum laser;SPF:short pass filter;BPF:bandpass filter; PBS:polarizing beam splitter;S1,S2:shutters;BE1,BE2:beam expanders;SMF:single mode fibers;VPP:vortex phase plate; BS1,BS2:beam splitter;QW:quarter wave plate; PMT:photomultiplier tube detector
2.2实验装置
我们所使用的光学相减显微镜的基本结构是基于之前被报道过的自制STED显微镜14的基础上设计完成的(如图2所示)。整个系统使用了普通倒置光学显微镜(IX71,Olympus,Japan)作为基本平台,利用超连续皮秒脉冲激光器(Fianium,Southampton,UK)作为光源,其波长范围从可见光波段到近红外波段(450-1750 nm),脉冲宽度为350 ps,重复频率为1 MHz。在激光器出口处设置一块窄带滤波片(BPF,FF01-650/13-25,Semrock,New York,USA)用以选择出650 nm作为激发波长。之后经过偏振光分离晶体(CVI,Albuquerque,USA)将光路分为偏振状态相互垂直的两路线偏振光,分别作为被减成像和减数成像的激发光源。两路光又分别经过两组扩束透镜组(BE1,BE2)之后耦合到单模保偏光纤(SMF,THORLABS,New Jersey,USA)中以保证光束质量并简化整个成像系统。其中减数成像的激发光路又经由螺旋位相板(VPP,RPC Photonics,Rochester,NY,USA)以获得0-2π的螺旋位相调制,在物镜焦平面处形成面包圈型光斑,螺旋位相板厚度对应激发波长650 nm,以保证面包圈型光斑质量。单模光纤输出的两路光先通过一块平面分束镜(BS1,THORLABS,New Jersey, USA)耦合共线,再利用一块半反半透分束镜(BS2, THORLABS,New Jersey,USA)引入油介质物镜(UPlan Sapo,NA=1.4,100×,Olympus,Japan)后口以及实现激发光和散射信号光的分离。另外,一块四分之一波片(THORLABS,New Jersey,USA)被放置在分束镜BS1和BS2之间,以保证两路激发光都为圆偏振光。样品的散射信号通过同一物镜收集之后,经过一个共聚焦针孔后由光电倍增管探测器(PMT,THORLABS,New Jersey,USA)探测。整个系统的图像扫描通过安装在显微镜平台上的压电位移台(P-545.3C7,PI,Germany)单线扫描移动来实现。PMT探测器和位移台都连接在一块数据采集卡(PCIe-6353,NI,USA)当中,以实现信号采集以及探测器与位移台同步等控制,而被减成像和减数成像的切换则通过两个快门(S1和S2, LS3T2,Uniblitz,USA)的开关来控制。
被减成像和减数成像的激发功率一般为10µW左右(物镜后口测得),重复频率为1 MHz,并且由于两者成像过程相对独立,所以不存在时间同步和对准。最后得到的所有实验数据的分析和演示都通过我们自己编写的Matlab程序进行。
2.3样品的制备
金纳米小球样品:采用购买的金溶胶溶液(Φ 80 nm gold bead,Accurate Chemical&Scientific Corporation,New York,USA)和10-3mol∙L-1的聚乙烯醇溶液(PVA,Sigma-Aldrich Corporation,USA) 以1:10的体积比混合后,超声30 min得到的混合溶液,随后旋涂(4000 r∙min-1,30 s)至洗净的玻璃片上并晾干。
有机聚合物微丝:10%(w)聚异丁烯酸异丁酯的二甲基甲酰胺(DMF)溶液作为聚合物,通过电纺丝的方法在玻璃片表面制备有机聚合物微丝。聚合物针尖与玻璃片之间的电压为1.5 kV∙cm-1。有机溶剂流速为100µL∙h-1。
3 实验结果和讨论
3.1金纳米颗粒的相减成像
我们首先利用80 nm金纳米颗粒成像来验证相减显微成像方法提高空间分辨率的能力。图3表示了样品同一区域(10µm×9µm)的普通共聚焦激发散射成像Ic(被减图像)和相减显微成像Is结果。实验中单个扫描步长为50 nm,采集时间为1 ms,被减图像和减数图像的激发光在物镜后口所测得的功率都为12µW,脉冲重复频率为1 MHz,可调参数r=1.2。如图3(a)中所示的两个相邻金纳米颗粒(白色箭头所指处),其无法通过普通共聚焦成像清楚地区分开来,而在经过Ic和Id相减处理之后得到Is,两个金纳米颗粒分别在Ic和Is的横截面图如图3 (d)所示,可见两个颗粒被清楚的区分开来。图3(e)显示了单个金纳米颗粒分别在共聚焦图像和相减图像当中的横截面(图3(a)和图3(c)蓝色箭头所指处),可测得共聚焦成像(图3(a))中金纳米颗粒的半高宽在319 nm,但在相减成像(图3(c))结果中金纳米颗粒半高宽减小到了215 nm,约为0.33λ,相比于共聚焦成像的结果,空间分辨率有了明显的提高。
3.2有机聚合物微丝的相减成像
我们使用有机聚合物微丝作为成像样品进一步验证相减显微镜的空间分辨能力(图4)。为了确定聚合物微丝的真实尺度,我们采用扫描电子显微镜(SEM)对聚合物微丝进行了成像,如图4(a)所示,聚合物体系由细小的微丝和尺寸较大的纺锤体组成,微丝的宽度通常在180-500 nm之间,而纺锤体宽度通常在数个微米。针对聚合物微丝进行光学相减成像,两幅图像的扫面范围为30µm× 30µm,单个步长为60 nm,采集时间为1 ms,激发光功率都为12µW,重复频率为1 MHz,调节参数r=0.85。对比扫描电子显微镜的结果,我们发现对于纺锤体而言只有纺锤体边缘的散射信号能被光学显微镜探测到,这是由于在介质边界处具有更强烈的散射信号所致。通过对比共聚焦图像(图4(b))和相减图像(图4(c))的结果可知,空间分辨率有了较大的提高,一些共聚焦成像中无法显示的图像细节在相减成像得到了展现。例如两幅图中白色箭头所指的一个小纺锤体位置,纺锤体边缘在共聚焦成像中重合到了一起,而在相减成像中两者被清楚地区分了开来(图4(d))。在蓝色箭头所示单个微丝的位置,在相减成像中微丝两个边缘也被探测成像出来,而共聚焦成像中只是单线的形状(图4(e))。因此可以证明在复杂样品的成像中,相减显微成像技术也能显著提高图像的空间分辨率。

图3 通过相减显微技术得到的金纳米颗粒的超分辨成像Fig.3 Super-resolution imaging of the gold nanobeads by the subtraction microscopy(a)confocal excitation image;(b)doughnut excitation image;(c)super-resolution subtraction image; (d)normalized intensity profiles along lines indicated by white arrows in(a)and(c); (e)normalized intensity profiles along lines indicated by blue arrows in(a)and(c).The bar scale is 1 μm in(a),(b),and(c).

图4 有机聚合物微丝的相减显微成像Fig.4 Super-resolution imaging of the polymer nanofibers with the subtraction microscopy(a)scanning electron microscope(SEM)image of polymer nanofibers,the bar scale is 1 μm in inset;(b)confocal image; (c)super-resolution subtraction image,the bar scale is 3 μm in(b)and(c);(d)normalized intensity profiles along lines indicated by white arrows in (b)and(c);(e)normalized intensity profiles along lines indicated by bule arrows in(b)and(c).
上述实验结果证明了光学相减显微技术能够利用散射光作为信号源实现非荧光样品的超分辨成像。不同于之前的超分辨成像技术需要利用荧光分子基团,光学相减显微技术的两路激发光原则上可以使用任意波长,无需高激发功率和复杂样品制备过程,减小了样品的光损伤。
4 结论
提出了利用光学相减显微镜获得非荧光样品超分辨成像,通过共聚焦散射成像作为被减图像,面包圈形光斑激发的散射成像为减数图像,两图像相减的方法提高图像的空间分辨率,两者的激发波长可以为任意的单一波长,并且激发功率可以在较低水平。使用相减显微成像技术对金纳米颗粒以及有机聚合物微丝进行成像实验,结果证明金纳米颗粒半高宽从316 nm下降至215 nm,约为0.33λ;而聚合物微丝样品图像的空间分辨率也有明显的提高。由于实验采用散射光作为信号源,证明了光学相减显微镜适用于任何光学信号来源,其在生物医学以及其他领域的应用前景也得到了扩展。
References
(1)Rust,M.J.;Bates,M.;Zhuang,X.W.Nature Methods 2006,3, 793.doi:10.1038/nmeth929
(2)Betzig,E.;Patterson,G.H.;Sougrat,R.;Lindwasser,O.W.; Olenych,S.;Bonifacino,J.S.;Davidson,M.W.;Lippincott-Schwartz,J.;Hess,H.F.Science 2006,313,1642.
doi:10.1126/science.1127344
(3)Klar,T.A.;Jakobs,S.;Dyba,M.;Egner,A.;Hell,S.W. Proceedings of the National Academy of Sciences of the United States of America 2000,97,8206.doi:10.1073/ pnas.97.15.8206
(4)Hell,S.W.Science 2007,316,1153.doi:10.1126/ science.1137395
最后借用何显斌教授的一句话:“只有当刑罚以正义和人道为基本价值取向的时候,刑法的价值—秩序和自由才能实现并确保和谐的共生关系。”[8]我们设立刑法是为了很好的维护正常的自由、秩序,而不是滥用刑罚。
(5)Wang,P.;Slipchenko,M.N.;Mitchell,J.;Yang,C.;Potma,E. O.;Xu,X.F.;Cheng,J.X.Nat.Photonics 2013,7,450. doi:10.1038/NPHOTON.2013.97
(6)Ye,H.;Qiu,C.W.;Huang,K.;Teng,J.;Luk'Yanchuk,B.;Yeo, S.P.Laser Phys.Lett.2013,10,64.doi:10.1088/1612-2011/ 10/6/065004
(7)Haeberle,O.;Simon,B.Opt.Commun.2009,282,3657.doi: 10.1016/j.optcom.2009.06.025
(8)Dehez,H.;Piche,M.;De Koninck,Y.Opt.Express 2013,21, 15912.doi:10.1364/OE.21.015912
(9)Segawa,S.;Kozawa,Y.;Sato,S.Opt.Lett.2014,39,4529.
doi:10.1364/OL.39.004529
(10)Kuang,C.F.;Li,S.;Liu,W.;Hao,X.;Gu,Z.T.;Wang,Y.F.; Ge,J.H.;Li,H.F.;Liu,X.Sci.Rep-UK 2013,3,6. doi:10.1038/srep01441
(11)Wolf,E.Proceedings of the Royal Society of London Series a-Mathematical and Physical Sciences 1959,253,349. doi:10.1098/rspa.1959.0199
(12)Richards,B.;Wolf,E.Proceedings of the Royal Society of London Series a-Mathematical and Physical Sciences 1959, 253,358.doi:10.1098/rspa.1959.0200
(13)Klar,T.A.;Engel,E.;Hell,S.W.Phys.Rev.E 2001,64,9. doi:10.1103/PhysRevE.64.066613
(14)Yu,J.Q.;Yuan,J.H.;Zhang,X.J.;Liu,J.L.;Fang,X.H. Chinese Science Bulletin 2013,58,4045.doi:10.1007/s11434-013-6011-z
Super-Resolution Optical Subtraction Microscopy Using Optical Scattering Imaging
ZHOU Qian1,2,3YU Jian-Qiang4ZHAO Li-Bo3LI De-Sheng5WU Kui6
ZHU Jian-Hua1,2YUAN Jing-He3,*FANG Xiao-Hong3
(1Department of Physics,Sichuan University,Chengdu 610064,P.R.China;2Key Laboratory of High Energy Density Physics and Technology of Ministry of Education,Chengdu 610064,P.R.China;3Key Laboratory of Molecular Nanostructure and Nanotechnology,Institute of Chemistry,Chinese Academy of Sciences,Beijing 100190,P.R.China;4College of Science, North China University of Technology,Beijing 100144,P.R.China;5State Key Laboratory of Polymer Physics and Chemistry,Institute of Chemistry,Chinese Academy of Sciences,Beijing 100190,P.R.China;6Key Laboratory of Analytical Chemistry for Living Biosystems,Institute of Chemistry,Chinese Academy of Sciences,Beijing 100190,P.R.China)
The existing form of super-resolution microscopy based on specific fluorescent tagging is unable to obtain super-resolution images of non-fluorescent samples.Hence,we have developed optical subtraction microscopy for obtaining super-resolution imaging in such cases.This method is based on image subtraction between the two optical scattering images from general confocal excitation and doughnut-shaped excitation, respectively.Unlike super-resolution fluorescence microscopy,subtraction microscopy requires no preprocessing of the sample,and the excitation power can be kept low to avoid sample damage.The non-fluorescent imaging of gold nanobeads and polymer nanofibers has been realized to demonstrate the feasibility of super-resolution subtraction microscopy.The lateral resolution decreases to 215 nm(0.33λ,1λ=650 nm)in subtraction imaging,and greater imaging detail of the sample is achieved via optical scattering.
Super-resolution microscopy;Subtraction imaging;Non-fluorescence imaging; Optical scattering imaging
February 25,2016;Revised:March 22,2016;Published on Web:March 23,2016.
O644
[Article]10.3866/PKU.WHXB201603234www.whxb.pku.edu.cn
*Corresponding author.Email:jhyuan@iccas.ac.cn;Tel:+86-10-62561679.
The project was supported by the National Key Basic Research Program of China(973)(2013CB933701),National Natural Science Foundation of China(21127901,91413119)and Key Technology Talent Program of ChineseAcademy of Sciences.
国家重点基础研究发展规划项目(973)(2013CB933701),国家自然科学基金(21127901,91413119)和中国科学院“关键技术人才”项目资助
