角蝇各龄期幼虫体内斯氏副柔线虫的分子生物学鉴定
2016-09-06陈林军史红蕾杨莲茹杨晓野邓侨李斌李莹莹
陈林军,史红蕾,杨莲茹,杨晓野,邓侨,李斌,李莹莹
(内蒙古农业大学兽医学院农业部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特010018)
角蝇各龄期幼虫体内斯氏副柔线虫的分子生物学鉴定
陈林军,史红蕾,杨莲茹,杨晓野,邓侨,李斌,李莹莹
(内蒙古农业大学兽医学院农业部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特010018)
确定角蝇各龄期幼虫体内的斯氏副柔线虫(Parabronema skrjabini)幼虫.通过大量剖检角蝇各龄期幼虫,收集其体内的线虫幼虫,经扩增测序获得ITS基因序列,利用DNAStar 5.0软件,将其与斯氏副柔线虫成虫的ITS基因序列进行同源性比较.结果表明,角蝇Ⅰ、Ⅱ、Ⅲ期幼虫体内的线虫幼虫确为斯氏副柔线虫幼虫.该研究结果不但为鉴定角蝇各龄期幼虫体内的斯氏副柔线虫幼虫提供了简易准确的方法,而且也为弄清斯氏副柔线虫在其传播媒介角蝇体内的发育过程奠定了基础.
角蝇;斯氏副柔线虫;ITS基因序列;分子生物学鉴定
Corresponding authors:YANG Lian-ru;YANG Xiao-ye
斯氏副柔线虫(Parabronema skrjabini)首次发现于Rassowska R I(Р И Рассовская)对土库曼斯坦地区反刍兽真胃内寄生性蠕虫种类进行调查的过程中[1].该寄生虫寄生于骆驼真胃内,可导致严重危害养驼业的斯氏副柔线虫病(Parabrone⁃mosis)的发生[2].目前,关于斯氏副柔线虫的生活史尚不完全清楚,只知道西方角蝇和截脉角蝇是骆驼斯氏副柔线虫病的传播媒介;2008-2010年,赵志国等通过分子生物学技术,确定了骆驼斯氏副柔线虫病的传播媒介为角蝇属的西方角蝇(Haematobia irritans)和截脉角蝇(Haematobia titil⁃lans)[3];2011年,李文生通过光学显微镜和扫描电子显微镜,对西方角蝇和截脉角蝇消化道内的斯氏副柔线虫幼虫的形态特征进行了详细的观察和描述[4].但是角蝇变态过程中何时感染的斯氏副柔线虫虫卵,斯氏副柔线虫虫卵如何随着角蝇的变态过程发育为感染性幼虫以及角蝇各龄期幼虫体内是否存在斯氏副柔线虫等问题还不清楚.本试验以传统方法对各龄期角蝇幼虫逐一剖检,在各龄期角蝇幼虫体内收集疑似斯氏副柔线虫幼虫,然后在形态学鉴定的基础上,利用分子生物学方法对其进行种类验证.
1 材料与方法
1.1试验虫体的来源试验用虫体来自于内蒙古农业大学兽医学院预防兽医系寄生虫学教研室,经形态学和分子生物学方法鉴定的野外采集的角蝇各龄期幼虫.
1.2形态学鉴定收集到的疑似斯氏副柔线虫幼虫形态观察结果与李文生[4]通过光学显微镜和扫描电子显微镜观察到的斯氏副柔线虫幼虫形态描述基本符合.其主要特征是:在光学显微镜低倍镜下观察,幼虫呈淡黄色或乳白色,整条虫体呈螺旋状盘曲;高倍镜下观察可见其头部稍窄,口孔位于其顶端;食道较短,由肌质部和腺质部两部分组成;肠与食道后端相连,呈管状,贯穿于整个虫体;虫体尾部末端顿圆,向腹面弯曲,似鱼钩,肛门明显并开口于虫体近末端处;在扫描电镜下观察,可见幼虫体表有许多由角皮的索状隆起形成的横纹;其口孔及周围的两片侧唇明显,头端的6个耳垂状物结构不明显;肛门呈横裂口状,一端弓起呈圆弧状,另一端平直.进一步采用分子生物学方法对其进行了验证.
1.3DNA提取分别随机取在角蝇Ⅰ、Ⅱ、Ⅲ期幼虫体内剖检得到的疑似斯氏副柔线虫幼虫各50条,另取1条斯氏副柔线虫成虫,使用DNA提取试剂盒(DNeasy Blood&Tissue Kit)分别提取角蝇各龄期幼虫体内的疑似斯氏副柔线虫幼虫的基因组DNA.
1.4基因扩增与纯化将上述提取的角蝇各龄期幼虫体内的疑似斯氏副柔线虫幼虫及斯氏副柔线虫成虫的基因组DNA,利用引物STM、STN对其ITS基因序列进行PCR扩增,引物序列为:上游引物(STM):5′-TTTTACAAGAGGGATACGCC-3′;下游引物(STN):5′-GGTATCACAAACTTATCGGG-3′. PCR扩增体系为50 μL,试验组用量:STM 1 μL(20 μmol/L),STN 1 μL(20 μmol/L),Premix Taq 25 μL,模板10 μL,双蒸水补足至50 μL;阴性对照组用量:STM 1 μL(20 μmol/L),STN 1 μL(20 μmol/L), Premix Taq 25 μL,双蒸水补足至50 μL;同时设用去离子水代替模板的阴性对照.PCR反应条件: 94℃预变性5 min,进入循环;94℃变性30,50℃退火30 s,72℃延伸1 min,共进行35个循环;72℃延伸10 min.扩展产物4℃保存备用.反应结束后,用1%琼脂糖凝胶电泳检测PCR扩增产物,然后使用胶回收试剂盒(EasyPure Quick Gel Extraction Kit)对得到的PCR扩增产物进行目的片段回收.
1.5基因的克隆与测序
1.5.1载体连接将角蝇各龄期幼虫体内疑似斯氏副柔线虫幼虫和斯氏副柔线虫成虫的PCR扩增纯化产物分别与pMD19-T载体连接,连接反应体系为10 μL,反应体系:5 μL Solution 1,1 μL pMD19-T vector,3 μL目的片段,无菌去离子水补足至10 μL;对照体系:5 μL Solution 1,1 μL pMD19-T vector,3 μL Consert insert,无菌去离子水补足至10 μL;参照pMD19-T载体的使用说明书进行载体连接.
1.5.2大肠杆菌感受态细胞的制备及重组子的转化参照DH5α感受态细胞的使用说明书将角蝇各龄期幼虫体内疑似斯氏副柔线虫幼虫和斯氏副柔线虫成虫的载体连接产物分别转入感受态细胞中,将适当体积已转化的感受态细胞,涂在含有X-gal、IPTG及氨苄青霉素的LB固体培养基上,倒置平皿37℃培养12~16 h.
1.5.3重组菌落的筛选将培养好的琼脂平板置于4℃冰箱内充分显色2 h,待平板上的蓝、白菌落清晰可见时,用灭菌抢头挑取白色菌落,接种至4 mL含有Amp的LB液体培养基中,180 r/min、37℃水浴振荡培养过夜.
1.5.4重组菌落PCR鉴定及测序待菌液培养结束后,震荡混匀,抽取10 μL菌液作为模板进行PCR鉴定.经1%琼脂糖凝胶电泳检测后,将出现阳性条带的菌液用封口膜封口后,送上海华大生物公司进行测序.
1.6基因序列分析使用DNAStar 5.0软件中的SeqMan程序,去掉角蝇各龄期幼虫体内疑似斯氏副柔线虫幼虫和斯氏副柔线虫成虫测序结果中的载体序列,并用字符底纹标记出引物STM和STN的碱基序列.将序列放在NCBI网站中搜索其同源序列,确定疑似斯氏副柔线虫幼虫的种类.然后进一步使用DNAStar 5.0软件中的MegA⁃lign程序,对角蝇各龄期幼虫体内的疑似斯氏副柔线虫幼虫与斯氏副柔线虫成虫的ITS基因序列进行比对,计算两者相关序列间的同源性,并寻找它们彼此之间的差异位点.
2 结果
2.1疑似斯氏副柔线虫幼虫ITS基因PCR扩增结果角蝇各龄期幼虫体内的疑似斯氏副柔线虫幼虫经斯氏副柔线虫特异性引物STM、STN扩增后,均出现了约500 bp左右的清晰可见条带,和阳性对照斯氏副柔线虫成虫扩增出的片段大小一致(图1).因此,可初步确定角蝇各龄期幼虫体内的疑似斯氏副柔线虫幼虫为斯氏副柔线虫幼虫,但最终确定其种类还需进一步的验证.
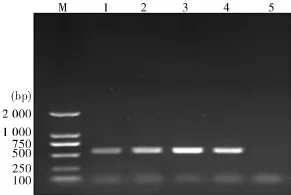
图1 疑似斯氏副柔线虫幼虫与斯氏副柔线虫成虫ITS基因PCR产物电泳图
2.2疑似斯氏副柔线虫幼虫ITS基因阳性克隆菌液PCR鉴定结果角蝇各龄期幼虫体内的疑似斯氏副柔线虫幼虫和斯氏副柔线虫成虫的阳性克隆菌液经特异性引物STM、STN扩增后,均出现大小一致,约500 bp左右的良好目的条带(图2).
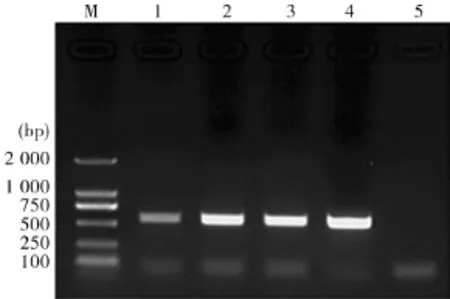
图2 疑似斯氏副柔线虫幼虫与斯氏副柔线虫成虫阳性克隆菌液PCR鉴定结果
2.3角蝇幼虫体内疑似斯氏副柔线虫幼虫ITS基因序列分析结果
2.3.1疑似斯氏副柔线虫幼虫与斯氏副柔线虫成虫ITS基因序列比较通过比较角蝇Ⅰ、Ⅱ、Ⅲ期幼虫体内的疑似斯氏副柔线虫幼虫与斯氏副柔线虫成虫的ITS基因序列,结果显示,四者之间共有541个保守碱基和10个差异碱基,其中差异碱基均表现为碱基的替换,而未出现碱基的缺失或插入.四者间的碱基差异具体为:角蝇Ⅰ期幼虫体内的疑似斯氏副柔线虫幼虫与角蝇Ⅱ期幼虫、角蝇Ⅲ期幼虫体内的疑似斯氏副柔线虫幼虫的ITS基因序列之间分别有8个、3个碱基不同,与斯氏副柔线虫成虫的ITS基因序列间有4个碱基不同;角蝇Ⅱ期幼虫体内的疑似斯氏副柔线虫幼虫与角蝇Ⅲ期幼虫体内的疑似斯氏副柔线虫幼虫的ITS基因序列有4个碱基不同,与斯氏副柔线虫成虫的ITS基因序列间有4个碱基不同;角蝇Ⅲ期幼虫体内的疑似斯氏副柔线虫幼虫的ITS基因序列与斯氏副柔线虫成虫的ITS基因序列之间有1个碱基不同.造成这些碱基的差异可能是由于测序过程中某些原因导致的.
2.3.2疑似斯氏副柔线虫幼虫与斯氏副柔线虫成虫ITS基因序列同源性比较使用DNAStar 5.0软件中的MagAlign程序,将角蝇Ⅰ、Ⅱ、Ⅲ期幼虫体内的疑似斯氏副柔线虫幼虫和斯氏副柔线虫成虫的ITS基因序列,与GenBank中已登录的斯氏副柔线虫rDNA ITS序列(EU420130.1)进行比较,结果显示,它们之间的同源性分别是98.9%、98.6%、99.5%和99.3%,且角蝇Ⅰ、Ⅱ、Ⅲ期幼虫体内的疑似斯氏副柔线虫幼虫和斯氏副柔线虫成虫的ITS基因序列之间的同源性分别为99.3%、99.3%和99.8%(图3).

图3 ITS基因序列之间同源性的比较
2.3.3角蝇各龄期幼虫体内疑似斯氏副柔线虫幼虫鉴定结果角蝇各龄期幼虫体内的疑似斯氏副柔线虫幼虫,经上述分子生物学方法鉴定为斯氏副柔线虫幼虫.
3 讨论与小结
线虫主要依靠其形态学特征进行分类鉴定,但只有具备丰富的专业知识和鉴定经验的专家才能借助于其形态学特征对线虫进行分类鉴定,对于一般的科技人员和检疫人员熟练掌握线虫形态学鉴
定方法是比较困难的.最近随着生命科学技术的发展,分子生物学方法已经被广泛应用到物种鉴定中,相比传统的形态学鉴定方法,分子生物学鉴定具有容易掌握和操作准确可靠的优点.
ITS序列位于18S~5.8S rDNA和5.8S~28S rDNA之间,分别为ITS1、ITS2两段,全长约1.0~ 1.5 kb.ITS序列的优点包括:(1)该序列不参与核糖体的形成且受到的选择压力小,适合于种属间的种群分化方面的研究[5];(2)该序列在种内非常保守,而在种间具有一定的差异,有利于PCR扩增引物的设计[6-7];(3)该序列包含着足够多的遗传信息且在绝大多数真核生物中均具有广泛的序列多态性[8];(4)ITS序列长度适中,一般为1.0~ 1.5kb,含有足够的遗传信息;(5)ITS序列是中等重复的多拷贝基因,仅需很少的标本量就能达到分析鉴定的要求[9];因此难以用传统分类方法进行分类的物种可以利用其有效地解决这一问题.由于ITS序列具有上述特点,因此在真核生物物种鉴定和系统分类中,常被作为重要的遗传标记.
本研究对大量角蝇各龄期幼虫进行了逐一剖检,在一些角蝇各龄期幼虫体内发现了线虫幼虫,经形态学鉴定初步定为斯氏副柔线虫幼虫,为了进一步确定其是否是斯氏副柔线虫幼虫,采用分子生物学方法进行了鉴定.通过提取角蝇各龄期幼虫体内疑似斯氏副柔线虫幼虫的基因组DNA,利用斯氏副柔线虫ITS基因特异性引物STM、STN对其进行了PCR扩增,经琼脂糖凝胶电泳检测结果可知,疑似斯氏副柔线虫幼虫与阳性对照斯氏副柔线虫成虫扩增出了大小一致的目的条带,均为551 bp,可初步确定其为斯氏副柔线虫幼虫.继而又将疑似斯氏副柔线虫幼虫和斯氏副柔线虫成虫的阳性克隆菌液测序,测得的角蝇Ⅰ、Ⅱ、Ⅲ期幼虫体内的疑似斯氏副柔线虫幼虫、斯氏副柔线虫成虫的ITS基因序列,与GenBank中已登录的斯氏副柔线虫rDNA ITS序列(EU420130.1)同源性分别是98.9%、98.6%、99.5%和99.3%;角蝇Ⅰ、Ⅱ、Ⅲ期幼虫体内的疑似斯氏副柔线虫幼虫与斯氏副柔线虫成虫的ITS基因序列之间的同源性分别为99.3%、99.3%和99.8%.因此可以确定角蝇各龄期幼虫体内的疑似斯氏副柔线虫幼虫为斯氏副柔线虫幼虫,该研究结果不但为鉴定角蝇各龄期幼虫体内的斯氏副柔线虫幼虫提供了简易准确的方法,而且也为弄清斯氏副柔线虫在其传播媒介角蝇体内的发育过程奠定了基础.
[1]Ivashkin V M,Khromova L A.Nematodes and domestic animals and their vectors-Diptera[M].Moscow:Published Science USRR, 1983(in Russian).
[2]张晓东.骆驼斯氏副柔线虫病流行病学调查及rDNA-ITS序列分析研究[D].呼和浩特:内蒙古农业大学硕士学位论文,2008.
[3]赵治国.我国骆驼斯氏副柔线虫病传播媒介的研究[D].呼和浩特:内蒙古农业大学博士学位论文,2010.
[4]李文生.角蝇体内斯氏副柔线虫的观察及COI基因特异性序列分析[D].呼和浩特:内蒙古农业大学硕士学位论文,2011.
[5]江世宏,孟子烨,陈晓琴,等.核糖体DNA序列分析在昆虫系统学研究中的应用[J].昆虫分类学报,2008,30(3):225-238.
[6]李正西.赤眼蜂rDNA分子系统学分析及蜂种诊断引物的开发和应用[D].北京:中国农业大学,2001.
[7]王庆.日本沼虾核rDNA内转录间隔区(ITS-1)全序列的测定及分析[D].南京:南京农业大学,2007.
[8]牛庆丽,罗建勋,殷宏.转录间隔区(ITS)在寄生虫分子生物学分类中的应用及其进展[J].中国兽医寄生虫病,2008,16 (4):41-47.
[9]马婷婷,陈光,刘春香.ITS序列的特点及其在昆虫学研究中的应用[J].应用昆虫学报,2011,48(3):711.
M olecular Identification of Parabronema skrjabini Larvae in Different Instars Larvae of Horn Flies
CHEN Lin-jun,SHI Hong-lei,YANG Lian-ru,YANG Xiao-ye,DENG Qiao,LI Bin,LI Ying-ying
(Key Laboratory of Clinical Diagnosis and Treatment Technology in Animal Disease, College of Veterinary Medicine,Inner Mongolia Agricultural University,Hohhot 010018,China)
In order to confirm the nematode larvae in different instars of horn flies is Parabronema skrjabini,a large number of different instars larvae of horn flies were dissected.We found that the nematodes in the insects could be the larvae of Parabronema skrjabini according to their morphology.To intestigate further,we used amplification and sequencing techniques,and obtained ITS sequences of the worm.Then,we compared it with ITS sequences of adult Parabronema skrjabini using DNAStar 5.0.The results showed that the worm in 1st,2nd and 3rd instar larvae of horn flies was proved to be Parabronema skrjabini.The study not only of⁃fered a simple and applicable way to identify Parabronema skrjabini larvae in different instars larvae of horn flies,but also build the foundation for studying the development process of Parabronema skrjabini in its vector,horn flies.
Horn Fly;Parabronema skrjabini;ITS sequences;Molecular Identification
S858.24
A
0529-6005(2016)02-0015-04
2015-09-28
国家自然科学基金项目(31160502)
陈林军(1991-),男,硕士,主要从事兽医寄生虫学研究,E-mail:chenlinjunvip@163.com
杨莲茹,E-mail:lianruyang122@126.com;杨晓野, E-mail:xiaoyeyang122@sohu.com
