橘子皮的皂化改性及其吸附铜离子的影响因素
2016-09-05刘玉宝
王 慧, 刘玉宝,韩 杰,花 儿,
(1.北方民族大学材料科学与工程学院,宁夏 银川 750021;2. 北方民族大学化学与化学工程学院,宁夏 银川 750021)
橘子皮的皂化改性及其吸附铜离子的影响因素
王 慧1, 刘玉宝2,韩 杰2,花 儿1,2
(1.北方民族大学材料科学与工程学院,宁夏 银川 750021;2. 北方民族大学化学与化学工程学院,宁夏 银川 750021)
以NaOH皂化改性的橘子皮为吸附剂,并以橘皮粉投加量(Q)、pH 值、搅拌速度(n)、温度(T)、吸附时间(t)为考察因素,对自制模拟实验室含铜废液进行了吸附实验。通过原子吸收分光光度法(Atomic Absorption Spectrometry, AAS)测定了吸附前后水中Cu2+的浓度,并探讨了在不同试验条件下,橘皮粉对铜离子的吸附率。最适宜吸附条件为:Q 25.00 g/L、pH值4.00、r 120 r/min、T 室温(15~35℃ )、t 60 min。
橘子皮,NaOH皂化,Cu2+,生物吸附,原子吸收分光光度法
橘子皮是柑橘加工过程中产生的废弃物,约占果重的25%~40%。近年来, 国内外学者通过皂化、磷酸化等化学处理改性法、交联等多种方法对橘子皮或橘子残渣进行改性,制备对重金属具有良好吸附性能的生物吸附剂[1-2]。生物吸附法在处理低浓度重金属离子废水过程中,具有吸附率高[3-5],成本低,操作简便,易于回收重金属[6]等独特优势[7]。本研究采用氢氧化钠化学处理橘皮粉,氢氧化钠不仅能使甲酯化的羧基皂化,提高羧基的数目,还能与醇羟基或酚羟基反应,生成醇钠,增加离子交换率。另外,生物吸附剂经氢氧化钠浸泡处理后,橘子皮中高分子聚合物的聚合度有所降低,木质素与碳水化合物结构断开,木质纤维素材料膨胀,提高了内部孔隙率和表面积[7],进一步提高了橘子皮对重金属离子的吸附效率。
利用皂化橘皮粉处理后的废水中残留的铜离子浓度较低,因此采用原子吸收分光光度法测定了吸附后铜离子浓度。通过考察橘皮粉的投加量,废水pH值,温度,搅拌转速等可能影响吸附率的几个因素,确定了皂化橘皮粉对铜离子吸附的最佳绿色工艺条件。近年,虽然已有研究者利用橘皮粉吸附铜离子的研究[8-9],却未见类似于该类研究方法。
1 材料与方法
1.1 材料与试剂
氢氧化钠(AR,天津永大化学试剂);浓盐酸(AR,天津风船化学试剂);氯化铜(AR,天津凯通化学试剂);无水乙醇(AR,国药集团化学试剂)。
橘子皮预处理流程: 将橘子皮洗净 → 烘干→ 粉碎机粉碎 → 过20目筛 → 电子天平称取橘皮粉25g于300mL(0.08 mol / L) NaOH水溶液 → 浸泡24小 → 用蒸馏水清洗至中性 → 用医用纱布过滤 → 晾干→ 放入密封袋中保存 → 皂化橘皮粉
模拟实验室含铜废液的配制: 取4.21g氯化铜粉末溶于3100 mL蒸馏水中,摇匀溶解即得334 mg / L的含铜废液(C0)。
1.2 仪器与设备
HZS-H 水浴振荡器,哈尔滨市东联电子技术开发有限公司;TAS-990原子吸收分光光度计,北京普析通用仪器有限责任公司;PHS-3C 精密 pH 计,上海机密科学仪器有限公司;粉碎机,启东市科安防爆电器通讯有限责任公司;KQ3200DV型数控超声波清洗器,昆山市超声仪器有限公司。
1.3 方法
1.3.1 AAS 测定条件
测定波长 324.7 nm,元素灯的电流 4 mA,狭缝长度 0.4 mm,火焰高度 6 mm,气流量 2000 mL / min。
1.3.2 标准曲线的绘制
如表1,配制一系列含铜离子标准溶液,采用AAS法,依次测定其吸光度。A=0.1709c+0.0452, R2= 0.9958
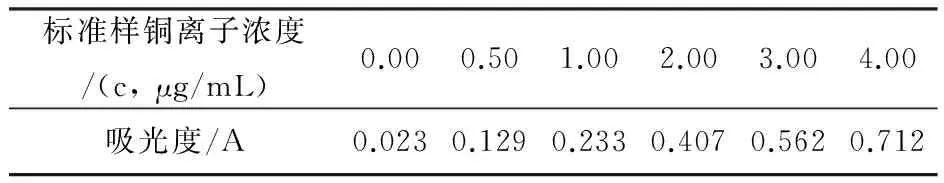
表1 标准曲线取点坐标
1.3.3 吸附试验流程
120 mL 自制模拟铜废液中加入改性橘皮粉,在指定投加量、废水pH值、加热温度、搅拌速度等条件下,进行吸附试验后,用医用纱布过滤,抽滤,取抽滤液用蒸馏水稀释50倍后用AAS法测定滤液中铜离子浓度。计算吸附率。
1.3.4 吸附率的计算
吸附率作为橘皮粉对废水中铜离子的吸附能力的参考指标,其计算公式如下:
(1)
式中, C0,CX分别为用橘皮粉吸附前后水中铜离子的浓度(mg/L)。
2 结果与分析
2.1 投加量对吸附率的影响
在pH值 4.00,n 120 r/min, t 25℃,Q(g / L)分别为8.33,16.67,25.00,33.33,41.67的条件下,吸附120 min得到的吸附率及吸附容量 如图1。吸附率先随橘皮粉投加量的增加而明显提高。从 25.00 g/L开始,继续增加投加量时,吸附达到饱和,吸附率无明显变化。这表明,随着吸附剂用量的增加,相关官能团的数量也会增加而金属吸附率提高,但添加过量时,部分结合位点可能因为不能充分暴露而导致降低吸附效果。对于Cu2+的吸附容量,随着橘皮粉投加量的增加而降低,到了一定的投加量后趋于稳定,为了保证吸附过程中有较高的吸附率与吸附容量,并节省资源,选择橘皮粉的最适宜投加量为25.00 g/L。
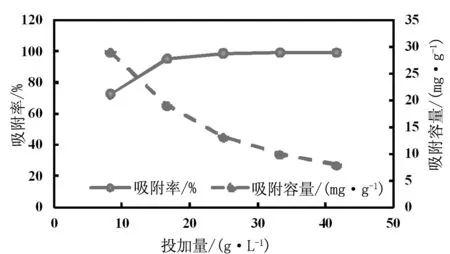
Fig.1 Effect of dosage on adsorption efficiency of Cu2+
2.2 pH 对吸附率的影响
n 120 r/min,t 25 ℃,Q 3.00 g, pH值分别在1.99、3.02、3.99、4.98、6.02的条件下吸附120 min 得到的吸附率 如图2。溶液pH较低时,吸附率也较低, pH值为1.99 时,橘子皮对Cu2+ 的吸附率为 93.37%。随着 pH 值的增加吸附率也提高,pH 值4.00 时,吸附率达到最高 99.19 %。这是因为溶液的pH偏低时,吸附位点周围被无数的氢离子充斥,阻碍了目标离子的靠近,而随着 pH 值增大,溶液中H+ 浓度减小,吸附率增大[1,6]。当pH值增加到6 时,吸附率有所降低。这可能是因为,随着溶液pH 值的增大,铜离子开始出现沉淀(一般使铜离子开始沉淀时溶液的pH 值为4.7),从而影响了橘皮粉对铜离子的吸附率。选择最适宜初始pH值为4.00。
2.3 吸附时间对吸附率的影响
pH 4.00,n 120 r/min,Q 3.00 g,T 25℃,t为30 min、60 min、90 min、120 min、150 min的条件下得到的吸附率 如图3。吸附率先随吸附时间的延长而提高,一定时间后,吸附率略有下降趋势,但最后趋于平稳。考虑成本及节约时间,选择最佳吸附时间为60min。
2.4 温度对吸附率的影响
pH 4.00,n 120 r/min,Q 25.00 g/L,t 60 min 的条件下,考察了不同温度15℃、20℃、 25℃、30℃、35℃ 时的吸附率, 如图4。在15℃ ~ 35℃ 温度范围内,对Cu2+的吸附率在98.97%~98.32%,无明显变化。因此,考虑节省能源,减少成本,根据操作环境温度在室温下(15~35℃)进行即可。
2.5 搅拌速度对吸附率的影响
pH 4.00, T 20 ℃,Q 25.00 g/L的条件下,分别选取搅拌速度为:60 r/min、90 r/min、120 r/min、150 r/min、180 r/min吸附60 min得到的吸附率 如图5。吸附率先随转速的加快而提高,60 min时93.53%,转速加快至90 r/min时提高至98.82%,吸附率明显提高。从90 r/min 开始吸附率在98.82%~99.18%,无明显变化,随着继续加快具有下降的趋势。因此,最适宜的搅拌速度为120 r/min。
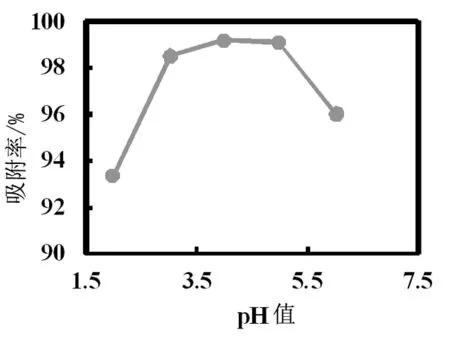
Fig.2 Effect of pH on adsorption efficiency

Fig.3 Effect of contact time on adsorption efficiency

Fig.4 Effect of temperature on adsorption efficiency
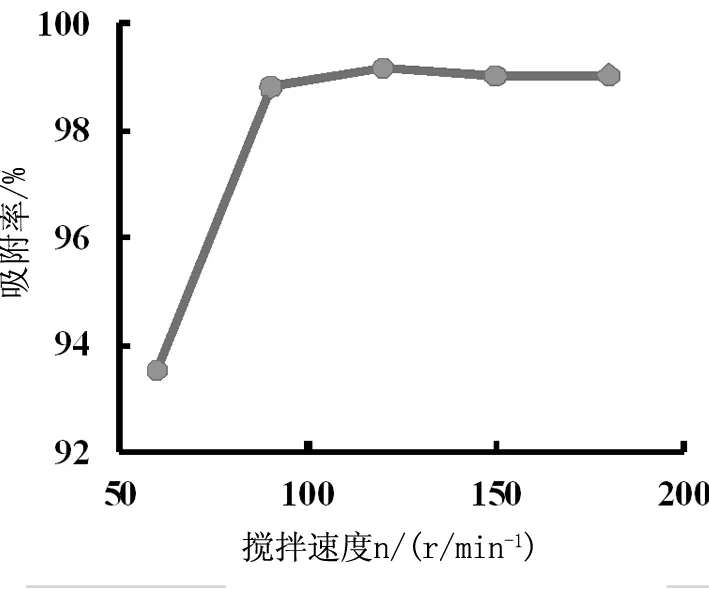
Fig.5 Effect of mixing rate on adsorption efficiency
3 结论
(1)投加量增至一定量时,吸附将达到饱和。因此,选择吸附剂用量时,应与吸附容量结合考虑,选择吸附剂投加量应适宜。本实验中最适宜投加量为25.00 g / L。
(2)橘皮粉吸附铜离子的最适宜pH值为4.00。
(3)吸附率随吸附时间的延长而提高,但是一定时间后趋于平稳。考虑成本及节约时间,应选择最佳工艺时间。本试验中最适宜吸附时间为60 min。
(4)在15~35℃ 温度范围内,对Cu2+的吸附率在98.97%~98.32%,无明显变化。因此,考虑节省能源,减少成本,根据操作环境温度在室温下(15~35℃)进行即可。3.5吸附率先随搅拌速度的加快而提高,加快至一定速度后,显示了下降的趋势。因此,考虑节能,应选择适宜搅拌速度。本试验中,最适宜搅拌速度为120 r/min。
[1] 冯宁川,郭学益,梁 莎.橘子皮化学改性及其对Cu(Ⅱ)离子的吸附性能[J].中国有色金属学报,2008, 18(1): 148-154.
[2] 梁 莎.橘子皮生物吸附剂化学改性合成及其对重金属离子吸附研究[D]. 长沙:中南大学,2010.
[3] LIANG S, GUO X Y, FENG N C, TIAN Q. Application of orange peel xanthate for the adsorption of Pb2+from aqueous solutions[J]. J Hazard Mater, 2009, 170: 425-429.
[4] MIRETZKY P, SARALEGUI A, CIRLLI A F. Simultaneous heavy metal removal mechanism by dead macrophytes[J]. Chemosphere, 2006, 62: 247-254.
[5] 赵 华,陈爱华,焦必宁. 柑橘皮对重金属生物吸附的研究进展[J].食品工业科技,2011,(12):532-543.
[6] 施 红.生物吸附法处理废水中重金属离子的研究[D].南京:河海大学,2006.
[7] 李洪涛,薛 松,冯家辉.农林废弃物对重金属离子吸附的研究进展[J]. 化学工业科技创新导报,2014(2):111.
[8] 冯宁川.橘子皮化学改性及其对重金属离子吸附行为的研究[D]. 长沙:中南大学,2009.
[9] FENG Ningchuan, GUO Xueyi, Liang Sha. Kinetic and thermodynamimc studies on biosorption of Cu(II) by chemically modified orange peel[J]. Transition of Nonferrous Metals Society of China, 2009, 19: 1365-1370.
(本文文献格式:王 慧,刘玉宝,韩 杰,等.橘子皮的皂化改性及其吸附铜离子的影响因素[J].山东化工,2016,45(12):22-24.)
NaOH-modified Orange Peel and the Effects of Various Factors on Adsorption of Copper (II) Ion
Wang Hui1, Liu Yubao2, Han Jie2, Hua Er1,2
(1.School of Materials Science and Engineering, Beifang University of Nationalities,Yinchuan 750021,China;2.School of Chemistry and Chemical Engineering,Beifang University of Nationalities,Yinchuan 750021,China)
NaOH-modified Orange peel was used for the absorption of the copper (II) ion from the Lab-wastewater. Dosage of orange peel (Q), pH value, adsorption temperature (T), mixing rate (n) and adsorption time (t) were studied as the effection factors. Atomic Absorption Spectrometry (AAS) method was used for the measurements of the concentration of Cu2+and adsorption efficiency was studied under the various factors above. Optimum conditions are Q 25.00 g/L, pH 4.00, n 120 r/min, T (15~35℃), t 60 min.
orange peel;NaOH-modified, copper(II) ion;biosorption;Atomic Absorption Spectroscopy
2016-04-14
北方民族大学研究生创新项目
王 慧(1990—),女,辽宁铁岭人,研究生,研究方向为材料化学。
X712
A
1008-021X(2016)12-0022-03
