EGFR 19-del和L858R突变型NSCLC患者预后比较
2016-09-05韦文娥利基林宁淑芳刘海洲蔡政民张力图
韦文娥,利基林,宁淑芳,刘海洲,蔡政民,张力图
(广西医科大学附属肿瘤医院,南宁530021)
EGFR 19-del和L858R突变型NSCLC患者预后比较
韦文娥,利基林,宁淑芳,刘海洲,蔡政民,张力图
(广西医科大学附属肿瘤医院,南宁530021)
目的比较表皮生长因子受体(EGFR)19外显子(19-del)突变和21外显子L858R点突变型非小细胞肺癌(NSCLC)患者的预后。方法收集257例NSCLC患者,取其新鲜组织或石蜡包埋组织,采用ARMS-PCR法检测EGFR基因型。收集临床资料,定期随访,以死亡为终点事件,失访或截止至末次随访时间尚未发生终点事件均纳入截尾数据,应用SPSS17.0软件进行统计分析。结果在257例患者中,19-del突变型134例,L858R突变型123例。两种类型突变患者的临床特征分布比较,P均>0.05。生存分析结果显示,19-del突变型中位生存期为798 d,L858R突变型中位生存期为710 d,两者的总生存期差异无统计学意义(P>0.05)。进一步对样本进行分层分析结果显示,在汉族患者中,19-del突变型患者预后比L858R突变型患者好(P=0.047),在壮族中未观察到差异有统计学意义(P>0.05)。在不同年龄、性别、TNM分期和临床分期上预后也没有统计学差异(P均>0.05)。结论 EGFR 19-del突变和L858R突变型NSCLC患者总体上总生存期相似,但是在汉族中EGFR 19-del型突变患者预后较好。
肺肿瘤;表皮生长因子受体突变;19外显子突变;21外显子L858R突变;预后分析
目前世界上肺癌仍是男性癌症死因中的首位[1]。非小细胞肺癌(NSCLC)约占肺癌的80%[2,3]。根据2015 NSCLC指南,手术仍是肺癌的首选治疗方法[4]。但是由于手术的局限性,部分患者不能进行手术治疗。晚期NSCLC患者可以获益于分子靶向治疗药物如酪氨酸激酶抑制剂(TKI)[5]。表皮生长因子受体(EGFR)突变是NSCLC患者中最常见的基因改变[6, 7],EGFR突变患者对TKI比常规化疗表现出更好的反应率和更长的无疾病进展生存期[8~10]。19外显子缺失突变(19-del)和21外显子L858R点突变是EGFR突变中最常见的两种亚型[11],但是这两种突变患者的临床疗效和预后差异仍有争议。本研究进行了相关探讨。现报告如下。
1 资料与方法
1.1临床资料收集2010年9月1日~2013年12月31日广西医科大学附属肿瘤医院NSCLC(EGFR 19-del 或L858R突变型)患者257例,均通过组织病理检查确诊。男131例、女126例,年龄21~89岁、中位年龄58岁;腺癌237例,鳞癌8例,腺鳞癌12例;汉族191例,壮族62例,其他民族(包括仫佬和满族)4例。分化程度为高分化25例、中分化90例、低分化101例,有41例患者因为是标本的原因无法评估其分化程度;根据肺癌TNM分期,远处转移119例,无远处转移138例;临床分期Ⅰ期43例,Ⅱ期18例,Ⅲ期76例,Ⅳ期120例。
1.2EGFR基因型的检测采取新鲜手术切除组织,并进行石蜡包埋组织切片。采用TIANamp基因组DNA试剂盒(天根生物技术有限公司),遵循实验手册的操作规程提取DNA,并通过ARMS-PCR进行EGFR基因检测,所用试剂盒为厦门艾德生物医药科技有限公司的EGFR检测试剂盒。每一次实验都设立阳性和阴性对照,所有的基因检测都是通过罗氏480 Ⅱ实时荧光定量PCR系统检测,数据分析是通过仪器配套的罗氏480 v1.5版软件来分析。PCR扩增分三个阶段,第一阶段为95 ℃、5 min;第二阶段为95 ℃、25 s,64 ℃、20 s,72 ℃、20 s,15个循环;第三阶段为93 ℃、25 s,60 ℃、35 s,72 ℃、20 s,31个循环;荧光信号FAM和HEX在第三阶段60 ℃时收集。通过确定Ct值来判断结果,当样品的Ct值≥阴性临界值时,判为阴性或低于检测下限;当样品某个反应管的Ct值<阳性临界值时,则该反应管判为强阳性;当样品某反应管的Ct值≥阳性临界值时,需要计算该反应管的ΔCt值(ΔCt值=突变Ct值-外控Ct值),ΔCt值<对应管的ΔCt Cut-off值时该反应管判为弱阳性,否则判为阴性或低于检测下限。
1.3统计学方法采用SPSS17.0统计软件。两种突变临床特征比较的差异分析采用χ2检验或Fisher′s确切概率法。生存时间从手术或活检后的第一天算起,随访截止至2015年12月31日。时间度量以天计算,终点事件为死亡,失访和截止至末次随访时间尚未发生终点事件的患者均定义为删失数据,生存分析采用Kaplan-Meier法。P<0.05为差异有统计学意义。
2 结果
2.1两种突变型NSCLC患者临床特征比较见表1。

表1 EGFR 19-del和L858R突变型NSCLC患者临床特征比较(例)
2.2生存分析结果本研究共收集257例NSCLC 患者,具有完整随访资料的有236例,死亡102例,失访21例。其中19-del突变患者失访13例,中位生存期为798 d;L858R突变患者失访8例,中位生存期710 d。19-del和L858R突变患者总生存期比较差异无统计学意义(P=0.160,图1)。应用Cox回归分析比较多个研究因素对风险率的影响发现,临床分期(Ⅰ~Ⅳ)级别越高风险越大(HR=2.471,95%CI:1.168~5.229,P=0.018)。进一步在两种突变患者中对临床分期进行分层分析,发现在Ⅰ~Ⅱ、Ⅲ~Ⅳ期中19-del和L858R突变型NSCLC患者的总生存期比较差异无统计学意义(P均>0.05,图2)。同时,我们还对本研究中的其他因素进行了分层分析。根据民族划分进行汉族和壮族进行生存分析发现,汉族中19-del突变患者的中位生存期为789d,L858R突变患者为584d,两者总生存期比较差异有统计学意义(P=0.047,图3A),壮族中19-del突变型患者的中位生存期为796 d,L858R突变型患者的中位生存期为870 d,两者总生存期比较差异无统计学意义(P=0.546,图3B)。
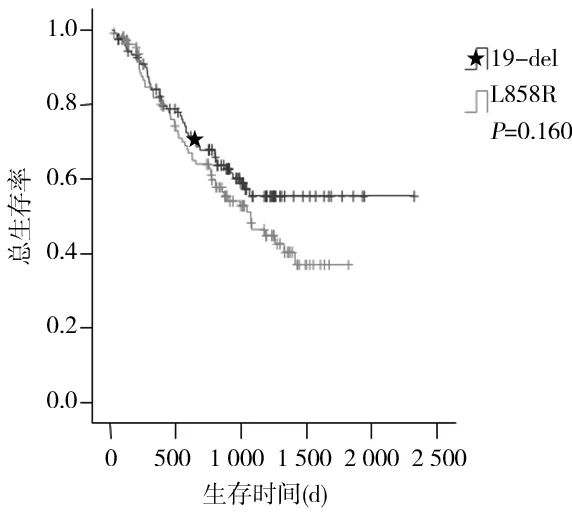
图1 EGFR 19-del和L858R突变患者生存曲线
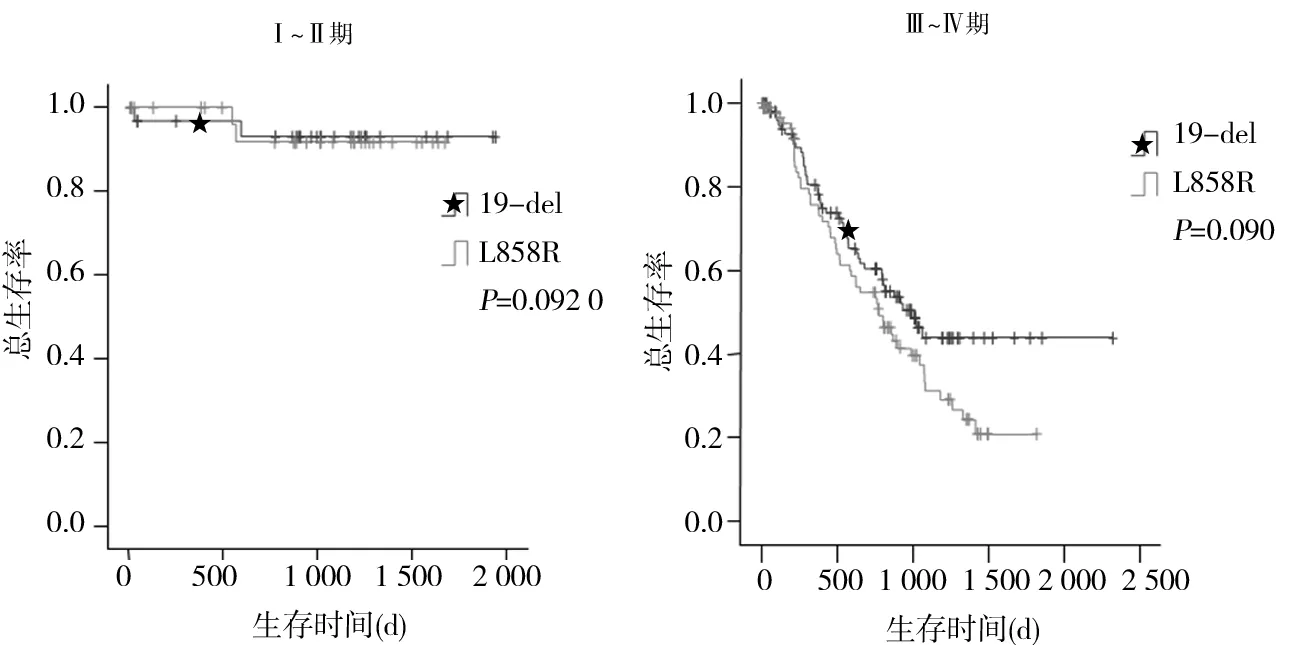
图2 不同临床分期EGFR 19-del和L858R突变患者的生存曲线
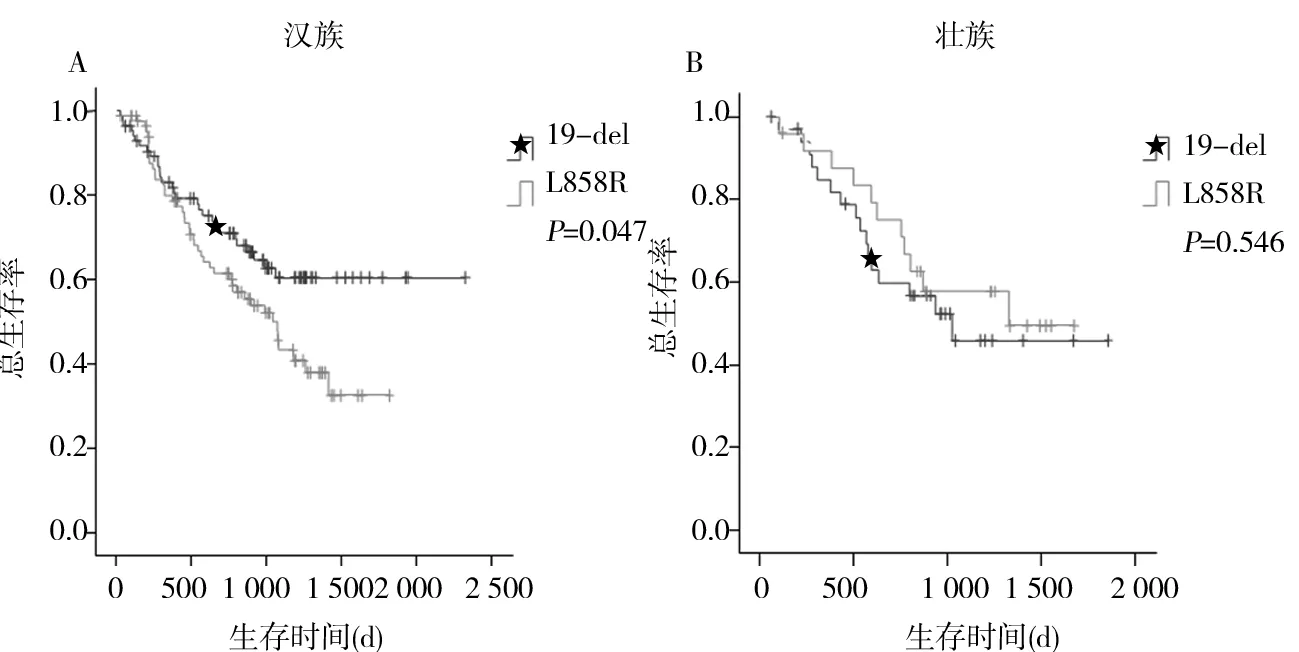
图3 汉族和壮族EGFR 19-del和L858R突变患者的生存曲线
3 讨论
肺癌作为世界上癌症死因中最主要癌症之一,得到了众多学者的关注和研究。精准医疗的正式提出使得NSCLC的靶向治疗再次受到关注。EGFR基因突变的发现使得NSCLC的治疗有了里程碑式的进步。其基因突变检出率在世界不同人群中的表现也各不一样,变化幅度从8%至66%[11,12]。EGFR基因突变好发于亚洲、女性、非吸烟和腺癌患者。分子靶向药物TKI如易瑞沙等对NSCLC EGFR突变型患者的疗效也得到了肯定。Maemondo 等[9]对EGFR突变型患者分组进行靶向药物TKI治疗和化疗的疗效比较发现,一线靶向治疗相比于标准化疗可以改善患者的无进展生存期。Jackman等[13,14]的临床研究也证实了靶向治疗对EGFR突变型患者有明显的改善作用,并且结果还显示19-del突变型患者比L858R型突变患者有更长的疾病进展时间和总生存时间。但是Maemondo等[9, 14]的研究显示,19-del和L858R突变型患者的总生存时间差异无统计学意义。本研究也进行了两种突变的预后分析,结果显示EGFR 19-del和L858R突变型NSCLC患者在年龄、性别、TNM分期、临床分期、组织学分型、分化和不同民族中的分布差异无统计学意义,与之前学者们的研究[14, 15]结果一致。我们对这两种突变患者的总生存期进行分析,结果显示EGFR 19-del和L858R突变型NSCLC患者总生存期差异无统计学意义,与Maemondo等[9, 14]的研究结果一致。在以民族划分进行壮族和汉族的分层分析发现,在汉族患者中,EGFR 19-del突变型患者相较于L858R突变型患者有更长的总生存时间,与Jackman等[8, 14, 15]研究结果一致。但是在壮族患者中观察到两种突变患者的总生存时间差异无统计学意义。从基因突变率在不同人群的分布不同和前面提到的在西方人群与日韩人群中不同突变亚型预后不一致考虑,我们认为不同地区不同民族不同人种有不同的基因背景可能是造成EGFR 19-del和L858R突变型NSCLC患者预后不一致的原因。当然,也有可能是因为研究对象的数量不足或者研究对象的治疗方法不一致及统计方法不一致引起的差异。接下来应该更深入地探索这两种突变在汉族和壮族患者中预后差异的原因。
[1] Torre LA, Bray F, Siegel RL, et al. Global Cancer Statistics, 2012 [J]. Ca Cancer J Clin, 2015,65(2):87-108.
[2] He YY, Zhang XC, Yang JJ, et al. Prognostic significance of genotype and number of metastatic sites in advanced non-small-cell lung cancer [J]. Clinlung Cancer, 2014,15(6):441-447.
[3] Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009 [J].Ca-Cancer J Clin, 2009, 59(4):225-249.
[4] Ettinger DS, Wood DE, Akerley W, et al. Non-small cell lung cancer, version 1.2015 [J]. JNCCN, 2014,12(12):1738-1761.
[5] Kuiper JL, Heideman DA, Würdinger T, et al. Rationale and study design of the IRENE-trial (NVALT-16): a phase Ⅱ trial to evaluate iressa rechallenge in advanced NSCLC patients with an activating EGFR mutation who responded to an EGFR-TKI used as first-line or previous treatment [J]. Clin Lung Cancer, 2015,16(1):60-66.
[6] Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib [J]. N Engl J Med, 2004,350(21):2129-2139.
[7] Paez JG, Janne PA, Lee JC, et al. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy[J]. Science, 2004,304(5676):1497-1500.
[8] Jackman DM, Yeap BY, et al. Phase Ⅱ clinical trial of chemotherapy-naive patients > or=70 years of age treated with erlotinib for advanced non-small-cell lung cancer [J]. J Clin Oncol, 2007,25(7):760-766.
[9] Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med, 2010,362(25):2380-2388.
[10] Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial[J]. Lancet Oncol, 2012,13(3):239-246.
[11] Gahr S, Stoehr R, Geissinger E, et al. EGFR mutational status in a large series of Caucasian European NSCLC patients: data from daily practice [J]. Br J Cancer, 2013,109(7):1821-1828.
[12] Gao B, Sun Y, Zhang J, et al. Spectrum of LKB1, EGFR, and KRAS mutations in chinese lung adenocarcinomas[J]. J Thorac Oncol, 2010,5(8):1130-1135.
[13] Jackman DM, Miller VA, Cioffredi LA, et al. Impact of epidermal growth factor receptor and KRAS mutations on clinical outcomes in previously untreated non-small cell lung cancer patients: results of an online tumor registry of clinical trials[J].Clin Cancer Res, 2009,15(16):5267-5273.
[14] Won YW, Han JY, Lee GK, et al. Comparison of clinical outcome of patients with non-small-cell lung cancer harbouring epidermal growth factor receptor exon 19 or exon 21 mutations[J]. J Clin Pathol, 2011,64(11):947-952.
[15] Zhu JQ, Zhong WZ, Zhang GC, et al. Better survival with EGFR exon 19 than exon 21 mutations in gefitinib-treated non-small cell lung cancer patients is due to differential inhibition of downstream signals[J]. Cancer Lett, 2008,265(2):307-317.
Comparison of prognosis between EGFR 19-del and L858R mutations in patients with non-small-cell lung cancer
WEIWen′e,LIJilin,NINGShufang,LIUHaizhou,CAIZhengmin,ZHANGLitu
(TheAffiliatedTumorHospitalofGuangxiMedicalUniversity,Nanning530021,China)
ObjectiveTo compare the prognosis between the epidermal growth factor receptor (EGFR) exon 19 (19-del) mutation and exon 21 L858R (L858R) mutation in patients with non-small-cell lung cancer (NSCLC). MethodsTotally 257 cases of NSCLC patients were selected. The fresh tissues or paraffin embedding tissues were obtained, and the EGFR genotypes were detected by ARMS-PCR. Meanwhile, we collected the clinical data, and the patients were followed up by using the death as the end. Patients without follow-up or the patients who did not have the outcome until the end of the follow-up were all brought into the censored data. All data were analyzed by SPSS17.0 software. ResultsThere were 134 cases with 19-del mutation and 123 cases with L858R mutation in 257 patients. No significant difference was found in the distribution of clinical characteristic between the two groups (P>0.05). The survival analysis showed that the median survival time of 19-del mutation was 798 d and that of L858R mutation was 710 d, and the overall survival time had no statistical difference in these two groups (P>0.05). Subsequently, the result from the stratified analysis revealed that the prognosis in patients with 19-del mutation was better than that of L858R mutation in Han nationality (P=0.047), and no significant difference was found in Zhuang nationality (P>0.05). Meanwhile, the overall survival time showed no statistically difference in age, gender, TNM stages and clinical stages between 19-del and L858R mutations (allP>0.05). ConclusionThe overall survival time is the same between NSCLC patients with 19-del mutation and with L858R mutation, but the prognosis of patients with 19-del mutation is better than that of L858R mutation in Han nationality.
lung carcinoma; epidermal growth factor receptor mutation; exon 19 mutation; exon 21 L858R mutation; prognostic analysis
广西科学研究与技术开发计划基金资助项目(桂科攻1298003-2-8;桂科攻1355005-3-10)。
韦文娥(1987-),女,硕士研究生,研究方向为肿瘤分子诊断。E-mail:weiwenehappy@163.com
简介:张力图(1966-) ,男,主任技师,研究方向为肿瘤分子诊断。E-mail:zhanglitu@gmail.com
10.3969/j.issn.1002-266X.2016.17.007
R734.2
A
1002-266X(2016)17-0022-04
2016-01-08)
