氮、磷养分添加对高寒草甸土壤酶活性的影响
2016-09-05孙亚男李以康杜岩功曹广民中国科学院西北高原生物研究所青海西宁80008中国科学院大学北京00049
孙亚男,李 茜,李以康,林 丽,杜岩功,曹广民*(.中国科学院西北高原生物研究所,青海西宁80008;2.中国科学院大学,北京00049)
氮、磷养分添加对高寒草甸土壤酶活性的影响
孙亚男1,2,李茜1,李以康1,2,林丽1,杜岩功1,曹广民1*
(1.中国科学院西北高原生物研究所,青海西宁810008;2.中国科学院大学,北京100049)
本试验以典型的青藏高原高寒矮嵩草草甸(Kobresia humilis meadow)为研究平台,以表征土壤碳、氮、磷、硫养分循环的6种土壤酶为研究对象,研究土壤酶以及土壤速效养分在4年氮、磷养分添加的累积效应下的变化规律,分析和评价氮、磷养分添加对土壤养分循环方面的影响。试验结果为:氮、磷养分添加改变了土壤中速效养分的含量;氮添加与0~10 cm土层中的碱性磷酸酶活性有正效应,磷添加抑制了0~10 cm土层中的碱性磷酸酶活性;氮、磷养分添加均抑制了0~10 cm土层中的脲酶活性;氮添加抑制了2个土层中的纤维素酶活性;芳基硫酸酯酶活性和蔗糖酶活性没有表现出显著差异性;10~20 cm土层中的几丁质酶活性在氮、磷养分添加处理下均增强,其中磷添加对几丁质酶活性的增幅最显著。结果表明:外源添加的氮在调控磷的矿化方面有促进作用,磷的添加对氮素的释放也有一定的作用;青藏高原高寒草甸受磷限制的程度可能更大。
青藏高原高寒草甸;土壤酶活性;速效磷;碱解氮;养分循环;磷限制
http://cyxb.lzu.edu.cn
孙亚男,李茜,李以康,林丽,杜岩功,曹广民.氮、磷养分添加对高寒草甸土壤酶活性的影响.草业学报,2016,25(2):18-26.
SUN Ya-Nan,LI Qian,LI Yi-Kang,LIN Li,DU Yan-Gong,CAO Guang-Min.The effect of nitrogen and phosphorus applications on soil enzyme activities in Qinghai-Tibetan alpine meadows.Acta Prataculturae Sinica,2016,25(2):18-26.
土壤酶是积累于土壤中,在胞外发生作用的酶的总称,包括存在于活细胞内的胞内酶和存在于土壤溶液中或者吸附在土壤颗粒表面的胞外酶。其主要来源于土壤微生物的活动、植物根系分泌物和动、植物残体分解过程中释放的酶[1-2]。土壤酶在催化对生命过程很重要的反应网、分解有机物、养分循环、有机质的形成、土壤结构的塑造等方面有着重要的作用[3]。在区域或者微环境尺度上测得土壤酶活性可以反映土壤对环境变化的迅速响应,也可以用于生态系统生物地球化学循环模型[4]。土壤酶被认为是由耕作、施肥等土壤管理方式导致的土壤特性发生变化的早期很重要的指示因子[5-6],可以作为指示土壤生态胁迫以及土壤生态修复的敏感的重要指标[7]。土壤中几乎所有的生物化学反应都是由土壤酶驱动的,碳、氮、磷、硫等养分的周转中均有各种不同功能的酶进行调控[8-9]。测定方法成熟的酶包括脱氢酶、葡萄糖苷酶、脲酶、酰胺酶、磷酸酶、芳基硫酸酯酶、纤维素酶等[1,10]。
在不同生态系统中进行养分添加试验,以土壤酶活性为研究内容的研究,在农田生态系统较多、研究内容也较全面。王俊华等[11]研究在区域尺度上以不同种类的养分(氮、磷、钾、有机肥、微肥等)进行添加;Guo等[12]以无机氮(铵、硝酸盐)、有机氮(尿素、氨基酸、脂肪酸等)等不同形式的氮肥添加;万忠梅等[13],Edwards等[14],曾艳等[15]的研究以设置不同浓度梯度的养分添加等内容来研究土壤酶活性的变化规律。近些年来,在森林和草原生态系统中考察养分添加对土壤酶活性的影响,研究较多的是不同水平的氮沉降[16-17]、氮和水添加试验[18]、模拟增温和养分添加试验[19]等对土壤酶活性的影响。在青藏高原上用酶化学的手段测定土壤酶活性,研究土壤养分循环,还需要进行大量的研究工作。
青藏高原高寒草甸土壤中碳、氮、磷总量丰富,但是由于该生态系统养分的有效性受到低温的限制,其中植物可利用的氮的释放对温度尤其敏感[20-21]。作为生态系统普遍受限制的养分,氮、磷的有效性会限制初级生产力和分解等生态学过程,研究二者之间的相互关系很有必要,氮磷限制在全球尺度上仍然缺乏深入的研究[22]。土壤酶是受许多相互作用的因子调控的,土壤酶活性直接反映着土壤中养分的供需关系[23],因此,土壤酶是用来考察由环境改变导致土壤生物化学循环改变的一个很好的工具。本试验就是在氮、磷养分添加背景下,着眼于地下,选择6种典型的土壤酶(碱性磷酸酶、脲酶、几丁质酶、芳基硫酸酯酶、纤维素酶、蔗糖酶)为研究对象,通过探讨养分添加对土壤酶的影响,分析土壤中养分的变化规律,为青藏高原高寒草甸土壤受氮、磷限制程度的问题提供新的证据,同时为科学合理地管理高寒草甸提供理论依据。
1 材料与方法
1.1研究区概况
本试验是在青海海北高寒草地生态系统国家野外科学观测研究站(简称海北站)进行的。海北站的地理范围是:纬度37°29′-37°45′N,经度101°12′-101°23′E。山地海拔约4000 m,谷区海拔约2900~3600 m。海北站的气候是由西伯利亚的东南季风和高气压带主导的,属于大陆季风气候,其冬季漫长而寒冷,夏季短暂而凉爽。全年平均气温是-1.11℃(1981-2013年),冬季高原地区的平均温度可以下降至-15~-20℃,夏季的最暖月(7月)在山谷的平均温度是14~22℃,高原的平均温度是4~10℃,其中极端高温达到27.6℃,极端低温有-37.1℃。平均年降水范围在516.8 mm(1981-2013年),其中80%的降水是来自夏季短暂的生长季节(5-9月)。平均年日照时间为2462.7 h,占到总的有效辐射的60.1%。海北站区的土壤类型主要是由高寒灌丛土、高寒草甸土、沼泽土等组成,主要特点是氮、磷、钾、有机质总量丰富,土壤发育年轻、土层薄、土表覆盖有较厚的草毡层。海北高寒草地的土壤中氮、磷主要存在于矿化过程弱的有机质阶段,其有效成分往往很低,无法满足地上植物的生长所需[24]。该试验研究于2011年5月选择位于海北站东北处大约2 km的一片地势较平整的草场作为养分添加试验样地。该试验样地区的草地类型属于耐寒中生植物高寒矮生嵩草(Kobresia humilis)草甸。
1.2试验设计
该试验设计类型属于完全随机区组试验设计,共4个处理,分别为:氮添加(N)、磷添加(P)、氮和磷混合添加(NP)、对照(CK)。4个处理随机安排在6个小区内,即每个处理6次重复,共计24个小样方,每个样方面积是6 m×6 m,各样方之间设置保护行。其中,N肥以尿素形式、100 kg/(hm2·年)的量进行添加;P肥以重过磷酸钙的形式、50 kg/(hm2·年)的量进行添加;NP是以上述N肥和P肥混合添加;CK为无养分添加。施肥时间选择在植物生长季的中期,雨天或晴天的傍晚进行。将肥料用手均匀地撒在对应的各个小区内,雨水或次日形成的露水使得肥料迅速溶解进入土壤,为保证施肥的均匀性,每个小区撒2次肥。实验期间,养分添加日期是从2011-2014年,每一年的6月1日、7月1日和8月1日进行。
1.3样品采集
土壤样品采集工作于2014年8月12日进行,取0~10cm和10~20cm两个层次的土壤。各养分添加处理小区随机选择4个点取样,混合制样。将取得的土壤样品分装入已编号的自封袋中,密封好置于盛有冰块的塑料泡沫箱中,带回实验室。土样分两种处理方式:一种是鲜土,过2 mm筛,置于4℃冰箱中,人工除去石块、草根等杂物,用于尽快测定含水量和酶活性,另一种是风干土,用来测定土壤速效磷和碱解氮含量。
1.4土壤酶活性的测定方法
该试验中土壤酶活性的测定原理均是向标准定量化的土壤样品中加入已知浓度的特定的基质,培养一段时间后,测定终产物的生成量[25]。土壤碱性磷酸酶活性的测定采用磷酸苯二钠比色法[1],以磷酸苯二钠为基质,在磷酸酶作用下,恒温箱中37℃下培养2h,测定生成苯酚的量;土壤脲酶的测定采用靛酚蓝比色法[1],以尿素为基质,恒温箱中37℃下培养24h,测定NH4+与次氯酸盐和苯酚反应,生成水溶性靛酚蓝的含量;土壤纤维素酶的测定采用3,5-二硝基水杨酸比色法[1],以羧甲基纤维素溶液为基质,恒温箱中37℃下培养72h,测定生成的还原糖;土壤芳基硫酸酯酶的测定采用对硝基酚硫酸盐比色法[26],以对硝基酚硫酸钾为基质,恒温箱中37℃下培养2 h,测定水解产生的对硝基酚含量;土壤几丁质酶的测定采用对二甲氨基苯甲醛法(DMAB)比色法[27-28]测定,以几丁质为基质,恒温箱中37℃下培养18h,测定几丁质水解产生的N-乙酰葡萄糖胺的含量,用来表示几丁质酶活性;土壤蔗糖酶的测定采用3,5-二硝基水杨酸比色法[1],以蔗糖为基质,恒温箱中37℃下培养24h,测定还原糖的含量。
1.5土壤速效养分的测定
风干土样用来测定速效磷和碱解氮的含量,速效磷的测定方法是采用0.5mol/L Na HCO3浸提、钼锑抗比色法测定[28];碱解氮的测定方法是用扩散皿进行碱解扩散、H2SO4滴定法[29]测定其含量。
1.6统计分析方法
该研究中随机区组试验设计的统计分析方法视为两因素方差分析(two way-ANOVA),用R 3.1.3软件对所测定的数据依次做正态性检验、方差齐性检验以及在P≤0.05水平下,对不同施肥处理下的各项酶活性等指标进行均值的Tukey HSD多重比较差异性分析,速效养分和土壤酶活性之间的相关关系采用的是Pearson相关性分析。绘图工具使用的是Origin 8.5。
2 结果与分析
2.1氮、磷养分添加对土壤酶活性的影响
2.1.1土壤碱性磷酸酶活性土壤中的磷酸酶是用来描述磷酸酯类和酸酐类水解作用的一类酶的总称,主要表征的是土壤中磷的状况[1]。青藏高原高寒草甸的土壤呈碱性,该试验测定的是碱性磷酸酶活性。如图1所示,外源增加N对0~10cm土层中的碱性磷酸酶的发生有正效应。单施N肥有增强0~10cm土层中碱性磷酸酶活性的趋势,与CK相比,增加幅度为13.19%,但是差异不显著。磷的添加对0~10cm土层中的碱性磷酸酶活性表现出了明显的抑制作用。NP混合施用和单施P肥后,0~10cm土层中的碱性磷酸酶活性显著降低,与CK相比,碱性磷酸酶活性的降低幅度分别达到6.94%和40.00%。土壤中的碱性磷酸酶活性呈现出随土层深度增加而降低的规律,0~10cm土层的碱性磷酸酶活性均高于10~20cm土层中的酶活性。各个养分添加处理下的碱性磷酸酶含量在10~20cm土层中没有表现出显著差异性。
2.1.2土壤脲酶活性土壤中脲酶的酶促反应产生的氨是植物生长所需的重要氮源之一。脲酶的专性较强,它可以酶促尿素水解生成氨、二氧化碳和水。因此,在尿素的水解与脲酶密切相关[1]。如图2,0~10cm土层中的脲酶活性在氮、磷养分添加处理下均受到抑制,其中单施P和NP混合施用的抑制作用最显著。0~10cm土层中,N、P、NP与CK相比,降幅分别为57.02%、79.05%和69.73%。土层中的脲酶活性呈现出随土层深度增加而降低的规律。10~20cm土层中的脲酶活性在氮、磷养分添加处理下没有表现出显著性差异。

图1 不同养分添加处理后碱性磷酸酶的活性Fig.1 The phosphatase activities in soils under N and P addition
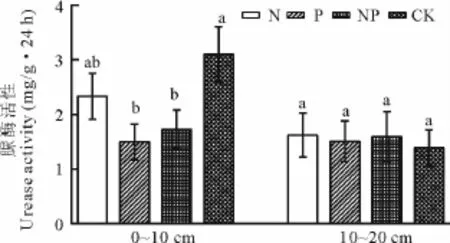
图2 不同养分添加处理后脲酶的活性Fig.2 The urease activities in soils under N and P addition
2.1.3土壤纤维素酶的活性纤维素是植物残体进入土壤的碳水化合物的重要组分之一。土壤纤维素酶是碳素循环过程中一个很重要的酶[30]。该试验的结果如图3,0~10cm土层中,单施N对纤维素酶表现出了明显的抑制作用。单施N和NP混合与CK相比,土壤纤维素酶活性的降低幅度分别为46.53%和29.85%。单施P肥对0~10cm土层中的纤维素酶活性有一定的积极作用,但是效果不显著。土壤中的纤维素酶活性呈现出随土层深度增加而降低的规律,0~10cm土层的纤维素酶活性均高于10~20cm土层中的酶活性。在10~20cm土层中,单施N肥的累积效应使得土壤纤维素酶的活性明显降低,与CK相比,降幅达到了64.92%。10~20cm土层中的土壤纤维素酶活性在单施N肥与NP混合添加之间差异显著,NP混合添加对纤维素酶活性有一定的促进作用,但是差异不显著,可能是较深层土壤受氮、磷养分限制的程度较大。
2.1.4土壤芳基硫酸酯酶的活性土壤中的芳基硫酸酯酶在硫的循环和周转中有着重要的作用,可以在早期指示土壤中硫化物的缺乏[25]。试验结果如图4所示,土壤中的芳基硫酸酯酶活性随土层深度的增加而降低。在0~10 cm和10~20 cm土层中,芳基硫酸酯酶活性在各个养分添加处理之间都没有表现出显著性差异(P>0.05)。氮、磷养分添加在该试验中没有影响到土壤中硫的养分状况。

图3 不同养分添加处理后纤维素酶的活性Fig.3 The cellulase activities in soils under N and P addition
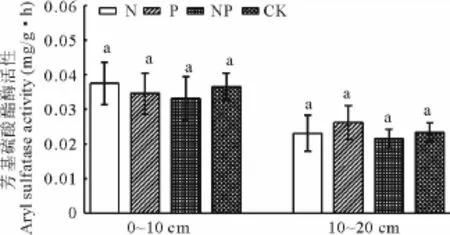
图4 不同养分添加处理后芳基硫酸酯酶的活性Fig.4 The aryl sulfatase activities in soils under N and P addition
2.1.5土壤几丁质酶的活性几丁质酶是几丁质分解主要途径中的至关重要的一类酶。几丁质酶水解几丁质的糖苷键,释放包括有机氮在内的更小的氮,最终被矿化为无机氮。几丁质代表了土壤中有机氮的一种重要形式[31]。如图5,该试验中测得的几丁质酶活性在10~20cm土层中均高于0~10cm土层中的几丁质酶活性。氮、磷养分添加不同程度地增强了几丁质酶活性,但是0~10cm土层中几丁质酶活性在各个养分添加处理之间没有表现出显著性差异。0~10cm土层中,N与CK相比,几丁质酶活性增幅达到95.73%(P=0.069)。10~20cm土层中,氮、磷养分添加均促进了几丁质酶活性,其中,P的添加与CK相比,差异极显著(P<0.01),几丁质酶的增加幅度为84.11%。说明磷的添加更有利于高寒草甸有机氮的释放。
2.1.6土壤蔗糖酶活性土壤蔗糖酶对增加土壤中的易溶性营养物起着重要作用。蔗糖酶活性不仅能够表征土壤的生物学活性强度,也可以作为评价土壤质量的一个很好的指标[1-2]。如图6,蔗糖酶活性随土层深度的增加而降低。0~10cm和10~20cm土层中的蔗糖酶活性在各个养分添加处理之间没有表现出显著差异性。

图5 不同养分添加处理后几丁质酶的活性Fig.5 The chitinase activities in soils under N and P addition

图6 不同养分添加处理后蔗糖酶的活性Fig.6 The sucrase activities in soils under N and P addition
2.2氮、磷养分添加背景下土壤速效养分的变化规律
2.2.1土壤速效磷含量的变化规律土壤中的速效磷是植物可以吸收利用的磷,来自有机磷的矿化和无机磷的释放[32]。对速效磷含量的测定结果如表1所示,0~10 cm土层中的速效磷含量均高于10~20cm土层中的速效磷含量。2个土层经养分添加处理后,NP和P添加的样方内速效磷含量显著提高,NP和P之间的差异极显著(P<0.01)。说明氮、磷养分添加显著增加了高寒草甸土壤速效磷的含量,氮、磷混合添加对速效磷的促进作用优于单独添加磷的作用。
表1 不同养分添加处理下速效磷和碱解氮(平均值±标准误)Table1 Available phosphorus and available nitrogen contents under different treatments

表1 不同养分添加处理下速效磷和碱解氮(平均值±标准误)Table1 Available phosphorus and available nitrogen contents under different treatments
注:小写字母表示处理间的差异显著性(P<0.05)。Notes:Different lowercase letters indicate significant difference among treatments(P<0.05).
氮磷养分添加处理N,P nutrient addition treatment NP CK速效磷Available P(mg/kg)0~10 6.95±0.30c 36.35±2.96b 47.57±1.81a 6.20±速效养分Available nutrient土层深度Soil depth(cm)N P 0.37c 10~20 3.48±0.38b 5.89±0.69a 7.70±0.79a 3.47±0.38b碱解氮Alkaline-N(mg/kg)0~10 62.70±1.76a 53.75±1.04b 56.17±1.59b 57.5 1±1.67b 8±1.28ab 10~20 43.54±1.11a 42.62±1.34a 41.28±0.92a 35.9
2.2.2土壤碱解氮的变化规律土壤中碱解氮的含量可以较好地反映近期土壤氮素的养分状况、氮素释放的速率,碱解氮是植物可以直接利用的有效态氮[33]。试验结果见表1所示,0~10cm和10~20cm两个土层中,单施N肥的样方内碱解氮含量最高,但是0~10cm和10~20cm土层中的碱解氮含量在各个施肥处理之间的差异性不同。0~10cm土层中,单独添加N对碱解氮的促进效应最明显,单施P和NP混合添加对碱解氮含量没有表现出促进作用。10~20cm土层中,氮、磷养分添加处理与CK相比,均显著提高了碱解氮的含量。
2.3土壤速效养分与土壤酶活性的相关关系
如表2,土壤中的速效磷含量和碱性磷酸酶活性在0~10cm土层中呈现出一定的负相关关系(R2=-0.51,P<0.05)。0~10cm土层中的速效磷含量和脲酶活性也呈显著负相关(R2=-0.61,P<0.05)。在10~20cm土层中,速效磷含量和芳基硫酸酯酶活性呈极显著正相关(R2=0.69,P<0.01)。0~10 cm和10~20cm土层中的碱解氮含量和6种土壤酶之间的相关关系均不显著。从总体上看,磷的添加对土壤酶活性的影响较大。
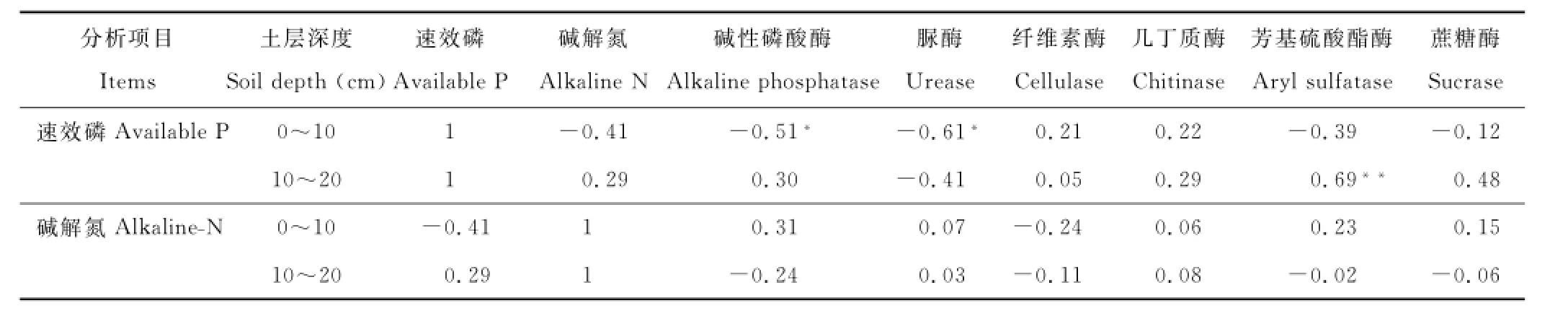
表2 土壤速效养分与土壤酶活性的相关关系Table2 The relationship of soil available nutrients and soil enzyme activities
3 讨论与结论
养分添加可以改变胞外酶的潜在活性,土壤酶活性的改变对于土壤有机质降解和植物残体的分解过程又是至关重要的[34]。但是土壤受多种生态因子的影响[21,35],具有极大的复杂性和不确定性。因此,在4年氮、磷养分添加试验的累积效应下,养分添加与土壤酶活性有着较复杂的效应。
某种特定养分的供应不仅会影响与之相关的特定的酶来矿化同种养分,而且还会矿化其他养分,即一种养分的供应在调控另一种养分的矿化方面发挥着一定的作用。试验表明,氮肥与0~10 cm土层中的碱性磷酸酶活性之间有着正效应,该结果同Moorhead和Sinsabaugh[36]的研究结果一致,说明氮的供应对表层土壤中碱性磷酸酶水解磷脂、释放有机磷、无机磷的矿化等过程有积极作用。磷肥与10~20 cm土层中的几丁质酶活性之间也是正效应,此结果与Olander和Vitousek[31]的研究结果类似。氮、磷混合施用促进速效磷的释放,磷的添加促进了10~20 cm土层中碱解氮的释放。
一些研究指出,土壤酶活性和养分有效性之间存在着负反馈作用[29,37-38],土壤酶活性高低是和生物对特定养分的需求相联系的。该试验中,0~10 cm土层中的速效磷含量和碱性磷酸酶活性之间存在显著的负相关关系;氮、磷添加对0~10 cm土层中的脲酶有抑制作用,其中,在0~10 cm土层中,速效磷含量和脲酶活性之间存在着极显著的负相关关系;氮、磷添加对10~20 cm土层中的几丁质酶有促进作用(P添加的增幅最显著)。
该试验中测得的芳基硫酸酯酶活性和蔗糖酶活性没有表现出一定的变化规律,其原因较为复杂。Jason等[39]的研究证明了近十年的施氮肥试验,平均有72 g/(m2·年)的多余的碳被输入到施氮肥的区域。该试验中添加的氮肥是尿素,其成分中有碳的存在,引入土壤的多余的碳可能会对蔗糖酶活性和纤维素酶活性有一定的影响。该试验中,氮添加就对2个土层中的纤维素酶活性有明显的抑制作用。胡雷等[40]的研究指出,蔗糖酶活性是由一系列复杂的影响因子(土壤的有机质、氮、磷含量、微生物数量及土壤呼吸强度等因素)的影响。Olander 和Vitousek[31]的研究指出,土壤酶会被土壤中的有机质和土壤黏粒固定,在固定和降解过程中十分稳定,因此某些养分循环变化可能被掩盖了。此外,也有可能是由于高寒草甸生态系统具有自我平衡的功能,适应了外源N、P的输入[41-42]。
土壤速效磷的含量在磷添加后显著增加,氮磷混合施用的促进作用在0~10 cm和10~20 cm土层中都是最明显的。说明氮磷混合添加后,氮对速效磷的释放发挥着积极的作用。养分添加对0~10 cm土层中的土壤碱解氮含量的增加没有显著的促进作用,但是对10~20 cm土层中的碱解氮含量有显著的促进作用。说明了高寒草甸土壤同时受到氮和磷的限制,尤其是较深土层同时受氮和磷限制的程度更大。
由6种土壤酶活性和土壤碱解氮、速效磷的变化规律,做出推测,土壤中的磷有可能是比氮更重要的养分限制因子,青藏高原高寒草甸的土壤受磷的限制程度可能更高。这一结果与杨晓霞等[42]在氮、磷养分添加处理下对植物群落地上、地下、总生物量的测定做出的推测结果较一致。在下一步的研究中,对氮、磷的添加剂量将设置浓度梯度,则反映的科学问题会更加严谨,更有助于为科学合理的管理青藏高原高寒草甸提供理论依据。
References:
[1]Guan S Y.Soil Enzymology and Research Method[M].Beijing:Agricultural Press,1986:274-323.
[2]Lin X G.Principle and Method of Soil Microbiology Research[M].Beijing:Higher Education Press,2010:243-265.
[3]Dick R P.Soil enzyme activities as integrative indicators of soil health.In:Pankhurst C E,Doube B M,Gupta V V S R.Biological Indicators of Soil Health[M].Wellingford:CABI,1997:121-156.
[4]Mc Laren A D.Soil as a system of humus and clay immobilized enzymes.Chemica Scripta,1975,8(3):97-99.
[5]Sinsabaugh R L,Antibus R K,Linkins A E.An enzymic approach to the analysis of microbial activity during plant litter decomposition.Agriculture Ecosystems and Environment,1991,34(1-4):43-54.
[6]Lu H,Yao T,Li J H,et al.Vegetation and soil microorganism characteristics of degraded grasslands.Acta Prataculturae Sinica,2015,24(5):34-43.
[7]Garcia C,Hernándes T.Biological and biochemical indicators in derelict soils subject to erosion.Soil Biology and Biochemistry,1997,29(2):171-177.
[8]Dick R P.Soil enzyme activity as an indicator of soil quality.In:Doran J W(eds).Defining Soil Quality for a Sustainable Environment[M].Madison:WI,1994:107-124.
[9]Moorhead D L,Sinsabaugh R L.Simulated patterns of litter decay predict patterns of extracellular enzyme activities.Applied Soil Ecology,2000,14(1):71-79.
[10]Acosta-Martinez V,Tabatabai M A.Enzyme activity in a liming agricultural.Biology and Fertility of Soils,2000,31(1):85-91.
[11]Wang J H,Yin R,Zhang H Y,et al.Changes in soil enzyme activities,microbial biomass,and soil nutrient status in response to fertilization regimes in a long-term field experiment.Ecology and Environment,2007,16(1):191-196.
[12]Guo P,Wang C Y,Jia Y,et al.Responses of soil microbial biomass and enzymatic activities to fertilizations of mixed inorganic and organic nitrogen at a subtropical forest in East China.Plant and Soil,2011,338(1-2):355-366.
[13]Wan Z M,Song CC,Liu D Y.The enzyme activity of Calamagrostisangustifolia litter decomposition affected by exogenous nitrogen input in a freshwater marsh.Acta Scientiae Circumstantiae,2009,29(9):1830-1835.
定理 若函数y=f(x)在区间[a,b]上的图象是一条不间断的曲线,且f(a)·f(b)<0,则函数y=f(x)在区间(a,b)上有零点.
[14]Edwards I P,Zak D R,Kellner H,et al.Simulated atmospheric N deposition alters fungal community composition and suppresses ligninolytic gene expression in a northern hardwood forest.Plos One,2011,6(6):e20421.
[15]Zeng Y,Zhou L Q,Huang M F,et al.Effects of nitrogen fertilization on enzyme activities in surface layer of red soil under mulberry cultivation.Acta Ecologica Sinica,2014,34(18):5306-5310.
[16]Andersson M,Kjoller A,Struwe S.Microbial enzyme activities in leaf litter,humus and mineral soil layers of European forests.Soil Biology and Biochemistry,2004,36(10):1527-1537.
[17]Hobbie S E.Interactions between litter lignin and soil nitrogen availability during leaf litter decomposition in a Hawaiian montane forest.Ecosystems,2000,3(5):484-494.
[18]Wang R Z,Dorodnikov M,Yang S,et al.Response of enzymatic activities within soil aggregates to 9-year nitrogen and water addition in a semi-arid grassland.Soil Biology and Biochemistry,2015,81(2):359-367.
[19]Liu L,Zhu X,Sun G,et al.Effects of simulated warming and fertilization on activities of soil enzymes in alpine meadow. Pratacultural Science,2011,28(8):1405-1410.
[20]Zhou X M.Chinese Kobresia Meadows[M].Beijing:Science Press,2001.
[21]Dessureault-RompréJ,Zebarth B J,Georgallas A,et al.Temperature dependence of soil nitrogen mineralization rate:Comparison of mathematical models,reference temperatures and origin of soils.Geoderma,2010,157(3-4):97-108.
[23]James T W,Rien A,George A K,et al.Enzymology under global change:organic nitrogen turnover in alpine and sub-Arcticsoils.Biochemical Society Transactions,2011,39(1):309-314.
[24]Zhao X Q,Zhou X M.Ecological basis of alpine meadow ecosystem management in the Tibet:experiences and approaches from Haibei Alpine meadow ecosystem research station.Ambio,1999,28(8):642-647.
[25]Tabatabai M A.Soil enzymes.In:Mickelson S H(ed).Methods of soil analysis,Part 2.Microbiological and Biochemical Properties[M].Madison:Soil Science Society of America,WI,1994:775-833.
[26]Tabatabai M A,Bremner J M.Arylsulfatase activity of soils.Proceedings Soil Science Society of America,1970,34(2):225-229.
[27]Rodriguez-Kabana R,Godoy G,Morgan-Jones G,et al.The determination of soil chitinase activity:Conditions for assay and ecological studies.Plant and Soil,1983,75(1):95-106.
[28]Gu X Y,Hu Z J.A method of determining the activity of soil chitinase.Chinese Journal of Soil Science,1994,25(6):284-285.
[29]Bao S D.Soil Agricultural Chemistry Analysis[M].Beijing:China Agriculture Press,1998:56-83.
[30]White A R.Visualization of cellulases and cellulose degradation.In:Brown R M(ed).Cellulose and other Natural Polymer Systems:Biogenesis,Structure,and Degradation[M].New York:Plenum Press,1982:489-509.
[31]Olander L P,Vitousek P M.Regulation of soil phosphatase and chitinase activity by N and P availability.Biogeochemistry,2000,49(2):175-190.
[32]Wang C T,Long R J,Wang Q J,et al.Distribution of organic matter,nitrogen and phosphorus along an altitude gradient and productivity change and their relationships with environmental factors in the alpine meadow.Acta Prataculturae Sinica,2005,14(4):15-20.
[33]Sun Z G,Liu J S,Yu J B.Seasonal change characteristics of alkaline hydrolysis nitrogen and total nitrogen in typical calamagrostis angustifolia wetland soils of Sanjiang Plain.Journal of Arid Land Resources and Environment,2008,23(8):145-149.
[34]Sinsabaugh R L,Carreiro M M,Repert D A.Allocation of extracellular enzymatic activity in relation to litter composition,N deposition,and mass loss.Biogeochemistry,2002,60(1):1-24.
[35]Burns R G.Enzyme activity in soil:location and possible role in microbial ecology.Soil Biology and Biochemistry,1982,14(5):423-427.
[36]Moorhead D L,Sinsabaugh R L.A theoretical model of litter decay and microbial interaction.Ecological Monographs,2006,76(2):151-174.
[37]McGill W B,Cole C V.Comparative aspects of cycling of organic C,N,S,and P through soil organic matter.Geoderma,1981,26(4):267-286.
[38]Wright A L,Reddy K R.Phosphorus loading effects on extracellular enzyme activity in Everglades Wetland soils.Soil Science Society of America,2001,65(2):588-595.
[39]Jason C N,Alan R T,Gerd G,et al.Variable effects of nitrogen addition on the stability and turnover of soil carbon.Nature,2002,419(10):915-917.
[40]Hu L,Wang C T,Wang G X,et al.Changes in the activities of soil enzymes and microbial community structure at different degradation successional stages of alpine meadows in the headwater region of Three Rivers,China.Acta Prataculterae Sinica,2014,23(3):8-19.
[41]Hobbie S H,Vitousek P M.Nutrient limitation of decomposition in Hawaiian forests.Ecology,2000,81(7):1867-1877.
[42]Yang X X,Ren F,Zhou H K,et al.Responses of plant community biomass to nitrogen and phosphorus additions in an alpine meadow on the Qinghai-Xizang Plateau.Chinese Journal of Plant Ecology,2014,38(2):159-166.
[1]关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
[2]林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010.
[6]卢虎,姚拓,李建宏,等.高寒地区不同退化草地植被和土壤微生物特性及其相关性研究.草业学报,2015,24(5):34-43.
[11]王俊华,尹睿,张华勇,等.长期定位施肥对农田土壤酶活性及其相关因素的影响.生态环境,2007,16(1):191-196.
[13]万忠梅,宋长春,刘德燕.氮输入对沼泽湿地小叶章枯落物分解过程中酶活性的影响.环境科学学报,2009,29(9):1830-1835.
[15]曾艳,周柳强,黄美福,等.不同施氮量对桑园红壤耕层酶活性的影响.生态学报,2014,34(18):5306-5310.
[19]刘琳,朱霞,孙庚,等.模拟增温与施肥对高寒草甸土壤酶活性的影响.草业科学,2011,28(8):1405-1410.
[20]周兴民.中国嵩草草甸[M].北京:科学出版社,2001.
[22]王绍强,于贵瑞.生态系统碳氮磷元素的生态化学计量学特征.生态学报,2008,28(8):3937-3947.
[28]顾向阳,胡正嘉.一种测定土壤几丁质酶活性的方法.土壤通报,1994,25(6):284-285.
[29]鲍士旦.土壤农化分析[M].北京:中国农业出版社,1998.
[32]王长庭,龙瑞军,王启基,等.高寒草甸不同海拔梯度土壤有机质、氮磷分布和生产力变化及其与环境因子的关系.草业学报,2005,14(4):15-20.
[33]孙志高,刘景双,于君宝.三江平原小叶章湿地土壤中碱解氮和全氮含量的季节变化特征.干旱区资源与环境,2009,23(8):145-149.
[40]胡雷,王长庭,王根绪,等.三江源不同退化演替阶段高寒草甸土壤酶活性和微生物群落结构的变化.草业学报,2014,23(3):8-19.
[42]杨晓霞,任飞,周华坤,等.青藏高原高寒草甸植物群落生物量对氮、磷添加的响应.植物生态学报,2014,38(2):159-166.
The effect of nitrogen and phosphorus applications on soil enzyme activities in Qinghai—Tibetan alpine meadows
SUN Ya-Nan1,2,LI Qian1,LI Yi-Kang1,2,LIN Li1,DU Yan-Gong1,CAO Guang-Min1*
1.Northwest Institute of Plateau Biology,Chinese Academy of Sciences,Xining 810008,China;2.University of Chinese Academy of Sciences,Beijing 100049,China
This study investigates the effect of nitrogen and phosphorus applications on soil nutrient cycles,focusing on soil enzyme activities in particular.Enzyme activities and available nutrients have been measured in plots of Qinghai-Tibetan alpine meadow with 4 years of N and P fertilizer application.The study focuses on six soil enzyme activities that represent several significant nutrient cycles(C,N,P,S).The results showed that the contents of available phosphorus and alkaline nitrogen increased under the different treatments.The activities of alkaline phosphatase,urease,chitinase and cellulase vary significantly under the different treatments,while there is no significant difference in the activities of arylsulfatase and sucrase.In soils at a depth of 0-10cm,nitrogen applications have a positive effect and phosphorus applications a negative effect on alkaline phosphatase activity.Urease activity is repressed in 0-10cm soils under both nitrogen and phosphorus treatments.In soils at a depth of 10-20cm,chitinase activity is significantly promoted by nitrogen and phosphorus applications,and especially by phosphorus.Cellulase activity at both soil depths is repressed by nitrogen treatment.The results indicate that nitrogen supply effects the mineralization of P and that phosphorus supply can promote the decrease of N.The relative degree of phosphorus limitation may be higher than nitrogen limitation in Qinghai-Tibetan alpine meadows.
Qinghai-Tibetan Alpine meadow;soil enzyme activities;available phosphorus;alkaline nitrogen;nutrient cycle;phosphorus limitation
10.11686/cyxb2015188
2015-04-13;改回日期:2015-06-29
国家973自然科学基金项目(2014CB954002)和青海省科技促进新农村计划项目(2013-N-540)资助。
孙亚男(1989-),女,甘肃武威人,在读硕士。E-mail:luckyyazi@163.com
Corresponding author.E-mail:caogm@nwipb.ac.cn
