HPLC法测定注射用雷贝拉唑钠含量
2016-09-05王淑玲周玉香李敬芝江苏柯菲平医药股份有限公司江苏南京210016
王淑玲,倪 辉,苏 梅,周玉香,李敬芝,何 杨(江苏柯菲平医药股份有限公司,江苏南京210016)
HPLC法测定注射用雷贝拉唑钠含量
王淑玲,倪辉,苏梅,周玉香,李敬芝,何杨(江苏柯菲平医药股份有限公司,江苏南京210016)
目的建立一种高效液相色谱(HPLC)法,测定注射用雷贝拉唑钠的含量。方法采用HPLC法,以0.01mol/L磷酸氢二钾缓冲液(pH 7.0)-甲醇(53∶47)作为流动相,检测波长为284 nm,流速为1.0 mL/min,柱温为25℃,测定注射用雷贝拉唑钠的含量。结果雷贝拉唑钠浓度在19.968~199.680 μg/mL时线性关系良好[Y=21.803 5X-17.373 4,相关系数(r)=1.000 0],注射用雷贝拉唑钠高、中、低3种浓度平均回收率(n=9)为99.9%[相对标准偏差(RSD)为0.08%],中间精密度试验的RSD为0.30%(n=6),重复性和耐用性良好。HPLC法测得3批(S28-140101、S28-140102、S28-140103)注射用雷贝拉唑钠的含量分别为101.3%、99.7%、100.1%。结论HPLC法简便、灵敏、准确,可作为注射用雷贝拉唑钠含量的检验方法。
苯咪唑类;药用制剂;色谱法,高压液相;质量控制;雷贝拉唑钠
雷贝拉唑钠为苯并咪唑类化合物[1-3],是日本卫材公司发现和开发的质子泵抑制剂[4],1997年在日本首先上市,1999年在美国和瑞典上市。雷贝拉唑钠与第一代质子泵抑制剂相比具有明显的优点[5-9]。注射用雷贝拉唑钠由印度Eisai公司开发,于2004年5月在印度上市[10],批准适应证为不适合口服雷贝拉唑的患者。注射用雷贝拉唑钠可以用于:(1)口服雷贝拉唑的序贯性疗法,如以前口服本品,现在由于某种原因不能口服的患者;(2)出血性或糜烂性活动性十二指肠溃疡;(3)出血性或糜烂性活动性胃溃疡;(4)腐蚀性和溃疡性胃食管反流病(GERD)的短期治疗;(5)预防酸增多;(6)重症黏膜损伤的急性治疗;(7)卓-艾氏(Zollinger-Ellison)综合征。本文旨在建立一种高效液相色谱(HPLC)法,以测定注射用雷贝拉唑钠的含量。
1 材料与方法
1.1材料
1.1.1仪器Agilent1260液相色谱仪(安捷伦公司,VWD紫外检测器);XS105、XS3DU型电子天平(梅特勒-托利多公司);PHS-3C pH计(雷磁-上海仪电科学仪器股份有限公司)。仪器1:Agilent-1260(紫外检测器,工作站:OpenLAB);仪器2:岛津LC-20AVP(泵LC-20AT,检测器SPD-20A,工作站:LCSolution)。
1.1.2试剂雷贝拉唑钠对照品(中国食品药品检定研究院,批号:100658-201203,含量:100%);注射用雷贝拉唑钠(自制,批号:S28-140101、S28-140102、S28-140103);雷贝拉唑钠(自制,批号:RL-131201);甲醇为色谱纯;水为超纯水,其余试剂均为分析纯。
1.2方法
1.2.1色谱条件[11-12]色谱柱:AgilentExtend-C18150.0mm× 4.6 mm,3.5 μm(安捷伦公司);色谱柱1、2、3分别为不同批号的Agilent Extend-C18柱。以0.01 mol/L磷酸氢二钾缓冲液(调节pH值至7.0)-甲醇(53∶47)为流动相;检测波长为284nm;流速为1.0mL/min;柱温为25℃。
1.2.2溶液的配制
1.2.2.1系统适用性溶液取雷贝拉唑钠与杂质D(过氧化物砜)适量,用溶剂[0.001 mol/L氢氧化钠溶液-甲醇(1∶1)]溶解并稀释制成每毫升约含雷贝拉唑钠100 μg,至少含杂质D 1 μg的混合溶液。
1.2.2.2对照品溶液雷贝拉唑钠对照品适量,精密称定,定量稀释制成每毫升约含100 μg的溶液。
1.2.2.3供试品溶液取本品5瓶,将其内容物混合均匀,精密称取适量(约相当于雷贝拉唑钠2 mg),置于20 mL容量瓶中,加溶剂[0.001 mol/L氢氧化钠溶液-甲醇(1∶1)]溶解并稀释至刻度,摇匀,即得。
1.2.2.4空白对照溶液取除雷贝拉唑钠外其他组分,按处方工艺制成空白样品,按1.2.2.3项下方法制成空白对照溶液。
1.2.3波长选择称取雷贝拉唑钠对照品及本品适量,分别用溶剂溶解并稀释制成约20 μg/mL溶液,根据《中华人民共和国药典》紫外-可见分光光度法[13]附录23,扫描范围200~400 nm,扫描间隔为0.2 nm,同法对空白溶剂进行扫描,记录最大吸收波长。
1.2.4系统适用性试验精密量取1.2.2.1项下的系统适用性溶液20 μL,注入液相色谱仪,考察理论板数、分离度。精密量取系统适用性溶液10 μL注入液相色谱仪,记录色谱图,理论塔板数按雷贝拉唑钠计算应不低于2 000,雷贝拉唑与杂质D峰分离度应不小于1.5。
1.2.5空白干扰专属性试验取1.2.2.1项下的系统适用性溶液,分别取溶剂及空白辅料溶液10 μL注入液相色谱仪,记录色谱图。
1.2.6线性与范围[14]取雷贝拉唑钠对照品适量,精密称定,加溶剂溶解并稀释制成每毫升约含雷贝拉唑钠1 mg的溶液作为贮备液,分别精密量取贮备液1、2、4、5、6、10 mL置50 mL容量瓶中,加溶剂稀释至刻度,摇匀得线性溶液1、2、3、4、5、6。在1.2.1色谱条件下,精密量取上述溶液各10 μL,注入液相色谱仪(仪器1),记录色谱图。以雷贝拉唑钠浓度为X轴、峰面积为Y轴进行回归计算,绘制回归曲线,得出回归方程。
1.2.7进样精密度取1.2.6项下的溶液4作为对照品溶液,连续进样6针,计算峰面积的相对标准偏差(RSD),测定进样精密度。
1.2.8准确度试验[14]按处方量(规格:10 mg)的80%(低)、100%(中)、120%(高)分别精密称取3个浓度梯度的雷贝拉唑钠(批号:100658-201203)和空白辅料(相当于处方量100%的雷贝拉唑钠),混匀。精密称定3个浓度梯度的混合样品各3份,分别相当于雷贝拉唑钠原料约8、10、12 mg,按含量测定方法进行测定,按外标法以峰面积计算回收率。
1.2.9精密度试验
1.2.9.1重复性试验按1.2.2.3项下方法制备供试品溶液。同法操作6份。同时,制备雷贝拉唑钠对照品溶液。精密量取上述溶液各10 μL,分别注入液相色谱仪,记录色谱图。
1.2.9.2中间精密度试验按含量测定方法,由不同分析人员在不同时间分别测定的含量,考察随机变动因素对精密度的影响。
1.2.10样品溶液稳定性取1.2.9.2项下的供试品溶液,于4℃放置33.0 h,分别于放置0.0、6.0、10.5、15.0、18.5、24.0、33.0 h 7个时间点各进样10 μL,记录色谱图,计算峰面积的相对标准偏差(RSD),以测定对照品溶液的放置稳定性。
1.2.11滤膜吸附试验(1)供试品贮备液配制:取本品适量(约相当于雷贝拉唑钠2 mg),精密称定,置20mL容量瓶中,加溶剂溶解并稀释至刻度,摇匀即得。(2)供试品溶液1:取供试品贮备液10 mL,离心,取上清液即得。供试品溶液2:取供试品贮备液滤过,弃去初滤液2 mL,取续滤液即得。供试品溶液3:取供试品贮备液滤过,弃去初滤液5 mL,取续滤液即得。(3)测定方法:精密量取供试品溶液1,供试品溶液2和供试品溶液3各10 μL,注入液相色谱仪,记录色谱图,计算含量RSD,考察滤膜吸附对测定结果的影响。
1.2.12耐用性试验[13]附录194为考察测定条件有小的变动时,测定结果不受影响的承受程度,对含量测定方法进行系统耐用性试验。考察的变动因素有:流动相比例、流速、柱温、流动相pH、波长、色谱柱等。标准方法:采用十八烷基硅烷键合硅胶为填充剂的色谱柱(如Agilent Extend-C18色谱柱,150.0mm×4.6mm,5.0μm);以0.01 mol/L的磷酸氢二钾缓冲液(pH 7.0)-甲醇(53∶47)为流动相;流速1.0 mL/min;柱温35℃;检测波长284 nm。分别取1.2.2.3项下供试品溶液和1.2.2.2项下对照品溶液各10μL注入液相色谱仪,记录色谱图。
1.2.13样品检测取不同批号的样品,分别按1.2.2.3项下方法制成供试品溶液,精密量取上述溶液各10μL,分别注入液相色谱仪,测定3批(S28-140101、S28-140102、S28-140103)注射用雷贝拉唑钠的含量。
2 结 果
2.1波长选择结果对照品及本品在(284±2)nm均有较强吸收,空白溶剂无干扰,故选择284 nm作为雷贝拉唑钠含量测定波长。见表1。

表1 检测波长选择结果
2.2系统适用性试验结果雷贝拉唑钠理论塔板数为8 733,分离度为8.88。试验结果表明该色谱条件良好,可以作为雷贝拉唑钠含量测定的色谱条件。
2.3空白干扰专属性试验空白干扰专属性试验结果表明空白溶剂、空白辅料对本品含量测定无干扰。
2.4线性与范围试验结果线性方程:Y=21.803 5X-17.373 4,相关系数(r)=1.000 0,雷贝拉唑钠在19.968~199.680μg/mL时与其峰面积呈线性关系。见表2、图1。

表2 线性与范围试验结果

图1 含量测定线性关系
2.5进样精密度结果采用HPLC法,连续进样6次,RSD为0.10%,小于2.00%,仪器进样精密度良好。见表3。
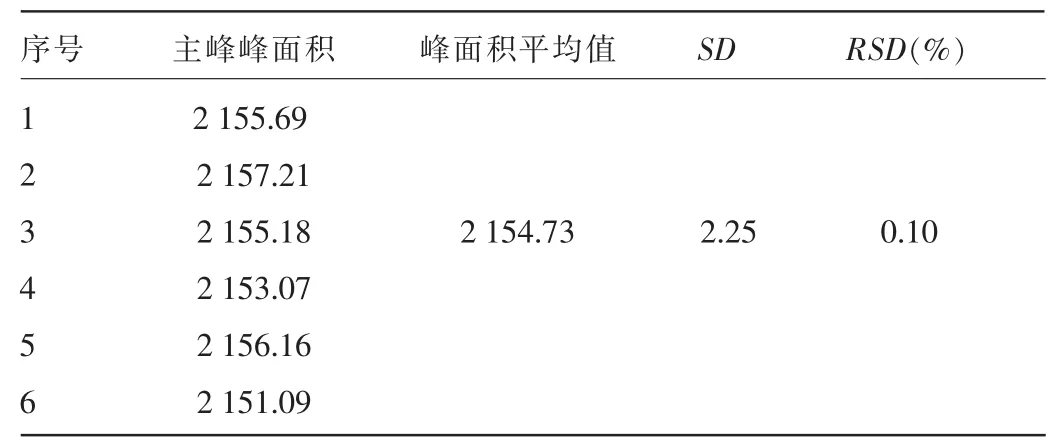
表3 进样精密度结果
2.6准确度试验结果HPLC法含量的平均回收率为99.9%,RSD为0.08%,表明该法的准确度高、可靠性好。见表4。

表4 含量测定回收率试验结果(n=9)
2.7精密度试验
2.7.1HPLC法重复性试验结果采用HPLC法测定雷贝拉唑钠的含量,RSD为0.35%,重复性较好。见表5。

表5 HPLC法重复性试验结果(n=6)
2.7.2中间精密度试验结果测定结果的RSD为0.30%,中间精密度较好。见表6。

表6 中间精密度试验结果
2.8样品溶液稳定性结果注射用雷贝拉唑钠溶液于4℃放置33.0 h峰面积的RSD为1.01%,溶液在4℃33.0 h内稳定。见表7。

表7 样品溶液的放置稳定性
2.9滤膜吸附试验结果供试品溶液未经滤膜滤过与经滤膜滤过含量RSD为0.24%,无明显变化,滤膜吸附量可忽略不计,不影响本品含量的测定。见表8。

表8 滤膜吸附试验结果
2.10系统耐用性试验流动相比例、流速、柱温、流动相pH、波长、色谱柱等因素的微小变化均可引起保留时间的改变,但不同条件下主峰分离度均大于1.5,同条件下含量测定结果平均值为101.5%,RSD为0.55%,不同条件下含量测定结果未见明显变化,说明色谱条件的微小变化,对本品含量的测定影响不大。不同条件下样品含量测定结果见表9。

表9 耐用性试验结果

续表9 耐用性试验结果
2.11样品测定HPLC法测得3批(S28-140101、S28-140102、S28-140103)注射用雷贝拉唑钠的含量分别为101.3%、99.7%、100.1%。
3 讨 论
本研究建立了一种采用HPLC法测定注射用雷贝拉唑钠含量的方法,雷贝拉唑钠的浓度在19.968~199.680 μg/mL时线性关系良好(Y=21.803 5X-17.3734,r=1.000 0),注射用雷贝拉唑钠低、中、高3种浓度平均回收率(n=9)为99.9%(RSD=0.08%),中间精密度试验RSD=0.30%(n=6),重复性和耐用性良好;HPLC法测得3批(S28-140101、S28-140102、S28-140103)注射用雷贝拉唑钠的含量分别为101.3%、99.7%、100.1%。HPLC法准确度高、方便快捷,能有效控制该品种的质量,可作为注射用雷贝拉唑钠含量的检验方法。根据实测3批样品含量测定结果,并考虑实际生产的复杂性,将注射用雷贝拉唑钠含量测定标准暂定为雷贝拉唑钠含量应为标示量的95.0%~105.0%。
[1]黄芳,向德尚.高效液相色谱法测定注射用雷贝拉唑钠的含量[J].数理医药学杂志,2009,22(5):584-586.
[2]宋冬梅,刘路,江文明,等.雷贝拉唑钠原料药中有关物质的HPLC法测定[J].中国医药工业杂志,2015,46(9):1013-1016.
[3]郭绍梅.雷贝拉唑钠冻干粉针的研制[J].食品与药品,2013,15(3):196-198.
[4]马延,王媛,畅瑞苗,等.HPLC法测定雷贝拉唑钠肠溶微丸的有关物质[J].中国生化药物杂志,2015,36(4):165-168.
[5]黄爱国.雷贝拉唑钠治疗消化性溃疡40例临床观察[J].中国民族民间医药杂志,2014,23(23):85.
[6]Kita T,Sakaeda T,Baba T,et al.Different contribution of CYP2C19 in the in vitro metabolism of three proton pump inhibitors[J].Biol Pharm Bull,2003,26(3):386-390.
[7]黄俊民.奥美拉唑与雷贝拉唑治疗消化道溃疡临床疗效比较[J].中国现代药物应用,2015,9(24):113-114.
[8]杨海斌,周贤斌.雷贝拉唑钠肠溶片在幽门螺杆菌阳性十二指肠溃疡中的疗效、安全性及优势分析[J].中国医院药学杂志,2015,35(23):2123-2126.
[9]陈珍月.雷贝拉唑治疗幽门螺杆菌相关性胃溃疡临床效果观察[J].医学理论与实践,2015,28(24):3362-3364.
[10]王勇峰,张志广,周永宁,等.注射用雷贝拉唑钠治疗十二指肠球部溃疡出血多中心、随机、双盲、阳性药物平行对照临床研究[J].胃肠药学,2014,19(5):275-276.
[11]钟皎,赵文艳.反相高效液相色谱法测定人血浆中雷贝拉唑钠浓度[J].中国临床药理学杂志,2015,31(9):751-753.
[12]李蒲江,谭淑珍,曾巨澜,等.高效液相色谱法测定注射用右旋雷贝拉唑钠粉针剂含量[J].应用化工,2016,45(2):373-376.
[13]国家药典委员会.中华人民共和国药典:二部[M].北京:中国医药科技出版社,2010.
[14]国家药典委员会.中国华人民共和国药典:四部[M].北京:中国医药科技出版社,2015:374-377.
ContentdeterminationofRabeprazoleSodiumforInjectionbyHPLC
WangShuling,NiHui,SuMei,ZhouYuxiang,Li Jingzhi,He Yang(Jiangsu Carephar Pharmaceutical Scientific and Technology Co.,Ltd.,Nanjing,Jiangsu 210016,China)
ObjectiveTo establish a HPLC method for the content determination of Rabeprazole Sodium for Injection. MethodsThe high-performance liquid chromatography(HPLC)was adopted with 0.01 mol/L dipotassium hydrogen phosphate buffer solution(pH7.0)-methanol(53∶47)as the mobile phase,the detection wave length was 284 nm,the flow rate was 1.0 mL/min,the column temperature was 25℃.The content of Rabeprazole Sodium for Injection was detected.ResultsThe rabeprazole sodi um concentration in the range of 19.968-199.680 μg/mL has a good linear relationship(Y=21.803 5X-17.373 4,r=1.000 0),the average recovery rates of high,middle and low concentrations(n=9)were 99.9%[relative standard deviation(RSD)=0.08%];the intermediate precision RSD was 0.30%(n=6),the repeatability and durability were good.The contents of 3 batches of Rabeprazole Sodium for Injection(S28-140101,S28-140102,S28-140103)detected by HPLC were 101.3%,99.7%and 100.1%respectively. ConclusionThe establishedHPLC method is simple,sensitive and accurate,which is suitable for the content determination of Rabeprazole Sodium for Injection.
Benzimidazoles;Pharmaceutical preparations;Chromatography,high pressure liquid;Quality control;Rabeprazole Sodium
10.3969/j.issn.1009-5519.2016.15.011
A
1009-5519(2016)15-2306-04
王淑玲(1983-),主要从事药物分析方面的工作。
(2016-04-11)
