2种左旋多巴片剂在Beagle犬体内的生物等效性研究
2016-09-05陈雪珊贺鑫韬马桂芝
陈雪珊, 滕 亮, 贺鑫韬, 马桂芝
(新疆医科大学1科学技术处, 乌鲁木齐 830011; 2第一附属医院药学部, 乌鲁木齐 830054;3新疆巴音郭楞蒙古自治州人民医院药学部, 新疆 库尔勒 841000; 4新疆医科大学药学院, 乌鲁木齐 830011)
·药学研究·
2种左旋多巴片剂在Beagle犬体内的生物等效性研究
陈雪珊1, 滕亮2, 贺鑫韬3, 马桂芝4
(新疆医科大学1科学技术处, 乌鲁木齐830011;2第一附属医院药学部, 乌鲁木齐830054;3新疆巴音郭楞蒙古自治州人民医院药学部, 新疆库尔勒841000;4新疆医科大学药学院, 乌鲁木齐830011)
目的考察单剂量给药后左旋多巴微囊漂浮片和美多芭片在Beagle犬体内的生物等效性。方法建立可用于测定beagle犬血浆中左旋多巴含量的高效液相色谱法,以美多芭片为参比制剂,采用双周期交叉试验设计进行试验,采用3P97药物动力学软件求算单剂量给药后药动学参数,对其生物等效性进行初步评价。结果建立了符合方法学要求的测定Beagle犬血浆中左旋多巴含量的高效液相色谱法。单剂量口服美多芭和左旋多巴微囊漂浮片的主要药物动力学参数:tmax分别为(0.73±0.12)、(1.47±0.20) h,Cmax分别为(5.04±0.92)、(2.54±0.68) μg/mL,MRT分别为(1.96±0.21)、(3.41±0.32) h,AUC0-∞分别为(11.33±0.97)、(10.38±1.52) μg·h-1·mL-1。单剂量给药的微囊漂浮片AUC0-∞与美多芭片AUC0-∞的几何均值比的90%置信区间为83.00%~99.90%,Cmax几何均值比的90%置信区间为52.10%~64.40%,秩和检验结果表明微囊漂浮片与参比片的tmax有差异。结论左旋多巴微囊漂浮片具有良好的缓释特性,单剂量给药后与参比制剂美多芭片吸收程度生物等效。
左旋多巴; 微囊; 漂浮片; 高效液相色谱法; 生物等效性
帕金森病(Parkinson′s Disease,PD)因具有较高的致残率导致开发新型抗帕金森病药物及其新剂型具有显著的社会意义和应用价值[1-3]。美国神经协会的评估结果表明复方左旋多巴制剂(美多芭等)是抗帕金森病药物的金标准药物[4],但是由于该药临床使用方法较为繁琐,导致其患者顺应性较差[5-6]。针对该制剂的缺点,本课题组前期研究已经完成了具有体外缓释特征、可分剂量使用的左旋多巴微囊漂浮片的工艺参数优选[7-9]。为考察其体内缓释特征及参比制剂美多芭的生物等效性,本研究在建立了测定Beagle犬血浆中左旋多巴药物浓度的HPLC方法的基础上,采用单次给药双周期交叉试验考察左旋多巴微囊漂浮片与美多芭片剂在Beagle犬体内的药物动力学行为,计算主要药动学参数,按《药物制剂人体生物利用度和生物等效性试验指导原则》中生物等效性判定方法对其药物生物等效性进行评价[10],为该产品的后续研发奠定基础。
1 材料与仪器
1.1药品与试剂左旋多巴对照品(中国食品药品检定研究院,批号 100170-201003),美多芭片(上海罗氏制药有限公司,批号:SH1324,每片含200 mg左旋多巴),复方左旋多巴漂浮片(课题组自制,批号:20130515,每片含100 mg左旋多巴),多潘立酮片(华东医药西安博华制药有限公司,生产批号1204019),甲醇(色谱级,Sigma公司),高氯酸(上海桃浦化工厂,批号:950420),盐酸(新疆烧碱厂,批号:02041950),磷酸(天津市致远化学试剂有限公司,批号20110418)。
1.2仪器LC-20A型高效液相色谱仪(日本岛津公司),BS110S型分析天平(北京赛多利斯天平有限公司,d=0.01),DW-86L205型超低温冰箱(广州傲雪制冷设备有限公司),Exceed-Cd-16A型实验室专用超纯水机(成都康宁实验专用纯水设备厂),KQ5200DE型超声波清洗器(昆山市超声仪器有限公司),LG10-2.4A型高速离心机(北京医用离心机)。
1.3动物健康雄性beagle犬6只,体质量(12±1)kg,由新疆医科大学第一附属医院临床医学研究院实验动物科学研究部提供并饲养[试验动物使用许可证号:SYXK(新)2010-0001]。
2 方法与结果
2.1体内分析方法的建立
2.1.1色谱条件色谱柱:Agilent ODS-1C18柱(250 mm×4.6 mm, 5 μm),流动相:甲醇(A)-0.1%三氟乙酸水溶液(B)梯度洗脱:0~2 min 98% B,2~25 min 98%~82% B,25~40 min 82%~98% B,流速:0.5 mL/min,柱温:30℃,进样量:20 μL,检测波长:220 nm。
2.1.2标准溶液的制备精密称取左旋多巴对照品适量,用稀盐酸(9→1 000 mL)溶解并制备左旋多巴储备液(200 μg/mL)。分别取储备液适量依次制备质量浓度分别为200、150、100、50、25、12.5、6.25、3.12、1.56和0.78 μg/mL的系列标准溶液。
2.1.3血浆样品预处理取Beagle犬全血2 mL,低温(8℃)4 200 r/min离心10 min,分取上层血浆,加入等量6%高氯酸溶液,震摇2 min,10 000 r/min离心15 min,上清液经0.22 μm微孔滤膜过滤后取20 μL进行分析。
2.1.4方法专属性按前述样品与处理方法对空白血浆、左旋多巴对照品、空白血浆加左旋多巴对照品、实际血浆样品进行处理后按前述色谱条件测定。结果表明内源性物质、代谢产物与左旋多巴色谱峰基线分离,对左旋多巴的测定无干扰,见图1。
2.1.5线性考察分别取空白血浆500 μL 10份,分别精密加入不同质量浓度的左旋多巴,使血浆中左旋多巴的质量浓度分别为20、15、10、5、2.5、1.25、0.62、0.31、0.16和0.078 μg/mL,按前述样品与处理方法处理后进样测定。直线回归结果表明待测物峰面积(A)与左旋多巴质量浓度(C)存在以下线性关系:A=36 728.46 C+20.78(r=0.999 9,n=10)。通过信噪比法确定最低定量下限为(LLOQ)0.078 μg/mL(S/N≥10)。2.1.6精密度试验取空白血浆500 μL,按前述样品处理方法制备3个质量浓度(0.156、2.5和15 μg/mL)的QC样品,对每一浓度进行分析(n=5),连续测定5 d,测定日内及日间的精密度,并与制备浓度比较计算方法的准确度。结果表明分析方法的精密度(RSD)均<15%,符合方法学要求。

a: 对照品溶液

b: 空白血浆

c: 空白血浆加左旋多巴对照品

d: 给予200 mg左旋多巴后1 h取血检测结果
图1左旋多巴色谱图
2.1.7稳定性试验取空白血浆500 μL,按前述样品处理方法制备3个质量浓度(0.156、2.5和15 μg/mL)的QC样品,对每一浓度进行分析(n=5);分别考察样品在室温放置24 h、在-80℃冰箱中冷冻28 d及反复冻融3次的稳定性。结果表明左旋多巴含量均稳定。
2.1.8提取回收率与基质效应取空白血浆500 μL 15份,按前述样品处理方法制备3个质量浓度(0.156、2.5和15 μg/mL)的QC样品(n=5),分别进样记下待测物峰面积A1。另取空白血浆500 μL15份,按“2.1.3”项下方法处理,加入左旋多巴对照品溶液,制成3个质量浓度(0.156、2.5、15 μg/mL)的未经提取的对照样品(n=5),记下待测物峰面积A2。取不同浓度的标准溶液,用6%高氯酸稀释制成3个质量浓度(0.156、2.5、15 μg/mL)的左旋多巴标准对照样品(n=5),分别进样并记下待测物峰面积为A3。计算提取回收率(%)与基质效应(%)。结果表明,测定血浆中左旋多巴质量浓度分析方法的提取回收率分别为(87.56±5.53)%、(87.56±3.33)%、(93.96±5.35)%,基质效应分别为(76.74±2.48)%、(104.34±1.66)%、(91.39±5.84)%,均符合方法学要求。
2.1.9方法的相对回收率将“2.1.8”项下求得的比值A1代入线性回归方程计算所测得浓度,经与加入浓度相比计算相对回收率。结果相对回收率分别为(108.44±7.40)%、(95.05±2.57)%、(101.98±2.11)%,均符合生物样品分析方法的要求。
2.2Beagle犬体内单次给药双周期交叉实验
2.2.1实验方法取6只健康雄性Beagle犬,体质量11~13 kg,禁食12 h(自由饮水),双交叉单剂量分别给予左旋多巴微囊漂浮片2片、美多芭片1片。给药2 h后饮水,4 h后进食,给药后分别于不同时间点经前肢静脉采血2 mL于肝素化试管中,按“2.1.3”项下方法处理样品并测定血药浓度。间隔1 w后,进行交叉给药。左旋多巴微囊漂浮片采血时间点分别为给药前和给药后0.5、0.75、1.0、1.5、2.0、3.0、4.0、5.0、7.0、9.0 h。美多芭片采血时间点分别为给药前和给药后0.167、0.333、0.5、0.75、1.0、1.5、2.0、4.0、6.0、9.0 h。
2.2.2测定结果6只Beagle犬分别单剂量口服左旋多巴微囊漂浮片和参比制剂复方美多芭片后,定时取样测定血浆中的药物浓度,平均血浆药物浓度-时间曲线见图2。
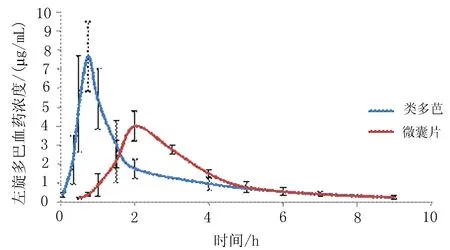
2.2.33P97药代动力学程序计算药动学参数采用3P97药代动力学程序[11]处理所得数据。结果表明2种左旋多巴片在犬体内的药动学行均为单室模型,见表1。
2.2.4应用3P97药代动力学软件对参数进行生物等效性判定对单剂量口服左旋多巴微囊漂浮片和普通片的lgAUC0-∞、lgCmax进行3素方差分析,结果表明2种制剂间、周期间、个体间差异均无统计学意义(P>0.05),进一步进行双侧t检验及(1~2 a)置信区间分析,微囊片AUC0-∞与参比制剂AUC0-∞的比值的90%置信区间为83.00%~99.90%,以80%~125%为等效标准,结果判定具有2种制剂吸收程度生物等效。Cmax在周期间、个体间差异均无统计学意义,而在制剂间有差异(P<0.05)。进一步进行双侧t检验及(1~2 a)置信区间分析,微囊片Cmax与参比制剂Cmax的比值的90%置信区间为52.10%~64.40%,以70%~145%为等效标准,结果判定2种制剂生物不等效。tmax经非参数检验(Wilcoxon符号秩和检验)差异有统计学意义(P<0.05),提示微囊片与参比片的tmax有差异,试验周期间、个体间无差异。以上结果提示与参比制剂相比,左旋多巴微囊漂浮片吸收程度生物等效,且具有缓释特征。
表13P97处理的左旋多巴微囊漂浮片与美多芭片药学动力参数
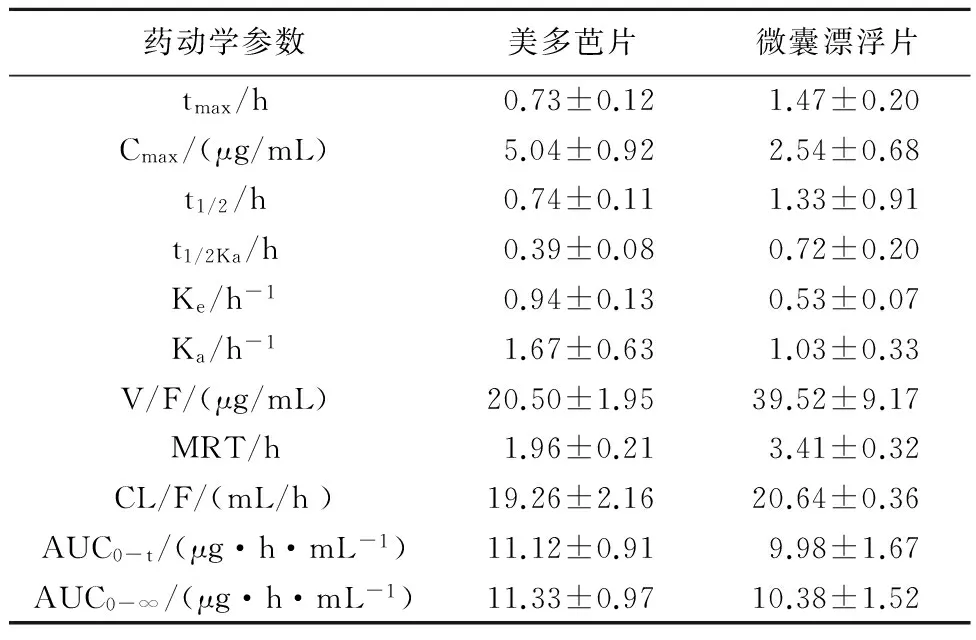
药动学参数美多芭片微囊漂浮片tmax/h0.73±0.121.47±0.20Cmax/(μg/mL)5.04±0.922.54±0.68t1/2/h0.74±0.111.33±0.91t1/2Ka/h0.39±0.080.72±0.20Ke/h-10.94±0.130.53±0.07Ka/h-11.67±0.631.03±0.33V/F/(μg/mL)20.50±1.9539.52±9.17MRT/h1.96±0.213.41±0.32CL/F/(mL/h)19.26±2.1620.64±0.36AUC0-t/(μg·h·mL-1)11.12±0.919.98±1.67AUC0-∞/(μg·h·mL-1)11.33±0.9710.38±1.52
3 讨论
本研究在求算药物动力学参数时既采用了3P97药物动力学软件进行计算,还尝试采用基于excel2003界面的统计矩法进行计算[12-13]。采用统计矩法求算单剂量口服美多芭和左旋多巴微囊漂浮片的主要药物动力学参数:tmax分别为(0.79±0.10)、(1.83±0.26)h,Cmax分别为(7.34±0.95)、(4.26±0.54)μg/mL,MRT分别为(2.61±0.18)、(3.99±0.32)h,AUC0-∞分别为(11.33±0.97)、(10.38±1.54)μg·h·mL-1。2种数据处理方法均表明与普通片相比,左旋多巴漂浮片的体内半衰期明显延长,达峰时间明显延迟,血药峰浓度明显低于普通片,达到了缓释的效果。与DOS界面的3P97药动处理软件相比,基于excel2003界面的统计矩法相对灵活、方便、快捷,统计过程更加直观。
在评价生物等效性时除了采用3P97药物动力学软件进行评价,还根据生物等效性评价的原理和文献,分别采用excel2003通过梯形法进行数据处理[14]和利用SPSS17.0统计软件进行相应的统计学分析。结果表明3种方法所得的具体数值有所不同,但是统计结论是一致的,即单剂量给药的微囊漂浮片AUC0-∞与参比制剂AUC0-∞的几何均值比的90%置信区间均在80%~125%内,2种制剂吸收程度生物等效,试验制剂与参比制剂的Cmax与tmax均存在差异,表明2种制剂的吸收速度存在差异,提示3种生物等效性评价方法有可能互相代替。
数据处理结果表明单剂量给药后左旋多巴微囊漂浮片在犬体内的药时曲线符合单室模型,2种制剂在体内吸收量相当,但微囊漂浮片的Cmax明显小于参比制剂,tmax明显大于参比制剂,其原因可能在于微囊漂浮片是将药物包封于微囊后在与漂浮材料压制成片剂,药物的释放既受漂浮材料的膨胀、溶蚀的影响,又要受药物透过微囊壁快慢的影响,因此其吸收过程变得非常缓慢,但微囊漂浮片在胃肠道中滞留时间延长,导致其吸收量并未减少。
综上所述,体内药动学结果提示微囊漂浮片在保证吸收量相等的前提下实现了缓释,有助于降低血药浓度的波动度,减少给药次数,从而避免多次给药可能发生的不良反应,提高患者用药的顺应性。
[1]Gordon PH, Mehal JM, Holman RC, et al. Parkinson′s disease among American Indians and Alaska natives: a nationwide prevalence study[J]. Mov Disord, 2012, 27(11):1456-1459.
[2]叶迎安,阮志芳.左旋多巴在帕金森病治疗中的合理应用[J].中国实用神经疾病杂志, 2008,11(1):101-103.
[3]曲伟,蒲小平.抗帕金森病新药研究进展[J].中国新药杂志, 2008,17(1):21-26.
[4]Navailles S ,Lagiere M,Contini A,et al.Multisite intracerebral microdialysis to study the mechanism of L-DOPA induced dopamine and serotonin release in the parkinsonian brain [J].ACS Chem Neurosci, 2013, 4(5):680-692.
[5]徐娉,张璟.左旋多巴治疗帕金森病用药方法及疗效观察[J].中国实用内科杂志, 2003,23(7):443-444.
[6]苏雅茹,蒋雨平.左旋多巴的临床应用 [J]. 中华医学信息导报, 2005, 20(19):12-14.
[7]马桂芝,滕亮,李文英,等.乳化-溶剂挥发法制备左旋多巴微囊[J].新疆医科大学学报,2014,37(1):47-50,53.
[8]周玲,程煜凤,李文英,等.左旋多巴微囊漂浮片的处方优选[J].中国药师,2015,18(8):1295-1299.
[9]马桂芝,马亮英,李文英,等.盐酸苄丝肼固体分散体制备工艺的研究[J].新疆医科大学学报,2015,38(7):862-865.
[10]国家药典委员会.中华人民共和国药典(二部)[S].北京:中国医药科技出版社,2010:附录195-199.
[11]李绪春,徐富培,周远大.2种奥卡西平片的人体生物等效性研究[J].中国药房,2012,23(42):3984-3986.
[12]袁进,石磊,赵树进.基于Excel求解静脉注射给药隔室模型参数及药动学参数[J].中国药师,2007,10(2):161-163.
[13]杨星钢,张国华,李伟,等.阿昔莫司缓释片的体外释放度与犬体内吸收相关性[J].中国新药与临床杂志,2005,24(7):508-511.
[14]梁文权.生物药剂学与药物动力学[M].北京:人民卫生出版社,2009:338-359.
(本文编辑施洋)
Study on bioequivalence of two kinds of Levodopa tablets in Beagle
CHEN Xueshan1, TENG Liang2, HE Xintao3, MA Guizhi4
(1DepartmentofScienceandTechnology,XinjiangMedicalUniversity,Urumqi830011,China;2DepartmentofPharmacy,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China;3DepartmentofPharmacy,People′sHospitalofXinjiangBayinguolengMongoliaAutonomousPrefecture,Korla841000,China;4CollegeofPharmacy,XinjiangMedicalUniversity,Urumqi830011,China)
ObjectiveTo study the pharmacokinetic properties of two kinds of levodopa tablets in Beagle. MethodsThe method of HPLC was established to determine Levodopa in beagle dog plasma. Using two-period randomized crossover design with Madopar as reference preparation, the main pharmacokinetic parameters were calculated by the software 3P97 using the dates in vivo after given a single oral dose of Madopar and Levodopa microcapsules floating tablets. The bioequivalence between Levodopa microcapsules floating tablets and reference preparation was preliminarily evaluated. ResultsThe method of HPLC was established to determine Levodopa in beagle dog plasma which complies with methodology requirements. The main pharmacokinetic parameters were as following respectively: tmaxwere (0.73±0.12) h and (1.47±0.20) h,Cmaxwere (5.04±0.92) μg/mL and (2.54±0.68) μg/mL, MRT were (1.96±0.21) h and (3.41±0.32) h, AUC0-∞were (11.33±0.97) μg·h-1·mL-1and (10.38±1.52) μg·h-1·mL-1, respectively. According to the guideline of pharmaceutical preparations of human bioavailability and bioequivalence test, the 90% confidence intervals for the geometric mean ratio of AUC0-∞and Cmaxvalues for the test and reference preparation were 83.00%~99.90%, 52.10%~64.40%, respectively. According to the results of rank sum test, the tmaxwere different between the test and reference preparation. Conclu-sionThe extent of absorption of Levodopa between the test and reference preparation was bioequivalent. Compared with the reference preparation, the Levodopa microcapsules floating tablets had a good sustained-release property.
Levodopa; Microcapsules; Floating tablets; HPLC; Pharmacokinetics; bioequivalence
乌鲁木齐市科学技术计划项目(G121320003)
陈雪珊(1984-),女(回族),硕士,助理研究员,研究方向:新药研发,E-mail:chenxueshan2010@sina.com。
马桂芝,女(回族),博士,副教授,硕士生导师,研究方向:中药民族药研究,E-mail:maguizhi000@126.com。
R945
A
1009-5551(2016)06-0717-04
10.3969/j.issn.1009-5551.2016.06.012
2015-10-6]
