林可霉素制剂中林可霉素含量测定方法研究进展
2016-09-03叶兆伟吴海港刘锦妮李尽哲
叶兆伟,吴海港,刘锦妮,李尽哲
(信阳农林学院 生物与制药工程学院,河南 信阳 464000)
数·理·化
林可霉素制剂中林可霉素含量测定方法研究进展
叶兆伟,吴海港,刘锦妮,李尽哲
(信阳农林学院 生物与制药工程学院,河南 信阳 464000)
林可霉素对革兰氏阳性球菌有较好抑制作用,主要是抑制细菌蛋白质的合成。目前对林可霉素含量的检测方法有多种,本文主要通过查阅国内近期文献,归纳总结了不同林可霉素制剂中林可霉素的含量测定方法的研究进展,为其质量评价和体内药动学过程的研究提供依据,并为林可霉素含量测定方法的进一步研究提供文献依据和分析思路。
林可霉素;HPLC;紫外分光光度法
林可霉素,为窄谱抗生素,对革兰氏阳性球菌有较好抑制作用,尤其对金葡菌、厌氧菌、肺炎球菌高效,主要抑制细菌蛋白质合成。林可霉素在治疗各种感染中得到广泛应用,因此建立不同样品中林可霉素快速而有效的含量检测方法尤为重要。目前,色谱法、质谱法、光谱法都可用于林可霉素的含量测定,实际选择时,可视具体情况而定。本文针对不同制剂中林可霉素含量测定方法作一介绍,并分析了各种方法的优劣,希望为林可霉素含量测定方法的选择提供参考。
1 色谱法
色谱法,又称色层法或层析法,是一种物理化学分析方法,利用不同溶质与固定相和流动相之间的作用力(分配、吸附等)的差别,当两相做相对移动时,各溶质在两相间进行多次平衡,使之达到相互分离的目的。色谱法测定林可霉素含量使用最多的是高效液相色谱法。该法简便,快捷,灵敏度高。
1.1胶体金免疫层析法
李利芬等[1]采用胶体金免疫层析法对牛奶中林可霉素的含量进行定性检测。用微量移液器分别吸取200μL、50μL待检样本和150μL样本稀释液于微孔中,缓慢抽吸且充分混匀。用该法对阴性生乳、阳性加标样品分别做了10次重复性检测,检测结果相同,重复性好;对阴性生乳、阳性加标样品做了8类物质的抗干扰实验,检测结果一致。
该法抗干扰能力强,检测过程用时6~7min,时间短;在检测过程中无需前处理,直接检测,操作简便。
1.2高效液相色谱法(HPLC)
黄滔敏等[2]用HPLC测定复方盐酸去氧肾上腺素喷鼻液中盐酸林可霉素等药物含量。采用Agilent C18柱,流动相:0.02 mol/ L磷酸氢二铵:乙腈=75:25(V/ V);柱温30℃,流速1 mL/ min ,检测波长240 nm,外标法计算含量。结果表明该条件下,盐酸林可霉素在2~7.2mg /mL浓度范围内,线性关系良好,r >0.9999(n =5),回收率为97 %~103%,RSD <2.0%(n =3)。8 h 内测量结果稳定,样品含量合格,为标示量的97 %~103%,该方法简便、快速,结果准确、可靠、重现性好。
吴洪应等[3]用HPLC法测定林可霉素利多卡因凝胶中林可霉素等含量。C18柱,以0.05mol / L的硼砂溶液-甲醇-乙腈( 60:35:5)为流动相,流速0.7ml /min,检测波长214nm。结果显示林可霉素在0.14~0. 28mg /mL浓度范围内,峰面积与进样浓度呈良好的线性关系( r=0.9999),重现性RSD为0.23%,故该法能快速简便地测定凝胶中林可霉素含量,结果准确可靠。
陈明等[4]采用HPLC法测定牛奶中林可霉素的残留量。牛奶样品水提,离心,经C18固相萃取柱净化,二极管矩阵检测器210nm 波长下检测。Agilent C18色谱柱,0.05mol/L硼砂溶液-甲醇(55:45,V/V)为流动相,流速1.0ml/min。结果显示,在1.0~10.0μg/g浓度范围内林可霉素含量与峰面积呈良好线性关系,平均回收率为82.9%~93.1%,最低检测限为0.5μg/ml。该法在反相柱上分离,紫外检测器测定,可一次性定性定量检测该样品中林可霉素的残留量,检测速度快,简便、准确。
朱曦等[5]利用 HPLC法检测盐酸林可霉素预混剂中林可霉素的含量。C18柱, 0.05mol/L 硼砂溶液:甲醇(1:1)为流动相,流速1.0mL/min,柱温(30±5)℃,检测波长214nm。结果中,林可霉素在0.1~3.5mg /mL浓度范围内与峰面积呈良好线性关系,r= 0.9998;平均回收率97.9%,RSD=1.0%;林可霉素峰与林可霉素B峰分离良好,变异系数RSD=0.23%,林可霉素峰与相邻杂质峰的分离度符合要求。该法能快速准确地测定盐酸林可霉素预混剂中林可霉素的含量。
赵明等[6]建立了蜂蜜中林可霉素残留的HPLC检测法。蜂蜜样品经碳酸盐缓冲液 (pH =9.0) 提取后,经C18固相萃取柱净化,甲醇和乙腈洗脱,洗脱液经氮气吹干,残渣用流动相溶解,在204nm 处紫外检测。
结果表明,在5.0~100μg/ml浓度范围内,r=0.9999,线性关系良好;样品平均回收率93.02% ±1.22%,日内变异系数在0.54%~1.58%,日间变异系数在0.27%~1.49%,日内、日间精密度均达到检测要求,分析时间短、准确性高,方法检测限为0.1μg/ml。该检测方法中,蜂蜜样品提取后只需用 C18固相柱净化,N2吹干,操作简单、快速,可作为蜂蜜中林可霉素残留检测的方法。
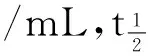
潘蕴慈、徐兵[8]采用HPLC法测定林可霉素-环丙沙星复方制剂中林可霉素的含量。C18柱,0.05mol /L硼砂-甲醇( 3:7) 为流动相, 214nm检测,流速 1.0ml /min,进样量10μl。
采用外标法,用两者含量的折干效价计算相对含量之百分比率。热稳定性试验中,80℃处理后对林可霉素的含量略有影响,在40℃、60℃加热10d后基本稳定;3500LX 光照10d后,各指标无变化,该制剂对光基本稳定;相对湿度80%,40℃恒温条件下10d,样品水分增加明显,表层有吸湿结块现象,但林可霉素含量与原样相比基本无差异,对湿稳定。该法简便,快捷,能快速测定样品处理前后的含量变化。
梁晓美等[9]采用HPLC法测定林可霉素甲硝唑凝胶中林可霉素的含量,建立了该凝胶的质控方法。Extend - C18柱,C18为填充剂,流动相为0.05mol.L-1硼砂溶液-甲醇( 4:6),柱温为 30℃,流速为1.0mL/min,检测波长为 214nm,进样量为10μL。结果中,林可霉素检测浓度的线性范围为 248.00~1033.34 μg/mL( r = 0.9999) , 平均回收率为101.10 % ( RSD = 1.54% )。本制剂制备工艺简便可行,检测方法稳定可控。
李景然[10]用HPLC法测定盐酸林可霉素滴眼液中林可霉素含量。Agilent C18柱,pH6.1磷酸缓冲液-乙腈(80:20)为流动相,检测波长214nm。结果表明,该溶液在8h内稳定性良好,各峰面积RSD为0.3%;回收率99.5%,RSD=0.55%;样品中中盐酸林可霉素的含量为95%~105%。本法专属性好,溶液稳定,线性关系良好,精密度高,可用于盐酸林可霉素滴眼液中盐酸林可霉素的含量测定。
在对不同林可霉素制剂中该药品进行定量定性时,采用HPLC法的比较多。多使用C18色谱柱,流动相多为不同比例的硼砂+甲醇或者磷酸+乙腈,检测波长通常在214nm。结果均显示该法分离效能高,分析速度快,灵敏度高,方法检测限可达0.1μg/ml。
1.3薄层色谱法(TLC)
王鑫芳等[13]找寻适合林可霉素中间供试品中B 组分检测方法。采用硅胶板,以醋酸-丁醇-水(2:1:1)为展开剂,用碘显色,观察不同的供试品浓度与展开时间。检测结果显示:在该薄层色谱条件下能有效分离林可霉素A与B 组分;样品浓度控制在800~900 U/mL,点样5 μL 展开60 min 分离效果最好,分出的杂质与林可霉素B 位置相同。故该法可适用于中间环节的生产控制。
TLC法用于检测林可霉素的不多,对样品中林可霉素的含量有要求,需大于4 %,否则检测不到。
1.4气相色谱法(GC)
陶燕飞等[14]建立了检测动物可食性组织中林可霉素残留量的GC法。
选用HP-5 毛细管柱,温度范围为325~ 350℃,5% 苯基和95% 二甲基聚硅氧烷作为填充材料,弱极性柱,等同于毛细管柱DB-5、R tx-5MS等。由于林可霉素和大观霉素衍生物极性低,选用此类型色谱柱较合适。
实验结果表明,该方法测定可食性组织中的林可霉素和大观霉素的残留量准确可靠,组织中添加林可霉素的定量限为30μg /kg。在组织中添加30~ 3 000μg/kg 林可霉素,回收率为73. 2% ~ 85. 7%。
GC法也能用于林可霉素的含量检测,陶燕飞等发现该法能同时检测林可霉素和大观霉素两种药物,缩短了分析时间,有机试剂用量少,前处理简单,回收率高。但是GC法检测样品中林可霉素的含量需要精细的萃取和衍生化步骤,如果反应及提取不完全都会影响检测结果,并且整个操作过程长,检测方法繁琐复杂,不能一次得到检测结果。
2 质谱法
质谱分析法是通过对被测样品离子的质荷比的测定来进行分析的一种分析方法。此种方法精确性、灵敏度均高,样品制备过程简单,但是要求样品得质子化,成本较高。
2.1高效液相色谱串联质谱法(LC-MS/MS)
高艳等[11]采用LC- MS/MS法测定猪的肌肉、肝脏、肾脏、脂肪和注射位点中,盐酸林可霉素-硫酸大观霉素注射液中林可霉素在5种组织中的残留消除情况。
结果表明,林可霉素在5种不同组织中的线性范围为 1~200 ng/mL,平均样品回收率为88.10%,批内变异系数为3.57%~11.18%,批间变异系数为4.13%~10.42%。林可霉素在猪肌肉、肝脏、肾脏、脂肪中的检测限为3μg/kg,定量限为10μg/kg,保留时间 6.5 min 左右。林可霉素与其他组分分离良好,色谱峰形较佳,该方法精确、灵敏,且样品制备过程简单,可用于动物组织样品中林可霉素残留的检测。
2.2液相色谱/大气压化学电离/离子阱质谱技术( HPLC/APCI/MS/MS)
潘爱华等[12]采用液液萃取法提取血液中林可霉素, HPLC/APCI/MS/MS进行检测。该法在0.02~3.0μg/mL范围内,线性相关系数0.99 93,检测限为5ng/mL( S/N=3 ),定量检出限为20ng/mL( S/N=10 )。各添加水平样品回收率均在95% 以上,日间和日内RSD 均小于5 %,适于样本分析的需要。
该方法将两种及其以上方法结合起来检测样品中林可霉素的含量。实验仪器设备较复杂,使用成本较高,但是方法精确、灵敏,定量检出限可达ng。
3 光谱法
光谱是光经过色散系统分光后,被色散开的单色光按波长大小而依次排列的图案。应用较多的是紫外分光光度法,操作简便、结果准确,所用试剂无毒害作用,具有一定的优越性。
3.1流动注射-化学发光分析法
王志银等[15]利用盐酸林可霉素在NaIO4-H2O2-H+体系中能发生强的化学发光反应,建立了一种测定盐酸林可霉素的流动注射-化学发光分析法,该法检出限3.6×10-8g /mL,RSD为1.0% (cs=1.0×10-6g /mL,n=11),线性范围为1.0×10-7~9.0×10-5g /mL,平均回收率为99.5%,该法操作简单,样品液本身为弱酸性(pH=6.5),故实验中不必对样品进行酸度调节。
陈建福[16]利用盐酸林可霉素对Luminol-KIO4体系化学发光有强烈的增敏作用,与反向流动注射技术结合,建立了流动注射化学发光法测定盐酸林可霉素的含量。结果表明,盐酸林可霉素的线性浓度范围为1.0×10-9~7.0 ×10-5mol/L,检出限为3.4×10-9mol/L,对浓度为1.0×10-7mol/L的盐酸林可霉素连续测定11 次, RSD为 0.8%,以片剂为基体,用标准加入法检验方法的回收率,测得结果在 99.6%~101.0% 之间。
该法是利用盐酸林可霉素在NaIO4-H2O2-H+体系中能发生强的化学发光反应而建立的,检测线低,回收率高。
3.2旋光法
李强,伍国梁[17]利用盐酸林可霉素具有旋光性的特点,采用旋光法测定绿药膏中盐酸林可霉素的含量。结果显示,室温放置4 h 内基本不变,CV为0.2%;平均回收率为99.74%,CV为0.5%;重现性良好;旋光法与微生物法测定绿药膏含量,结果基本一致,但旋光法比微生物法操作简捷,可用于生产厂对本品中间体的质量控制,可加快灌装过程。
尹慧[18]采用旋光法测定盐酸林可霉素注射液的含量。结果表明,盐酸林可霉素在2.0~10.0ml/L的浓度内,线性关系良好;该溶液旋光度在7h内稳定;平均回收率98.6%,RSD为0.36%;与微生物测定法比较含量发现,含量比较接近,且操作简便、易行,适用于药厂对半成品检测和医院 对符合中国药典规定产品的快速检验。
该法利用盐酸林可霉素具有旋光性的特点而建立的,稳定性好,回收率也高。
3.3紫外分光光度法(UV)
徐碧雄等[19]采用UV法测定盐酸林可霉素乳膏的含量。结果显示,样品在36.56~82.26 μg/mL范围内r=0.9996;样品平均回收率为99.63 %,RSD为0.18 %;45.0μg/mL林可霉素溶液,加入氯化钯溶液1.5ml摇匀,24h内吸收值基本无变化。方法操作简便,可作为该制剂的质量控制方法。
文九芳,邹振鸿[20]利用UV法测定盐酸林可霉素甘油中盐酸林可霉素的含量。原理为盐酸林可霉素与钯盐形成稳定配合物,在379.2nm 处有最大吸收。线性范围0.03046~0.1828mg/ml(r =0.9998),平均回收率为100.25%,RSD为1.70 %(n =6)。该方法简捷,结果准确,适用于医院制剂的质量控制。
邵耀东等[21]用UV法测定盐酸林可霉素注射液中林可霉素含量。波长380 nm,质量浓度在25~175μg / mL 范围内时,r = 0.999 8( n = 5) ,线性关系良好;林可霉素吸收度的 RSD=0.44%( n = 5),样品溶液稳定;药品浓度的RSD =0.42% ( n = 5) ,该法重现性良好;平均样品回收率为100.57 %,RSD =0.85%。结果表明该方法稳定、重现性较好。
冯学忠等[22]以 0.02 mol/L 氯化钯溶液为参比液,UV法在 380 nm ±1 nm 波长处测定盐酸林可霉素注射液中林可霉素的含量。结果表明,林可霉素在50~250 μg/mL内,吸光度与浓度呈良好的线性关系,相关系数r =0.9999,平均回收率为99.5%,RSD 为0.9% ( n = 5)。该法和 HPLC 法测定林可霉素的含量,结果基本一致。
该法利用氯化钯与盐酸林可霉素形成稳定络合物,且在380nm 处有最大吸收而建立的,线性关系良好,回收率高。紫外分光光度计较普遍,操作简便、结果准确,所用试剂无毒害作用,具有一定的优越性。操作简便、快速,结果准确,适于作为生产企业中间产品的质量控制方法。
4 小结
通过文献的对比分析发现,林可霉素含量测定方法应用较多的色谱法中的HPLC法。HPLC法具有高速、高效、高灵敏度、色谱柱可重复利用、样品稳定不被破坏、易回收等优点。同时也存在缺点,主要是 “柱外效应”。从进样到检测器检测过程中,除了柱子以外的任何死空间中,如果流动相的流型有变化,被分离物质的任何扩散和滞留都会显著地导致色谱峰的加宽,柱效率降低。高效液相色谱检测器的灵敏度不及气相色谱。而紫外分光光度法等方法相对较少,但方法相对简便、快捷和重现性好、低消耗、低污染,值得进一步关注和探索。
文献多采用硼砂+甲醇或者磷酸+乙腈的溶剂系统做流动相,样品的洗脱能力较强,保留时间较为适宜,峰形对称,分离度较好,分离效果较好。
此外,对于林可霉素制剂多成分同时检出的研究中,检测波长不一样,多为214 nm 下予以研究,也有其他波长,但分离效果均较好,这可能与样品的用量、制剂方法、辅料差异等有关,仍需在试验中进一步考察。在实际应用中,可以结合实验室检测条件,选择合适的方法进行检测,也可以利用各种方法的长处,互相补充,从而达到检测目的。
[1]李利芬,杨国辉,赵文君,等.胶体金法定性检测牛奶中林可霉素的应用[J].中国乳品工业,2014,42(9):53-54.
[2]黄滔敏,段更利,王东蕾,等.HPLC测定复方盐酸去氧肾上腺素喷鼻液中盐酸去氧肾上腺素、地塞米松磷酸钠和盐酸林可霉素的含量[J].复旦学报(医学版),2010,37(5):598-600.
[3]吴洪应,龚纯. HPLC法同时测定林可霉素利多卡因凝胶中林可霉素和盐酸利多卡因的含量[J]. 中国药品标准,2005,6(2):26-28.
[4]陈 明,耿志明.高效液相色谱法测定牛奶中林可霉素的残留量[J].食品科学,2008,29(12):572-574.
[5]朱曦,刘引兰,董文婷.高效液相色谱法测定盐酸林可霉素预混剂中林可霉素的含量[J].湖北畜牧兽医,2012,(10):4-6.
[6]赵明,曾明华,余林生高效液相色谱法检测蜂蜜中林可霉素残留的方法研究[J].蜜蜂杂志,2008,(5):5-7.
[7]吴海港,叶兆伟,刘锦妮.环丙-林可霉素复方长效注射剂在猪体内的药物动力学研究[J].畜牧与兽医,2015,47(8):61-65.
[8]潘蕴慈,徐兵采.林可霉素-环丙沙星复方制剂稳定性的考察[J].中国兽药杂志,1997,32(2):12-15.
[9]梁晓美,陈旭芳,兰海娟,等.林可霉素甲硝唑凝胶的制备及质量控制[J].中国药房,2007,18(22):1723-1724.
[10]李景然. 盐酸林可霉素滴眼液的HPLC法测定[J]. 黑龙江科技信息,2014,(26):134.
[11]高艳,岳静,黄显会,等.林可霉素-大观霉素注射液在猪体内的残留消除研究[J].2014,35(1):106-109.
[12]潘爱华,姚骏骅,陈缵光,等.液相色谱/质谱法检测血液中林可霉素[J].中山大学学报(自然科学版),2005,44(5):46-48.
[13]王鑫芳,刘颖,李明江,等.用薄层色谱法检测林可霉素B 组分[J].中国生化药物杂志,2006,27(6):371,382.
[14]陶燕飞,于刚,陈冬梅,等.动物可食性组织中林可霉素和大观霉素残留检测方法-气相色谱法[J].中国农业科技导报,2008,10(S2):63-68.
[15]王志银,何云华,聂峰.流动注射-化学发光法测定盐酸林可霉素[J].分析试验室2000,19(5):21-23.
[16]陈建福.反相流动注射化学发光法测定盐酸林可霉素[J].嘉应学院学报( 自然科学),2012,30(2):39-41.
[17]李强,伍国梁.旋光法测定绿药膏的盐酸林可霉素含量[J].南京军医学院学报,2000,22(4):259.
[18]尹慧.旋光法测定盐酸林可霉素注射液含量[J].苏州医学院学报,1996,16(2):386-387.
[19]徐碧雄,刘圣,沈爱宗,等.紫外分光光度法测定盐酸林可霉素乳膏的含量[J].中国现代应用药学杂志,1998,15(4):41-42.
[20]文九芳,邹振鸿.紫外分光光度法测定盐酸林可霉素甘油中盐酸林可霉素的含量[J].湖北省卫生职工医学院学报,2002,15(2):42-43.
[21]邵耀东,赵小华,胡彬,等.紫外分光光度法测定盐酸林可霉素注射液中林可霉素含量[J].黑龙江畜牧兽医,2012,(5):89-90.
[22]冯学忠,吴广辉,方炳虎,等. 盐酸林可霉素紫外分光光度测定方法的建立[J]. 动物医学进展,2009,30(12):60-63.
(编辑:严佩峰)
Research on the Progress of Lincomycin Content Determination Method
YE Zhao-wei, WU Hai-gang, LIU Jin-ni, LI Jin-zhe
(College of Biological and Pharmaceutical Engineering, Xinyang Argriculture and Forestry University, Xinyang 464000, China)
Lincomycin has good inhibition effect to gram positive coccus, mainly inhibit bacterial protein synthesis. In recent years,the methods for determination of Lincomycin have been studied by many scholars. The research development on the analytical method of determination about Lincomycin are reviewed systematically through consulting the domestic recent literature,which provides a basis for literature evidence or ideas for further research and determination of Lincomycin.
Lincomycin; HPLC; UV
2015-10-18
河南省高等学校重点科研项目计划( 15B350005) ;信阳市科学技术项目( 140052).
叶兆伟(1982-),男,河南信阳人,讲师,主要从事药物药理作用研究.
O657.3;R927
A
2095-8978(2016)02-0102-05
