铜修饰复合电极检测H2O2
2016-09-03马永均铁珍珍
王 娜,马永均,铁珍珍
(西北师范大学化学化工学院,甘肃 兰州 730070)
铜修饰复合电极检测H2O2
王娜,马永均,铁珍珍
(西北师范大学化学化工学院,甘肃兰州730070)
以铜修饰氰桥配位聚合物复合玻碳电极(CuCME)为工作电极,利用阴极溶出伏安法检测H2O2。实验结果证明,该复合修饰电极是对H2O2有较好的感应,检测H2O2有较明显的峰形,操作简单快捷。在最佳的实验条件下,H2O2的峰电流值和其浓度在0.5~160 mM的范围内呈双对数的线性关系,线性相关系数达到0.9986。此外,该复合修饰电极在灵敏度,重现性和稳定性等方面都有很好的性能。
双氧水;复合电极;铜修饰;阴极溶出伏安法
检测H2O2在临床、生物和工业生产中都非常重要,因为过量H2O2对人体和环境有很多危害。此外,H2O2还是氧化还原酶参与反应的产物[1],通过检测H2O2的浓度可以间接知道其他物质的含量。检测目前检测H2O2有很多方法:化学滴定法[2],色谱法[3],分光光度法[4],化学发光法[5]和电化学法[6-8]等,其中电化学传感器制备简单、操作方便、检测灵敏而被广泛关注[9]。初期使用H2O2传感器时,是用酶参与反应,虽然效果明显但是酶容易变性失活,对pH和温度要求高,使用过程繁琐且价格昂贵,因此,现在无酶H2O2传感器已经是一个热门的领域,并且已经有很多的努力为此付出且卓有成效[10-11]。
因此,本文用电化学沉积的方法制备了一种新型的铜修饰氰桥配位聚合物复合玻碳电极,再利用阴极溶出伏安法研究了H2O2在该电极上的电化学行为。
1 实 验
1.1仪器与试剂
所有的电化学实验都在电化学工作站(CHI760B,上海辰华仪器公司)上进行,并采用三电极测试体系,以铜修饰复合电极(直径为5 mm)为工作电极,铂丝为对电极,Ag/AgCl(1 mol·L-1KCl)为参比电极。双氧水(30%,国药集团化学试剂有限公司);盐酸(优级纯);若无特别说明,其他试剂均为分析纯。实验用水为超纯水。
1.2电极的处理与制备
首先,按常规方法将玻碳电极(ф=5 mm)预处理好,浸入由0.25 mM缬氨酸和100 mM PBS(pH 6.5)组成的修饰电解质中,在0.40~1.52 V(versus Ag/AgCl)电位内以200 mV·s-1速率CV扫描2圈。
然后,经过第一步修饰后的电极被冲洗干净后浸入电镀电解液中电镀氰桥配位聚合物层,根据文献[12], 第二步特殊的电解液(pH 2.65)中包括22.50 μmol硝酸铕,8.50 μmol顺-4-环己烯-1,2-二羧酸,5.50 μmol铁氰化钾(III),0.20 μmol硝酸铁,并放入一氯乙酸缓冲溶液比色管中。在0.50~-0.25 V的电位范围内CV扫描8段,扫速为85 mV·s-1。
1.3分析过程
支持电解质溶液是0.18 M的盐酸+0.025 mg/mL Cu(II)溶液。差示脉冲阴极溶出伏安法(DPCSV)实验参数分别是,脉冲振幅:50 mV,脉冲宽度:0.05 s,脉冲周期:0.2 s。根据实验优化得到的最佳结果,每次实验均在-0.50 V沉积20 s,经过2 s的静息时间后,在-0.35 V~-0.75V的电位范围内记录示差脉冲伏安图。在每次测量之前,工作电极都要在空白的支持电解质溶液中0 V下清洗20 s来除去前一次沉积所带来的干扰。
2 结果与讨论
2.1铜离子的影响
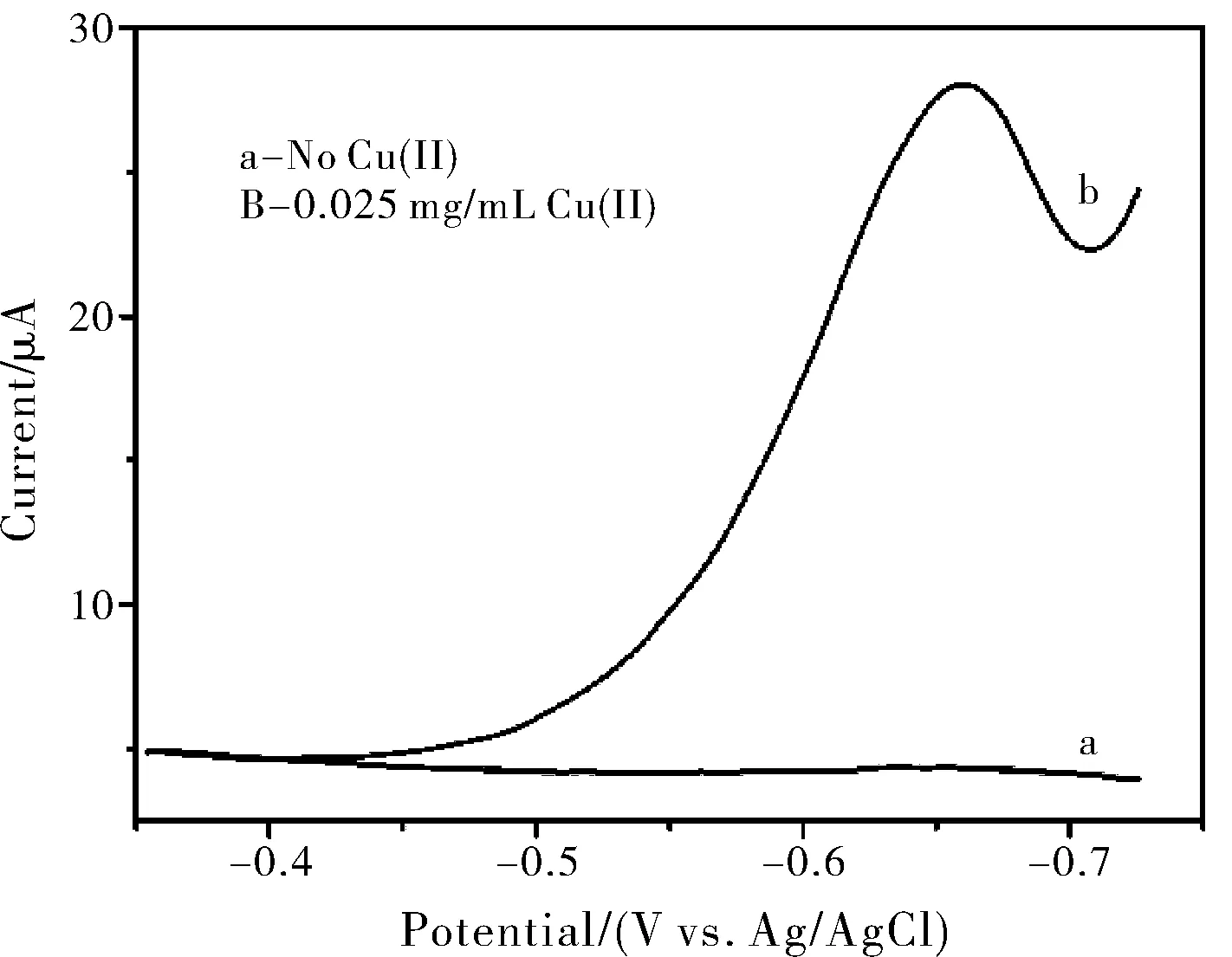
图1 CuCME在0.18M HCl支持电解质中检测1×10-3 MH2O2的DPCSV 伏安图(-0.50 V沉积20 s)
实验考察了支持电解质溶液中是否含有Cu(II)对检测H2O2的影响。从图1中可以明显地观察出,在其他条件相同的情况下,支持电解质中不含有Cu(II)时该复合修饰电极检测H2O2时几乎无电流,可是在支持电解质溶液中加入一定量Cu(II)时,会得到一个非常明显的H2O2峰,并且电流很大,峰形较好。这说明有Cu(II)的参与时,该复合修饰电极能够更灵敏地感应H2O2,因此使得电流响应信号更大。
2.2铜离子浓度的影响
上述实验结果已经证明了Cu(II)参与反应可以显著提高H2O2在CuCME电极上的DPCSV响应信号,因此Cu(II)浓度也是该复合修饰电极检测H2O2重要因素之一。图2为铜修饰复合电极检测1×10-3M H2O2在0.18 M HCl和不同浓度Cu(II)的支持电解质溶液中峰电流趋势图,从图2中可以看出,Cu(II)浓度太小,H2O2的峰电流响应信号非常小(图1也证明了没有Cu(II),H2O2的峰电流响应信号很微弱),Cu(II)浓度超过0.025 mg/mL时,H2O2的峰电流响应信号又略有降低,因此, 0.025 mg/mL为 Cu(II)的最佳浓度,在之后的实验中均使用这个最佳量。
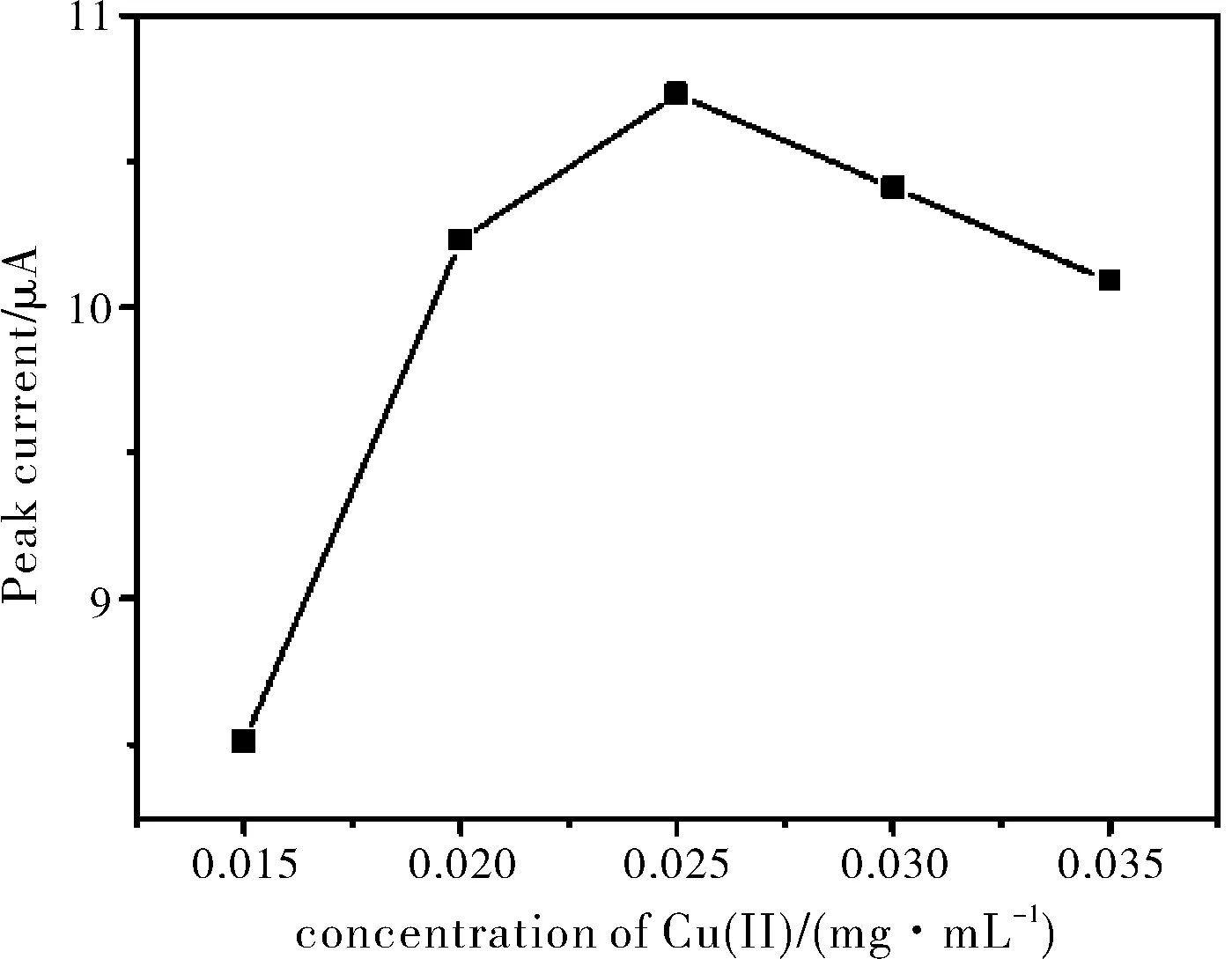
图2 CuCME在0.18 M HCl支持电解质中检测1×10-3 M H2O2的DPCSV峰电流和Cu(II)浓度间的关系图(-0.50 V沉积20 s)
2.3支持电解质中HCl浓度的影响
选支持电解质的浓度在溶出分析中也是非常重要的条件,浓度的大小对分析物的峰电流的大小,形状以及分析物的线性关系都是有影响的。此实验考察了不同浓度的HCl对1×10-3M H2O2峰电流的影响,结果发现: 0.18 M的HCl会使CuCME检测H2O2的电流信号最大,因此,CuCME在之后实验中都选用这个最佳浓度。
2.4沉积电位和沉积时间的选择
图3、图4是在0.18 M HCl中含0.025 mg/mL为 Cu(II)的支持电解质溶液中,CuCME检测H2O2的溶出峰电流和沉积电位、沉积时间的关系图。实验考察了沉积电位从-0.40 V到-0.60 V的H2O2的溶出峰电流的趋势图,从图3中可以看出,-0.50 V处的H2O2的溶出峰电流明显高于其他的沉积电位的H2O2的溶出峰电流,因此最佳的沉积电位是-0.50 V。图4则是沉积时间与H2O2的溶出峰电流的关系图。因为CuCME检测H2O2时能够快速得到响应信号,所以沉积时间的优化点也相对紧密。从图4中可以看出当沉积时间增长到60 s时, H2O2的溶出峰电流便不再增加,出现了平台区,说明60 s的沉积就能使电极表面达到饱和。5~20 s的时间区间与H2O2的溶出峰电流近似成直线变化,且斜率最陡,因此,在以后CuCME检测H2O2的实验中的均选择在-0.50 V的沉积电位下沉积20 s。
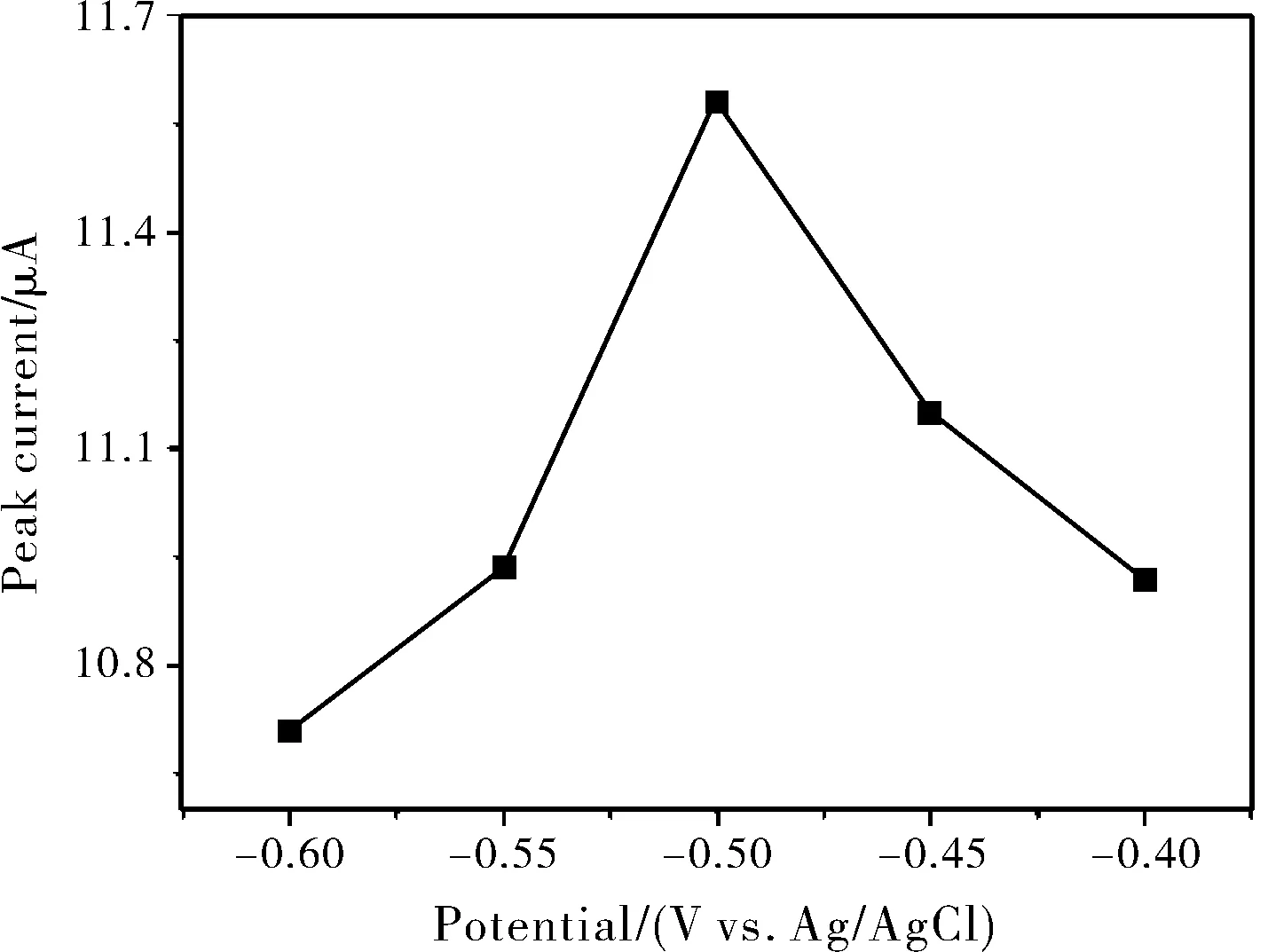
图3 CuCME在0.18 M HCl中含0.025 mg/mL Cu(II)的支持电解质中检测1×10-3 M H2O2的DPCSV峰电流和沉积电位的关系图(沉积20 s)
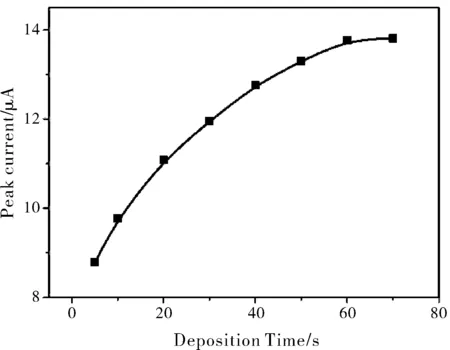
图4 CuCME在0.18 M HCl中含0.025 mg/mL Cu(II)的支持电解质中检测1×10-3 M H2O2的DPCSV峰电流和沉积时间的关系图(-0.50 V沉积)
2.5CuCME的性能验证
图5为在最佳条件下,CuCME测定H2O2差示脉冲伏安图。由于线性区间内全部浓度所对应的H2O2的溶出峰电流值跨度大,在一张图上无法清楚的显示,因此选择其中的一段浓度区间(5.0×10-4~5.0×10-3M)DPCSV伏安图做叠图。从图5中可以看出,随着H2O2浓度的增加,其还原峰电流成比例增加。在0.5~160 mM的浓度范围内,H2O2还原峰电流的对数与其浓度的对数的大小呈良好线性的关系(图6),线性回归方程为logIp(A)=-2.293+0.881logCH2O2(M),R2=0.9986。这说明此铜修饰复合电极能在一段较高的浓度区域内快速地测定H2O2,且线性范围近似3个数量级。
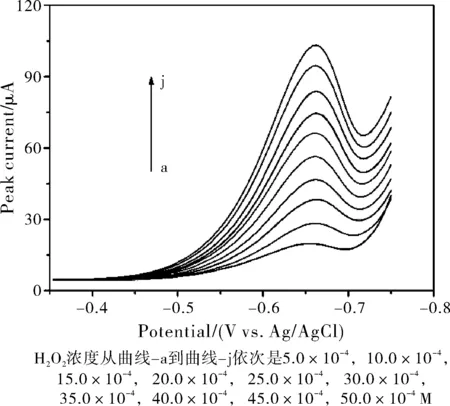
图5 不同浓度的H2O2在CuCME上的示差脉冲伏安图
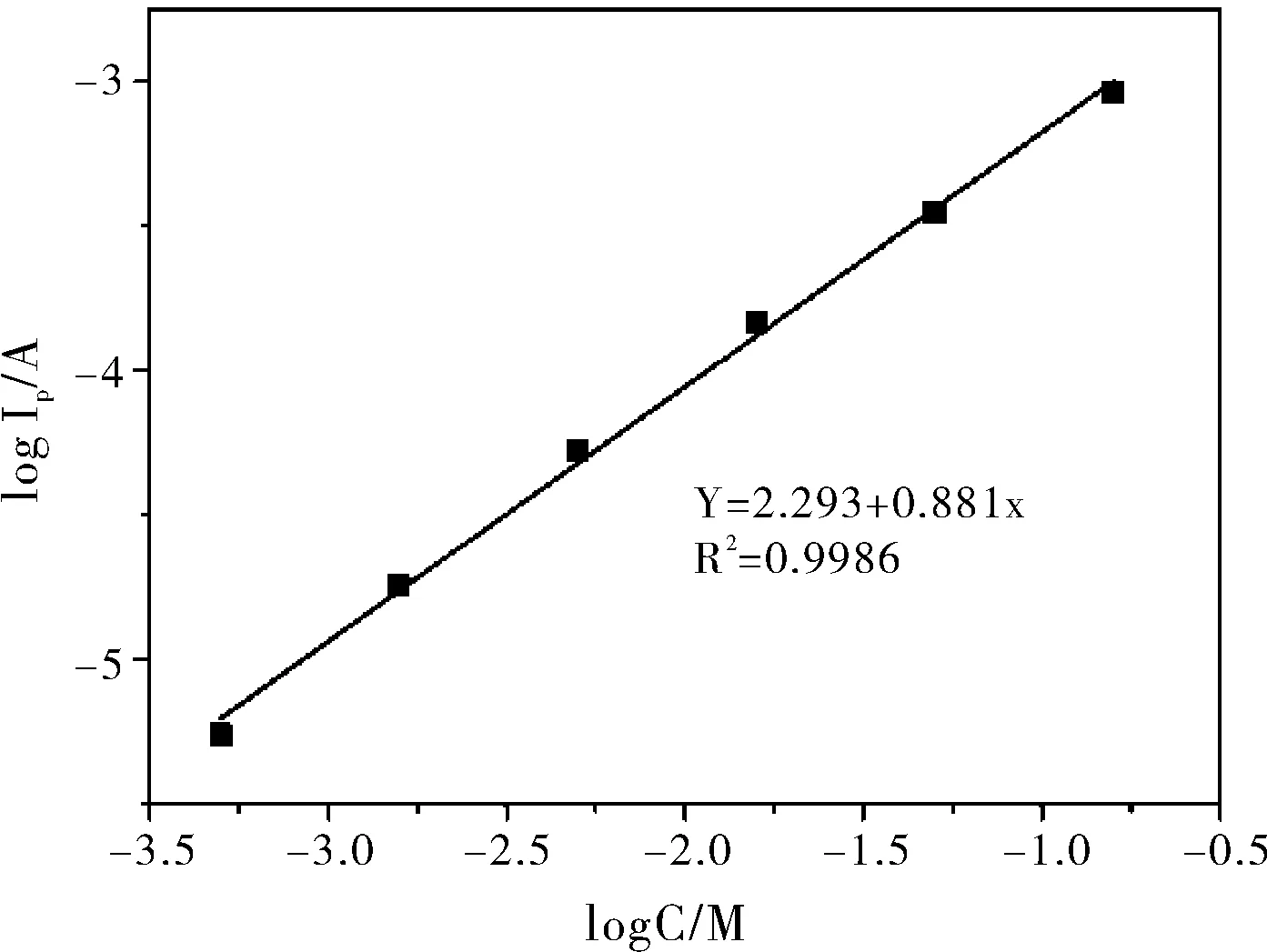
图6 H2O2的溶出峰电流和浓度间的标准曲线
2.6电极的重现性和稳定性
本实验还考察了重复测定5×10-3M H2O2时CuCME的重现性,及其稳定性。结果表明在该复合修饰电极上 H2O2溶出峰电流的相对标准偏差为2.8%,这说明用此复合膜修饰电极对H2O2的测定具有良好重现性。用同一支CuCME测定同一浓度 H2O2,结果表明:同一支电极可以连续使用三周,电流基本保持不变,且峰形、峰位也没有改变,这表明铜修饰复合电极可以长期使用而不降低电流响应信号。
2.7干扰实验
在测定H2O2实验中,影响检测准确性的一个重要因素就是共存干扰物。实验证明对于1×10-3M H2O2, 当误差在±5%范围内,下列物质不干扰测定:乙醇无影响,葡萄糖(2000 mg/L),Na2SO4(1400 mg/L),KNO3(1000 mg/L),酒石酸(1000 mg/L),柠檬酸(1000 mg/L),尿素(750 mg/L),L-谷氨酸(700 mg/L),抗坏血酸(100 mg/L)。
3 结 论
本实验以铜修饰氰桥配位聚合物复合玻碳电极(CuCME)为工作电极测定H2O2。从DPCSV伏安曲线上证明,H2O2在一段较宽的浓度范围内的峰电流与各自的浓度呈双对数的线性关系,而且在此H2O2传感器重现性好,稳定性高,能够简单、快速地测定较大浓度的H2O2。
[1]欧朝凤,袁若,柴雅琴,等. 基于硫瑾/碳纳米管修饰金电极的过氧化氢生物传感器[J]. 分析化学研究简报, 2007, 35(7): 1011-1014.
[2]E C Heudis, H Romeyn. Accuracy of determination of hydrogen peroxide by cerate oxidimetry [J].Analytic Chemistry, 1954, 26(2): 320-325.
[3]S Effkemann, U Pinkernell, U Karst. Peroxide analysis in layndry detergents using liquid chromatography [J]. Analytical ChimicaActa, 1998, 363(1): 97-103.
[4]范华峰, 张忠义, 刘振林. 分光光度法测定食品中过氧化氢[J]. 中国卫生检验杂志, 2006, 6(9): 1079-1080.
[5]K Nakashima, K Maki, S Kawaguchi, et al. Peroxyoxalate chemiluminescence assay of hydrogen peroxide and glucose using 2,4,6,8-tetrathiomorpholinopyrimido[5,4,d]-pyrimdine as a fluorescent component [J]. Analytical Aciences, 1991, 7(5): 709-713.
[6]B Wang, J J Zhang, Z Y Pana, et al. A novel hydrogen peroxide sensor based on the direct electron transfer of horseradish peroxidase immobilized on silica-hydroxyapatite hybrid film [J]. Biosensors and Bioelectronics, 2009, 24(5): 1141-1145.
[7]X Lu, J Zhou, W Lu, et al. Carbon nanofiber-based composites for the construction of mediator-free biosensors [J]. Biosensors and Bioelectronics, 2008, 23(8): 1236-1243.
[8]姚飞, 贾丽萍, 霍瑞伟, 等. 纳米银/ds-DNA/聚(3,4-乙烯基二氧噻吩)复合膜修饰电极的制备及应用于过氧化氢无酶传感器[J]. 传感技术学报, 2013, 26(6): 762-768.
[9]M P N Bui, X H Pham, K N Han, et al. Electrocatalytic reduction of hydrogen peroxide by silver particles patterned on single-walled carbon nanotubes [J]. Sensors and Actuators B: Chemical, 2010, 150(1): 436-441.
[10]W Gao, W W Tjiu, J Wei, et al. Highly sensitive nonenzymatic glucose and H2O2sensor based on Ni(OH)2/electroreduced grapheme oxide-Multiwalled carbon nanotube film modified glass carbon electrode[J]. Talanta, 2014, 20: 484-490.
[11]B Zhao, Z Liu, W Fu, et al. Construction of 3D electrochemically reduced graphene oxide-silver nanocomposite film and application as nonenzymatic hydrogen peroxide senso [J].Electrochemistry Communications, 2013, 27: 1-4.
[12]Y Ma, Z Jin, B Peng, et al. Investigation of direct electrooxidation behavior of NADH at a chemically modified glassy carbon electrode[J].Journal of the Electrochemical Society, 2015, 162(6): H317-H320.
Cu Modified Composite Electrode for Determination of H2O2
WANGNa,MAYong-jun,TIEZhen-zhen
(College of Chemistry & Chemical Engineering, Northwest Normal University, Gansu Lanzhou 730070, China)
The Cu modified cyano-bridged mixed coordination polymer composite glassy carbon electrode (CuCME) as working electrode to determine H2O2by cathodic stripping voltammetry. The experimental results showed that the CuCME had good reponse and distinct peak shape for determination H2O2, and the operation was simple and quick. What’s more, under the optimum conditions, the peak current value and concentration (0.5~160 mM) of H2O2presented the double logarithm linear relationship and the linear correlation coefficient was 0.9986. In addition, the CuCME had excellent properties of sensitivity, reproducibility and useable endurance.
H2O2; composite electrode; Cu modified; cathodic stripping voltammetry
O657.1
B
1001-9677(2016)07-0116-03
