EGFR、PDGFRA和VEGFR2在结肠癌中的表达及变异分析
2016-09-03邓子龙刘蔚东中南大学湘雅医院湖南长沙410008
邓子龙,刘蔚东(中南大学湘雅医院,湖南 长沙 410008)
临床论著
EGFR、PDGFRA和VEGFR2在结肠癌中的表达及变异分析
邓子龙,刘蔚东
(中南大学湘雅医院,湖南 长沙 410008)
目的探讨受体酪氨酸激酶表皮生长因子受体(EGFR),血小板源性生长因子受体α多肽(PDGFR A)和血管内皮细胞生长因子受体2(VEGFR 2)在30例结肠癌中的过表达及基因突变情况。方法收集该院确诊为结肠癌的30例组织标本,免疫组织化学检测组织标本中EGFR,PDGFR A和VEGFR 2表达情况,PCR-SSCP检测标本中EGFR(外显子18-21)和PDGFR A(外显子12、14和18)的基因突变情况。 结果收集该院确诊为结肠癌的30例组织标本,免疫组织化学显示EGFR的阳性表达率为43.3%(13/30),但是EGFR热点区域(外显子18-21)未检测到激活突变。而在17例患者(56.7%)中检测到EGFR外显子20的密码子787(Q787Q)的一处无义碱基替换(CAG>CAA)。PDGFR A在所有恶性细胞中阳性表达,热点区域也未发现激活突变,但是9例标本中的12号外显子的密码子567发生CCA>CCG无义突变;4例标本中的18号外显子的密码子824发生GTC>GTT无义突变。在2例标本中还发现,14号内含子有两处碱基改变IVS14+3G>A 和IVS14+49G>A,4例标本中的18号内含子存在IVS18-50insA改变。有22例(73.3%)中VEGFR 2阳性表达,且VEGFR 2表达与肿瘤未转移呈正相关(P=0.038)。结论结肠癌中虽然EGFR和PDGFR A过表达,但是未检测到激活突变,而VEGR 2也在结肠癌中过表达,其表达与肿瘤未发生转移有关。本研究结果为未来结肠癌治疗提供可能的方向。
表皮生长因子受体;血小板源性生长因子受体α多肽;血管内皮细胞生长因子受体2;结肠癌
结肠癌是人类最常见的恶性消化道肿瘤,全球每年有超过100万新增确诊结肠癌病例,是世界上引起死亡的主要癌症之一[1]。结肠癌是正常结肠上皮恶性转化为腺瘤性息肉的结果[2]。尽管结肠癌被大多数发达国家列入早期肿瘤筛查项目,结肠癌治疗方法取得长足进步,但是结肠癌仍然是女性因癌症死亡的第2大原因,男性因癌症死亡的第3大原因[3]。根据目前的治疗条件,早期根治性手术切除仍是结肠癌最有效的治疗方法。然而,晚期结肠癌患者可供选择的治疗方法并不多,且疗效都不理想。因此,结肠癌早期诊断十分必要。目前,广泛使用的结肠癌分类系统是国际抗癌联盟(The International Union against Cancer,UICC)分期标准,该系统是基于临床病理特征,如肿瘤大小、淋巴结转移及器官转移等情况进行分类。然而,由于结肠癌患者具有异质性,UICC分期标准并不能够准确预测结肠癌患者临床结局。结肠癌患者临床表现各不相同,即使处于相同阶段的结肠癌结局也可能大不相同。因此,通过更好地阐述结肠癌分子基础识别结肠癌特异性生物标志物和治疗靶点将有助于开发结肠癌新的治疗手段。
有丝分裂信号机制的分布,尤其是受体酪氨酸激酶(receptor tyrosine kinases,RTKs)信号是肿瘤进展的标志性事件,目前RTKs已成为靶向治疗的主要靶点[4]。RTKs是跨膜蛋白,由细胞外区域、跨膜区域、近膜区域和细胞内区域等组成,而两个激酶区定位于细胞内区域。当RTKs与生长因子结合、受体二聚化和自我磷酸化时,位于细胞内区域的酪氨酸残基激活MAPK、PI3K、JAK/STAT等信号通路途径,从而影响细胞内基因表达。在肿瘤发生和发展过程中,RTKs通常表达下调,并且通过过度磷酸化维持信号传导通路在激活状态,导致肿瘤生长、进展、增殖、去分化、凋亡抑制、转移和血管生成[5-6]。
在不同种类的RTK中,Ⅰ类[如酪氨酸激酶表皮生长因子受体(epidermal growth factor receptor,EGFR)]和Ⅲ类[如血小板源性生长因子受体α多肽(platelet-derivedgrowthfactorreceptoralpha,PDGFRA)、KIT、血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)等]被证实参与器质性肿瘤形成过程[7]。EGFR是首个被证实与人类肿瘤有关的RTK,EGFR拮抗剂已成为癌症治疗的新希望,EGFR拮抗剂主要分为两类,一类是针对胞外区域的单克隆抗体,如西妥昔单抗;另一类是小分子酪氨酸激酶抑制剂,如吉非替尼(Gefitinib)和厄洛替尼(Erlotinib)等[8]。近年来,小分子改变已被证实与患者对新研发的抗EGFR药物的响应率有关,尤其是EGFR胞内激酶区域(外显子18-21)热点区的EGFR突变是吉非替尼和厄洛替尼治疗肺癌有效性的重要预测因子。有临床研究报道,伊马替尼等KIT和PDGFRA抑制剂在胃肠道基质肿瘤治疗中取得了良好效果[9]。与抗EGFR药物类似的是,KIT和PDGFRA基因的特异性激活基因突变与患者对伊马替尼响应率有关。除了这些选择性抑制剂,多靶点抑制剂在肿瘤治疗中也取得了重要突破,如靶向抑制KIT、PDGFR和VEGFR2的舒尼替尼(Sunitinib);靶向KIT、VEGFR2、PDGFR和BRAF等细胞内酪氨酸激酶的索拉菲尼;靶向KIT、PDGFR 和VEGFR的帕唑帕尼等。VEGFR2不但是促有丝分裂因子,也是重要的血管生成因子,因此阻断VEGFR2活性在肿瘤治疗中具有重大价值。近来有研究报道,结肠癌中未见KIT分子变异,并发现小部分病例中KIT通过KIT/SCF共表达激活[10]。本文的实验主要研究结肠癌中EGFR、PDGFRA和VEGFR2等RTKs的过表达和激活基因突变等表达变异情况,并评估RTKs在结肠癌治疗中的作用价值。
1 材料与方法
1.1研究对象
选取2001年1月-2012年12月于中南大学湘雅医院就诊并经病理确诊为结肠癌的30例病理和随访资料完整的患者纳入本次研究。其中,男性17例,女性13例;年龄24~77岁,平均(49±44.7)岁,12例患者伴淋巴结转移,2例患者疾病复发。评价随访时间为24个月。
1.2EGFR、PDGFRA和VEGFR2免疫组织化学检测
免疫组织化学染色采用二步法染色(SP法),具体操作按说明书一、二抗杂交,最后经DAB显色,逐级脱水、透明、封片。
1.3肿瘤组织DNA准备
按照试剂盒说明提取结肠癌组织中的基因组DNA,置于-20℃冰箱冷冻保存备用。
1.4EGFR与PDGFRA基因突变检测
采用下述引物聚合酶链反应扩增EGFR基因外显子18-21和PDGFRA基因外显子12、14和18,EGFR正向引物:5'-GGTACTGGTGGAGTATGATAG -3',反向引物:5'-TGGTCCTGCACCAGTAATATG-3';PDGFRA正向引物:5'-CTCTFCATAATGCTTGCTCT GATAGC-3',反向引物:5'-GTGGAAAAATAGCCTCA ATTC-3',扩增产物长度分别为248bp和211bp。反应条件为:初始变性94℃、5 min;94℃、30 s,56℃、30 s,72℃、20 s,45个循环;72℃延伸10 min;4℃结束反应。PCR产物经3%琼脂糖凝胶电泳确定后,用ABI公司的3730XL测序仪进行序列分析。应用Chromas软件在信噪比>98%的条件下判断基因突变情况。
1.5统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,计数资料以率表示,两两组间用χ2检验和均数t检验,P<0.05为差异有统计学意义。
2 结果
2.1EGFR表达特征
免疫组织化学分析表明,EGFR的阳性(2+/3+)表达率约为43.3%(13/30)(见图1)。本实验还通过突变分析探讨EGFR过表达的可能分子基础,结果显示EGFR基因的“热点区”(内含子18-21)中无突变,但是在17例(56.7%)患者第20号内含子的787号密码子中检测到沉默碱基替换(CAG>CAA)。EGFR基因变化和临床病理参数无相关性。
2.2PDGFRA表达特征
免疫组织化学结果表明,30例结肠癌中21例PDGFRA强阳性表达(3+),6例中等阳性表达(2+),3例阳性表达(+),所有病例都呈阳性表达(见图2)。PDGFRA阳性表达于肿瘤细胞浆和内皮细胞及成纤维细胞等基质成分。
本研究同样对30例结肠癌中PDGFRA的热点外显子12、14和18进行突变分析,结果同样未发现PDGFRA的激活突变。然而本研究发现,PDGFRA中存在沉默突变,在9例患者中发现PDGFRA12号外显子第567号密码子中的碱基替换(CCA>CCG);还在4例患者中发现PDGFRA18外显子第824号密码子中的碱基替换(GTC>GTT)。此外,在2个不同病例中发现14号内含子碱基替换(IVS14+3G>A和IVS14+49G>A)(见图3),在4个病例中发现了18号内含子(IVS18-50insA)碱基替换(见附表)。由于所有病例中PDGFRA表达均为阳性,因此PDGFRA表达与病理参数之间的相关性无法进行分析。
2.3VEGFR2表达特征
免疫组织化学结果检查VEGFR2的阳性表达率为73.3%(22/30),6例为中等阳性表达(2+),16例为强阳性表达(3+),VEGFR2阳性表达主要定位于恶性细胞细胞浆。基质中未发现VEGFR2阳性表达,但是在少数肿瘤细胞周围的内皮细胞弱阳性表达(见图4)。VEGFR2表达与临床病理参数表明VEGFR2过表达与肿瘤不发生转移呈正相关(P=0.038)。
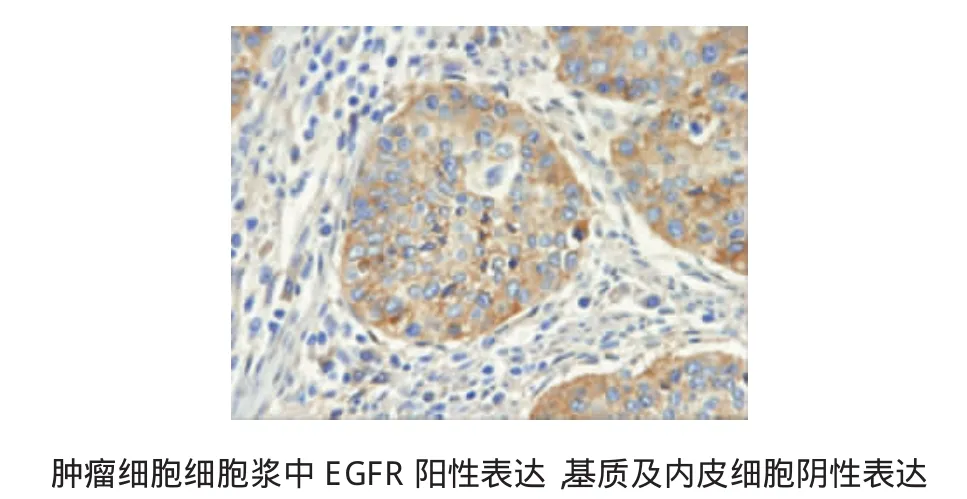
图1 免疫组织化学检测EGFR在结肠癌中的表达 (×40)
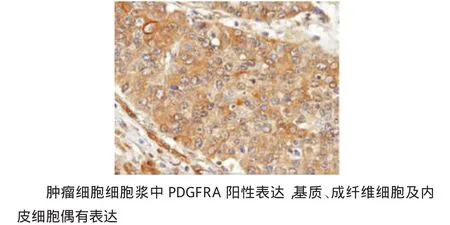
图2 免疫组织化学检测PDGFRA在结肠癌中的表达 (×40)

图3 PDGFRA序列部分电泳图谱
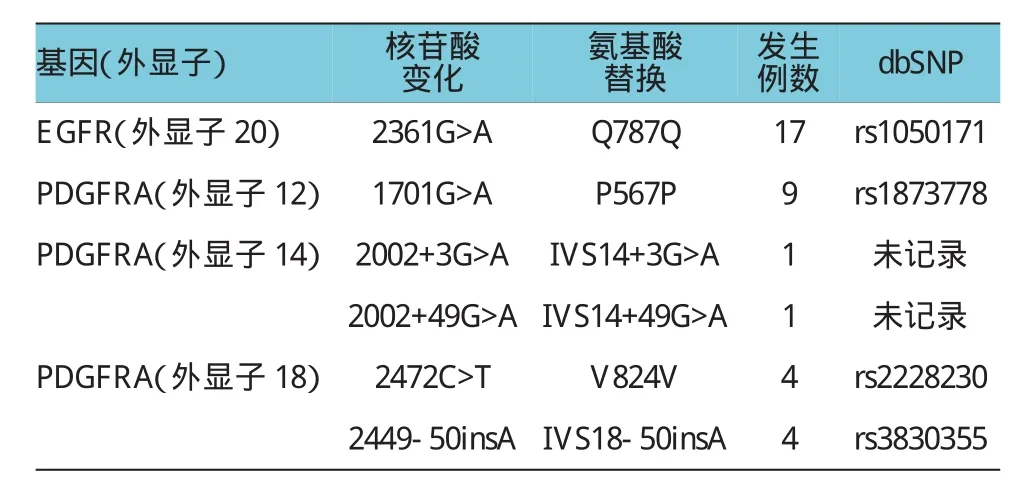
附表 结肠癌中EGFR和PDGFRA基因突变类型分析
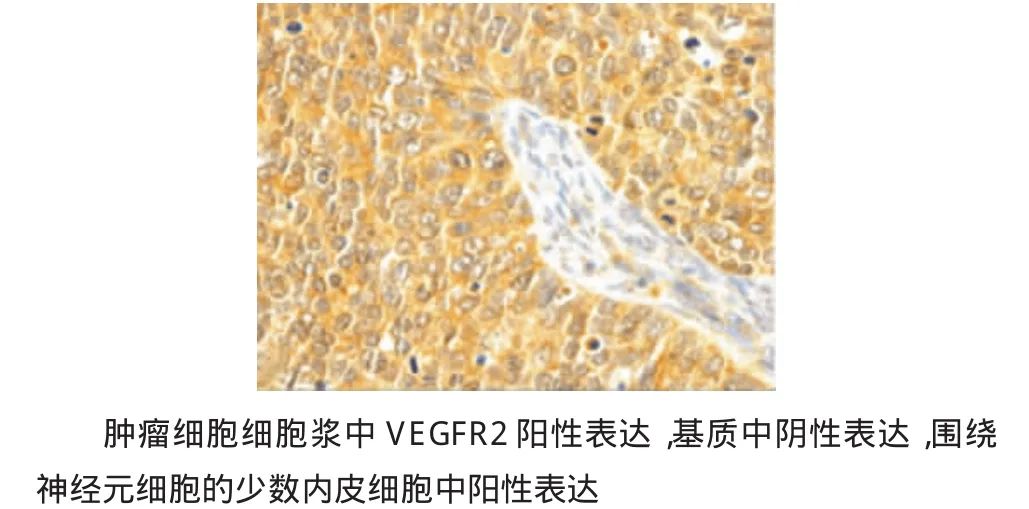
图4 免疫组织化学检测VEGFR2在结肠癌中的表达 (×40)
3 讨论
随着人们对肿瘤细胞中分子改变事件认识的不断加深,使得有效靶向治疗肿瘤的新药物层出不穷。EGFR、PDGFR和VEGFR2等分子在肿瘤增殖和血管生成中发挥重要,是肿瘤治疗的潜在靶点。本研究结果可用于识别这些治疗靶点的分子改变,而这些治疗靶点能够预测结肠癌对选择性抑制剂治疗的阳性反应率。
EGFR过表达在结肠癌中发生频率较高,频率范围一般在25%~70%间[11]。本研究和以往其他研究结果显示,EGFR在33%~43%的结肠癌中过表达[12]。尽管存在EGFR过表达,本文的实验并未发现结肠癌中有EGFR激活基因突变,但是在17例标本中(56%)发现EGFR第20号内含子中的787号密码子中有沉默碱基替换(CAG>CAA)。这一多态性被称为单核苷酸多态性(single nucleotide polymorphism,SNP),EGFR的SNP具有人种差异,在亚洲和非裔美国人群中G等位基因发生频率更高,而欧洲人种中A等位基因发生频率更高(rs1050171,NCBI SNP数据库),NP在EGFR功能中的作用目前仍不清楚。Taguchi等[13]在不同基因表达型头颈部鳞状细胞癌细胞株中未发现EGFR mRNA和蛋白表达水平有变化,但是其研究发现G/A杂合基因型细胞株对吉非替尼的敏感性明显高于G/G纯合基因型头颈部鳞状细胞癌细胞株。Arias-Pulido等[14]近来在89例宫颈癌(75例鳞状细胞癌、9例腺癌及5例腺鳞癌)中研究也未发现EGFR激活突变,EGFR在腺鳞癌中过表达机制仍有待进一步研究。以往研究还发现EGFR能够被EGFR基因扩增或HPV E5和E6 等HPV癌基因蛋白调控,HPV E5和E6通过抑制EGFR内吞和降解使EGFR表达水平升高[15]。有临床实验评价了抗EGFR治疗对进展期结肠癌的效果,该研究目前正在进行西妥昔单抗单独或联合放疗治疗复发性或早期结肠癌。一项30例局部复发进展期或转移性结肠癌患者参与的多中心Ⅱ期临床实验发现基于吉非替尼治疗后,患者无客观反应率,且1/ 5的患者疾病稳定进展,该研究结果提示药物肿瘤响应率与EGFR免疫组织化学检测的表达结果无关[16]。该结论并不出乎研究者们的意料,因为某些肿瘤患者,特别是肺癌患者,与显著临床响应有关的参数并不是EGFR免疫活性,而是EGFR酪氨酸激酶激活突变。本研究显示结肠癌中没有EGFR激活突变情况,因此笔者推测厄洛替尼和吉非替尼单独使用的药效性较低。
目前,有关PDGFRA在结肠癌发生过程中作用的研究较少。Estevez-Garcia等[17]分析36例结肠癌组织中PDGFRA的表达情况,结果表明PDGFRA在肿瘤细胞中的过表达率为42%,而在基质细胞中的过表达率仅为8%。Bernal-Sprekelsen等[18]最近的一项研究中发现PDGFRA几乎全部表达于结肠癌的基质,而在肿瘤新生细胞中较少表达。本研究显示结肠癌中,PDGFRA主要过表达于肿瘤基质或者新生肿瘤细胞中。造成该结果的原因可能是研究小组间使用的抗体不一致或者分析的标本组织学亚型不一致。本研究显示不管是否存在基因变异,结肠癌中未检测到PDGFRA的激活突变,这些基因变异绝大部分属于基因变异。本研究结果与Estevez-Garcia 等[17]在36例结肠癌中的研究结果一致。然而,最近在大鼠模型和结肠癌肿瘤标本中的前临床研究显示基于伊马替尼的治疗对宫颈癌有一定疗效。
VEGFR2广泛分布于人类疾病和肿瘤中。以往研究认为VEGFR2主要分布于激活的内皮细胞,但是近来免疫组织化学研究发现VEGFR2也分布于肿瘤细胞中,磷酸化VEGFR2易位至肿瘤细胞核是肿瘤发展过程中常见事件,这可能与肿瘤中存在自分泌VEGF/VEGFR2环有关。Shen等[19]研究显示VEGFR2是前癌干细胞(precancerous stem cell,pC-SCs)标志物。本文实验显示VEGFR2在大约2/3的结肠癌中阳性表达,但是VEGFR2过表达与肿瘤未发生转移相关,该结果提示结肠癌中还存在其他促进转移的分子,如本研究发现的那样VEGFR2在肿瘤细胞浆中过表达。目前,对结肠癌患者采用抗VEGFR2药物治疗已在进行临床实验,其中索拉菲尼和放疗及顺铂联合治疗正在进行Ⅰ、Ⅱ临床评估。研究认为,同时抑制多种受体酪氨酸激酶能够优化分子靶向抑癌药物相关的总疗效。目前,帕唑帕尼和拉帕替尼联合或单独治疗转移结肠癌的疗效和安全性正在进行临床研究,拉帕替尼是EGFR和HER2的双重酪氨酸激酶及抑制[20]。
总之,本研究全面分析结肠癌中 EGFR、PDGFRA和VEGFR2等癌基因蛋白的表达和变异情况,结果表明结肠癌中虽然EGFR和PDGFRA过表达,但是未检测到激活突变,而VEGR2也在结肠癌中过表达,其表达与肿瘤未发生转移有关。本研究结果为未来结肠癌治疗提供了可能的方向。
[1]GJ S.World health classification of tumours pathology and genetics:tumours of the digestive system[J].Lancet Oncology,2001, 22(7):454-455.
[2]Kim JC,Kim SY,Roh SA,et al.Gene expression profiling: canonical molecular changes and clinicopathological features in sporadic colorectal cancers[J].World J Gastroenterol,2008,14(43): 6662-6672.
[3]Honein-AbouHaidar GN.Benefits and barriers to participation in colorectal cancer screening:a protocol for a systematic review and synthesis of qualitative studies[J].Bmj Open,2014,4(2): 297-301.
[4]Mirshafiey A,Ghalamfarsa G,Asghari B,et al.Receptor Tyrosine Kinase and Tyrosine Kinase Inhibitors:New Hope for Success in Multiple Sclerosis Therapy[J].Innov Clin Neurosci,2014,11(7/8): 23-36.
[5]Grusch M,Schelch K,Riedler R,et al.Spatio-temporally precise activation of engineered receptor tyrosine kinases by light[J].The EMBO Journal,2014,33(8):1713-1726.
[6]Del Campo JM,Prat A,Gil-Moreno A,et al.Update on novel therapeutic agents for cervical cancer[J].Gynecol Oncol,2008, 110(8):S72-76.
[7]Hojjat-Farsangi M.Small-molecule inhibitors of the receptor tyrosine kinases:promising tools for targeted cancer therapies[J].Int J Mol Sci,2014,15(8):13768-13801.
[8]Wu LL,Zhang ZQ,Yao HL,et al.Clinical efficacy of second-generation tyrosine kinaseinhibitors in imatinib-resistant gastrointestinal stromal tumors:a meta-analysis of recent clinical trials[J].Drug Des Devel Ther,2014,8(6):2061-2067.
[9]Sosipatros A,Boikos,Constantine A,et al.The genetic landscape of gastrointestinal stromal tumor lacking KIT and PDGFRA mutations[J].Endocrine,2014,47(2):401-408.
[10]Gavert N.c-Kit Is Suppressed in Human Colon Cancer Tissue and Contributes to L1-Mediated Metastasis[J].Cancer Research, 2013,73(18):5754-5763.
[11]Laurent-Puig P.Analysis of PTEN,BRAF,and EGFR status in determining benefit from cetuximab therapy in wild-type KRAS metastatic colon cancer[J].Journal of Clinical Oncology,2009, 27(35):5924-5930.
[12]Press OA.Gender-related survival differences associated with EGFR polymorphisms in metastatic colon cancer[J].Cancer Research,2008,68(8):3037-3042.
[13]Taguchi T,Tsukuda M,Imagawa-Ishiguro Y,et al.Involvement of EGFR in the response of squamous cell carcinoma of the head and neck cell lines to gefitinib[J].Oncol Rep,2008,19(5): 65-71.
[14]Arias-Pulido H,Joste N,Chavez A,et al.Absence of epidermal growth factor receptor mutations in cervical cancer[J].Int J Gynecol Cancer,2008,18(9):749-754.
[15]Zhang B,Srirangam A,Potter DA,et al.HPV16 E5 protein disrupts the c-Cbl-EGFR interaction and EGFR ubiquitination in human foreskin keratinocytes[J].Oncogene,2005,249(19): 2585-2588.
[16]Lynch TJ,Bell DW,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of nonsmall-cell lung cancer to gefitinib[J].N Engl JMed 2004,20(350):2129-2139.
[17]Estevez-Garcia P,Castano A,Martin AC,et al.PDGFR alpha/beta and VEGFR2 polymorphisms in colorectal cancer:incidence and implications in clinical outcome[J].Bmc Cancer, 2012,12:514(5):683-697.
[18]Bernal-Sprekelsen JC.Spontaneous rectovaginal fistula during bevacizumab therapy for colon cancer[J].International Journal of Colorectal Disease,2013,28(4):591.
[19]Shen R,Ye Y,Chen L,et al.Precancerous stem cells can serve as tumor vasculogenic progenitors[J].PLoS ONE,2008,3(7): e1652.
[20]Faivre S,Djelloul S,Raymond E.New paradigms in anticancer therapy:targeting multiple signaling pathways with kinase inhibitors[J].Semin Oncol,2006,33(19):407-420.
(张蕾编辑)
Molecular characterization of EGFR,PDGFRA and VEGFR2 in colon cancer
Zi-long Deng,Wei-dong Liu
(Xiangya Hospital,Central South University,Changsha,Hunan 410008,China)
Objective To investigate EGFR,PDGFRA and VEGFR2 RTKs overexpression and activating gene mutations in a cohort of 30 colon cancer patients sample.Methods EGFR,PDGFRA and VEGFR2 immunohistochemistry was performed in all samples,followed by DNA isolation from the gross macroscopically dissection of the neoplastic area.Screening for EGFR(exons18-21)and PDGFRA(exons12,14 and 18)mutations was done by PCR-single-strand conformational polymorphism(PCR-SSCP).Results Despite the presence of EGFR immunohistochemical positive reactions in 43%(13/30)of the samples,no EGFR activating mutations in the hotspot region(exons18-21)were identified.A silent base substitution(CAG>CAA)in EGFR exon 20 at codon 787(Q787Q)was found in 17 cases(56%).All PDGFRA immunohistochemical reactions were positive and consistently observed in the stromal component,staining fibroblasts and endothelial cells,as well as in the cytoplasm of malignant cells.No activating PDGFRA mutations were found,yet,several silent mutations were observed,such as a base substitution in exon 12 (CCA>CCG)at codon 567(P567P)in 9 cases and in exon18(GTC>GTT)at codon 824(V824V)in 4 cases.We also observed the presence of base substitutions in intron 14(IVS14+3G>A and IVS14+49G>A)in two different cases,and in intron 18(IVS18-50 insA)in 4 cases.VEGFR2 positivity was observed in 22 of 30 cases(73.3%),and was significantly associated with lack of metastasis(P=0.038).Conclusions Despite the absence of EGFR and PDGFRA activating mutations,the presence of overexpression of these three important therapeutic targets in a subset of cases may be important in predicting the sensitivity of colon cancer to specific anti-RTKs drugs.
EGFR;PDGFRA;VEGFR2;colon cancer
R 735.35
A
10.3969/j.issn.1005-8982.2016.04.005
1005-8982(2016)04-0024-05
2015-08-26
