miR-101、miR-223和miR-424在肺结核诊断中的价值*
2016-09-02颜保松邓少丽
颜保松,王 静,罗 杰,陈 鸣,邓少丽△
(1.第三军医大学大坪医院野战外科研究所检验科,重庆 400042;2.重庆市公共卫生医疗救治中心检验科 400036)
论著·临床研究
miR-101、miR-223和miR-424在肺结核诊断中的价值*
颜保松1,王静2,罗杰1,陈鸣1,邓少丽1△
(1.第三军医大学大坪医院野战外科研究所检验科,重庆 400042;2.重庆市公共卫生医疗救治中心检验科400036)
目的探寻对肺结核有潜在诊断价值的miRNA标记物。方法以健康组、肺炎组和肺癌组作为对照组,以肺结核患者作为肺结核组,采用qRT-PCR技术检测并分析8种miRNA(miR-21、miR-29a、miR-101、miR-378、miR-146a、miR-223、miR-361-5p和miR-424)在44例肺结核组和98例对照组外周血单个核细胞中的表达差异。选取合适的miRNA采用Logistic回归进行筛选并建立回归方程,通过ROC曲线评价该方程的诊断效能。结果Logistic回归筛选出3种对肺结核诊断有意义的miRNA分子即miR-101、miR-223和miR-424,ROC曲线分析显示这3种miRNA的组合对肺结核具有良好的诊断效能:AUC=0.939,诊断特异性为81.63%,灵敏性为90.91%。结论miR-101、miR-223和miR-424可作为肺结核潜在的有诊断价值的标记物。
微RNAs;结核,肺;诊断;标记物
结核病是一个重大的全球性公共卫生问题,严重威胁着人类健康。肺结核是结核病中最常见的临床类型,相比肺外结核,其能够经飞沫播散的特性注定了其在结核病防控工作中的重要地位。然而肺结核因临床表现多样,影像学表现缺乏足够的特异性,实验室也缺乏理想的生物学指标,致使其诊断至今仍然困扰着临床医务工作者。MicroRNA(miRNA)是一类长度约22 nt的非编码单链RNA,通过抑制或降解特异性mRNA分子介导基因转录后调控,参与到细胞的多种生物学进程,与许多疾病的发生、发展密切相关[1]。近年来miRNA表达及功能的相关研究表明结核病患者体内一些miRNA的表达水平发生了改变[2],基因组学的研究结果也间接证实了上述结论[3-4],提示这些异常表达的miRNA有可能作为诊断肺结核潜在的生物标记物。本研究选取多种已报道的表达有差异的miRNA通过qRT-PCR技术进行检测验证,采用Logistic回归并结合ROC曲线进行分析,旨在筛选出对肺结核有诊断价值的miRNA分子。
1 资料与方法
1.1一般资料肺结核组44例,选自2015年9~11月就诊于重庆市公共卫生医疗救治中心的住院患者;对照组98例,为同期就诊于第三军医大学大坪医院野战外科研究所的住院患者(肺炎组、肺癌组)和健康体检者(健康组)。患者纳入标准:(1)年龄18~75岁;(2)无人类免疫缺陷病毒(HIV)感染及其他自身免疫性疾病,近期未接受过糖皮质激素类药物或免疫抑制剂类药物的治疗;(3)无心、肝及肾等脏器的功能障碍;(4)健康组为无任何临床症状且常规体检未发现异常者,肺结核组、肺炎组及肺癌组均由3位经验丰富的医生根据临床表现、影像学资料、微生物学结果及病理结果等作出诊断;(5)活动性肺结核组及肺炎组未经针对性治疗或治疗时间小于3 d,且无肿瘤及其他感染性疾病;肺癌组未经手术切除或化疗时间小于3 d,且无其他肿瘤及感染性疾病。采集的临床资料包括:所有研究对象的年龄、性别、抗酸染色结果、健康组结核T细胞斑点实验(T-SPOT.TB)结果,肺癌组研究对象的肺癌病理类型,以及肺炎组研究对象的感染类型等。本研究经第三军医大学大坪医院野战外科研究所及重庆市公共卫生医疗救治中心伦理委员会批准,所有研究对象均签署知情同意书。

表1 研究对象临床资料
-:无数据。
1.2方法
1.2.1候选miRNA的确定文献[5-12]报道了多种在肺结核患者血清(血浆)或外周血单个核细胞(PBMCs)或淋巴细胞中存在差异表达的miRNA分子,为扩大筛选范围,本研究忽略标本类型及对照组的因素。在经qRT-PCR技术验证过的存在差异的miRNA分子中进行选择,优先选择经ROC评价证实诊断效能优良者,最终选定了8种miRNA。8种候选miRNA为:miR-21[5]、miR-29a[6]、miR-101[7]、miR-378[7]、miR-146a[8]、miR-223[9-10]、miR-361-5p[11]、miR-424[8,10]。根据上述文献报道,与健康组比较,肺结核患者低表达miR-101、miR-146a,高表达miR-29a、miR-361-5p、miR-378、miR-424;与肺炎组(或肺癌组)比较,肺结核患者miR-21、miR-101和miR-223表达水平较低。
1.2.2PBMCs的分离抽取研究对象外周静脉血2 mL,乙二胺四乙酸(EDTA)抗凝,采用人淋巴细胞分离液(天津美德太平洋科技有限公司)以密度梯度离心法分离PBMCs。具体操作如下:(1)用2 mL无菌磷酸盐缓冲液(PBS)等倍稀释抗凝全血,缓慢加入到2 mL人淋巴细胞分离液的表面;(2)1 000 g常温下离心22 min,用无菌塑料吸管小心吸取中间白细胞层;(3)用注射用生理盐水洗涤细胞2次(800 g离心10 min);(4)将上述分离的PBMCs加入1 mL TRIzol(Invitrogen公司)重悬混匀,充分裂解后置-80 ℃冻存备用。
1.2.3总RNA的提取及miRNA的qRT-PCR检测使用TRIzol试剂严格按照说明书操作进行总RNA(含miRNA)的提取,采用NanoDrop ND-1000分光光度计(Thermo Scientific)检测所提取的RNA的质量和浓度,留取符合实验要求的RNA样本(浓度大于或等于50 ng/μL,吸光度比值A260/A280≥1.7)进行后续的qRT-PCR检测。使用All-in-OneTMmiRNA 实时定量PCR(qRT-PCR) Detection Kit试剂 (GeneCopoeia公司)按照说明书操作进行miRNA的加尾、逆转录及qPCR检测,实验所需的内参及特异性上游引物均购自GeneCopoeia公司。qPCR反应在BIO-RAD C1000 PCR扩增仪上按以下程序进行:93 ℃预变性10 min;93 ℃变性10 s,60 ℃退火20 s,72 ℃延伸20 s,循环40次。
1.2.4数据处理以U6 snRNA作为内参对数据进行归一化处理,设定健康组某个研究对象miRNA的表达量为1,通过2-△△CT法计算肺结核组相对对照组miRNA的表达变化倍数。考虑到影响qRT-PCR实验结果的因素相对较多,对表达差异存在统计学意义的miRNA,本研究设定其相对表达变化倍数需大于或等于1.5或小于或等于0.5才适合作为诊断指标进入回归方程进行分析。
1.3统计学处理采用Graphpad Prism 5.0统计软件,根据方差是否齐性以Mann-Whitney检验或t检验比较两组间差异,以P<0.05为差异有统计学意义。采用SPSS 19.0统计软件以Logistic逐步向前法建立多元回归方程,并以ROC曲线分析评价该方程的诊断效能。
2 结 果
2.1临床资料本研究共纳入研究对象142例,其中肺结核组44例,对照组98例(健康组36例,肺炎组32例,肺癌组30例)。其中,年龄及性别在肺结核组和对照组之间的差异均无统计学意义(P>0.05),见表1。

n:肺结核组相对对照组mRNA表达的变化倍数。*P<0.01,与肺结核组比较。
图18种miRNA在肺结核组和3组对照组中的表达情况
2.2PBMCs中候选miRNA的表达情况
2.2.1候选miRNA表达水平的差异肺结核组与健康组比较,miR-29a、miR-101、miR-378和miR-424的表达差异有统计学意义(P<0.05),肺结核组低表达miR-29a和miR-101,高表达miR-378和miR-424;肺结核组与肺炎组比较,8种miRNA的表达差异均有统计学意义(P<0.05),肺结核组的表达水平均低于肺炎组;肺结核组与肺癌组比较,除miR-29a外另外7种miRNA的表达差异均有统计学意义(P<0.05),肺结核组的表达水平均低于肺癌组,见图1。
2.2.2候选miRNA表达水平的变化倍数除miR-29a外,其余7种miRNA均适合进入回归方程。miR-29a的表达虽然差异有统计学意义,但其改变倍数为0.84(肺结核组与健康组比较)和0.74(肺结核组与肺炎组比较),不满足实验要求,见图1。
2.3回归方程的建立及ROC曲线评价回归方程的诊断效能排除miR-29a,对剩余7种miRNA采用Logistic回归进行分析,建立的回归方程为:Logit(患肺结核概率P)=1.698-4.791×(miR-101)-3.428×(miR-223)+2.968×(miR-424)。ROC曲线分析证实了该模型对肺结核具有良好的诊断效能,曲线下面积(AUC)=0.939,95%CI:0.900~0.977;诊断灵敏性为90.91%,特异性为81.63%,见图2。
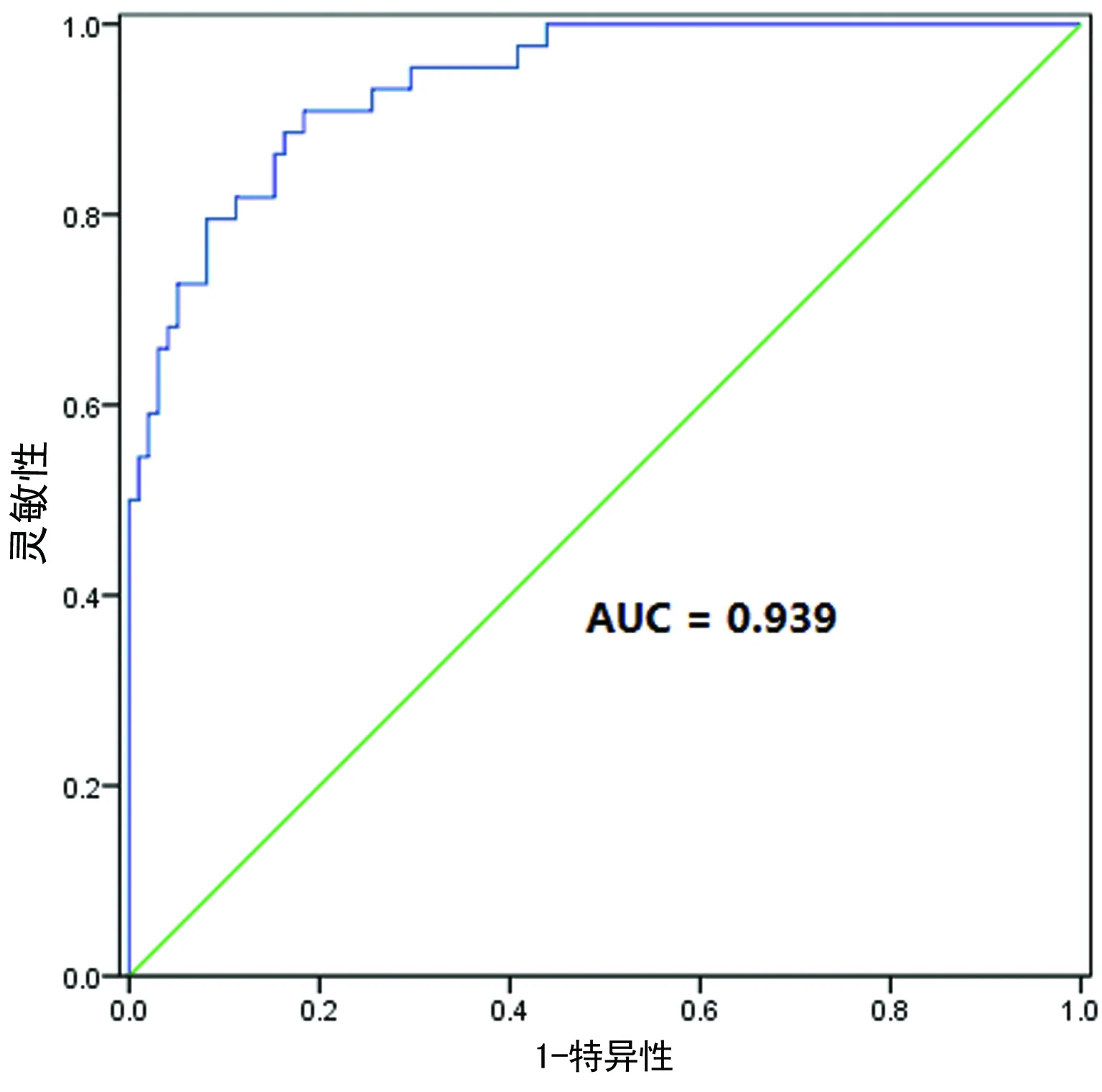
图2 ROC曲线
3 讨 论
对肺结核进行及时准确的诊断,不仅能够使患者尽早得到针对性治疗进而改善预后,更重要的是能够使传染源得到及时有效的控制,避免结核病的传播,然而近期的研究结果表明肺结核的诊断经常被延误[13-14]。目前肺结核的实验室诊断主要依赖于对结核杆菌自身或其成分的检测,如痰涂片抗酸染色法、培养法,以及PCR扩增法等。这些检测方法一方面对下呼吸道标本不易获得的病例如小儿肺结核的诊断存在着局限性;另一方面本身也存在着诸如灵敏度较低、仪器设备要求高、检测周期长等缺陷[15]。近年来发展起来的基于宿主免疫反应的诊断方法如γ干扰素释放试验(IGRA)虽可在一定程度上弥补上述不足,但是却不能区分活动性肺结核和潜伏性结核感染[16-17]。
miRNA的相关研究为肺结核诊断提供了新的思路和方向。尽管目前已有多项关于miRNA作为肺结核诊断指标的研究报道[18],但是这些研究在对照组的选择上不够全面,临床上肺结核经常要与另外两种常见的肺部疾病-肺炎与肺癌进行鉴别,而这些研究仅仅选择健康人及(或)潜伏性结核感染者作为对照,缺乏足够的说服力。本研究以健康组、肺炎组和肺癌组共同作为对照组,通过对8种候选miRNA进行检测和筛选,最终确定了3种符合要求的miRNA分子即miR-101、miR-223和miR-424,ROC曲线分析结果显示了这3种miRNA的组合对肺结核具有良好的诊断价值,其研究前景值得期待。
虽然本研究和Spinelli等[8]的研究结果都显示肺结核组PBMCs中miR-223的表达水平与健康组相比差异没有统计学意义,但是在肺组织[18]或单核/巨噬细胞[19-20]中miR-223的表达上调。上调表达的miR-223对肺结核患者具有双重作用,(1)其可通过转录后调控机制抑制中性粒细胞趋化因子如CXC趋化因子配体2(CXCL2),CC趋化因子配体3(CCL3)和白细胞介素6(IL-6)的表达,避免了大量中性粒细胞趋化至肺组织而导致的病理损伤,发挥对机体的保护作用[12];(2)miR-223可以通过抑制巨噬细胞内核因子kB(NF-kB)的活性,降低促炎症因子的表达[19],以及抑制巨噬细胞凋亡等作用来削弱机体的抗结核免疫[20]。本研究结果显示,与健康组相比,肺结核组PBMCs中miR-101表达下调及miR-424表达上调,与预期结果一致,但这两种miRNA异常表达的原因及其在肺结核发病机制中的作用尚不清楚,有待进一步研究。
本研究观察到8种候选miRNA中,miR-29a、miR-146a、miR-361-5p的检测结果与预期结果不一致,推测可能以下方面的原因。(1)可能与标本类型选择的不同有关,如miR-29a和miR-361-5p,其在血清中表达的变化趋势可能并不能代表其在PBMCs中的变化趋势。(2)可能与研究样本量较小有关,如miR-146a,虽然本研究的结果显示结核组和健康组miR-146a的表达差异无统计学意义,但是观察两组数据,结核组miR-146a表达量有低于健康组的趋势,若扩大样本量则有可能会显现这种差异。(3)可能与所选研究人群的遗传背景不同有关。
需要指出的是该项研究尚存在着一定的缺陷和不足。(1)该研究在实验设计方面还不尽完善,如研究样本量较小且研究对象来源比较单一,以及没有采用独立样本或临床前瞻性实验设计进行效能验证等,可能会影响到研究结论的可信性;(2)该研究最初可供筛选的候选miRNA数量仅仅只有8种,故最终确定的3种miRNA可能不是最佳的组合方案。尽管如此,本研究仍然认为该项研究具有一定的科学性和实用性,对肺结核生物标记物的深入研究具有借鉴意义和重要的参考价值。
综上所述,本研究从8种miRNA中筛选得到了3种对肺结核有潜在诊断意义的miRNA标记物(miR-101、miR-223和miR-424),这3种miRNA的组合对肺结核具有良好的诊断价值,该研究结果为进一步深入研究肺结核的实验室诊断方法提供了科学的参考资料。
[1]Felekkis K,Touvana E,Stefanou C,et al.microRNAs:a newly described class of encoded molecules that play a role in health and disease[J].Hippokratia,2010,14(4):236-240.
[2]Ueberberg B,Kohns M,Mayatepek E,et al.Are microRNAs suitable biomarkers of immunity to tuberculosis?[J].Mol Cell Pediatr,2014,1(1):8.
[3]Huang HH,Liu XY,Liang Y,et al.Identification of 13 blood-based gene expression signatures to accurately distinguish tuberculosis from other pulmonary diseases and healthy controls[J].Biomed Mater Eng,2015,26 Suppl 1:S1837-1843.
[4]van Rensburg IC,Loxton AG.Transcriptomics:the key to biomarker discovery during tuberculosis?[J].Biomark Med,2015,9(5):483-495.
[5]Abd-El-Fattah AA,Sadik NA,Shaker OG,et al.Differential microRNAs expression in serum of patients with lung cancer,pulmonary tuberculosis,and pneumonia[J].Cell Biochem Biophys,2013,67(3):875-884.
[6]Fu Y,Yi Z,Wu X,et al.Circulating microRNAs in patients with active pulmonary tuberculosis[J].J Clin Microbiol,2011,49(12):4246-4251.
[7]Zhang X,Guo J,Fan S,et al.Screening and identification of six serum microRNAs as novel potential combination biomarkers for pulmonary tuberculosis diagnosis[J].PLoS One,2013,8(12):e81076.
[8]Spinelli SV,Diaz A,D′Attilio L,et al.Altered microRNA expression levels in mononuclear cells of patients with pulmonary and pleural tuberculosis and their relation with components of the immune response[J].Mol Immunol,2013,53(3):265-269.
[9]Geng Q,Fan T,Zhang B,et al.Five microRNAs in plasma as novel biomarkers for screening of early-stage non-small cell lung cancer[J].Respir Res,2014,15(1):149.
[10]Wang C,Yang S,Sun G,et al.Comparative miRNA expression profiles in individuals with latent and active tuberculosis[J].PLoS One,2011,6(10):e25832.
[11]Qi Y,Cui L,Ge Y,et al.Altered serum microRNAs as biomarkers for the early diagnosis of pulmonary tuberculosis infection[J].BMC Infect Dis,2012,12(1):384.
[12]Dorhoi A,Iannaccone M,Farinacci M,et al.MicroRNA-223 controls susceptibility to tuberculosis by regulating lung neutrophil recruitment[J].J Clin Invest,2013,123(11):4836-4848.
[13]Sreeramareddy CT,Qin ZZ,Satyanarayana S,et al.Delays in diagnosis and treatment of pulmonary tuberculosis in India:a systematic review[J].Int J Tuberc Lung Dis,2014,18(3):255-266.
[14]Li Y,Ehiri J,Tang S,et al.Factors associated with patient,and diagnostic delays in Chinese TB patients:a systematic review and meta-analysis[J].BMC Med,2013,11(1):156.
[15]Ryu YJ.Diagnosis of pulmonary tuberculosis:recent advances and diagnostic algorithms[J].Tuberc Respir Dis (Seoul),2015,78(2):64-71.
[16]Metcalfe JZ,Everett CK,Steingart KR,et al.Interferon-gamma release assays for active pulmonary tuberculosis diagnosis in adults in low-and middle-income countries:systematic review and meta-analysis[J].J Infect Dis,2011,204 Suppl 4:S1120-1129.
[17]Xia H,Wang X,Li F,et al.Diagnostic values of the QuantiFERON-TB Gold In-tube assay carried out in China for diagnosing pulmonary tuberculosis[J].PLoS One,2015,10(4):e121021.
[18]Harapan H,Fitra F,Ichsan I,et al.The roles of microRNAs on tuberculosis infection:meaning or myth?[J].Tuberculosis (Edinb),2013,93(6):596-605.
[19]Liu Y,Wang R,Jiang J,et al.miR-223 is upregulated in monocytes from patients with tuberculosis and regulates function of monocyte-derived macrophages[J].Mol Immunol,2015,67(2 Pt B):475-481.
[20]Xi X,Zhang C,Han W,et al.MicroRNA-223 Is Upregulated in Active Tuberculosis Patients and Inhibits Apoptosis of Macrophages by Targeting FOXO3[J].Genet Test Mol Biomarkers,2015,19(12):650-656.
The diagnostic value of miR-101,miR-223 and miR-424 as potential biomarkers on pulmonary tuberculosis*
YanBaosong1,WangJing2,LuoJie1,ChenMing1,DengShaoli1△
(1.DepartmentofClinicalLaboratory,DapingHospital,ResearchInstituteofFieldSurgery,theThirdMilitaryMedicalUniversity,Chongqing400042,China;2.DepartmentofClinicalLaboratory,PublicHealthTreatmentCenter,Chongqing400036,China)
ObjectiveTo explore potential miRNA biomarkers for diagnosis of pulmonary tuberculosis.MethodsHealthy group,pneumonia group and lung cancer group were selected as control group,and the patients with pulmonary tuberculosis were acted as experimental group.The expression levels of 8 miRNAs (miR-21,miR-29a,miR-101,miR-378,miR-146a,miR-223,miR-361-5p and miR-424)in 44 cases of experimental group and 98 cases of control group were detected by qRT-PCR,and their differences were compared between each group.Logistic regression was applied to select diagnostic miRNA markers and set up the regression equation;ROC curve was used to evaluate the diagnostic accuracy of the equation.ResultsWe identified a panel of miR-101,miR-223 and miR-424 that yielded high diagnostic accuracy.The AUC for the miRNA panel was 0.939 with 90.91% sensitivity and 81.63% specificity.ConclusionmiR-101,miR-223 and miR-424 might be used as potential biomarkers for diagnosis of pulmonary tuberculosis.
MicroRNAs;tuberculosis,pulmonary;diagnosis;biomarker
10.3969/j.issn.1671-8348.2016.14.010
国家自然科学基金资助项目(81371760);国家传染病重大专项(2013ZX10003006-003-002)。作者简介:颜保松(1980-),主管技师,在读硕士,主要从事结核病研究。△
,E-mail:dengshali@tmmu.edu。
R521
A
1671-8348(2016)14-1902-04
2015-11-08
2016-02-18)
