过表达miR-29a对人椎间盘退变髓核细胞凋亡的影响
2016-09-02刘晓潭田林强王宏伟郭志豪
刘晓潭,田林强,王宏伟,郭志豪
(新乡医学院第三附属医院骨二科,河南新乡 453003)
过表达miR-29a对人椎间盘退变髓核细胞凋亡的影响
刘晓潭,田林强,王宏伟,郭志豪
(新乡医学院第三附属医院骨二科,河南新乡 453003)
目的探讨miR-29a在人椎间盘退变髓核(NP)细胞凋亡的调控作用。方法体外培养椎间盘退变NP细胞,构建重组真核表达质粒cherry/miR-29a,脂质体Lipofectamine转染进入NP细胞,应用反转录实时定量PCR(RT-qPCR)检测NP细胞中miR-29a 的表达变化,Western blot 法检测凋亡相关蛋白Caspase-3 前体的表达变化,流式细胞仪检测NP细胞凋亡水平变化。结果NP细胞转染重组质粒cherry/miR-29a 48 h 后,NP细胞中miR-29a 的表达水平较NP细胞和转染空质粒的NP细胞中的miR-29a明显升高(P<0.05);凋亡相关蛋白Caspase-3前体的水平则明显下降(P<0.05);NP细胞凋亡水平明显升高 (P<0.05)。结论在椎间盘NP细胞中过表达miR-29a 能促进NP细胞凋亡,其机制可能是通过Caspase-3途径起作用。
椎间盘;细胞凋亡;Caspase-3;过表达;miR-29a;椎间盘退变NP细胞
据相关报道,约80%的老年人患腰痛疾病[1]。其中椎间盘退变(intervertebral disc degeneration,IDD)是椎间盘源性腰痛等一系列下腰痛疾病的主要病因,引起负责基质合成的髓核(nucleus pulposus,NP)细胞凋亡,导致髓核细胞数量减少,是这个病变过程的关键原因[2-4]。所以,通过抑制髓核细胞的凋亡,可能会促进髓核基质的合成,达到延缓椎间盘退变的目的,具有重要的生物学和医学意义。
微小RNA(miRNA) 是一类长度约22 bp的内源性非编码RNA,为生物体内重要的转录后基因调控因子[5],在生物体细胞增殖与凋亡中发挥重要作用[6]。目前已有研究报道微小RNA-29a(miR-29a) 参与肝癌细胞凋亡的调控[7],但miR-29a调控椎间盘退变髓核细胞凋亡及其相应的靶基因鲜有报道,本研究通过脂质体lipofectamine转染法使miR-29a成功在体外培养的椎间盘退变NP细胞中过表达,观察miR-29a对凋亡相关蛋白半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)前体表达水平的影响,并通过流式细胞仪检测NP细胞的凋亡水平,检测过表达miR-29a对椎间盘退变髓核细胞凋亡的影响。
1 资料与方法
1.1一般资料NP细胞来源于新乡医学院附属医院的椎间盘退变患者。其中,男6例(50%),女6例(50%),患者均签署知情同意书且在未接受治疗前收集样本,包括NP细胞。
1.2方法
1.2.1试剂及仪器定量PCR用的SYBR Green PCR Master Mix(日本TOYOBO公司);逆转录试剂盒,限制性内切酶、TaqDNA聚合酶、dNTP (日本Takara公司);总蛋白提取试剂盒(BestBio公司);脂质体LipofectamineTM2000、TRIzol(美国Invitrogen公司);Guava凋亡检测试剂盒( 南京凯基生物公司),Caspase-3和甘油醛-3-磷酸脱氢酶(GAPDH)的抗体(santa cruz公司),反转录实时定量PCR(RT-qPCR)反应仪为ABIPRISM@7500(ABI 公司)。
1.2.2miR-29a真核表达载体的构建由miRBase网站查询获得miR-29a前体序列(M10000087),应用primer 5.0设计引物,上游引物序列F:5′-GCG AAT TCA TGG TTA AAG AGC CCA ATG TAT GCT G-3′,下游引物序列R:5′-CGG GTA ACC AGT ATA ACC ATT CAT GAT ATG CTA A-3′,划线处分别为EcoR Ⅰ和Kpn Ⅰ酶切位点,引物由上海life公司合成。PCR反应程序为:95 ℃ 3 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 5 min。用EcoR Ⅰ和Kpn Ⅰ双酶切PCR产物及pmR-mcherry质粒3 h,T4连接酶16 ℃过夜连接酶切回收产物,连接产物转化至DH 5α大肠杆菌感受态细胞中,经Amp抗性筛选和挑选阳性克隆提取重组质粒进行双酶切鉴定后测序验证。
1.2.3细胞培养及转染将NP细胞株于37 ℃,5% CO2及一定湿度下培养在RPMI1640培养液+10%胎牛血清中至6孔板中的细胞生长密度达70%~80%,用lipofectamine转染试剂盒分别将重组质粒cherry/miR-29a和空载体cherry转染至NP细胞,具体步骤参照转染试剂盒说明书。每孔质粒量为0.5 ug,终浓度为150 nmol/L。试验分为3个组:重组质粒组、空质粒组和空白组。
1.2.4RT-qPCR检测miR-29a在椎间盘组织及NP细胞中的表达情况采用RT-qPCR来检测miR-29a转录水平的差异。Trizol法提取组织或细胞的总RNA,oligo dT法反转录合成cDNA后进行miR-29a mRNA水平定量PCR检测。microRNA茎环引物为:上游5′-ACA CTC CAG CTG GGT TTG GGA GTC T-3′,下游5′-CTC AAC TGG TGT CGT GGA-3′;U6基因为内参:上游5′-CTC GCT TCG GCA GCA CA-3′,下游5′-AAC GCT TCA CGA ATT TGC GT-3′。RT-qPCR扩增程序为:50 ℃ 2 min,95 ℃ 10 min (1 个循环);95 ℃ 15 s,60 ℃ 1 min共40 个循环。RT-qPCR反应完成后进行熔解曲线分析,为单一峰,目的基因为特异性扩增。为确保qRT-PCR结果的准确性,对每一个样品重复分析3次,包括靶标基因(miR-29a)和看家基因(U6)。观察IDD患者椎间盘组织与健康对照组织中miR-29a的表达情况。
1.2.5流式细胞术检测NP细胞的凋亡水平用不含乙二胺四乙酸(EDTA)的胰酶消化NP细胞;4 ℃、500 r/min离心10 min,弃上清液,收集NP细胞;将NP细胞悬于标记缓冲液中;加入Guava试剂,避光室温反应15 min;加入标记缓冲液,用流式细胞仪观察细胞凋亡情况。
1.2.6Western blot蛋白水平检测细胞凋亡蛋白Caspase-3前体的表达转染48 h后收集样品,细胞去培养基后加入RIPA裂解液,蛋白质定量试剂盒 (BCA 法)蛋白定量后按一定浓度进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)恒压电泳,浓缩胶80 V,20~30 min,分离胶100 V 电泳,电泳时间根据Marker的位置确定;恒流276 mA 转膜2.5 h;室温封闭1 h;1∶1 000稀释Ⅰ抗4 ℃孵育过夜;1∶4 000稀释Ⅱ抗室温孵育1 h;暗室曝光。
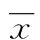
2 结 果
2.1患者椎间盘组织中miR-29a的表达情况miR-29a在IDD患者椎间盘组织中的水平显著高于健康对照组织中的水平(P<0.05),见图1。
2.2重组质粒cherry/miR-29a的构建与鉴定PCR 扩增产物经琼脂糖凝胶电泳分析,可见到与预期片段大小相符的条带(图2A)。对重组质粒cherry/miR-29a进行EcoR Ⅰ和Kpn Ⅰ双酶切检测,获得约4 500 bp和400 bp的条带 (图2B),与预期大小相符,miR-29a前体片段已成功连接至cherry空质粒中;对重组质粒进行测序,结果也证明插入的片段是miR-29a序列。
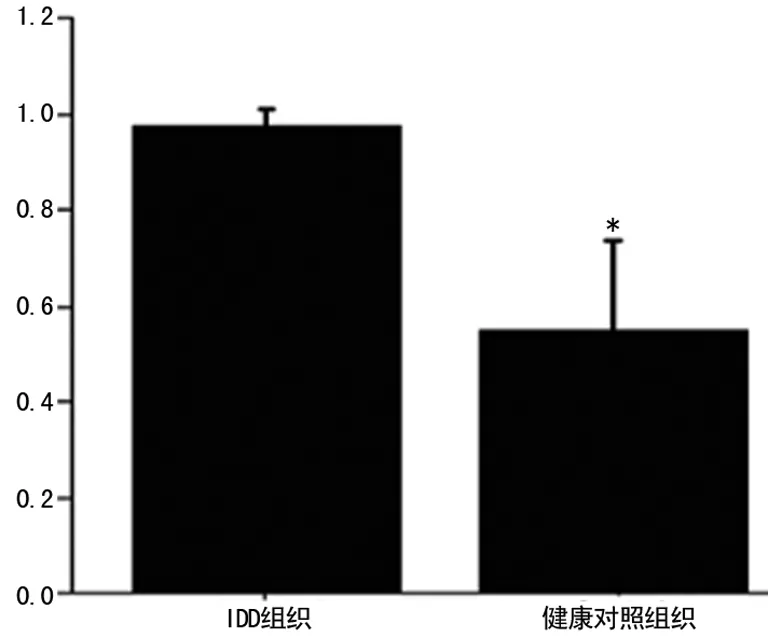
图1 椎间盘退变患者与健康对照组织中
1、2:miR-29a前体片段PCR产物;3:miR-29a前体片段PCR产物;4:cherry/miR-29a双酶切产物;M1:DL 500 bp Marker。
图2PCR产物及EcoR Ⅰ和Kpn Ⅰ双酶切产物电泳图
2.3RT-qPCR检测miR-29a的表达水平cherry/miR-29a感染NP细胞24 h后,RT-qPCR检测结果是miR-29a的表达水平较cherry空载体的表达显著升高(P<0.01),见图3。

图3 miR-29a的相对表达量
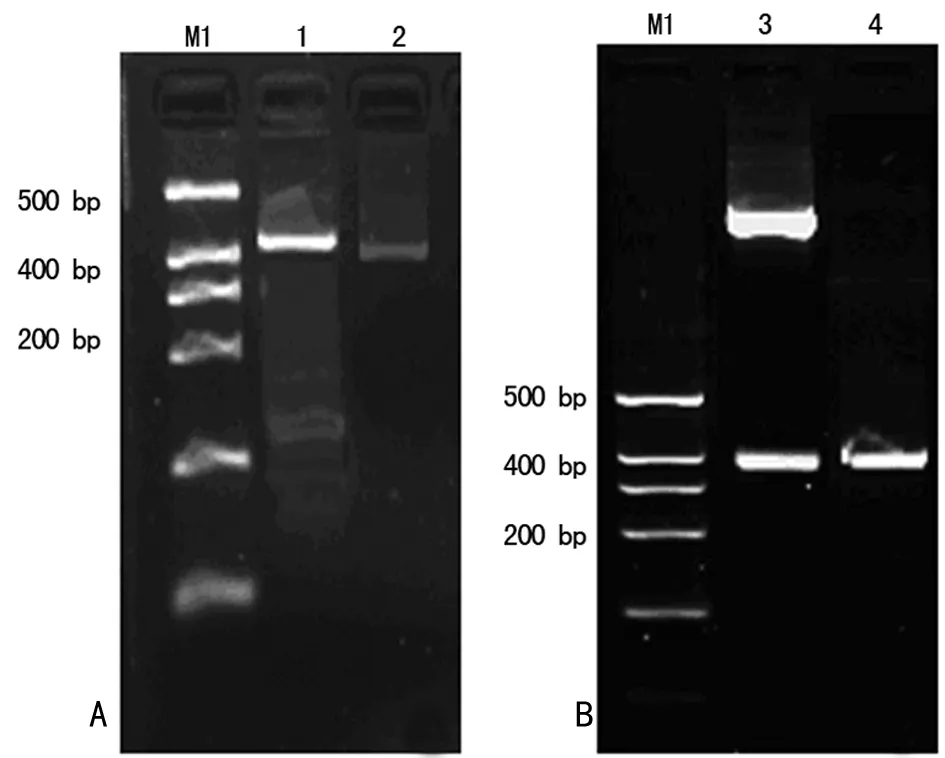
2.4过表达miR-29a对NP细胞凋亡的影响NP细胞转染cherry/miR-29a后,采用Guava流式细胞方法检测,空白组[(3.12±0.46)%]和空质粒组[(3.33±0.79)%]与重组质粒组细胞的凋亡率[(18.32±1.77)%]比较,差异有统计学意义(P<0.05),见图4。
A:空白组;B:空质粒组;C:重组质粒组。
图4流式细胞术检测NP细胞的凋亡情况
2.5miR-29a对NP细胞相关凋亡蛋白Caspase-3的影响空白组与空质粒组中Caspase-3前体的表达量差异无统计学意义(P>0.05);重组质粒组中Caspase-3前体的表达量均低于于空质粒组和空白组(P<0.05)。如图5所示,过表达miR-29a后,Caspase-3的蛋白水平的表达出现明显的下调。与空白组(1.12±0.09)和空质粒组(1.09±0.11)相比较,重组质粒组细胞(0.50±0.15)中凋亡相关蛋白Caspase-3水平低,差异有统计学意义(P<0.05)。

1:空白组;2:空质粒组;3:重组质粒组。
图5Western blot检测Caspase-3前体的水平
3 讨 论
人类miR-29 家族存在不同的亚型,分别由miR-29a/29b/29c组成。近年来,多项研究证实miR-29与细胞增殖及凋亡有着重要的作用。如在间变淋巴瘤激酶(ALK)阳性间变性大细胞淋巴瘤中,miR-29a的表达下调,从而引起MCL-1过表,促进细胞凋亡;在神经细胞成熟的过程中,miR-29b直接靶向BH3基因,抑制细胞凋亡[8-9]。而有报道显示miR-29a参与椎间盘退变的发生和发展,在本试验结果证实miR-29a在椎间盘退变患者椎间盘组织中的表达水平与健康正常组织相比差异有统计学意义。
有报道使用病毒载体感染法使心肌细胞过表达 pre-miRNA (miRNA 的前体),结果显示细胞内pre-miRNA的表达量升高超过1 000倍,而miRNA 成熟体却只有1.5~2.0 倍的提升[10]。本试验中所采用的特异性转染试剂Lipofectamine 进一步地提高了细胞的转染效率,转染miR-29a的重组质粒cherry/miR-29a 进入体外培养的原代NP细胞,经RT-qPCR验证,NP细胞中miR-29a 成熟体的表达量较空白组和空质粒组明显上升,成功在NP细胞内过表达miR-29a。
综上所述,通过脂质体转染的方法,miR-29a 的过表达能促进椎间盘NP细胞的凋亡,进一步的机制研究发现Caspase-3前体的表达水平也下降,提示NP细胞的凋亡可能是通过降解Caspase-3实现的。本研究为证实miRNA参与椎间盘NP细胞凋亡调控,阐明椎间盘退变的分子机制和有效治疗椎间盘退变提供了有利的试验依据。
[1]Takahashi K,Aoki Y,Ohtori S.Resolving discogenic pain[J].Eur Spine J,2008,17(Suppl 4):428-431.
[2]Liu G,Cao P,Chen H,et al.MiR-27a regulates apoptosis in nucleus pulposus cells by targeting PI3K[J].PLoS One,2013,8(9):e75251.
[3]Zhao CQ,Jiang LS,Dai LY.Programmed cell death in intervertebral disc degeneration[J].Apoptosis,2006,11(12):2079-2088.
[4]Cui J,Eldredge JB,Xu Y,et al.MicroRNA expression and regulation in human ovarian carcinoma cells by luteinizing hormone[J].PLoS One,2011,6(7):e21730.
[5]Ambros V.The functions of animal microRNAs[J].Nature,2004,431(76):350-355.
[6]Guehring T,Wilde G,Sumner M,et al.Notochordal intervertebral disc cells:sensitivity to nutrient deprivation[J].Arthritis Rheum,2009,60(4):1026-1034.
[7]Xiong Y,Fang JH,Yun JP,et al.Effects of microRNA-29 on apoptosis,tumorigenicity,and prognosis of hepatocellular carcinoma[J].Hepatology,2010,51(3):836-845.
[8]Desjobert C,Renalier MH,Bergalet J,et al.MiR-29a down-regulation in ALK-positive anaplastic large cell lymphomas contributes to apoptosis blockade through MCL-1 overexpression[J].Blood,2011,117(24):6627-6637.
[9]Kole AJ,Swahari V,Hammond SM,et al.miR-29b is activated during neuronal maturation and targets BH3-only genes to restrict apoptosis[J].Genes Dev,2011,25(2):125-130.
[10]Duisters RF,Tijsen AJ,Schroen B,et al.miR-133 and miR-30 regulate connective tissue growth factor:implications for a role of microRNAs in myocardial matrix remodeling[J].Circ Res,2009,104(2):170-178.
Overexpression of MicroRNA-29a regulates nucleus pulposus cells apoptosis in human intervertebral disc degeneration
LiuXiaotan,TianLinqiang,WangHongwei,GuoZhihao
(SecondDepartmentofOrthopaedics,theThirdAffiliatedHospitalofXinxiangMedicalCollege,Xinxiang,Henan453003,China)
ObjectiveTo investigate the role of MicroRNA-29a (miR-29a) on nucleus pulposus cells apoptosis in human intervertebral disc degeneration.MethodsIntervertebral disc degeneration nucleus pulposus cells was isolated,cells were transfected with recombinant plasmid cherry/miR-29a by lipofectamine method,and then RT-qPCR was used to measure the expressive level of miR-29;the protein expressive level of Caspase-3 was detected by Western blot and flow cytometry(FCM) was applied to detect the cells apoptosis.ResultsNP cells transfer to the recombinant plasmid cherry/miR-29a.The miR-29a expression level of NP cell was significantly higher compared with the blank and empty plasmid group(P<0.05);the apoptosis-related protein Caspase-3 precursor level significantly decreased (P<0.05) while the NP cell apoptosis level significantly increased (P<0.05) after 48 hours.ConclusionThe overexpression of miR-29a might regulate nucleus pulposus cells apoptosis of human intervertebral disc degeneration,and the mechanisms among it might be concerned with Caspase-3 pathway.
intervertebral disk;apoptosis;Caspase-3;overexpression;miR-29a;intervertebral disc degeneration nucleus pulposus cells
刘晓潭(1976-),讲师,硕士,主要从事骨关节疾病及脊柱研究。
论著·基础研究
10.3969/j.issn.1671-8348.2016.14.007
R34
A
1671-8348(2016)14-1893-03
2015-11-18
2016-01-06)
