甘草酸苷对肝癌细胞SMCC-7721凋亡的诱导作用*
2016-09-02郑晓珂王利娟张红巧杨小昂
郑晓珂,王利娟,张红巧,杨小昂
(1.郑州大学第五附属医院肿瘤科,郑州 450052;2.郑州大学医药科学研究院,郑州 450052)
·论著·
甘草酸苷对肝癌细胞SMCC-7721凋亡的诱导作用*
郑晓珂1,王利娟1,张红巧1,杨小昂2
(1.郑州大学第五附属医院肿瘤科,郑州 450052;2.郑州大学医药科学研究院,郑州 450052)
目的探讨甘草酸苷对肝癌细胞SMCC-7721凋亡诱导作用及相关机制。方法以甘草酸苷(0、10、30、100 μg/mL)处理肝癌细胞SMCC-7721 48 h后,咪唑蓝(MTT)法检测肝癌细胞活力的影响;流式细胞术检测细胞凋亡和线粒体膜电位;紫外分光光度法检测细胞中含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)、Caspase-9活性的影响;Western blot分析线粒体途径中相关蛋白p53、细胞色素C(CytC)、B淋巴细胞瘤-2(Bcl-2)和Bcl-2相关蛋白(Bax)的表达。结果与阴性对照比较,10、30、100 μg/mL甘草酸苷可显著降低细胞的活力(P<0.01),诱导细胞凋亡(P<0.01),促进线粒体膜电位去极化(P<0.01),抑制肝癌细胞SMCC-7721Caspase-3、Caspase-9活性(P<0.01),并上调p53、CytC、Bax的表达(P<0.01),下调Bcl-2的表达(P<0.01),且作用呈现浓度依赖关系。结论甘草酸苷可通过线粒体途径诱导肝癌细胞SMCC-7721凋亡。
肝肿瘤;细胞凋亡;甘草酸;肝癌细胞SMCC-7721;甘草酸苷;线粒体途径
肝癌是世界上最常见的癌症之一,目前临床上使用的化疗药物在杀死癌细胞的同时,也杀死了正常的细胞,给患者造成了很大痛苦,寻找高效、低毒的药物具有显著意义。病毒引起的肝硬化、肝炎是肝癌产生的危险因素[1-2]。在治疗慢性病毒性乙型肝炎的临床研究中发现,复方甘草酸苷有降低肝细胞损害的作用[3]。亦有研究表明甘草酸苷对急性肝衰竭大鼠模型具有保护作用[4]。本课题考察甘草酸苷对肝癌细胞SMCC-7721的凋亡诱导作用及其机制,现报道如下。
1 材料与方法
1.1材料人肝癌细胞SMCC-7721购于中国科学院上海细胞库,目录号为TCHu 52。 复方甘草酸苷注射液,由日本米诺发源制药株氏会社提供,含甘草酸苷2 mg/mL,注册号为H20030185。兔抗p53、细胞色素C(CytC)、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)单克隆抗体购自美国Abcam公司;Annexin V-FITC细胞凋亡检测试剂盒、线粒体膜电位检测试剂盒(JC-1法)、含半胱氨酸的天冬氨酸蛋白水解酶-3(Caspase-3)、9分光光度法检测试剂盒购自南京凯基生物科技发展有限公司;甘油醛-3-磷酸脱氢酶(GADPH)购自碧云天生物技术研究所;胎牛血清、DMEM培养基、MTT购自美国Gibco公司。Forma Class Ⅱ生化培养箱购自美国Themo公司;ChemiDoc MP凝胶成像系统购自Bio-Rad公司; FACSCalibur流式细胞仪购自美国BD公司;双垂直电泳仪、转印电泳仪购自北京六一仪器厂;Tecan Infinite F200/M200型多功能酶标仪购自瑞士TECAN集团公司。
1.2方法
1.2.1MTT法将处于对数生长期的肝癌细胞SMCC-7721,消化,调整细胞浓度,接种,培养24 h。加入含甘草酸苷(10、30、100 μg/mL)DMEM培养基,继续培养48 h,加MTT(5 mg/mL)20 μL,4 h后,吸弃上清液,并加入DMSO 150 μL,振荡摇匀,在酶标仪570 nm处测定光密度(OD)值。
1.2.2流式细胞术检测按1.2.1方法接种,给药48 h后,按照Annexin V-FITC 细胞凋亡检测试剂盒说明书的方法进行操作。用0.25%的胰蛋白酶[不含乙二胺四乙酸(EDTA)]消化细胞,磷酸盐缓冲液(PBS)洗涤2次,离心收集细胞;再按顺序依次加入500 μL Binding Buffer、5 μL Annexin V-FITC及 5 μL碘化丙啶(PI),混匀后,室温、避光反应10 min左右,在1 h内进行流式细胞仪检测。
1.2.3细胞线粒体膜电位(△ψm)检测按1.2.1方法接种,给药48 h后,按照JC-1法说明书的方法进行操作。用0.25%胰蛋白酶(不含EDTA)消化,PBS洗涤2次,离心收集细胞。将10×Incubation Buffer稀释成1×Incubation Buffer。取1 μL JC-1加入到500 μL 1×Incubation Buffer中配成JC-1工作液,取500 μL JC-1工作液,加入培养板中,37 °C孵育15 min,离心收集细胞,1×Incubation Buffer 500 μL重新悬浮细胞,流式细胞仪分析。线粒体膜电位检测采用荧光燃料JC-1作为跨膜电位指示剂。JC-1可透过正常细胞膜以单聚体形式聚集细胞内,并依赖于线粒体跨膜电位的极性,当其浓度增高可形成多聚体,并发射红色荧光 (Q2区间);而细胞发生凋亡时,线粒体跨膜电位去极化,细胞内JC-1浓度降低,就以单体的形式存在,发射绿色荧光(Q4区间)。根据这一特征检测线粒体膜电位的变化。
1.2.4Caspase-3、Caspase-9酶活性检测按1.2.1方法接种,给药48 h后,按照Caspase-3、Caspase-9分光光度检测试剂盒说明书的方法进行操作。用0.25%胰蛋白酶(不含 EDTA)消化,PBS洗涤2次,离心收集细胞。将50 μL 预冷的Lysis Buffer加入细胞中,吹打均匀并置冰上裂解30 min,每隔10 s进行振荡,4 ℃ 10 000 r/min离心 1 min,小心吸取上清液,置4 ℃待测。取1~2 μL上清液,检测其中的蛋白浓度。再吸取50 μL含100~200 μg 蛋白的细胞裂解上清液,按顺序依次加入2×Reaction Buffer 50 μL、Caspase-3 Substrate 5 μL,于37 ℃避光孵育4 h,用酶标仪检测405 nm处吸光度,计算出每毫克蛋白相当的OD值。
1.2.5Western blot检测按1.2.1方法接种,收集细胞,用裂解液裂解细胞,4 ℃ 10 000 r/min离心10 min,获得蛋白样品。BCA蛋白定量试剂盒检测蛋白浓度。蛋白变性,30~50 ng蛋白样品上样,进行十二烷基磺酸钠(SDS)凝胶电泳2 h,湿法转膜30~60 min,5%脱脂奶粉封闭,加入一抗(1∶100)4 °C孵育过夜,三羟甲基氨基甲烷盐酸盐溶液(TBST)洗涤3次,后加入二抗(1∶500)室温孵育1.0~1.5 h,TBST洗涤3次。后加电化学发光(ECL)曝光液在凝胶成像系统中曝光。并用“Quantity one”软件对蛋白灰度值进行统计分析。
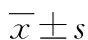
2 结 果
2.1甘草酸苷对肝癌细胞肝癌细胞SMCC-7721活力的影响随着作用浓度的增加,甘草酸苷对肝癌细胞SMCC-7721活力抑制作用逐渐增强,在100 μg/mL时,抑制程度最大,差异有统计学意义(P<0.01),见图1。
2.2甘草酸苷对肝癌细胞SMCC-7721凋亡的影响正常肝癌细胞SMCC-7721中仅有少量的细胞发生早期凋亡和晚期凋亡;随着给药浓度的增加,早期和晚期凋亡细胞数均显著增加,与对照组比较差异有统计学意义(P<0.05),见表1。
*:P<0.01,与对照组比较。
图1 甘草酸苷对肝癌细胞SMCC-7721活力的影响
a:P<0.01,与对照组比较。
表2 甘草酸苷对肝癌细胞SMCC-7721线粒体膜电位及
a:P<0.05,b:P<0.01,与对照组比较。

*:P<0.01,与对照组比较。
图2甘草酸苷对肝癌细胞SMCC-7721中及CytC水平的影响
2.3甘草酸苷对肝癌细胞SMCC-7721线粒体膜电位的影响随着给药浓度的增加,甘草酸苷可显著引起细胞线粒体膜电位去极化,且作用呈现浓度依赖关系,见表2。
2.4甘草酸苷对肝癌细胞SMCC-7721中Caspase-3、Caspase-9活性的影响与对照组相比,随着给药浓度的增加,甘草酸苷能显著抑制肝癌细胞SMCC-7721中Caspase-3、Caspase-9活性,差异均有统计学意义(P<0.05),见表2。
2.5甘草酸苷对肝癌细胞SMCC-7721中p53及CytC水平的影响与对照组相比,随着给药浓度的增加,甘草酸苷能显著抑制p53及CytC的表达,差异均有统计学意义(P<0.01),见图2。
2.6甘草酸苷对肝癌细胞SMCC-7721中Bax、Bcl-2水平的影响与对照组相比,随着给药浓度的增加,甘草酸苷能显著提高Bax的表达,下调Bcl-2的表达,差异均有统计学意义(P<0.01),见图3。

*:P<0.01,与对照组比较。
图3甘草酸苷对肝癌细胞SMCC-7721中Bax、Bcl-2水平的影响
3 讨 论
肝癌的发生不仅仅因为细胞增殖过度和分化异常,细胞程序性凋亡减少也可导致其发生。因此通过诱导肿瘤细胞凋亡使其重新恢复细胞凋亡能力,已成为肿瘤治疗目前的研究热点之一[5]。乙型肝炎、丙型肝炎病毒感染是肝细胞癌产生的危险因素之一[1-2]。甘草酸苷具有抗病毒引起的肝炎[3]。因此本文通过MTT实验和 Annexin V-FITC流式细胞法检测甘草酸苷对肝癌细胞SMCC-7721的作用,发现一定剂量甘草酸苷能显著抑制肝癌细胞SMCC-7721活力,诱导肝癌细胞SMCC-7721凋亡。
凋亡途径包括内源性和外源性两个通路,内源性通路由线粒体途径介导。线粒体是细胞能量代谢的中心,细胞凋亡会使线粒体功能发生紊乱及障碍,而线粒体功能障碍反之也会促使自由基大量产生、兴奋性氨基酸大量释放、钙离子超载外,也能直接诱导细胞凋亡。当含Bcl-2家族的成员的在接受细胞内的死亡信号后被激活,会引起线粒体膜通透性明显升高,诱发CytC的释放,诱导Caspase-9的活化激活级联反应。Bax mRNA 表达低下或缺失参与了肝胆管癌的发生、发展过程[6]。Bcl-2过表达参与了肝癌的发生、发展及转移等过程[7]。通过线粒体途径及上调Bax表达、增加Bax/Bcl-2比率可诱导肝癌SMMC-7721细胞凋亡[8]。当甘草酸苷作用SMMC-721后,可提高Bax表达,抑制Bcl-2表达,提示甘草酸苷可通过调节Bax、Bcl-2蛋白表达从而诱导肿瘤细胞凋亡。
CytC是一种水溶性蛋白,位于线粒体内外膜之间,并与内膜松弛相连,当线粒体受损后,线粒体通透性转变孔道开放,CytC从构建的空隙中进入细胞质中,引起后续的凋亡反应。线粒体的损伤为线粒体凋亡途径中标志性的指标。CytC的表达是肝癌细胞凋亡的晚期事件[9]。本试验发现,通过一定剂量甘草酸苷作用肝癌细胞SMCC-7721后,细胞质中CytC表达上升,线粒体去极化显著。Caspase-家族在程序性细胞死亡过程中发挥了关键的作用。Caspase-9是凋亡发生的启动者,而Caspase-3被认为是Caspase级联反应中最重要的执行者,活化的Caspase-3可以裂解PARP进而引起DNA的损伤,还可以诱导细胞骨架结构重构和瓦解[10]。Caspase-3低表达在肝癌中的发生、发展过程中起着重要作用[11]。Caspase-9的高表达参与了肝癌的发生过程[12]。本试验也证实肝癌细胞SMCC-7721中Caspase-3、Caspase-9活性较低,给予一定剂量的甘草酸苷能显著抑制Caspase-3、Caspase-9活性的上升。
p53在细胞凋亡引起的DNA损伤过程中是一个关键因素,它是第1个被证实的抑癌基因,其产物p53蛋白存在于正常的细胞内,参与细胞生长、分化和死亡,与肿瘤的发生密切相关。研究证实p53能够引起线粒体介导的Caspase依赖性凋亡的发生[13]。同时p53能够调节诱导凋亡与抗凋亡基因之间的平衡,而其激活也是凋亡所需的[14]。p53蛋白的低表达是肝癌细胞低分化,高转移潜能,预后差的生物学标志之一[15]。通过提高p53表达,能一定程度上诱导肝癌细胞SMCC-7721凋亡[16]。本试验也发现,肝癌细胞SMCC-7721中p53低表达,甘草酸苷作用后,可显著提高p53表达。
总之,一定剂量的甘草酸苷能诱导肝癌细胞SMCC-7721凋亡,是通过促进细胞线粒体膜电位去极化,上调p53、CytC、Bax的表达,下调Bcl-2的表达来实现。
[1]Surveillance PA,Age-Specific OC.In relation to the epidemic of hepatitis C infection[J].J Registry Manag,2013,40(3):144-145.
[2]Strasser SI.Managing hepatitis B to prevent liver cancer:recent advances[J].Expert Rev Gastroenterol Hepatol,2014,8(4):409-415.
[3]陈金强.复方甘草酸苷治疗慢性病毒性乙型肝炎的临床研究[J].中国药业,2013,22(4):27-28.
[4]裴旭东,翟玉峰,张怀宏.复方甘草酸苷对大鼠急性肝衰竭保护机制的研究[J].实用药物与临床,2012,15(8):464-466.
[5]Liu Q,Chen W,Jiao Y,et al.Pulsatilla saponin A,an active molecule from Pulsatilla chinensis,induces cancer cell death and inhibits tumor growth in mouse xenograft models[J].J Surg Res,2014,188(2):387-395.
[6]Zhao W,Zhang B,Guo X,et al.Expression of Ki-67,Bax and p73 in patients with hilar cholangiocarcinoma[J].Cancer Biomark,2014,14(4):197-202.
[7]杨闯,魏振彤,郑宇,等.肝癌中Bcl-2、Bax和C-myc基因的表达及其临床意义[J].中国老年学杂志,2009,29(4):450-451.
[8]李海艳,徐燕丰,辛海量,等.科罗索酸对SMMC-7721细胞生长抑制作用的初步研究[J].山东医药,2011,51(52):44-46.
[9]陈昊,陈乃玲,张春芳,等.细胞色素C及相关细胞凋亡蛋白、基因在原发性肝癌组织表达的临床意义[J].中国实验诊断学,2011,15(7):1083-1086.
[10]Han HJ,Kwon HY,Sohn EJ,et al.Suppression of E-cadherin mediates gallotannin induced apoptosis in Hep G2 hepatocelluar carcinoma cells[J].Int J Biol Sci,2014,10(5):490-499.
[11]郭晓东,杨美,郭超楠,等.肝癌组织中凋亡调控因子Fas、FasL及Caspase-3的表达及意义[J].肝脏,2014,15(4):250-253.
[12]郭晓东,李志伟,杨美,等.Caspase-9和Survivin在肝癌组织中的表达及意义[J].临床肝胆病杂志,2014,30(3):253-256.
[13]Qu C,Chen T,Fan C,et al.Efficacy of neonatal HBV vaccination on liver cancer and other liver diseases over 30-year follow-up of the Qidong hepatitis B intervention study:a cluster randomized controlled trial[J].PLoS Med,2014,11(12):e1001774.
[14]Cheng M,He B,Wan T,et al.5-Fluorouracil nanoparticles inhibit hepatocellular carcinoma via activation of the p53 pathway in the orthotopic transplant mouse model[J].PLoS One,2012,7(10):e47115.
[15]王为东,李玉军.肝细胞肝癌中端粒酶、p53和CK19的表达及意义[J].临床与实验病理学杂志,2012,28(8):862-866.
[16]邹夏慧,张焜和,陈江,等.仙鹤草水提液对SMMC-7721肝癌细胞的抗癌作用及其机制[J].重庆医学,2013,42(32):3929-3931,3934.
Induction of glycyrrhizin on apoptosis in hepatocellular carcinoma cell SMCC-7721*
ZhengXiaoke1,WangLijuan1,ZhangHongqiao1,YangXiaoang2
(1.DepartmentofOncology,theFifthAffiliatedHospitalofZhengzhouUniversity,Zhengzhou,Henan450052,China;2.InstitudeofMedicine,UniversityofZhengzhou,Zhengzhou,Henan450052,China)
ObjectiveTo explore the molecular biological mechanism and induction of glycyrrhizin on apoptosis in hepatocellular carcinoma cell SMCC-7721.MethodsMTT method was used to detect the viability of SMCC-7721 cells after the cells were cultured with glycyrrhizin of 0 (negative control),10,30 and 100 μg/mL.The mitochondrial membrane potential and cell apoptosis of SMCC-7721 cell was measured by flow cytometry.The activity of Caspase-3,Caspase-9 was assayed by spectrophotometric assay.The mitochondrial pathway related protein p53,cytochrome (CytC),Bax,Bcl-2 was assayed by Western blot.ResultsCompared with negative control group,10,30,100 μg/mL glycyrrhizin inhibited SMCC-7721 cell viability (P<0.01),induced SMCC-7721 cell apoptosis and promoted mitochondrial membrane potential depolarization (P<0.01),as well as inhibited the activity of Caspase-3 and Caspase-9 (P<0.01),upregulated the expression of p53,CytC,Bax(P<0.01) and down-regulated the expression of Bcl-2 (P<0.01).The effects were related with the medicine concentration in does-dependent.Conclusionglycyrrhizin could induce SMCC-7721 cell apoptosis,which might be related with mitochondrial pathway.
liver neoplasms;apoptosis;glycyrrhizic acid;hepatocellular carcinoma cell SMCC-7721;glycyrrhizin;mitochondrial pathway
10.3969/j.issn.1671-8348.2016.14.003
国家自然科学基金资助项目(81071724)。作者简介:郑晓珂(1980-),主治医师,硕士,主要从事恶性肿瘤综合治疗研究。
R735.7
A
1671-8348(2016)14-1879-03
2015-11-12
2015-12-28)
