横向定量牵拉法制作大鼠视神经精确损伤模型
2016-09-02谷新怡赵朋波刘爱伟尚姗姗闫晓玲吴鲁华夏燕婷
谷新怡,周 剑,赵朋波,刘爱伟,尚姗姗,闫晓玲,吴鲁华,夏燕婷
·实验论著·
横向定量牵拉法制作大鼠视神经精确损伤模型
谷新怡1,周剑1,赵朋波1,刘爱伟1,尚姗姗2,闫晓玲1,吴鲁华2,夏燕婷1
Foundation items:National Natural Science Foundation Project (No.81173307); Natural Science Foundation Project of Beijing (No.16G40086)
1Department of Ophthalmology, Dongfang Hospital Affiliated to Beijing University of Chinese Medicine, Beijing 100078, China;2Department of Ophthalmology, the Third Affiliated Hospital of Beijing University of Chinese Medicine, Beijing 100029, China
Correspondence to:Jian Zhou. Department of Ophthalmology, Dongfang Hospital Affiliated to Beijing University of Chinese Medicine, Beijing 100078, China.zhj9667@126.com
Abstract
•AIM: To make a rat model of optic nerve injury by using the transverse quantitative traction method, and to evaluate the survival rate of retinal ganglion cells (RGCs) of the model using the method of fluorogold retrograde labeling.
•METHODS:Twenty-five Wistar rats were randomly divided into five groups: sham operation group, 1d, 3d, 7d and 14d after tractive optic nerve injury group. The model groups pulled the left optic nerve with lateral tensiometer; the sham operation group only exposed the optic nerve but not pulled. The right eyes of each group were served as normal control eyes. The RGCs density of the five groups was observed by fluorogold retrograde labeling.
•RESULTS:In the normal control group, the RGCs labeled by the fluorescent gold were round or oval, clear boundary, no obvious fluorescent dye leakage and partially visible cell processes. However, in the optic nerve traction groups, the number of RGCs decreased with time increasing and the cell distribution was not uniform. Lots of fluorescent leakages and microglial cells were observed. Compared with the normal control group, there was no significant difference in the morphology and density of RGCs of sham operation group (P>0.05). In 1d, 3d, 7d and 14d after traction of the optic nerve groups, the number of RGCs were reduced progressively and the density of RGCs of the left eye was significantly lower than that in the normal control group (P<0.01). The survival rates of RGCs in the groups of 1d, 3d, 7d and 14d after optic nerve traction were (78.94±0.92)%, (60.07±0.90)%, (38.92±1.42)% and (17.31±0.97)% respectively.
•CONCLUSION:The transverse quantitative traction method can establish a model of easily quantifiable optic nerve injury, which can provide a powerful tool for further study on the treatment of optic nerve injury.
目的:采用横向定量牵拉法制作大鼠视神经损伤模型,并利用荧光金逆行标记评价视神经牵拉伤后视网膜节细胞(retinal ganglion cells,RGCs)的存活率。
方法:将25只雄性Wistar大鼠随机均分为5组,即假手术组和视神经牵拉伤后1、3、7、14d组。模型组用横向张力计牵拉左眼视神经,假手术组仅暴露左眼视神经但不予牵拉,各组以右眼为正常对照。用荧光金逆行标记,并观察假手术组及视神经牵拉伤后1、3、7、14d组RGCs的密度。
结果:正常对照组RGCs形态多呈圆形或椭圆形,边界清楚,细胞外无明显荧光染料渗漏,部分可见明显细胞突起;而视神经牵拉伤后RGCs随时间延长而不断减少,细胞分布不均匀,并可见大量荧光渗漏及小胶质细胞。与正常对照组相比,假手术组RGCs形态和密度无明显差异(P>0.05);视神经牵拉伤后第1、3、7、14d的RGCs数量进行性减少,且其密度均明显低于正常对照组(P<0.01);视神经牵拉伤后第1、3、7、14d的RGCs存活率分别为78.94%±0.92%、60.07%±0.90%、38.92%±1.42%和17.31%±0.97%。
结论:横向定量牵拉法可以建立易于量化的视神经损伤模型,为进一步研究视神经损伤后的治疗方法提供有力工具。
横向定量牵拉法;视神经损伤;荧光金;视网膜神经节细胞
引用:谷新怡,周剑,赵朋波,等.横向定量牵拉法制作大鼠视神经精确损伤模型.国际眼科杂志2016;16(9):1625-1628
0引言
外伤性视神经病变(traumatic optic neuropathy,TON)是一种严重的致盲眼病,目前无较好的治疗方法,通过建立视神经损伤动物模型对研究视神经损伤机制及治疗具有重要意义。国内外学者通过大量的探索,研制出了各具特点的视神经损伤动物模型,但由于它们自身的局限性,故不能完全成为满意的视神经损伤模型,本研究所采用的大鼠视神经横向定量牵拉伤模型,直接暴露视神经进行定量损伤,具有可控性强、受力均匀、定量一致等特点,是较理想的视神经损伤模型。
视神经损伤后视网膜神经节细胞(retinal ganglion cells,RGCs)数目进行性减少是导致视功能不可逆性损害的组织病理学基础,RGCs的准确计数是目前国际上公认的评价视神经损伤程度的重要形态学指标;同时,荧光金(fluoro-gold,FG)是Schmued等[1]在1986年发现的一种新型荧光物质,也是目前较为稳定的逆行荧光示踪剂,广泛应用于神经细胞的标记。本实验首次采用横向定量牵拉法制作大鼠视神经损伤模型,并利用荧光金立体定位注射法对RGCs逆行标记,检测RGCs的存活率,评价横向定量牵拉法对视神经造成的影响。
1材料和方法
1.1材料
1.1.1实验动物与分组选择健康成年雄性Wistar大鼠(SPF级)25只,200~220g,购自北京维通利华实验动物有限公司。行外眼及眼底检查,无眼疾者纳入实验,实验期间于北京中医药大学东方医院实验动物中心饲养,自由摄食、饮水,室内通风干燥。采用随机数字表进行完全随机化的分组,共分5组,即假手术组、视神经牵拉伤后1、3、7、14d组,每组5只为一笼,共5笼。各组大鼠右眼均不处理,作为各组的正常对照眼。
1.1.2主要实验试剂及仪器荧光金(美国Fluorochrome公司),多聚甲醛(北京索莱宝科技有限公司),戊巴比妥钠(AUKS公司),水合氯醛(北京索莱宝科技有限公司),脑立体定位仪(美国stoelting公司,51600型),牙科钻头(瑞士Institut Straumann AG),5μL微量注射器(上海安亭科学仪器厂),横向张力计(日本东京精机DTN-1),直接检眼镜(苏州六六视觉科技股份有限公司),体式解剖显微镜(日本Olympus公司,SZ61型),倒置荧光显微镜(日本Olympus公司,IX81型)。
1.2方法
1.2.1 FG逆行标记RGCs各组大鼠分别于造模前7d采用双上丘注射法逆行标记RGCs。常规20g/L戊巴比妥钠(按100mg/kg大鼠体质量)腹腔注射全身麻醉实验大鼠。颅顶备皮,沿颅顶正中线向后垂直剪开皮肤约2cm,分离暴露前囟、冠状缝、矢状缝及人字缝;将大鼠固定于脑立体定位仪上,耳棒固定骨性耳道(两边刻度一致),调节微量注射器针头位于Bregma点,记录读数;调节针头位于前囟后6.2mm,分别旁开1.4mm处,牙科钻钻孔,直径约1mm;进针深5mm,退1mm,FG每孔注射2μL,1min内匀速注射完毕,留针5min。另侧上丘同样操作。缝合皮肤,伤口涂抗生素眼膏,回笼饲养。
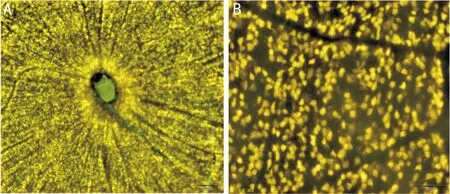
图1正常大鼠视网膜RGCs分布及形态A:视网膜(×400);B:距视盘1/6处的RGCs(×200)。
1.2.2横向定量牵拉法制作视神经损伤模型FG标记7d后进行视神经牵拉伤模型制作。术前直接检眼镜查大鼠眼底视网膜及血管无异常。常规20g/L戊巴比妥钠(按100mg/kg大鼠体质量)腹腔注射全身麻醉实验大鼠。在体式显微镜下进行造模操作,大鼠俯卧位,沿大鼠左眼颞侧眶缘剪开皮肤,长约1cm,剪除上方部分眶脂肪,剪断(亦可保留)外直肌,向眶尖部钝性分离并剪开神经鞘膜暴露视神经,采用6-0类聚酯缝线在球后1~2mm处圈住视神经并打结(圈长等于视神经横截面周长,注意不能拉紧),缝线另一头连接横向张力计(最小刻度0.01N),以 0.10N 拉力垂直于视神经水平牵拉并持续 20s,另外整个操作过程均由同一个人完成以保证方向、力度的一致性。牵拉完成后立即观察,如大鼠术眼瞳孔散大、直接对光反射消失、间接对光反射存在、眼底视网膜无血管出血或闭塞、视网膜苍白缺血不超过5min,予以纳入试验,否则予以淘汰。术后缝合皮肤,常规抗炎,回笼饲养。
1.2.3视网膜铺片和RGCs计数损伤组在视神经牵拉伤后各时间点,假手术组在造模后1wk取视网膜。10%水合氯醛过量麻醉处死各组大鼠,于颞侧做球结膜缝线标记,立即取出眼球并置于4%多聚甲醛-PBS溶液中固定2h。沿角巩膜缘后0.5mm剪开眼球,去除角膜和晶状体,分离视网膜,并在视网膜上、下、鼻、颞侧各剪一小口,将视网膜置于载玻片上,滴防荧光淬灭剂后加盖玻片,市售无色透明指甲油封片。将已铺片的视网膜置于倒置荧光显微镜下观察,紫外线激发荧光。在每张视网膜的鼻上、鼻下、颞上、颞下四个象限分别距视盘1/6、1/2和5/6视网膜半径处共拍摄12张200×的荧光照片,对照片标记的RGCs直接进行人工计数,求平均值,其中圆形胞体、直径超过8μm为RGCs,而形态不规则且直径较小的为小胶质细胞,不予计数[2-3]。最终计算出每平方毫米视野范围内的RGCs数,以及RGCs的标识率和丧失率(标识率=每只大鼠损伤眼RGCs/正常对照眼RGCs×100%,RGCs丧失率=1-RGCs标识率)。
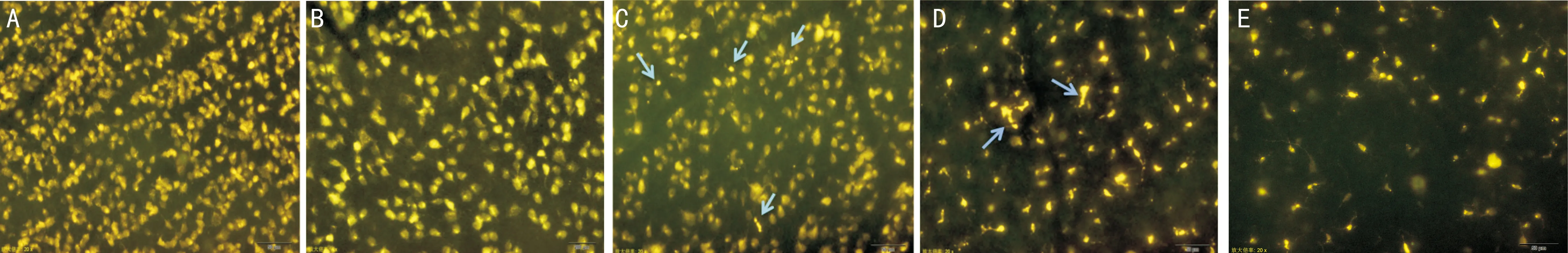
图2距视盘1/6处的RGCs(×200)A:假手术组;B:视神经牵拉伤后1d,FG标记RGCs与假手术组比较略减少;C:视神经牵拉伤后3d的RGCs;D:视神经牵拉伤后7d的RGCs;E:视神经牵拉伤后14d的RGCs(箭头所指为吞噬了死亡RGCs及荧光金的小胶质细胞)。
表1各组大鼠RGCs密度
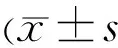
,细胞数/mm2)
注:bP<0.01vs右眼(对照眼);dP<0.01vs左眼(损伤眼)。
2结果
2.1荧光金标记的正常大鼠视网膜RGCs分布及形态荧光金标记的RGCs在倒置荧光显微镜下观察,在视网膜各象限分布均匀,视盘周围的中心区域RGCs分布较周边部密集,视网膜血管自视盘呈放射状向外分布,且血管走行区未见RGCs。标记的细胞形态多呈圆形或椭圆形,胞浆呈强荧光,边界清楚,胞体直径大于8μm,细胞外无明显荧光染料渗漏(图1)。
2.2荧光金标记的视神经损伤后大鼠视网膜RGCs形态及分布视神经牵拉伤后1d,视网膜中荧光金标记的RGCs数量与假手术组比较略减少,但细胞形态未见明显变化,且细胞外未见明显FG渗漏(图2)。损伤后3d,视网膜中FG标记的RGCs数量进一步减少,胞浆中荧光分布不均匀,部分FG渗漏到细胞外,并可见少量小胶质细胞(图2C,如箭头所示)。损伤后7d,视网膜中FG标记的RGCs明显减少,可见大量吞噬了死亡RGCs及荧光金的小胶质细胞,形态多为双极形,直径小(图2D,箭头所示)。损伤后14d,视网膜中FG标记的RGCs数量更少,分布不规律,FG渗漏增多,可见大量小胶质细胞,其胞体呈不规则形状(图2E)。
2.3各组大鼠RGCs存活情况
2.3.1各组大鼠RGCs密度假手术组左眼与右眼两个样本比较,服从正态分布,采用配对样本t检验,结果显示差异无统计学意义(P>0.05),说明仅暴露视神经未对视神经造成损伤;1d组、3d组、7d组及14d组的视神经损伤眼(左眼)与自身正常对照眼(右眼)比较,各组样本均服从正态分布,经过配对样本t检验分析,结果显示差异均具有统计学意义(P<0.01,表1)。假手术组、1d组、3d组、7d组及14d组五组间左眼(即视神经损伤眼)RGCs密度比较,采用one-way ANOVA分析,分析结果显示,各组间总体差异具有统计学意义(F=897.669,P<0.01)。将五组变量进行两两比较,经one-way ANOVA分析显示,并经Bonferroni法将检验水准进行校正,结果显示五组间左眼RGCs密度的差异具有统计学意义(P<0.01,表1,图3)。
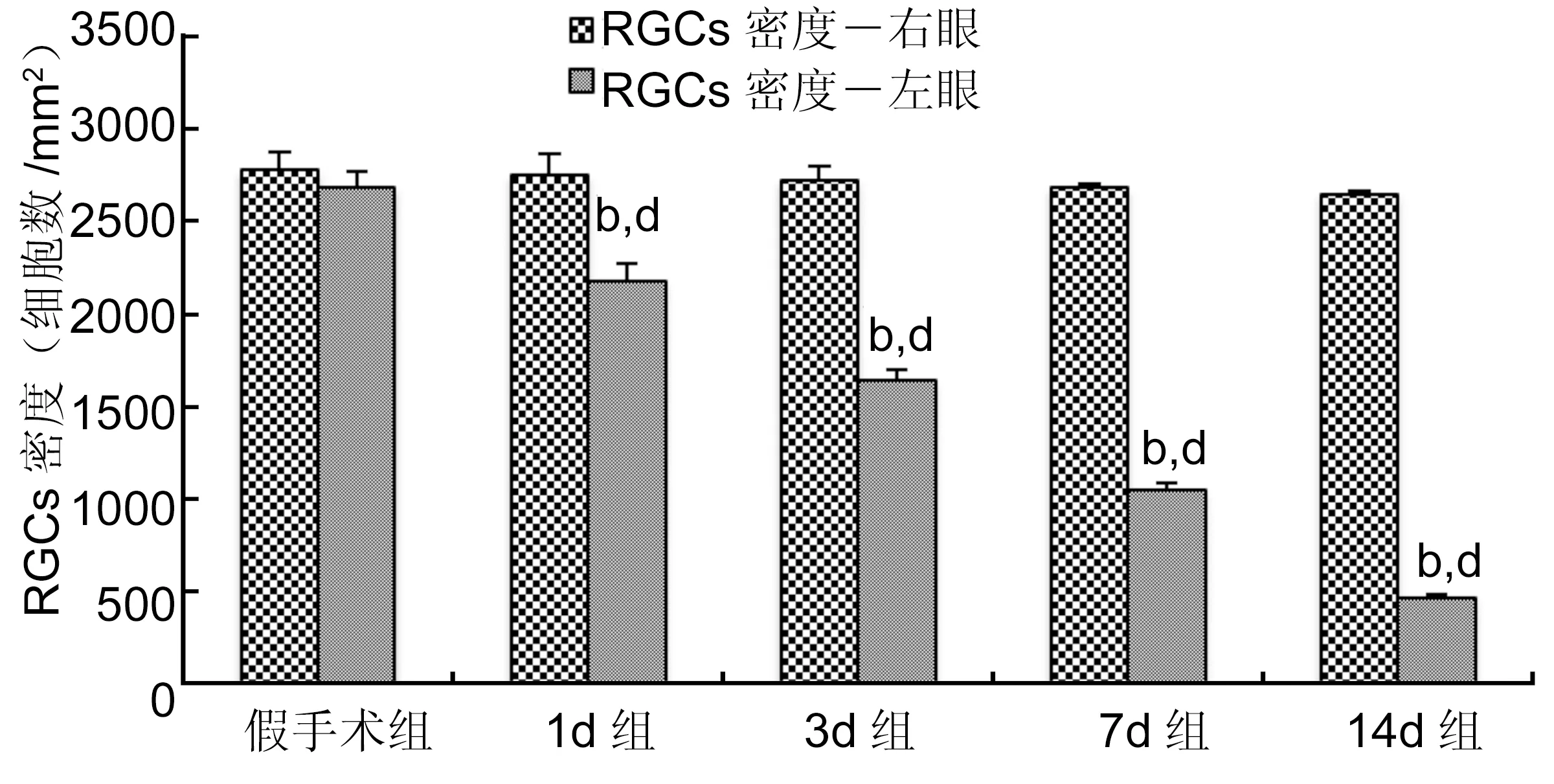
图3各组大鼠RGCs密度bP<0.01vs右眼(对照眼);dP<0.01vs损伤眼的假手术组。
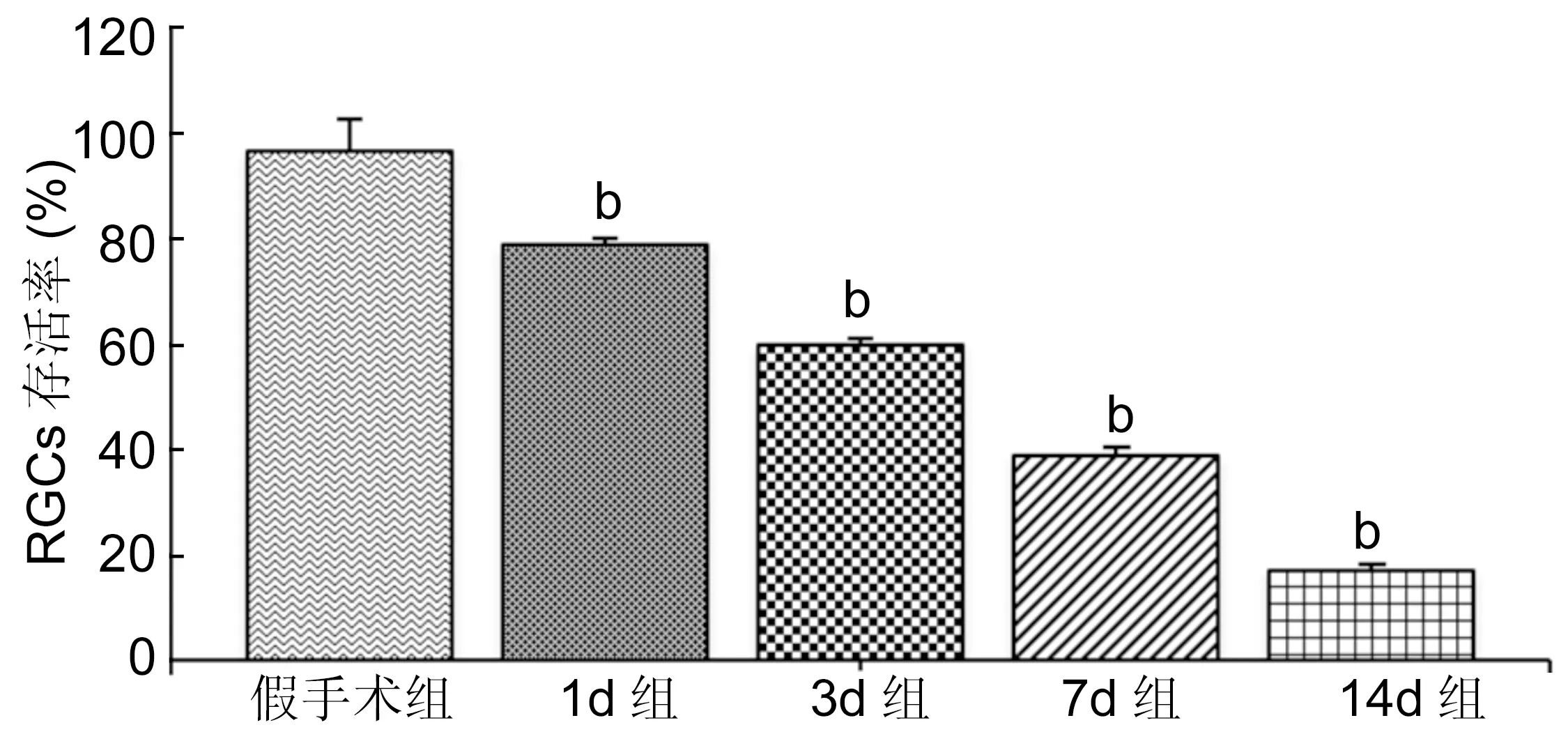
图4各组大鼠RGCs标识率bP<0.01vs假手术组。
2.3.2各组大鼠RGCs标识率经Kruskal-WallisH检验分析,各组RGCs标识率比较,差异具有统计学意义(P<0.01),经ANOVA-Games-Howell分析,各组间均具有统计学意义(P<0.01,表2,图4)。
3讨论
外伤性视神经损伤是眼科常见致盲眼病,其组织病理学基础为RGCs的进行性死亡,目前多采用视神经管减压术或大剂量激素冲击进行治疗,但临床效果不理想,为了研究视神经损伤的机制及有效治疗方法,首先需要研制出稳定的、操作简便的、可重复性强的、易于标化且类似于人类视神经损伤状态的视神经损伤动物模型。国内外学者通过大量探索,研究出各具特点的外伤性视神经损伤模型,目前研究最为广泛的主要包括视神经横断伤、视神经夹持伤、视神经撞击伤及视神经牵拉伤动物模型,各有利弊。

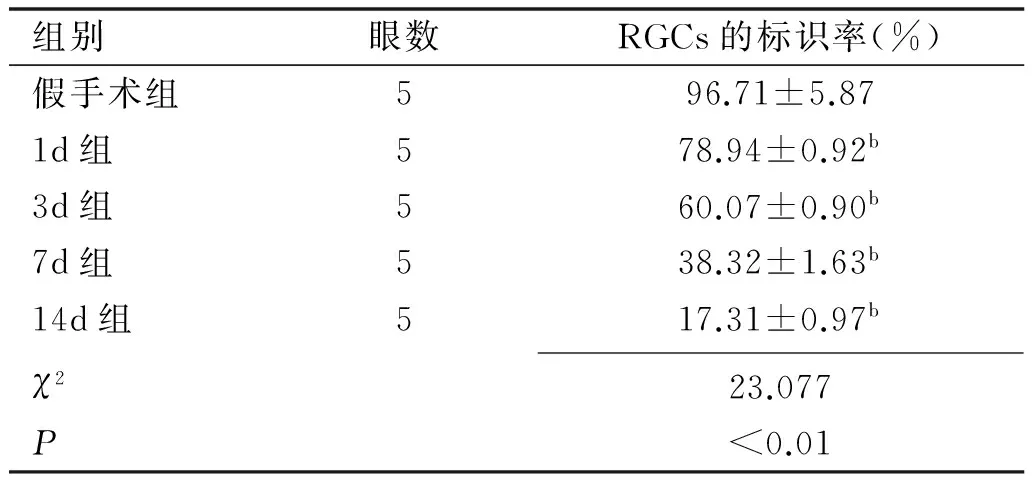
组别眼数RGCs的标识率(%)假手术组596.71±5.871d组578.94±0.92b3d组560.07±0.90b7d组538.32±1.63b14d组517.31±0.97bχ223.077P<0.01
注:bP<0.01vs假手术组。
视神经横断伤动物模型是各种视神经损伤模型中最容易统一致伤量,且操作简便的模型[4-6],但是该模型视网膜神经节细胞轴突完全离断,使其在随后的视神经保护治疗研究等方面存在着很大的局限性,限制了其在视神经损伤研究中的应用。视神经夹持伤是目前实验研究中应用最广泛的方法[7],具有设计简单、易于操作、创伤性小、成模率高,且能够保证视神经髓鞘的完整性等特点,然而根据文献报道[8-11],对于该模型所使用的夹持器械(包括血管钳、动脉瘤夹、视神经钳夹等)以及夹持的力度和时间等方面难以保持统一的规范,受多种因素影响,且损伤量过大,因此缺乏统一的、可控制的致伤标准。视神经撞击伤是一种十分接近临床的间接性损伤模型,利用间接撞击力通过颅骨传导至视神经,主要包括闭合性和开放性撞击法[12],虽然该模型与临床外伤性视神经损伤特点比较吻合,但是人与实验动物在解剖结构上存在很大差异,且其存在造模操作复杂、设备要求高、动物致死率高等不足,因此并不是理想的模型。视神经牵拉伤动物模型类似于部分外伤性损伤及手术牵拉损伤,其方向可以分为与视神经管平行或与视神经管垂直,前者模拟了视神经的弥漫性轴索损伤,后者类似视神经管骨折所致的切割伤;该模型进行实验研究可以获得较好的临床意义,但该模型手术步骤复杂、操作难度大,不利于开展大量研究工作[13-16]。本研究采用横向定量牵拉法制作大鼠外伤性视神经损伤模型,直接暴露视神经,用聚酯缝合线圈住视神经,可控性较强,且视神经受力均匀、定量一致,对视网膜各个部位的损伤基本相同,是较理想的视神经损伤模型。
视神经损伤后直接受累的是RGCs,对其标记的方法主要有辣根过氧化物酶及各种荧光染料等,但是前者参与细胞代谢,易从标记的细胞内扩散到周围组织,且照射后褪色较快,无法在细胞中长期储存。而荧光金[1]在细胞内分解缓慢,不易扩散,与周围组织分界清楚,且灵敏度高,不易淬灭,不仅能清楚显示RGCs的形态学特征,还能对RGCs进行计数。本研究采用横向定量牵拉法制作大鼠视神经损伤模型,以FG为标记物,通过轴浆运输逆行标记RGCs,观察RGCs的形态及数量,从而评价大鼠视神经牵拉伤后RGCs的存活率。结果显示,FG能够较好地标记RGCs,并在正常视网膜中显示标记的RGCs呈金黄色,形态多为圆形或椭圆形,边界清楚,易于计数。正常对照组(右眼)与假手术组(仅暴露视神经的左眼)的RGCs密度相比较差异无统计学意义(P=0.283>0.05),说明仅暴露视神经而不予牵拉不会造成视神经损伤;而视神经牵拉伤后第1、3、7、14d的RGCs存活率进行性下降(78.94%、60.07%、38.32%、17.31%,P<0.01),明确展示了RGCs在视神经损伤后的消亡过程,表明横向定量牵拉法可以建立易于量化的视神经损伤模型,为进一步研究视神经损伤后的治疗方法提供有力工具。
1 Schmued LC, Fallon JH. Fluoro-Gold: a new fluorescent retrograde axonal tracer with numerous unique properties.BrainRes1986;377(1):147-154
2 Cheng L, Sapieha P, Kittlerova P,etal. TrkB gene transfer protects retinal ganglion cells from axotomy-induced deathinvivo.JNeurosci2002;22(10):3977-3986
3 Germain F, Calvo M, Villa P. Rabbit retinal ganglion cell survival after optic nerve section and its effect on the inner plexiform layer.ExpEyeRes2004;78:95-102
4 Koeberle PD, Wang Y, Schlichter LC. Kv1.1 and Kv1.3 channels contribute to the degeneration of retinal ganglion cells after optic nerve transectioninvivo.CellDeathDiffer2010;17(1):134-144
5 Stowell C, Arbogast B, Cioffi G,etal. Retinal proteomic changes following unilateral optic nerve transection and early experimental glaucoma in non-human primate eyes.ExpEyeRes2011;93(1):13-28
6 Wong WK, Cheung AW, Yu SW,etal. Hepatocyte growth factor promotes long-term survival and axonal regeneration of retinal ganglion cells after optic nerve injury: comparison with CNTF and BDNF.CNSNeurosciTher2014;20(10):916-929
7 Templeton JP, Geisert EE. A practical approach to optic nerve crush in the mouse.MolVis2012;18:2147-2152
8 Zhang ZZ, Gong YY, Shi YH,etal. Valproate promotes survival of retinal ganglion cells in a rat model of optic nerve crush.Neuroscience2012;224(8):282-293
9 Zaverucha-do-Valle C, Mesentier-Louro L, Gubert F,etal. Sustained effect of bone marrow mononuclear cell therapy in axonal regeneration in a model of optic nerve crush.BrainRes2014;1587(31):54-68
10廖良,徐铭谦,韦企平,等.钳夹法造成大鼠视网膜神经节细胞过量丢失.眼科新进展 2011;31(2):101-104
11曹霞,姜晓璇,马林昆,等.大鼠视神经钳夹伤模型的建立及磁共振成像运用初探. 眼科新进展 2014;4(3):205-208
12王一,周继红,许立军,等.间接视神经损伤动物模型的研制.中华创伤杂志 1999;15(4):287-289
13 Gennarelli TA, Maxwell WL, Thibault LE,etal. Axonal injury in the optic nerve: a model simulating diffuse axonal injury in the brain.JNeurosurg1989;71(2):244-253
14秦波,成洪波,黄丽娜,等. 牵拉性视神经损伤后视神经中MDA、SOD水平的改变.眼科新进展 2007;27(4):283-284
15王开仕,王正敏.视神经牵拉伤的实验研究.上海医学 2002;25(8):479-483
16 Maxwell WL, Bartlett E, Morgan H. Wallerian degeneration in the optic nerve stretch-injury model of traumatic brain injury: a stereological analysis.JNeurotrauma2015;32(11):780-790
Transverse quantitative traction method making optic nerve precise injury model in rats
Xin-Yi Gu1, Jian Zhou1, Peng-Bo Zhao1, Ai-Wei Liu1, Shan-Shan Shang2, Xiao-Ling Yan1, Lu-Hua Wu2, Yan-Ting Xia1
2016-04-20Accepted:2016-08-08
•transverse quantitative traction method; optic nerve injury; fluorogold; retinal ganglion cells
国家自然科学基金面上项目(No.81173307);北京市自然科学基金面上项目(No. 16G40086)
1(100078)中国北京市,北京中医药大学东方医院眼科;2(100029)中国北京市,北京中医药大学第三附属医院眼科
谷新怡,在读博士研究生,研究方向:视神经疾病。
周剑,硕士,主任医师,博士研究生导师,主任,研究方向:视神经疾病.zhj9667@126.com
2016-04-20
2016-08-08
Gu XY, Zhou J, Zhao PB,etal. Transverse quantitative traction method making optic nerve precise injury model in rats.GuojiYankeZazhi(IntEyeSci) 2016;16(9):1625-1628
10.3980/j.issn.1672-5123.2016.9.06
