核壳结构SiO2@Ag@Cu2O与SiO2@Ag@Cu复合颗粒制备研究
2016-09-02连利仙孔清泉
梁 霄,连利仙,刘 颖,2,孔清泉,汪 莉
(1. 四川大学 材料科学与工程学院,成都 610065;2. 先进特种材料及制备加工技术教育部重点实验室,成都 610065)
核壳结构SiO2@Ag@Cu2O与SiO2@Ag@Cu复合颗粒制备研究
梁霄1,连利仙1,刘颖1,2,孔清泉1,汪莉1
(1. 四川大学 材料科学与工程学院,成都 610065;2. 先进特种材料及制备加工技术教育部重点实验室,成都 610065)
通过在不同粒径的二氧化硅微球模板上进行化学镀银得到SiO2@Ag粉体,并进一步在不同尺寸的SiO2@Ag复合结构上沉积Cu2O、Cu得核壳结构SiO2@Ag@Cu2O与SiO2@Ag@Cu混合粉末复合颗粒。发现通过改变镀铜液的pH值与还原剂滴加速率等参数可以控制包覆表层的物相,当pH值低于10时,不会出现含有铜元素的沉积层;当pH值处于10~11之间,且降低还原剂滴速有利于得到Cu2O镀层;pH值提高至12且还原剂滴加速率增高则有利于在表面得到Cu单质包覆层。
二氧化硅模板;核壳结构;银铜复合颗粒
0 引 言
近年来,核壳结构材料的独特形貌结构以及相关物理化学性质得到了外界的关注[1-4],广泛应用于光学、药物缓释、催化、传感、环境工程与电磁等诸多领域[5-9]。SiO2兼具化学稳定性与热稳定性,通过Stöber法[10]制备的单分散球形SiO2是一种理想的模板材料,可以在表面包覆金属制备具有良好球形度与均匀性的SiO2@Ag,SiO2@Au,SiO2@Ni等多种核壳结构[11-13]。此类核壳结构具有独特的结构与物理化学性能,兼具SiO2与金属的特性,更好适用于导电吸波材料以及电磁屏蔽材料中;同时以SiO2为基体相较于纯金属而言节省了贵金属使用量,因而代替纯金属(尤其是贵金属)可以实现更高的经济效益。
化学镀法制备SiO2与金属复合的核壳结构,可以在无外加电源时利用基体表面自发的氧化还原反应获得可控的金属包覆层[14]。SiO2@Ag@Cu可以代替银铜双金属粉末,广泛地应用于电子浆料、 电磁屏蔽材料和催化剂等领域[15];SiO2@Ag@Cu2O则是一种理想杀菌材料,同时电介质@导体@半导体的复合结构有利于增强壳层Cu2O的光催化性能[16]。本文利用化学镀制备了SiO2@Ag@Cu与SiO2@Ag@Cu2O混合粉末,考察了化学镀过程中pH值、还原剂滴加速率以及SiO2@Ag尺寸等因素对壳层物相以及微观形貌的影响,通过控制镀层中Cu与Cu2O的比例,实现SiO2@Ag@Cu与SiO2@Ag@Cu2O复合核壳结构的可控制备。
1 实 验
1.1单分散SiO2模板的制备
在匀速搅拌的去离子水中加入无水乙醇,溶液澄清后添加氨水,搅拌10min,溶液混合均匀后缓慢加入正硅酸乙酯。磁力搅拌24h后,将溶液离心,用去离子水清洗3次,再使用无水乙醇离心清洗后在烘箱中烘干24h,得到SiO2粉末固体。
1.2SiO2@Ag核壳结构的制备
取SiO2微球0.5g与10mL无水乙醇进行磁力搅拌,将SnCl2敏化液加入SiO2悬浮液中敏化30min后,离心分离清洗SiO2微球表面。利用AgNO3活化SiO2微球30min,离心分离取出SiO2微球后与镀银液混合搅拌,同时缓慢滴入还原剂,反应1~2h后制得SiO2@Ag,用去离子水、无水乙醇清洗取出干燥[15]。
1.3SiO2@Ag@Cu与SiO2@Ag@Cu2O核壳结构的制备
取SiO2@Ag分散在20mL无水乙醇中,将50mL镀铜液(EDTA作络合剂)加入SiO2@Ag分散液中,加入甲醛作为还原剂,磁力搅拌1h,通过控制溶液pH值与还原剂滴加速率,得到SiO2@Ag@Cu2O或SiO2@Ag@Cu混合粉末;用去离子水与无水乙醇离心清洗4~5次后取出烘干。
2 结果与讨论
2.1SiO2@Ag复合微球
图1为以不同粒径SiO2为模板包覆Ag壳层得到的SiO2@Ag核壳结构的SEM微观形貌。随着模板的减小,Ag壳层包覆厚度及致密度有所降低,这是因为模板粒径降低导致其比表面积的增大,Ag颗粒需要覆盖的面积增加因而导致了镀层的相对疏散化。可以通过调整镀银液中银含量等参数来改善控制Ag壳层厚度。
包覆在模板表面的Ag并非致密结合,而是以片状岛屿的形态均匀分布,如图1所示。二氧化硅作为模板与Ag元素的润湿性差,润湿角接近180°(共价键和金属键不相容且氧化硅球表面惰性较强),Ag元素依靠SiO2模板形核与自由形核的形核势垒接近,无法自发在其表面形核长大。

图1不同尺寸SiO2@Ag复合微球SEM显微形貌
Fig1SEMmorphologyofSiO2@Agwithdifferentsize
因此,包覆Ag壳层,首先需要使SnCl2敏化液中的Sn2+粘附在模板表面,活化过程则利用氧化还原反应使Ag元素置换掉模板表面的锡离子,在包覆过程中以活化反应置换出的Ag原子作为表面活性点进行Ag的扩散长大,活化中未包覆Sn2+的部位Ag元素难以自发形核长大,镀银阶段Ag的生长扩散以表面Ag颗粒的晶粒长大占优,因而最后的Ag包覆层颗粒多呈孤立的岛屿状结构。
2.2SiO2@Ag@Cu与SiO2@Ag@Cu2O核壳结构
2.2.1pH值的影响
化学镀铜可分为阴极反应与阳极反应,从阴极反应过程可以看出,Cu2+被还原为Cu+的倾向低于其直接被还原为铜单质,一价Cu+生成在热力学上是可行的,因而可以可控调节SiO2@Ag表面含铜包覆层的物相。
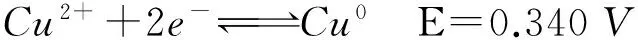
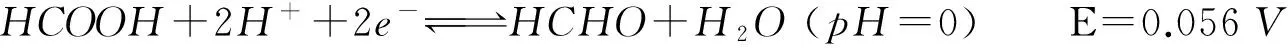
不同pH值下,甲醛阳极反应的标准电极电位不同,pH值为0时E=0.056V,生成甲酸盐阴离子;pH值为14时E=1.070V,生成甲酸,两者电位差值超过1V,热力学上表明碱性环境有利于铜的还原。
图2为不同pH值下化学镀铜制备样品的X射线衍射图,物相分析表明镀铜过程中pH值对包覆结果影响较大。由图2可见,在不同酸碱环境下进行化学镀铜表层的物相不同,当pH值较低时,镀铜液中的Cu2+不能被还原仍然以离子形式存在于溶液中;当pH值=10,粉末上开始析出Cu2O与单质Cu,同时随着pH值进一步提高,Cu2O比例降低,Cu含量增高。升高pH值有利于提高化学镀铜速率与热力学驱动力,在较快Cu还原速率下,Cu+的还原受到抑制,镀液中Cu2+快速地被还原成单质Cu。当pH值不低于13,化学镀体系中出现大量游离的碎屑状单质Cu,这是因为此时Cu2+还原成单质Cu的热力学驱动力进一步增大,降低了镀液中Cu自由形核的能量位垒以致镀液失稳,反应速率的增大也使得游离Cu单质与SiO2@Ag表面Cu的生成形成竞争关系;同时,Cu2+过快的还原速率致使SiO2@Ag表面镀层因为快速生长而相互连接,形成了较大的块状团聚体,因而不能通过单方面继续提高pH值获得单一晶相的SiO2@Ag@Cu。
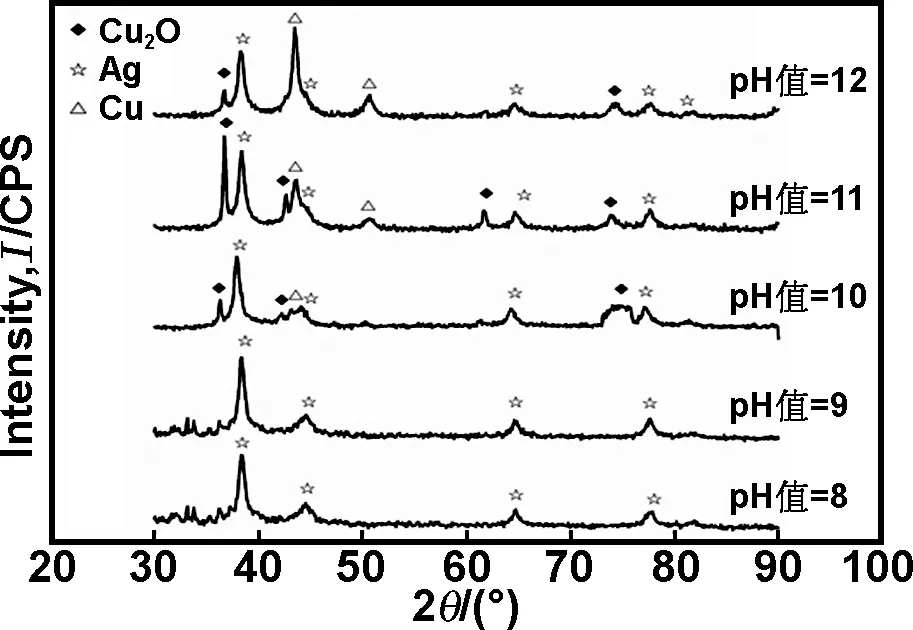
图2不同pH值下SiO2@Ag@Cu2O/Cu的XRD衍射图
Fig2XRDpatternsofSiO2@Ag@Cu2O/CuunderdifferentpH
图3是反应环境pH值分别为8、11、12时,最外层壳层的显微形貌。pH值=8时SiO2@Ag微观形貌并未发生变化;pH值=11时,随着氢氧根离子浓度升高,Cu2+在Ag镀层上被还原并形核长大。当pH值在10~11左右,Cu2+被还原为Cu+的趋势占优,继而以Cu2O的形式析出沉积在SiO2@Ag表面,形成一层粗糙但致密的包覆层,并且在包覆层上可以观察到清晰的立方结构。Cu2O的微观形貌由〈100〉与〈111〉面的生长速度比值决定,比值变化会使晶体从八面体逐渐过渡到立方体,〈111〉晶面生长速率较快导致了下图中Cu2O呈立方结构。进一步提高反应的pH值,镀层物相由Cu2O转变为单质Cu时,Cu2O立方体结构基本消失,铜包覆层表面呈粗糙的颗粒状。

图3不同pH值下SiO2@Ag@Cu2O/Cu的SEM显微形貌
Fig3SEMmorphologyofSiO2@Ag@Cu2O/CuunderdifferentpH
pH值的变化可以改变表面镀层的物相及微结构;将pH值保持在10~11的范围,有利于得到以Cu2O为主的包覆层,pH值为12时更有利于得到以单质Cu为主的镀层。因此改变pH值是通过改变SiO2@Ag外部镀层物相组成来可控制备SiO2@Ag@Cu2O和SiO2@Ag@Cu混合粉末核壳复合结构的有效手段。
2.2.2还原剂添加速率的影响
图4为改变还原剂滴加速率制备的SiO2@Ag@Cu2O和SiO2@Ag@Cu混合粉末样品X射线衍射图。

图4不同还原剂滴加速率下SiO2@Ag@Cu2O/Cu的XRD衍射图
Fig4XRDpatternsofSiO2@Ag@Cu2O/Cuwithdifferentreducingagentadditionrate
结果表明还原剂滴加速率不同,还原后生成的物相组成有所不同,两者都可以观察到Ag、Cu2O的衍射峰,并有相对较为微弱的Cu单质相峰位;且滴加速率增大时,Cu的峰面积增大,即单质Cu的生成量增加。图5为还原剂滴加速率对SiO2@Ag@Cu2O/Cu复合微球显微形貌的影响。

图5还原剂滴加速率对SiO2@Ag@Cu2O/Cu复合微球显微形貌的影响
Fig5EffectofdifferentadditionrateofreducingagentonSiO2@Ag@Cu2O/Cumorphology
甲醛氧化交换电流密度相较阴极反应中Cu2+还原的交换电流密度小1~2个数量级,因而化学镀铜反应中速控步骤为甲醛分子的氧化,镀铜受到甲醛氧化速率控制。Cu2O与单质Cu的生成是竞争反应。当只考虑热力学因素,可以发现Cu+生成单质Cu的标准电极电位为0.522V,Cu+被继续还原的自由能较高。但在氢氧根离子浓度较大的碱性镀液中,Cu+生成后迅速与游离氧生成了Cu2O固体,还原反应受限,SiO2@Ag表面沉积物质的主要物相由单质Cu生成速率决定。
化学镀铜中单质铜的反应速率随甲醛浓度增高而上升。还原剂的滴速改变实质是改变了反应初始阶段时体系甲醛浓度。缓慢滴加甲醛,反应开始时甲醛浓度较低,Cu2+被还原为单质Cu速率降低,当Cu2O生成时继续添加甲醛不能使已生成的Cu2O被还原为单质Cu。致使Cu2+更倾向于被还原为一价的Cu+。还原剂缓慢滴加有利于得到Cu2O的包覆层,提高反应中单质Cu的还原速率将有效抑制Cu2O的生成。
2.2.3SiO2模板尺寸的影响
SiO2模板的大小也是影响着Cu2O与Cu在SiO2@Ag表面的生长的因素之一,调整包括SiO2尺寸在内的化学镀银工艺参数,SiO2表面的Ag包覆层厚度变化较小,Ag层厚度保持在10~40nm之间,SiO2@Ag尺寸可以近似等于SiO2的尺寸。图6为不同粒径SiO2@Ag为模板制备的SiO2@Ag@Cu与SiO2@Ag@Cu2O核壳结构混合粉末扫描图片,因为SiO2@Ag尺寸对于表面Cu2O或Cu壳层的影响呈现阶段性的变化,当SiO2粒径从540nm变化至400nm时表面含Cu壳层的微观形貌变化不大;选择了表面含Cu壳层具有明显微观形貌差异的3个模板尺寸,分别为2μm、540nm、170nm作为观察对象。结果表明SiO2@Ag直径在2μm左右,粉体表面的Cu2O包覆层基本由约100nm的立方结构组成;而当模板尺寸降至540nm,立方结构减少但表面依然形成了致密的Cu2O包覆层;进一步使用直径约170nm的模板 ,SiO2@Ag模板上只有局部区域表面析出了少量60nm左右的不规则颗粒。从图6中可以观察到SiO2粒径降低,SiO2@Ag表面越不容易得到致密的Cu2O或Cu壳层。在具有催化活性的Ag表面,铜以沿晶生长的形式沉积,而在SiO2非活性表面则可能因为两者结合力弱发生脱落迁移,因而SiO2@Ag模板尺寸对含Cu壳层微观形貌的影响取决于Ag壳层的致密程度。随着SiO2模板变小,Ag壳层致密度越低,从而导致当模板尺寸降至170nm时,Cu2O更倾向于在镀铜液中自由形核,而非形成致密的壳层结构。

图6模板尺寸对SiO2@Ag@Cu2O/Cu显微形貌的影响
Fig6EffectofplatensizeonSiO2@Ag@Cu2O/Cumorphology
SiO2@Ag模板尺寸对含Cu壳层制备的影响主要来自其表面Ag元素分布状态,因而可以通过进一步优化SiO2@Ag制备工艺获得更为致密的Ag壳层,有效降低模板尺寸对SiO2@Ag@Cu2O与SiO2@Ag@Cu混合粉末核壳复合结构的不良影响。
3 结 论
研究了核壳结构SiO2@Ag@Cu2O与SiO2@Ag@Cu混合粉末复合颗粒的化学镀工艺,研究表明可以通过改变化学镀过程中pH值与还原剂甲醛滴加速率有效控制最外部壳层物相:甲醛滴加速率与pH值为12时有利于得到SiO2@Ag@Cu;甲醛滴加速率降低且控制pH值在10~11之间,有利于制备SiO2@Ag@Cu2O。研究实现了通过化学镀工艺参数的调整对SiO2@Ag@Cu与SiO2@Ag@Cu2O混合粉末复合核壳结构的可控制备。
[1]LiF,ZhaoYL,DaiW,etal.FacilesynthesisofAg@SiO2core-shellnanowiresonlargescale[J].JournalofMaterialsScience:MaterialsinElectronics, 2014, 26(3): 1602-1607.
[2]PupoMMS,López-SuárezFE,Bueno-LópezA,etal.Sn@PtandRh@Ptcore-shellnanoparticlessynthesisforglyceroloxidation[J].JournalofAppliedElectrochemistry, 2014, 45(2): 139-150.
[3]ShankarSS,RaiA,AhmadA,etal.RapidsynthesisofAu,Ag,andbimetallicAucore-AgshellnanoparticlesusingNeem(Azadirachtaindica)leafbroth[J].JournalofColloidandInterfaceScience, 2004, 275(2): 496-502.
[4]AlayogluS,NilekarAU,MavrikakisM,etal.Ru-Ptcore-shellnanoparticlesforpreferentialoxidationofcarbonmonoxideinhydrogen[J].NatureMaterials, 2008, 7(4): 333-338.
[5]HeD,WangS,LeiL,etal.Core-shellparticlesforcontrollablereleaseofdrug[J].ChemicalEngineeringScience, 2015, 125: 108-120.
[6]OenerSZ,MannSA,SciaccaB,etal.Au-Cu2Ocore-shellnanowirephotovoltaics[J].AppliedPhysicsLetters, 2015, 106(2): 023501.
[7]WangY,QuF,LiuJ,etal.EnhancedH2SsensingcharacteristicsofCuO-NiOcore-shellmicrospheressensors[J].SensorsandActuatorsB:Chemical, 2015, 209: 515-523.
[8]HirakawaT,KamatPV.ChargeseparationandcatalyticactivityofAg@TiO2core-shellcompositeclustersunderUV-irradiation[J].JournaloftheAmericanChemicalSociety, 2005, 127(11): 3928-3934.
[9]ZhangH,SongY,ShengY,etal.EDTA-assistedfabricationofTiO2core-shellmicrosphereswithimprovedphotocatalyticperformance[J].CeramicsInternational, 2015, 41(1): 247-252.
[10]RazinkJJ,SchlotterNE.Correctionto“preparationofmonodispersesilicaparticles:controlofsizeandmassfraction”byBogushGH,TracyMA,ZukoskiIVCF,JournalofNon-CrystallineSolids, 1988,(104):95-106[J].JournalofNon-CrystallineSolids, 2007, 353(30-31): 2932-2933.
[11]DengZ,ChenM,WuL.NovelmethodtofabricateSiO2/Agcompositespheresandtheircatalytic,surface-enhancedRamanscatteringproperties[J].TheJournalofPhysicalChemistryC, 2007, 111(31): 11692-11698.
[12]XiaoG,ManS,ShiW,etal.Surfaceplasmonresonanceandsurface-enhancedRamanscatteringactivityofSiO2-Aucore-capnanostructurearrays[J].AppliedPhysicsA, 2014, 117(4): 1907-1914.
[13]WuHM,TsengWJ.ElectrolessnickelmetallizationtoprepareSiO2-Nicompositeparticlesviapolyelectrolytesroute[J].CeramicsInternational, 2015, 41(1): 1863-1868.
[14]CaiJun,HuYanyan,LanMingming.Manufacturingandcharacterizationofcompositechemicalplatinglightweightconductiveparticlesbaseonmicroorganismstemplate[J].JournalofFunctionalMaterials, 2014, 45(19): 19109-19114.
[15]ChoiE,LeeS,PiaoY.Asolventlessmix-bake-washapproachtothefacilecontrolledsynthesisofcore-shellandalloyAg-Cubimetallicnanoparticles[J].CrystEngComm, 2015, 17(31): 5940-5946.
[16]NikabadiHR,ShahtahmasebiN,Rokn-AbadiMR,etal.StructuralverificationandopticalcharacterizationofSiO2-Au-Cu2Onanoparticles[J].BulletinofMaterialsScience, 2014, 37(3): 527-532.
ThefabricationofSiO2@Ag@Cu2OandSiO2@Ag@Cucore-shellstructure
LIANGXiao1,LIANLixian1,LIUYing1,2,KONGQingquan1,WANGLi1
(1.CollegeofMaterialsScienceandEngineering,SichuanUniversity,Chengdu610065,China;2.AdvancedSpecialMaterialandPreparationProcessingTechnologyKeyLaboratoryoftheMinistryofEducation,Chengdu610065,China)
Inthisarticle,SiO2@Ag@CuandSiO2@Ag@Cu2Ocompositecore-shellstructureissynthesizedbyelectrolessplatingaCu2OorCushellonthepowderofSiO2@Ag,wherethebasicSiO2@Agisfabricatedthroughthesilverplatingondifferentsizesofsilicatemplates.ItisfoundthatthechangesofparameterslikepHvalueandreducingagentadditionratecanregulateandcontroltheoutmostshellphase:theCu2OshellisappreciablewhenpHmaintainsbetween10-11withlowerreducingagentadditionrate,whilehigherpHandadditionrateofreducingagentwillresultinashellmainlycomposedofCu.
silicatemplate;core-shellstructure;Ag-Cucompositepowder
1001-9731(2016)05-05207-05
四川省科技支撑计划资助项目(2014GZ0088)
2015-06-10
2015-08-10 通讯作者:连利仙,E-mail:lianlixian@scu.edu.cn
梁霄(1989-),女,四川达州人,硕士,师承连利仙副教授,从事纳米材料与纳米技术研究。
TB333
A
10.3969/j.issn.1001-9731.2016.05.039
