响应面法分析玉米半胱氨酸蛋白酶活性影响因素*
2016-09-02陈方奇刘回民郑明珠刘景圣
陈方奇,刘回民,郑明珠,靳 松,刘景圣
(1 吉林农业大学食品科学与工程学院,吉林 长春 130118;2 小麦和玉米深加工国家工程实验室,吉林 长春 130118;3 吉林农业大学生命科学学院,吉林 长春 130118)
科学实验
响应面法分析玉米半胱氨酸蛋白酶活性影响因素*
陈方奇1,2,刘回民2,3,郑明珠1,2,靳松1,刘景圣1,2
(1 吉林农业大学食品科学与工程学院,吉林长春130118;2 小麦和玉米深加工国家工程实验室,吉林长春130118;3 吉林农业大学生命科学学院,吉林长春130118)
玉米半胱氨酸蛋白酶(zea mays Cysteine Protease)是一类重要的蛋白水解酶,为了研究玉米半胱氨酸蛋白酶酶学性质,用重组毕赤酵母表达玉米半胱氨酸蛋白酶,以玉米半胱氨酸蛋白酶的相对酶活力为指标,采用响应面法分析pH、温度、MgCl2浓度对该酶活性的影响。结果表明,当pH 5.95,温度55.89 ℃,MgCl2浓度6.08 mM,预测的相对酶活力为166.78%,实测值为167.13%。模型合理,有参考价值。
玉米半胱氨酸蛋白酶;发酵;响应面法;酶活
半胱氨酸蛋白酶是以Cys-His-Asn/Glu氨基酸序列为活性中心的一类酶,广泛分布于从病毒至脊椎动物的生物体中[1-2]。半胱氨酸蛋白酶是植物体内重要的蛋白水解酶,参与多种生理过程[3-7]。该酶的最适温度和pH和稳定性具有满足食品工业和医药行业运用的先天优势[8-9]。
玉米不仅是重要的粮食作物,也是燃料、医药等领域的重要原料[10-13]。研究玉米中的半胱氨酸蛋白酶具有重要的实际意义。玉米半胱氨酸蛋白酶(zmCP1)属于C1家族,常以酶源的形式存在并以外切酶为主。其中10~26 个氨基酸残基组成的酶前体,结合到内质网后,通过分子内或分子间蛋白水解而激活,其它C1家族半胱氨酸蛋白酶(木瓜蛋白酶、猕猴桃素、组织蛋白酶B)尽管与zmCP1的一级结构和二级结构具有很高的同源性,但在酶学性质上有很大差别[2]。本文利用重组毕赤酵母菌株GS115-zmCP1表达zmCP1并利用响应面法分析pH值,MgCl2浓度,温度三个因素对zmCP1活力的影响,为深入研究zmCP1的酶学性质提供依据。
1 实 验
1.1材料与试剂
重组毕赤酵母菌株GS115-zmCP1由实验室保存;MgCl2、生物素、酵母氮源YNB、咪唑购自鼎国公司;酵母浸粉、蛋白胨购自Sigma公司;R-AMC(7-氨基-4-甲基香豆素)、AMC购自上海生工;BCA蛋白测定试剂盒购自TaKaRa公司;组氨酸抗体、辣根过氧化物酶偶联的羊抗鼠抗体购自QIAGEN公司。
1.2实验方法
1.2.1重组毕赤酵母菌株GS115-zmCP1的诱导表达
挑取阳性转化子于BMGY培养基中,30 ℃,250 rpm振荡培养至OD600=2~6;3000 g 4 ℃离心5 min收集菌体并用 25 mL BMMY培养基在相同条件下进行诱导表达,每24 h补加100%甲醇至甲醇终浓度为0.5%,发酵96 h后离心收集上清,以GS-pPICZα-A和不加甲醇诱导的GS115-zmCP1作为阴性对照[14-15]。
1.2.2发酵产物SDS-PAGE与Western-Blot分析
取1 mL96 h发酵液上清液进行SDS-PAGE分析,上样量20 μL。用凝胶成像系统对电泳结果进行分析,以1:1000稀释的Penta-His Antibody作为一抗,1:1000稀释的HRP-Goat Anti-Mouse IgG为二抗进行Western-Blot分析鉴定。
1.2.3重组蛋白zmCP1的纯化
将96 h的发酵液用0.22 μm微孔滤膜过滤除菌,再经超滤管(蛋白分子截留量:10 kD)进行浓缩,测酶活。用镍柱进行纯化。纯化前,让镍柱中的20%乙醇自然流出,用5个柱体积的蒸馏水清洗,然后用5个柱体积的Binding buffer(20 mM磷酸钠缓冲液,500 mM氯化钠,20 mM咪唑,pH 7.4)进行平衡,上样,用10个柱体积的Binding buffer洗去杂蛋白,再用5个柱体积的Elution buffer(20 mM磷酸钠缓冲液,500 mM氯化钠,500 mM咪唑,pH 7.4)洗脱目的蛋白,收集量1 mL。对洗脱蛋白进行SDS-PAGE分析。
1.3zmCP1酶活的测定
1.3.1制备标准曲线
称取适量AMC于100%DMSO中, 用Tris-HCl(pH 8.0、50 mmol)缓冲液配成不同浓度的200 μL AMC溶液,在激发波长380 nm、发射波长460 nm、狭缝宽5 nm条件下测定荧光强度,以荧光强度为横坐标,AMC摩尔浓度为纵坐标,制作标准曲线[16-17]。
1.3.2样品测定
参照文献[16-17]检测zmCP1酶活。反应体系为200 μL:5 μL酶液,10 μL底物(100 mmol/L,20%DMSO),185 μL Tris-HCl(pH 8.0、50 mmol)。反应液50 ℃水浴30 min 后冰浴60 min,检测荧光活力。激发波长380 nm、发射波长460 nm、狭缝宽5 nm/1.5 nm。酶活单位为U,1 U定义为每分钟催化生成1 μmol AMC所需要的酶量。比活力=总活力(U)/总蛋白(mg)。蛋白含量用BCA 蛋白测定试剂盒测定。
1.4单因素试验
选取MgCl2浓度(1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10 mM)、反应温度(35、40、45、50、55、60、65、70、75、80 ℃)、pH值(3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)进行单因素试验。固定值分别为,MgCl2浓度:4.0 mM,反应温度:50 ℃,pH值:5.5;以R-AMC为底物按照上述酶活测定方法测定,以纯化的zmCP1酶活为100%,相对酶活为纵坐标,不同单因素为横坐标,探究各因素对zmCP1酶活的影响。
1.5响应面试验设计
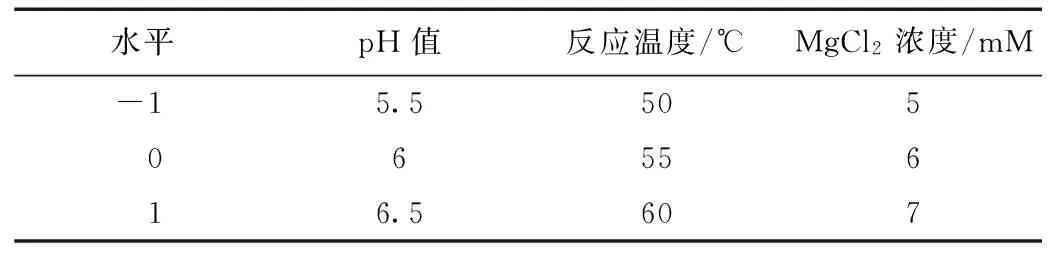
表1 响应面试验因素水平和编码
在单因素试验的基础上,以相对酶活作为响应值,进行3因素3水平响应面分析,采用Box-Benhnken 法进行响应面优化。试验因素水平设计表,见表1。
2 结果与讨论
2.1zmCP1的表达鉴定及纯化
GS115-zmCP1重组菌经过96 h甲醇诱导,以GS-pPICZ-A和不加甲醇诱导的GS115-zmCP1为对照。SDS-PAGE分析结果见图1。
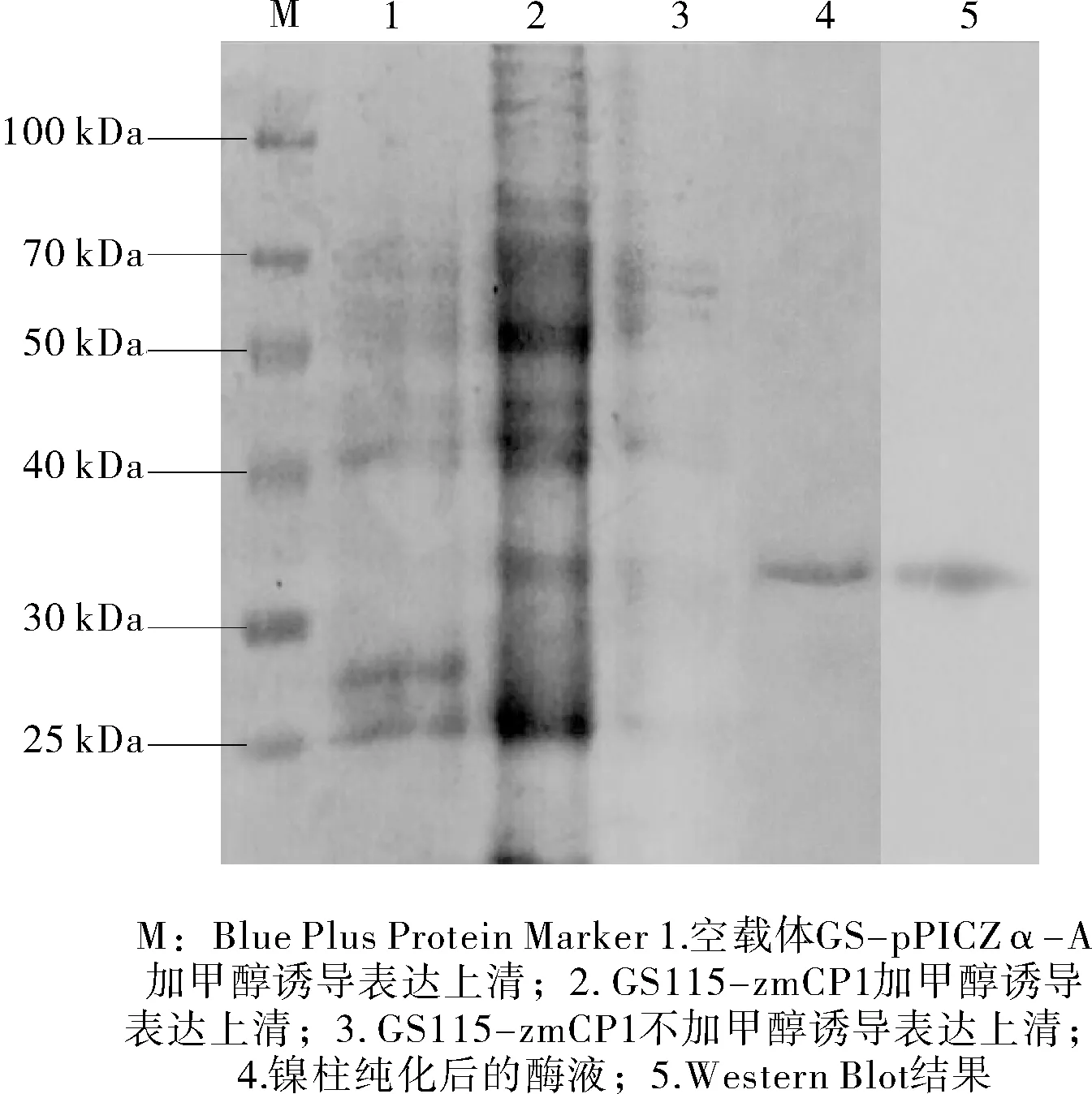
图1 发酵产物的蛋白电泳图和Western Blotting 鉴定
由图1可知:在甲醇诱导后,GS115-zmCP1能特异性表达分子量约为34 kDa的蛋白,与理论分子量一致,Western-Blot鉴定的结果与SDS-PAGE分析结果相一致,表明zmCP1在毕赤酵母GS115中成功表达。纯化后zmCP1的比活力为209.32 U/mg。以纯化后的酶活力为100%,进行单因素试验。
2.2单因素试验结果
2.2.1pH对zmCP1活性的影响
pH对zmCP1活性的影响如图4所示:高、低pH值和对酶活力都有抑制作用,在pH值从3.5逐渐增大的过程中,酶活力迅速上升,在6.0处达到最高点,之后酶活力下降相对缓和。因此选择pH值6.0进行响应面优化试验。
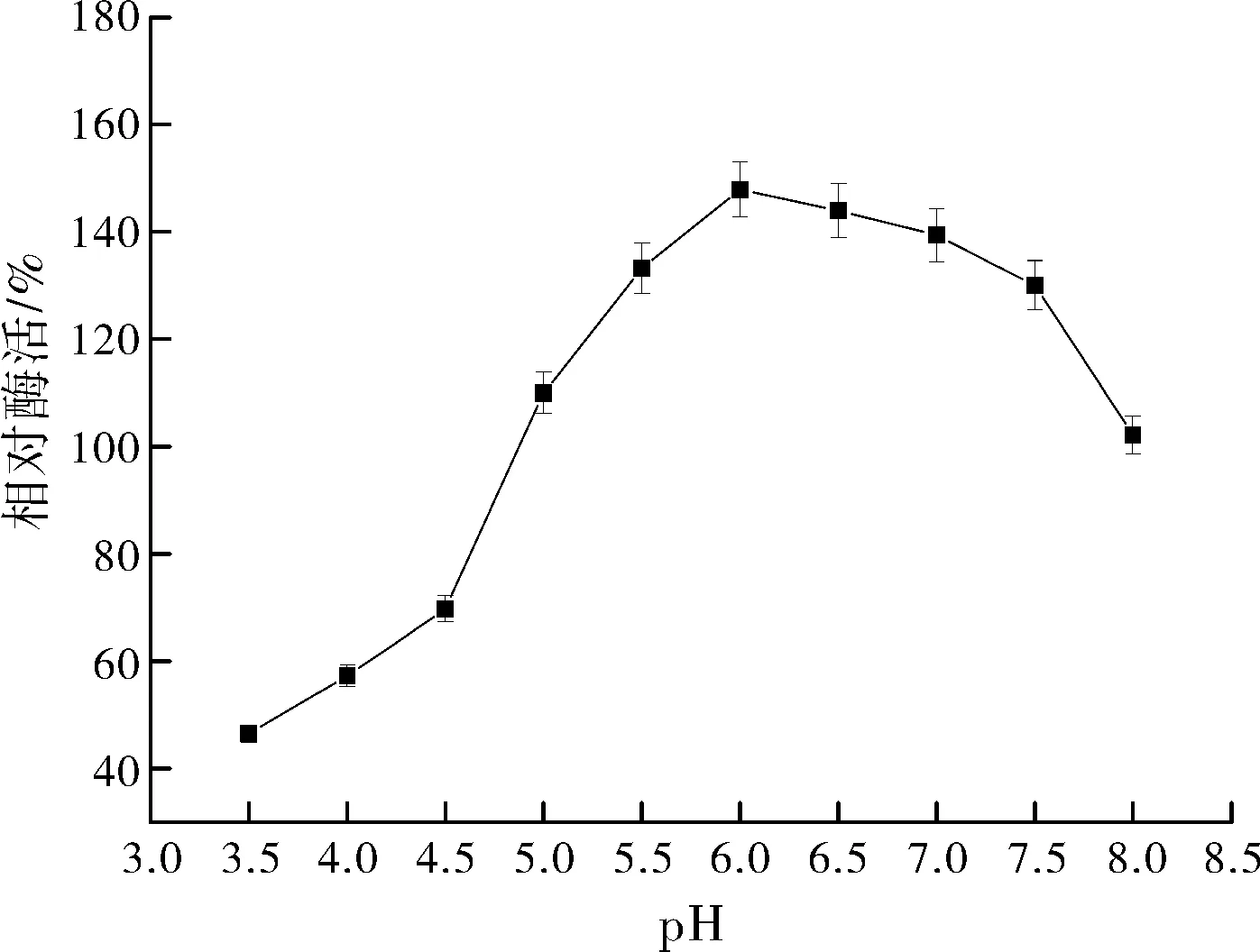
图2 pH对zmCP1活性的影响
2.2.2反应温度对zmCP1活性的影响
反应温度对zmCP1活性的影响如图3所示:zmCP1温度适应范围很宽,随着反应温度的升高,酶活力呈现先上升,后下降的趋势,在80 ℃时依然具有70%左右的活性,55 ℃的时候达到最大值,因此选择反应温度55 ℃进行响应面优化试验。

图3 反应温度对zmCP1活性的影响
2.2.3MgCl2浓度对zmCP1活性的影响
MgCl2浓度对zmCP1活性的影响如图4所示:随着MgCl2浓度的增大,酶活力逐渐上升,在6 mM时,酶活力达到最大值,但是在超过6 Mm后,酶活力就呈现出抑制作用。因此选择MgCl2浓度6 mM进行响应面优化试验。
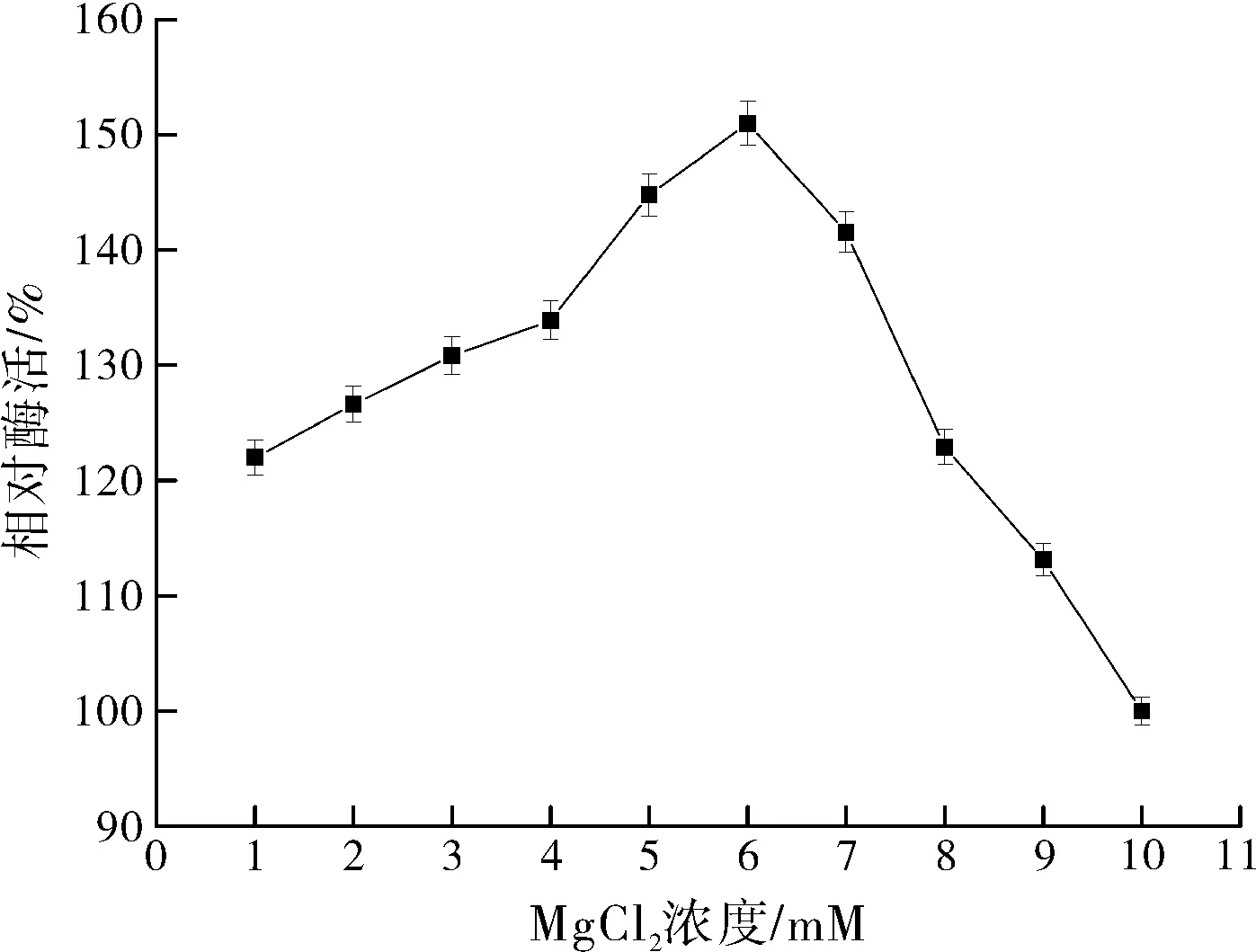
图4 MgCl2浓度对zmCP1活性的影响
2.3响应面试验优化结果
2.3.1响应面分析设计及结果
用Box-Benhnken法,以zmCP1相对酶活力为响应值,MgCl2浓度、温度、pH为自变量进行响应面试验设计,响应面试验设计及响应值见表2。
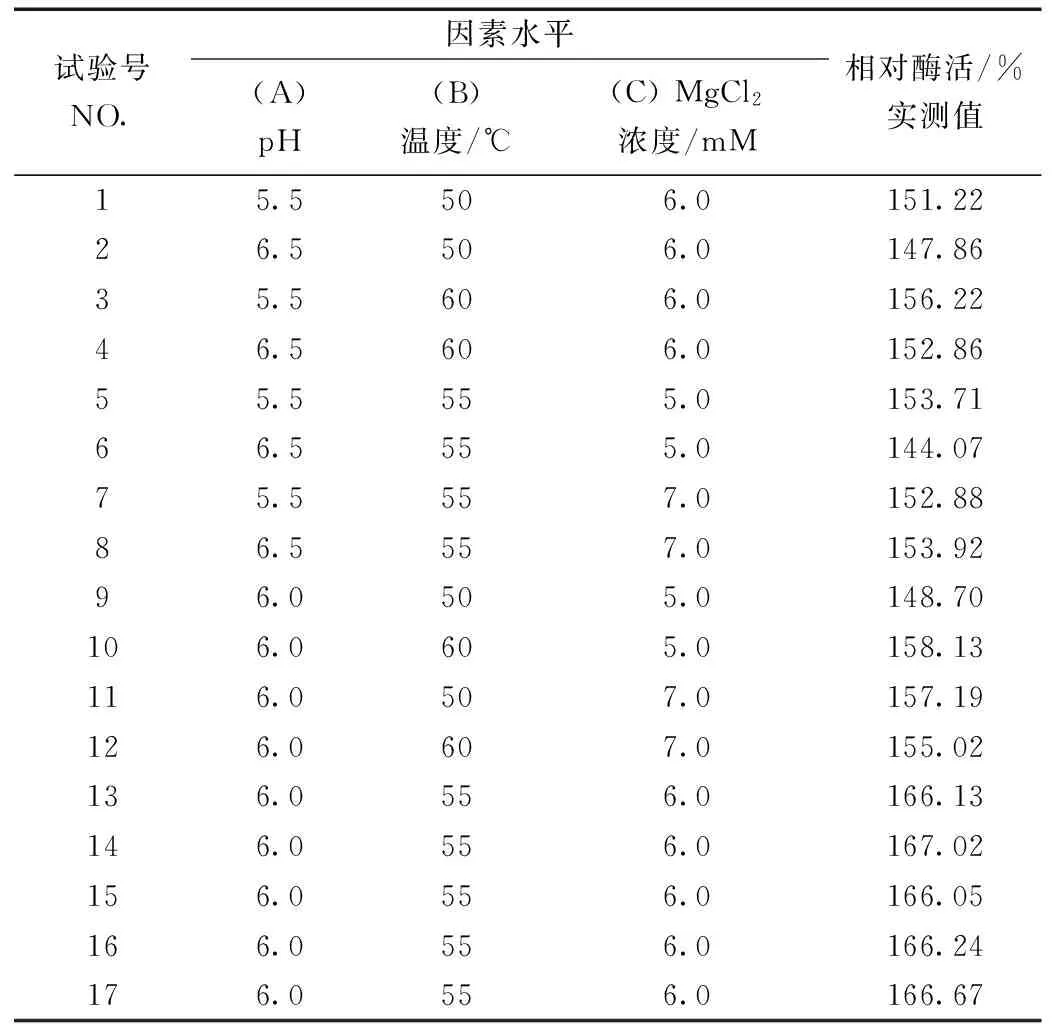
表2 响应面试验设计方案与结果
使用Design-Expert软件进行多元回归拟合,结果分析表明,zmCP1酶活力大小与pH、温度、MgCl2浓度之间为Quadratic模型关系,方程为:
zmCP1酶活力=166.42-1.91A+2.16B+1.80C+2.67AC-2.90BC-9.00A2-5.38B2-6.28C2
从方程中一次项回归系数的绝对值大小可看出各影响因素对响应值的影响程度为:B(温度)>A(pH)>C(MgCl2浓度)。
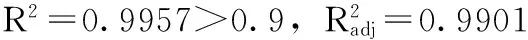
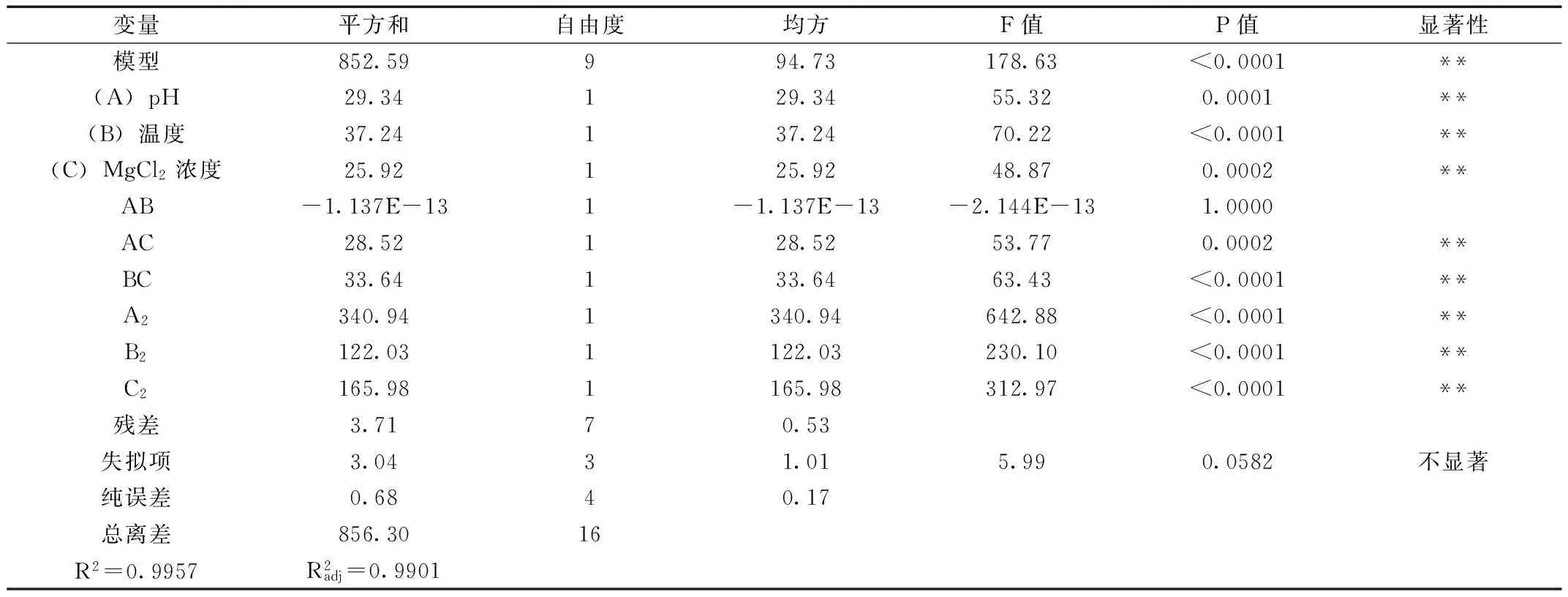
表3 响应面模型方差分析
注:P<0.01为极显著,表示为**;P<0.05为显著,表示为*。
2.3.2模型响应面分析
图5~图7为由回归方程建立的响应面3D图,反应了pH、温度、MgCl2浓度对响应值zmCP1酶活的影响。曲线坡度的陡峭程度能够反映出随着影响因素的变化而导致的响应值的变化趋势;等高线形状反应出两个交互作用是否显著,偏椭圆则显著,偏圆形则不显著[18]。


图5 Y=f(A,B)的响应面图和等高线
由图5可知响应面曲线相对趋于平缓,pH和温度的交互作用对酶活性影响不大,且等高线的形状偏圆形,说明pH和温度两因素的交互作用不够显著。
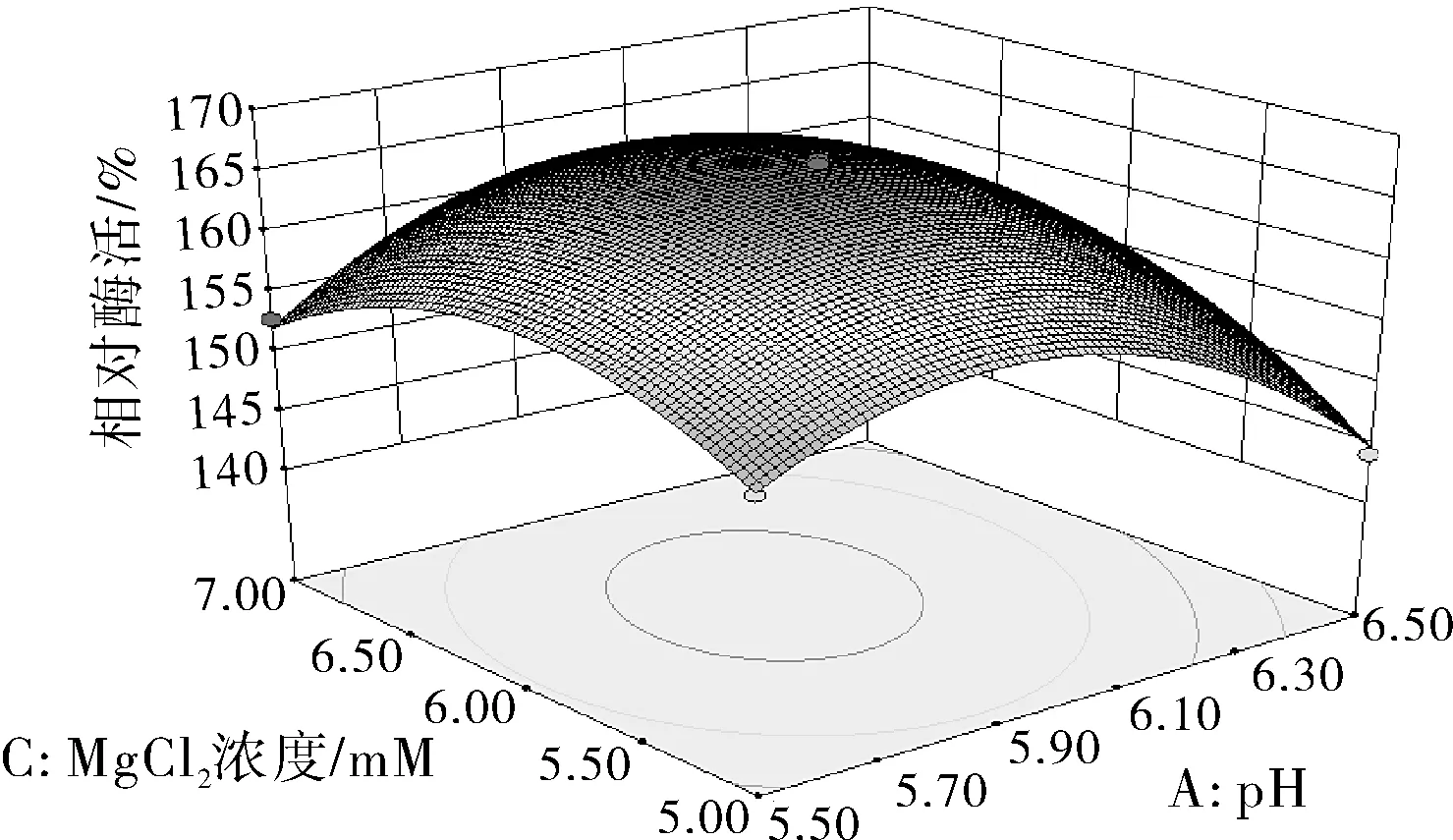
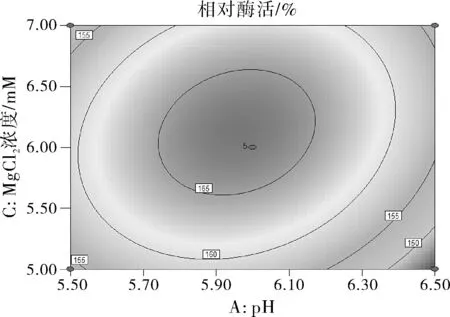
图6 Y=f(A,C)的响应面图和等高线
由图6可知响应面曲线相对陡峭,说明pH和MgCl2浓度的交互作用对酶活性影响较大,且等高线形状偏椭圆形,说明pH和MgCl2两因素的交互作用显著。

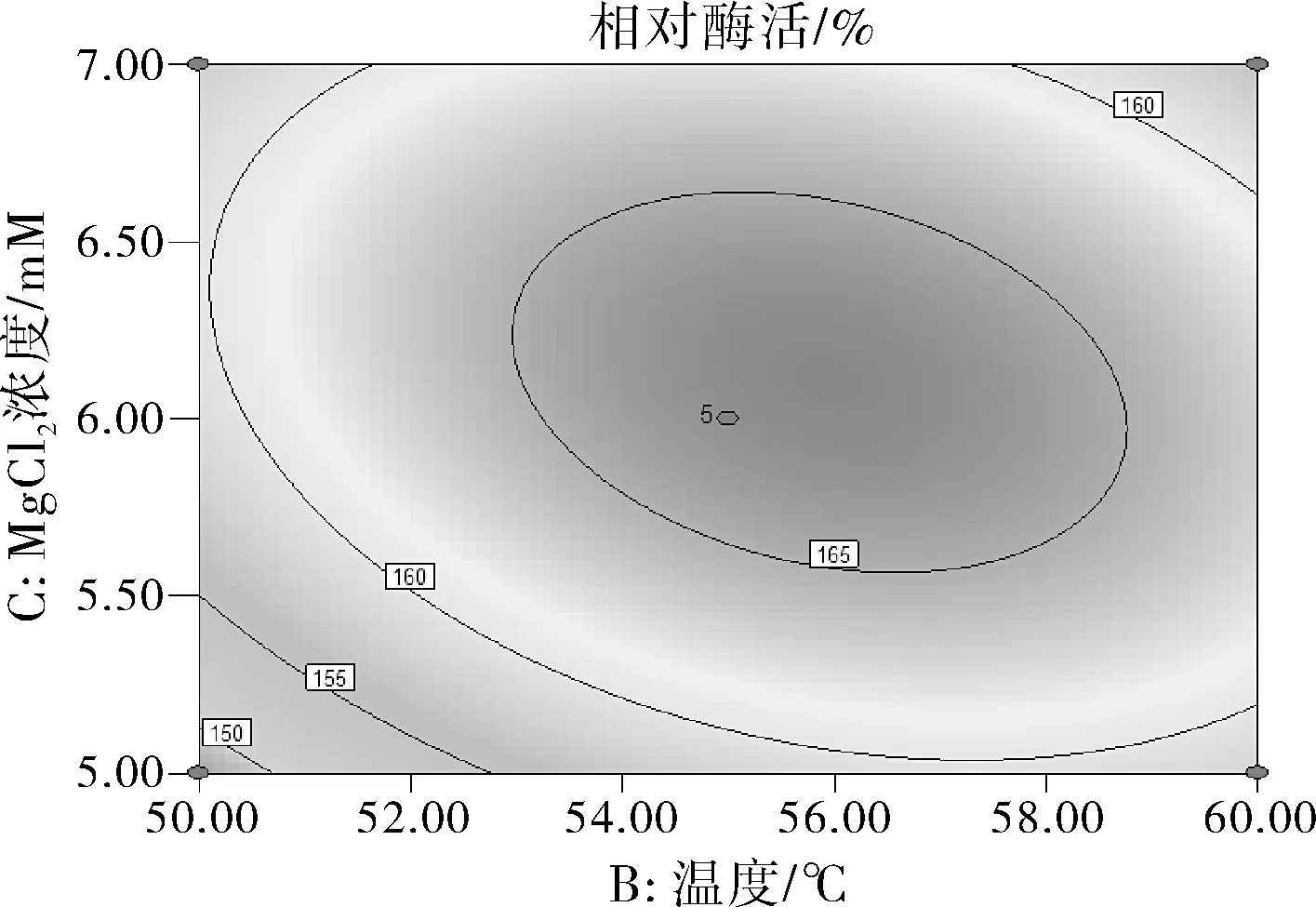
图7 Y=f(B,C)的响应面图和等高线
由图7可知响应面曲线虽不及图6响应面曲线陡峭,但是从等高线形状偏椭圆形能够看出温度和MgCl2浓度两因素的交互作用显著。
2.4验证试验
运用Design-Expert分析响应面试验得出的zmCP1酶活最佳参数为pH 5.95,温度55.89 ℃,MgCl2浓度6.08 mM;预测相对酶活力为166.78%。由于实际操作原因,将参数修改为pH6.0,温度56 ℃,MgCl2浓度6.0 mM。在上述参数条件下进行三组平行验证试验,得到的zmCP1相对酶活为167.13%,预测值与实测值相差不大,说明数学模型的合理性较高;响应面法分析各因素对zmCP1酶活力影响较可靠,有参考价值。
3 结 论
本文利用毕赤酵母进行真核表达,使得表达出的zmCP1具有天然活[19-20]并且通过 Box-Behnken 的中心组合设计及响应面分析,建立zmCP1相对酶活力的二次多项式数学模型,验证表明该模型合理,可很好地预测zmCP1在pH,温度,MgCl2浓度交互作用影响下的相对酶活。软件分析结合实际操作情况得到的zmCP1酶活的最佳参数为pH 5.95温度56 ℃,MgCl2浓度6.08 mM。相应的zmCP1相对酶活达到166.78%。验证试验的结果(167.13%)与预测值基本吻合,说明该模型可靠,将该模型结合zmCP1较宽的温度和pH适应范围,能够较为精准的指导该酶在实际生产中的运用。
[1]Rawlings N D, Barrett A J. Families of cysteine peptidases[J].Methods Enzymol,1994,244:461-486.
[2]Wiederanders B, Kaulmann G, Schilling K. Functions of propeptide parts in cysteine proteases[J].Curr Protein Pept Sci,2003,4(5):309-326.
[3]Grudkowska M,Zagdanska B.Multifunctional Role of Plant Cysteine Proteinases[J].Acta Biochimica Polonica, 2004,51(3):609-624.
[4]Gonzalez-Rabade N, Badillo-Corona J A, Aranda-Barradas J S, et al. Production of plant proteases in vivo and in vitro--a review[J].Biotechnol Adv,2011,29(6):983-996.
[5]闫龙凤,杨青川,韩建国,等.植物半胱氨酸蛋白酶研究进展[J].草业学报,2005(05):11-19.
[6]Watanabe Y, Matsushima S, Yamaguchi A, et al. Characterization and cloning of cysteine protease that is induced in green leaves of barley[J]. Plant Sci,2009,176(2):264-271.
[7]Lecaille F, Kaleta J, Brommole D. Human and parasitic papain-like cysteine proteases:their role in physiology and pathology and recent developments in inhibitor design[J]. Chem Rev,2002,102(12):4459-4488.
[8]吴显荣,朱利泉.木瓜蛋白酶[J].北京农业大学学报,1988,14(1):13-17.
[9]Leite Andréa Pinto,de Oliveira Beatriz Guitton Renaud Baptista,Soares Marja Ferreira,Barrocas Desirée Lessa Rodrigues.Use and effectiveness of papain in the wound healing process: a systematic review.[J].Revista Gaucha de Enfermagem,2013,333:245-249.
[10]王如芳,张吉旺,董树亭,等.我国玉米主产区秸秆资源利用现状及其效果[J].应用生态学报,2011,06:1504-1510.
[11]郭玲霞,黄朝禧,彭开丽.从中国玉米生物乙醇发展分析生物能源对粮食安全的影响[J].中国科技论坛,2011,09:139-145.
[12]王莉,胡胜德.玉米用途之争:粮食消费还是能源消费[J].农业经济,2008,11:8-9.
[13]王雪茜,陈正华,孙军.玉米秸秆能源化利用途径与方法[J].中国资源综合利用,2014(10):35-38.
[14]Yang-yuan Li, Kai-xin Zhong, Ai-hong Hu, et al. High-level expression and characterization of a thermostable xylanase mutant from Trichoderma reesei in Pichia pastoris[J]. Protein Expression and Purification,2014:90-96.
[15]Ping Yu, Xiaoqin Shen. Enhancing the production of S-adenosyl-L-methionine in Pichia pastoris GS115 by metabolic engineering[J]. AMB Express,2012,21:1-7.
[16]詹冬玲.超嗜热古菌Pyrococcus horikoshii OT3半胱氨酸蛋白酶的研究[D].吉林大学,2011.
[17]Than M E, Helm M, Simpson D J, et al. The 2.0 A crystal structure and substrate specificity of the KDEL-tailed cysteine endopeptidase functioning in programmoled cell death of Ricinus commolunis endosperm[J]. J Mol Biol,2004,336(5):1103-1116.
[18]范晓良,李行诺,楚楚,等.响应面法优化加压溶剂萃取香菇多糖工艺研究[J].中国食品学报,2012, 12(2):98-103.
[19]Leonardo M. Damasceno,Chung-Jr Huang,Carl A. Batt. Protein secretion in Pichia pastoris and advances in protein production[J].Applied Microbiology and Biotechnology,2012,931:31-39.
[20]Gabriel Potvin,Ayla Ahmad,Zisheng Zhang.Bioprocess engineering aspects of heterologous protein production in Pichia pastoris: A review[J]. Biochemical Engineering Journal,2012,64:91-105.
Analysis of Influences of Different Factors onZeaMaysCysteine Proteases Using Response Surface Methodology (RSM)*
CHENFang-qi1,2,LIUHui-min2,3,ZHENGMing-zhu1,2,JINSong1,LIUJing-sheng1,2
(1 College of Food Science and Engineering, Jilin Agricultural University, Jilin Changchun 130118;2 National Engineering Laboratory of Wheat and Corn Deep Processing, Jilin Agricultural University,Jilin Changchun 130118;3 College of Life Science, Jilin University, Jilin Changchun 130023, China)
ZeamaysCysteine Protease is a kind of significant proteolytic enzymes, in order to study the enzymology properties of zmCP1, the zmCP1 was expressed by using the recombinant P. pastoris and the influences of different factors (pH, temperature, concentration of MgCl2) on the activity of zmCP1 were analyzed by RSM with the relative enzyme activity of zmCP1 acted as response value. The results showed that when the three factors was pH 5.95,55.89 ℃,6.08 mM MgCl2,respectively, the predicted relative enzyme activity was 166.78%, measured value was 167.13%. The model is reasonable and has reference value.
zmCP1; fermentation; RSM; enzyme activity
国家自然科学基金(31171760);公益性行业(粮食)科技专项基金(201313011-3);吉林农业大学科研启动基金。
陈方奇(1991-),男,硕士研究生,研究方向为食品生物化学工程与功能性食品的研究。
刘景圣(1964-),男,教授,博士,研究方向为粮食深加工与功能性食品。
Q786
A
1001-9677(2016)010-0043-05
