基质细胞衍生因子-1对小鼠关节软骨细胞自噬水平的影响
2016-09-02张津铭吕正涛卢伟伟李兴艳董永辉祁军黄晖郭风劲陈安民
张津铭 吕正涛 卢伟伟 李兴艳 董永辉 祁军 黄晖 郭风劲 陈安民
·骨科护理·
基质细胞衍生因子-1对小鼠关节软骨细胞自噬水平的影响
张津铭吕正涛卢伟伟李兴艳董永辉祁军黄晖郭风劲陈安民
目的通过研究基质细胞衍生因子-1(stromal derived factor-1,SDF-1)对小鼠关节软骨细胞自噬的影响,探讨SDF-1在骨性关节炎中的作用及机制。方法分离并体外培养小鼠关节软骨细胞,分别予以0、1、10、100、1 000 μg/L浓度的五组重组SDF-1蛋白干预24 h。运用RT-PCR检测各组细胞的微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)和UNC-51样激酶复合物1 (uncoordinated-51 like kinase 1,ULK1)mRNA表达情况,运用Western Blot方法检测LC3-Ⅱ、LC3-Ⅰ、ULK1及泛素连接蛋白62(ubiquitin-binding protein p62,p62)蛋白表达水平,通过透射电镜观察自噬溶酶体。结果RT-PCR结果显示10、100、1 000 μg/L浓度条件下LC3、ULK1的mRNA水平明显高于对照组,且差异具有统计学意义(P<0.05)。Western Blot结果显示1、10、100、1 000 μg/L的各组细胞的LC3-Ⅱ/ LC3-Ⅰ比值、ULK-1表达水平较对照组升高,p62蛋白表达水平较对照组明显降低,差异具有统计学意义(P<0.05)。透射电镜结果显示经SDF-1干预后,自噬溶酶体较对照组增多,差异具有统计学意义(P<0.05)。结论SDF-1可诱导小鼠关节软骨细胞自噬的发生,SDF-1可能通过调节软骨细胞自噬水平参与了骨性关节炎的进展。
基质细胞衍生因子-1;软骨细胞;自噬;骨关节炎
基质细胞衍生因子-1(stromal derived factor-1,SDF-1)又称为CXC趋化因子配体-12[chemokine(C -X-C motif)ligand 12,CXCL12],是属于CXC趋化因子亚家族,其受体为CXC趋化因子受体4[chemokine(C-X-C)receptor 4,CXCR4]和趋化因子受体CXC趋化因子受体7[chemokine(C-X-C)receptor 7,CXCR7],具有调控细胞动员、迁移等作用[1]。
目前认为SDF-1/CXCR4轴在骨性关节炎及类风湿性关节炎的发生中也起着重要作用[2]。已经发现骨性关节炎患者关节液中SDF-1浓度较正常人增高,并且其浓度与骨性关节炎程度呈正相关,并发现SDF-1导致骨性关节炎的发生可能通过其促进软骨细胞释放基质金属蛋白酶-3(matrix metalloproteinase 3,MMP-3)、基质金属蛋白酶-13(matrix metalloproteinase 13,MMP-13)等导致软骨损伤[3]。自噬是真核生物中高度保守的生理过程,缺氧、氧化应激、营养缺乏及其他细胞应激均能导致自噬水平的升高以维持细胞内稳态和细胞在恶劣条件下存活[4],自噬在骨性关节炎中起重要作用[5]。
本研究拟通过研究不同浓度的SDF-1对小鼠关节软骨细胞自噬水平的影响,探讨SDF-1在骨性关节炎发生发展过程中的作用及机制。以期为进一步揭示骨性关节炎的发病机制及其药物治疗等提供实验基础。
材料与方法
一、主要试剂及材料
胎牛血清(Gibco公司,美国);Dulbecco改良Eagle培养基与F12营养素1∶1培养基(Dulbecco's Modified Eagle Media∶Nutrient Mixture F-12,DMEM/F12,Hyclone公司,美国)。Rever Tra Ace-α-逆转录试剂盒、RT-PCR试剂盒(Toyobo公司,日本)。LC3抗体、ULK-1抗体、p62抗体(CST公司,美国)。甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、蛋白定量检测试剂盒、凝胶试剂盒、化学发光检测试剂盒、胰蛋白酶、Ⅱ型胶原酶(武汉博士德公司,中国)。重组小鼠SDF-1α蛋白(PeproTech公司,美国)。LC3、ULK1、GAPDH引物由武汉擎科生物公司合成。
二、小鼠关节软骨细胞的分离及培养
采用3~4天龄的C57BL/6小鼠,雌雄不限,由华中科技大学同济医学院实验动物中心提供,为清洁级实验动物。常规处死小鼠后于无菌操作下游离膝关节,充分清理滑膜组织及半月板后以显微剪分离关节软骨组织,剪碎至1 mm3大小。依次用0.25%胰蛋白酶37℃消化30 min,0.2%Ⅱ型胶原酶消化6~ 8 h。收集小鼠细胞并接种于含10%胎牛血清的DMEM/F-12培养基中,置于恒温37.0℃,5%CO2培养箱中培养。
三、细胞干预及分组
选取体外培养的第1~2代软骨细胞按2×105个/孔接种于6孔板中,细胞生长至80%融合后更换为无血清培养基并进行药物干预。行RT-PCR和Western Blot实验时,将细胞分为五组,分别予以SDF-1重组蛋白0、1、10、100和1 000 μg/L,干预时间为24 h,并设立3个平行实验。行透射电镜检测时将细胞分为0 μg/L和100 μg/L组,两组分别予以SDF-1重组蛋白0、100 μg/L干预24 h,设立3个平行实验。
四、RT-PCR检测基因表达
抽提各组细胞总RNA,主要步骤如下:将实验处理后的细胞用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤3次,加入裂解液350 μl,充分裂解后收集悬液。12 000 g离心15 min,收集上清并静置后加入200 μl三氯甲烷,静置10 min后以12 000 g离心15 min。取上清液加入等体积异丙醇,充分混匀后离心去除上清液。经75%乙醇洗涤后用无酶水重新溶解获得总RNA。使用逆转录试剂盒中的随机引物及逆转录酶进行逆转录。而后应用RT-PCR仪对cDNA产物进行RT-PCR检测。反应体系为20 μl,其中含SYBR RT-PCR SuperMix 10 μl,无酶水为7.4 μl,上、下游引物(表1)各0.8 μl,模板cDNA 1 μl。预变性:95℃30s。变性:95℃15 s;退火: 60℃15 s;延伸:72℃30 s;共40个循环。

表1 各基因引物序列及产物长度
五、Western Blot检测蛋白表达
干预后的细胞用预冷的PBS洗涤,每孔加入100 μl细胞裂解液制备蛋白样本。测定蛋白浓度后每孔加入20 μg蛋白样本并进行电泳,转膜后使用5%牛血清白蛋白(bovine serum albumin,BSA)溶液室温摇床上封闭1 h,加入按1∶1 000稀释的一抗后于4℃孵育过夜,洗膜后加入按1∶5 000稀释的辣根过氧化物酶(horse radish peroxidase,HRP)标记的二抗,室温下孵育1 h。洗膜后用化学发光试剂盒显色并采集照片,用Image Lab 5.1软件测量条带灰度值并进行统计分析。
六、透射电镜观察自噬小体
干预后将软骨细胞以0.25%胰酶消化脱壁,离心成细胞团并用2.5%戊二醛磷酸盐缓冲液固定,洗涤后再次用1%锇酸固定液固定。经乙醇、丙酮梯度脱水后包埋、固化,制备超薄切片后以3%醋酸铀-枸橼酸铅双染色。透射电镜观察拍片。两组细胞分别在电镜下随机挑选25个细胞,计数细胞内自噬溶酶体的数量并进行统计分析。
七、统计学分析
采用SPSS 17.0统计软件包对数据进行统计学分析,各组计量资料用平均值±标准差(±s)表示,采用单因素方差分析及t检验进行统计检验,P<0.05为差异有统计学意义。
结果
一、SDF-1对关节软骨细胞ULK1和LC3的mRNA表达的影响
样本经RT-PCR检测后运用2-∆∆Ct法进行计算分析,结果显示SDF-1浓度为0、1、10、100、1 000 μg/L各组细胞的ULK1的mRNA相对表达水平分别为: 1.00±0.16、1.14±0.29、1.83±0.23、2.47±0.38和1.98± 0.31,其中10、100和1 000 μg/L组较对照组升高,差异具有统计学意义(P<0.05,图1 a)。0、1、10、100和1 000 μg/L各组细胞的LC3的mRNA相对表达水平分别为:1.00±0.15、1.08±0.09、1.42±0.13、1.68±0.21和1.80±0.33,其中10、100和1 000 μg/L组的LC3 mRNA相对表达水平较对照组增加,差异具有统计学意义(P<0.05,图1 b)。但1 μg/L组的ULK1、LC3 mRNA相对表达水平较对照组,差异没有统计学意义(P>0.05)。
二、SDF-1对关节软骨细胞LC3-Ⅱ/LC3-Ⅰ比值以及ULK1、p62蛋白表达水平的影响
Western Blot结果示各组细胞均表达LC3、ULK1、p62蛋白(图2 a)。关节软骨细胞经不同浓度SDF-1干预24h后,1、10、100和1000μg/L的各组细胞的LC3-Ⅱ/LC3-Ⅰ比值较对照组明显升高,差异具有统计学意义(P<0.05,图2 b)。1、10、100和1 000 μg/L的各组的ULK-1蛋白表达水平较对照组升高,且差异具有统计学意义(P<0.05,图2 c)。1、10、100和1 000 μg/L的各组的p62蛋白表达水平较对照组明显降低,差异具有统计学意义(P<0.05,图2 d)。
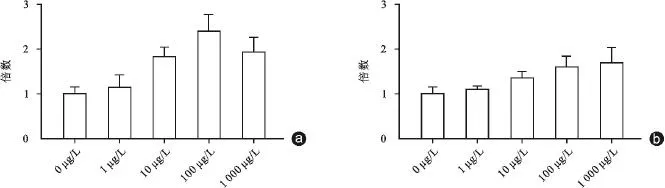
图1 RT-PCR检测ULK1及LC3的mRNA表达水平 a:经不同浓度SDF-1干预的关节软骨细胞ULK1 mRNA相对表达水平。1、10、100和1 000 μg/L组分别与0 μg/L组比较,P值分别为0.516、0.007、0.004、0.009;b:经不同浓度SDF-1干预的关节软骨细胞LC3 mRNA相对表达水平。1、10、100和1 000 μg/L组分别与0 μg/L组比较,P值分别为0.476、0.022、0.010、0.020
三、透射电镜观察SDF-1对关节软骨细胞自噬小体的影响
透射电镜实验中,0 μg/L组和100 μg/L组软骨细胞经透射电镜检查可见细胞核、线粒体、内质网等超微结构(图3 a、c)。图3中白色箭头所指示结构即为自噬溶酶体,其内可见内质网、线粒体等细胞器结构,部分内容物已降解(图3 b、d)。可见经浓度为100 μg/L的SDF-1干预后,自噬溶酶体的数量较对照组增多,差异具有统计学意义(P<0.05,图3 e)。
讨论
一、自噬的定义及过程

图2 Western Blot检测并计算LC3-Ⅱ/Ⅰ比值以及ULK1、p62蛋白表达水平 a:蛋白凝胶电泳图;b:条带灰度分析计算LC3-II/I比值。1、10、100和1 000 μg/L组分别与0 μg/L组比较,P值分别为0.027、0.004、0.001、0.002;c:条带灰度分析计算ULK1相对表达量。1、10、100和1 000 μg/L组分别与0 μg/L组比较,P值分别为0.001、0.012、0.001、0.005;d:条带灰度分析计算p62蛋白相对表达量。1、10、100和1 000 μg/L组分别与0 μg/L组比较,P值分别为0.001、0.007、0.009、0.005
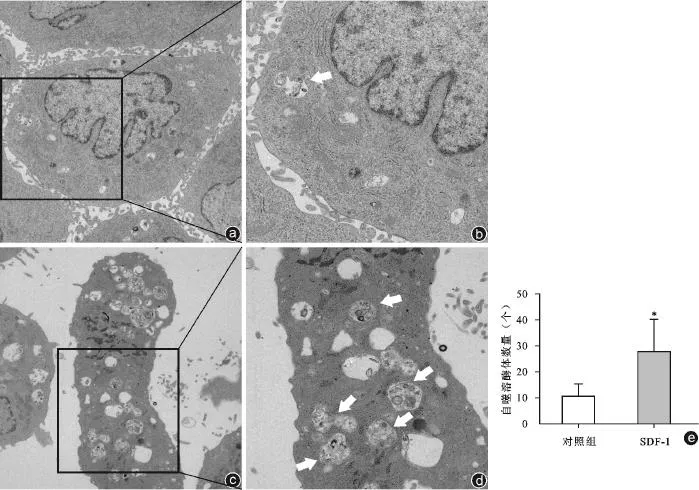
图3 透射电镜观察小鼠关节软骨细胞自噬溶酶体(白色箭头)(3%醋酸铀-枸橼酸铅双染色) a:对照组,1 700×;b:对照组,3 500×;c:SDF-1组,1 700×;d:SDF-1组,3 500×;e:透射电镜下观察两组细胞中自噬溶酶体的数量。与对照组比较,*P<0.001
自噬现象最早被发现于20世纪60年代,是真核生物在自噬相关基因(autophagy related gene,Atg)的调控下通过溶酶体降解和回收细胞组分、营养物质的高度保守的生物过程[6,7]。研究报道自噬在关节软骨发育[8]、肿瘤[9]、神经系统疾病[10]中均发挥重要作用。自噬发生初期会形成一个小的类似“脂质体”样的双层膜结构,通过扩张、延伸、封闭成为具有双层膜结构的球状自噬小体,其内常包裹细胞质、降解蛋白、损伤细胞器等结构,而后自噬体与溶酶体融合形成自噬溶酶体,期间自噬体的内膜被溶酶体酶降解,自噬体中的“货物”也被降解,氨基酸、脂肪酸等产物可被回收供细胞重新利用,而残渣或被排出细胞外或滞留在胞质中,该过程可通过透射电镜观察[7,11]。当自噬发生时,ULK-1(即ATG1在哺乳动物中的同源物)承担启动作用,胞质型LC3(即LC3-Ⅰ)蛋白与磷脂酰乙醇胺结合形成膜型LC3(即LC3-Ⅱ)定位于自噬体的膜上,参与自噬体膜的延伸过程,因此通过测定LC3-Ⅱ/LC3-Ⅰ值可以反映细胞自噬水平的变化[12]。自噬的底物p62通常在自噬增加时其降解增多,表达量减少,当自噬被抑制时p62发生累积表达增高,相反自噬增加时其表达降低[13]。
二、SDF-1对细胞自噬水平的影响
SDF-1是一种趋化因子,具有诱导炎性细胞迁移、定植的作用。Kanbe等[14]在对骨性关节炎患者关节液的研究中发现,其SDF-1浓度较正常人增高,并且其浓度与骨性关节炎程度呈正相关。Herberg等[15]的研究表明SDF-1β能通过提高骨髓间充质干细胞自噬水平使其在过氧化氢诱导的细胞死亡中存活下来。Yang等[16]发现SDF-1α可以诱导牙髓干细胞发生自噬和迁移。王天宝等[17]通过敲减SDF-1的受体CXCR4的表达,抑制了人结肠癌细胞的自噬水平。本研究中给予不同浓度SDF-1干预小鼠关节软骨细胞,发现高浓度SDF-1干预后,LC3、ULK1 mRNA水平与ULK-1蛋白表达、LC3-Ⅱ/LC3-Ⅰ比值较对照组明显升高,p62蛋白水平较对照组明显下降。结果提示高浓度SDF-1可以诱导小鼠关节软骨细胞自噬的发生。
但SDF-1对细胞自噬水平的调节并不一致,Mei等[18]通过研究发现SDF-1浓度与子宫内膜的自噬水平呈负相关。Hashimoto等[19]在对胃癌细胞系的研究中发现SDF-1可以通过使丝氨酸/苏氨酸特异性蛋白激酶(serine/threonine-specific protein kinase,AKT)磷酸化激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路,导致MMPs的升高、细胞迁移和自噬水平的降低,并且通过予以雷帕霉素(mTOR信号通路抑制剂)可以抑制上述过程,提高胃癌细胞的自噬水平。由于自噬是一个受多种机制调节的复杂、动态的过程,造成研究结果不一致的原因可能是在不同组织细胞、不同疾病时期条件下SDF-1对自噬水平的调节会受到其他调控机制影响而变化。本研究中通过透射电镜观察到软骨细胞自噬溶酶体的形态,给予100 μg/L的SDF-1重组蛋白后,软骨细胞中自噬小体的数量较对照组明显增多,进一步提示高浓度SDF-1能诱导软骨细胞自噬的发生。
三、SDF-1可能通过调控软骨细胞自噬参与骨性关节炎的进展
通常认为适当的自噬可以使细胞适应缺氧、应激的外界环境而使细胞存活,但过高水平的自噬则会导致细胞发生自噬性死亡(即Ⅱ型程序性细胞死亡)[20,21]。同时也有研究表明早期骨性关节炎患者,尤其是接近关节面的软骨细胞的自噬水平较正常对照组明显升高,但随着骨性关节炎病情进展,软骨细胞的自噬水平则明显降低[5]。Caramés等[22]在小鼠模型的研究中发现关节软骨细胞的自噬水平随着年龄的增长而逐渐降低。Almonte-Becerril等[23]认为在骨性关节炎初期,自噬表现为软骨损伤的代偿机制发挥保护作用,但在骨性关节炎后期可能导致细胞死亡而促进骨性关节炎发生。通过分析本研究的结果,可以推测在早期软骨损伤后,SDF-1可能通过促进软骨细胞自噬从而抑制软骨损伤,但高浓度的SDF-1可能会通过诱导软骨细胞自噬性死亡而加重骨性关节炎的病情进展,SDF-1可能通过调节软骨细胞自噬水平参与了骨性关节炎的进展。
[1]张博,刘娜,刘洪臣.SDF-1/CXCR-4生物轴的研究进展[J].中华老年口腔医学杂志,2015(2):101-104.
[2]Wei F,Moore DC,Wei L,et al.Attenuation of osteoarthritis via blockade of the SDF-1/CXCR4 signaling pathway[J].Arthritis Res Ther,2012,14(4):R177.
[3]Kanbe K,Takemura T,Takeuchi K,et al.Synovectomy reduces stromal-cell-derived factor-1(SDF-1)which is involved in the destruction of cartilage in osteoarthritis and rheumatoid arthritis[J].J Bone Joint Surg Br,2004,86(2):296-300.
[4]Zou H,Zhuo L,Han T,et al.Autophagy and gap junctional intercellular communication inhibition are involved in cadmiuminduced apoptosis in rat liver cells[J].Biochem Biophys Res Commun,2015,459(4):713-719.
[5]Li YS,Zhang FJ,Zeng C,et al.Autophagy in osteoarthritis[J]. Joint Bone Spine,2016,83(2):143-148.
[6]Nguyen HT,Dalmasso G,Muller S,et al.Crohn's disease-associated adherent invasive Escherichia coli modulate levels of microRNAs in intestinal epithelial cells to reduce autophagy[J].Gastroenterology,2014,146(2):508-519.
[7]Liu Y,Levine B.Autosis and autophagic cell death:the dark side of autophagy[J].Cell Death Differ,2015,22(3):367-376.
[8]Rosenthal AK,Gohr CM,Mitton-Fitzgerald E,et al.Autophagy modulates articular cartilage vesicle formation in primary articular chondrocytes[J].J Biol Chem,2015,290(21):13028-13038.
[9]Yang H,Peng YF,Ni HM,et al.Basal autophagy and feedback activation of akt are associated with resistance to metformininduced inhibition of hepatic tumor cell growth[J].PLoS One,2015,10(6):e0130953.
[10]Janda E,Lascala A,Carresi C,et al.Parkinsonian toxin-inducedoxidative stress inhibits basal autophagy in astrocytes via NQO2/ quinone oxidoreductase 2:Implications for neuroprotection[J].Autophagy,2015,11(7):1063-1080.
[11]Zhai C,Cheng J,Mujahid H,et al.Selective inhibition of PI3K/ Akt/mTOR signaling pathway regulates autophagy of macrophage and vulnerability of atherosclerotic plaque[J].PLoS One,2014,9 (3):e90563.
[12]Klionsky DJ,Abdalla FC,Abeliovich H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4):445-544.
[13]覃琴,谢红,殷明,等.细胞外信号调节激酶通路介导的自噬对七氟烷后处理大鼠心肌缺血再灌注的保护机制[J].中华老年心脑血管病杂志,2015,17(8):859-863.
[14]Kanbe K,Takagishi K,Chen Q.Stimulation of matrix metalloprotease 3 release from human chondrocytes by the interaction of stromal cell-derived factor 1 and CXC chemokine receptor 4[J]. Arthritis Rheum,2002,46(1):130-137.
[15]Herberg S,Shi X,Johnson MH,et al.Stromal cell-derived factor-1 beta mediates cell survival through enhancing autophagy in bone marrow-derived mesenchymal stem cells[J].PLoS One,2013,8(3): e58207.
[16]Yang JW,Zhang YF,Wan CY,et al.Autophagy in SDF-1α-mediated DPSC migration and pulp regeneration[J].Biomaterials,2015,44:11-23.
[17]王天宝,石汉平,韩方海,等.CXCR4-PI3KⅢ-自噬轴与结肠癌LoVo细胞转移潜能相关性研究[J].中华肿瘤防治杂志,2013 (23):1812-1816.
[18]Mei J,Zhu XY,Jin LP,et al.Estrogen promotes the survival of human secretory phase endometrial stromal cells via CXCL12/ CXCR4 up-regulation-mediated autophagy inhibition[J].Hum Reprod,2015,30(7):1677-1689.
[19]Hashimoto I,Koizumi K,Tatematsu M,et al.Blocking on the CXCR4/ mTOR signalling pathway induces the anti-metastatic properties and autophagic cell death in peritoneal disseminated gastric cancer cells[J].Eur J Cancer,2008,44(7):1022-1029.
[20]Ma KG,Shao ZW,Yang SH,et al.Autophagy is activated in compression-induced cell degeneration and is mediated by reactive oxygen species in nucleus pulposus cells exposed to compression[J].Osteoarthritis Cartilage,2013,21(12):2030-2038.
[21]Porter KM,Jeyabalan NLiton PB.MTOR-independent induction of autophagy in trabecular meshwork cells subjected to biaxial stretch[J].Biochim Biophys Acta,2014,1843(6):1054-1062.
[22]Caramés B,Olmer M,Kiosses WB,et al.The relationship of autophagy defects to cartilage damage during joint aging in a mouse model[J].Arthritis Rheumatol,2015,67(6):1568-1576.
[23]Almonte-Becerril M,Navarro-Garcia F,Gonzalez-Robles A,et al. Cell death of chondrocytes is a combination between apoptosis and autophagy during the pathogenesis of Osteoarthritis within an experimental model[J].Apoptosis,2010,15(5):631-638.
Effect of stromal derived factor-1 on autophagy level of articular chondrocyte in mice.
ZHANG Jinming,LYU Zhengtao,LU Weiwei,LI Xingyan,DONG Yonghui,QI Jun,HUANG Hui,GUO Fengjin,CHEN Anmin. Department of Orthopaedics,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
CHEN Anmin,E-mail:anminchen@hust.edu.cn
ObjectiveTo investigate the effect of stromal derived factor-1(SDF-1)on autophagy level of articular chondrocyte in mice and to explore the effect and mechanism of SDF-1 in osteoarthritis.Methods The articular chondrocytes were obtained from 3-to 4-days-old C57BL/6 mice,cultured in vitro,and treated by recombinant SDF-1 protein for 24 h.The concentrations of SDF-1 were 0,1,10,100 and 1 000 μg/L respectively. The mRNA levels of LC3 and ULK1 were detected by the real-time polymerase chain reaction(RT-PCR).The expression levels of LC3-Ⅱ,LC3-Ⅰ,ULK1 and p62 proteins were examined by Western Blot.ResultsAfter chondrocytes were treated with SDF-1 of 10,100 and 1 000 μg/L,the mRNA expression levels of LC3 and ULK1 were up-regulated as compared with control group.The ratio of LC3-Ⅱto LC3-Ⅰand the expression of ULK-1 protein were increased,and the expression of p62 protein was reduced in SDF-1-treated groups(1,10,100 and 1 000 μg/L)as compared with control group(P<0.05 for all).Transmission electron microscopy revealed that as compared with control group,autophagic lysosomes were increased significantly after chondrocytes were treated with SDF-1(P<0.05).ConclusionSDF-1 can induce autophagy of articular chondrocytes in mice.SDF-1 maybe participate the progress of osteoarthritis through regulating autophagy level of articular chondrocyte.
Stromal cell-derived factor-1;Chondrocyte;Autophagy;Osteoarthritis
10.3969/j.issn.1674-8573.2016.04.011
国家自然科学基金(81472082,81572094)
430030武汉,华中科技大学同济医学院附属同济医院骨科
陈安民,E-mail:anminchen@hust.edu.cn
(2015-12-26)