铝离子存在下槲皮素与牛血清白蛋白的相互作用
2016-09-02许树军邹淑君
徐 暘,许树军,张 蕾,于 芳,邹淑君
(1.黑龙江中医药大学药学院,哈尔滨150040;2.黒龙江迪龙制药有限公司研发部,安达151400)
铝离子存在下槲皮素与牛血清白蛋白的相互作用
徐暘1,许树军1,张蕾1,于芳2,邹淑君1
(1.黑龙江中医药大学药学院,哈尔滨150040;2.黒龙江迪龙制药有限公司研发部,安达151400)
采用荧光光谱和同步荧光光谱研究Al3+存在时,槲皮素(Qct)与牛血清白蛋白(BSA)之间的相互作用.实验结果表明,Al3+存在,能够增强槲皮素对BSA的荧光猝灭程度、使槲皮素与BSA的结合常数增大、影响了槲皮素对BSA的荧光猝灭类型、没有改变槲皮素与BSA的作用力类型.Al3+的引入使蛋白质分子肽链更加紧缩,疏水性增加.
槲皮素;牛血清白蛋白;铝离子;荧光法
血清白蛋白是生物体中重要的载体蛋白,能与小分子药物可逆结合,然后将小分子药物输送到机体的各个部位.在小分子药物与血清白蛋白相互结合并被转运的过程中,外源或内源金属离子可能会对药物分子-血清白蛋白的相互作用过程产生影响[1].金属离子的存在,对药物小分子与蛋白质结合有减弱或增强作用.一般认为,减弱作用主要是由于金属离子与蛋白质的结合作用使其变成受制状态下的刚性肽链,改变了结合位点处的构象,从而削弱了药物与蛋白质的结合[2].增强作用则主要是由于金属离子同时与药物和蛋白质结合,在药物和蛋白质分子间形成“离子架桥”,从而起到增强作用[3].研究金属离子存在下药物分子与血清白蛋白的相互作用,有助于确切地了解药物在体内的贮运、吸收及释放受金属离子的影响情况.
槲皮素存在于许多植物的花、叶、果实中,具有广泛的生物学作用,是自然界中最强的抗氧化剂之一[4].槲皮素进入血液后有99.4%的比例与血清白蛋白结合[5].Al3+是生物体常见的外源性金属离子,在生命活动中具有一定的毒副作用,本研究就是通过荧光法考察Al3+存在下,槲皮素与牛血清白蛋白(BSA)的相互作用,以了解如果血液中有Al3+存在,将会对槲皮素在血液中的分布、吸收、药效等产生哪些影响.
1 实验部分
1.1仪器与试剂
XS10fDU型电子分析天平:瑞士梅特勒公司;PB-20型pH计:德国赛多利斯仪器有限公司;SK250LH型超声波清洗器:上海科导超声仪器有限公司;CU600型温水浴锅,上海益恒实验仪器有限公司;RF-5301PC型荧光光度计:日本岛津公司.
槲皮素(98%):中国药品生物制品检定所;三羟甲基氨基甲烷(Tris 99.8%):上海博宏生物科技有限公司;牛血清白蛋白(BSA 99.8%):美国Sigma公司;实验用水均为二次蒸馏水;其他试剂未经说明均为国产分析纯.
1.2溶液的配制
以Tris-HCl缓冲溶液(0.05 mol/L,pH=7. 4,含0.01 mol/L NaCl以维持溶液离子强度)为溶剂配制1×10-5mol/L的BSA溶液,置于4℃的冰箱中保存.槲皮素首先用少量甲醇溶解,再用二次蒸馏水定容配制成1×10-4mol/L的溶液.另用二次蒸馏水配制5×10-3mol/L的AlCl3溶液.
1.3实验方法
1)在8支都盛有1.00 mLBSA(1.0×10-5mol/L)溶液的10 mL容量瓶中,分别加入0,100~800μL的槲皮素溶液(1.0×10-4mol/L),用Tris -HCl(pH=7.40)溶液定容,分别于290、300、310 K水浴20 min.
2)另在8支都盛有1.00 mLBSA(1.0×10-5mol/L)溶液的10 mL容量瓶中,分别加入0,100~800μL的AlCl3溶液(5×10-3mol/L),用Tris-HCl(pH=7.40)溶液定容,分别于290、300、310 K水浴20 min.样品溶液的荧光光谱.3)另在9个10 mL容量瓶中均加入BSA(1×10-5mol/L)溶液1 mL,从第2号容量瓶开始加入AlCl3(5×10-3mol/ L)溶液1 mL,第3~9号容量瓶再依次加入100~800μL的槲皮素溶液(1.0×10-4mol/L),Tris-HCl缓冲溶液定容.每组都在固定激发波长为280 nm,290~450 nm范围内扫描荧光光谱.第2)、3)组同时固定Δλ=15 nm及Δλ=60 nm,扫描同步荧光光谱.荧光光谱和同步荧光光谱的激发狭缝均为5 nm,发射狭缝均为3 nm.
1.4数据处理
数据处理均参考文献[6]的方法.
2 结果与讨论
2.1铝离子对槲皮素猝灭BSA的荧光光谱的影响
图1是300K时,BSA溶液的荧光发射光谱.其中图(A)是不同浓度的Al3+存在下BSA溶液的发射光谱,图(B)是不同浓度的槲皮素存在下BSA溶液的发射光谱,图(C)是Al3+、槲皮素同时存在下BSA溶液的发射光谱.由图1可见,Al3+溶液对BSA的荧光猝灭作用很弱.槲皮素对BSA有很强的、规律性的荧光猝灭作用;且随着槲皮素浓度的增加,BSA的荧光峰呈现规律性的下降;当Al3+存在时,不同浓度的槲皮素仍能使BSA荧光发生规律性的猝灭,且猝灭程度比没有Al3+时增大.表明Al3+的加入,使槲皮素对BSA内源荧光的猝灭程度加强.
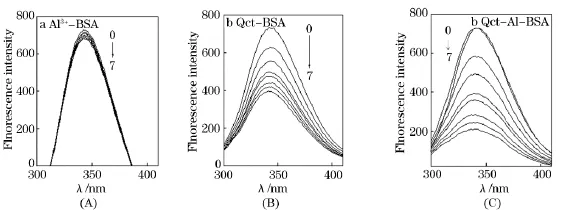
图1 Al3+、槲皮素及二者共同存在下BSA的荧光猝灭光谱
2.2铝离子对槲皮素猝灭BSA荧光机理的影响
对猝灭机理、结合常数和结合位点数的分析均参照文献[6]的方法和原理进行处理.根据sternvolumn方程做图计算得到的相关荧光猝灭常数Ksv及碰撞猝灭速率常数Kq的相关数值见表1.结果表明槲皮素对BSA的荧光猝灭常数Ksv随温度的升高呈现规律性降低,且碰撞猝灭速率常数Kq远大于各类猝灭剂对生物大分子的最大扩散碰撞常数,所以槲皮素对BSA的荧光猝灭属于静态猝灭.而Al3+存在下,槲皮素对BSA猝灭常数Ksv随温度的升高不能呈现规律性降低,但碰撞猝灭常数Kq仍远大于各类猝灭剂对生物大分子的最大扩散碰撞常数,因此推测Al3+存在下,槲皮素对BSA是静态猝灭、动态猝灭同时存在的混合猝灭作用.
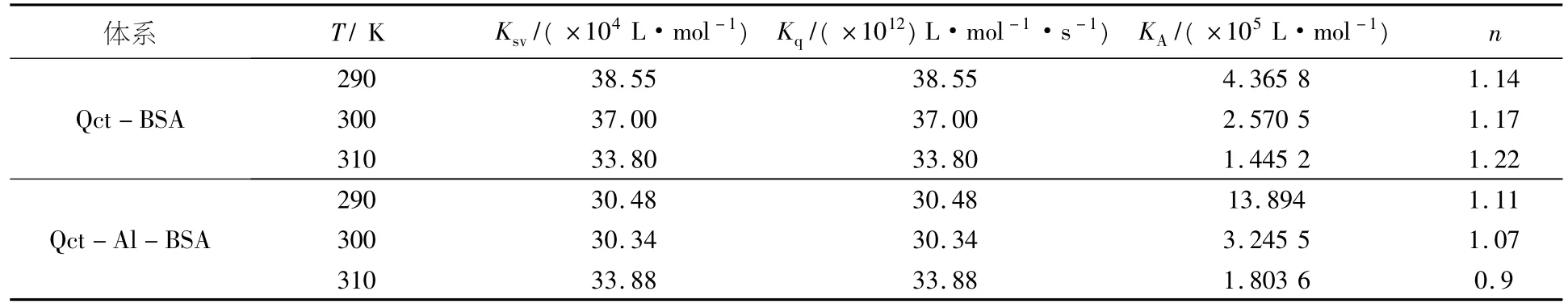
表1 槲皮素-M-BSA相互作用的结合参数
2.3铝离子对槲皮素与BSA结合常数和结合位点数的影响
根据双对数方程推导计算没有Al3+存在及有Al3+存在下槲皮素与BSA的结合常数KA和结合位点数n,相关数值见表1.不论Al3+存在与否,槲皮素与BSA的结合常数KA均随温度升高呈稳定下降趋势,且与BSA结合常数处于105数量级,属于强结合作用.从表中数据的平均效果看,Al3+存在下槲皮素与BSA的结合常数KA大于单独槲皮素对BSA的结合常数,该结果表明Al3+存在时,槲皮素与BSA的结合稳定性增大.从结合位点数n来看,Al3+存在使槲皮素与BSA结合位点数略有减小.结合前面的荧光光谱判断,应该是Al3+同时与槲皮素和蛋白质发生了配位作用[7].
2.4铝离子对槲皮素与BSA相互作用力类型的影响
表2是Al3+不存在和存在时,槲皮素与BSA相互作用的热力学参数.参照文献[6],根据Ross等人的分析方法,结合表2中的数据可知,两个反应体系ΔG均为负值,表明两种情况下反应都是自由能降低的过程,并且反应能够自发进行.反应体系的热力学参数均符合ΔH<0、ΔS<0,表明不论有无Al3+存在,槲皮素与BSA之间主要作用力类型都是氢键和范德华力.说明Al3+的加入不改变槲皮素与BSA的作用力类型.

表2 槲皮素-M-BSA相互作用的热力学参数
2.5铝离子对槲皮素与BSA相互作用同步荧光光谱的影响
荧光发射基团附近微环境的结构变化信息都能被同步荧光技术所探知.同步荧光一般是利用发射单色器、固定激发与发射之间的波长差来获得固定的Δλ.对于BSA,当Δλ=15 nm时,只显示酪氨酸残基的荧光特征光谱,当Δλ=60 nm时,只显示色氨酸残基的荧光特征光谱.所以从BSA最大发射波长的变化趋势,可以得到蛋白质分子中色氨酸残基微环境以及酪氨酸残基微环境的极性变化情况[6].图2中(A)、(B)是Δλ=15 nm时没有Al3+和有Al3+存在时槲皮素对BSA同步荧光光谱的影响,(C)、(D)是Δλ=60 nm时没有Al3+和有Al3+存在时槲皮素对BSA同步荧光光谱的影响.两种同步荧光光谱都可获悉,Al3+存在时,槲皮素对BSA酪氨酸和色氨酸残基的荧光猝灭作用都比没有Al3+存在时强.不论有没有Al3+存在,槲皮素均能使BSA的同步荧光蓝移,但有Al3+存在时,蓝移程度略有增加,可见,Al3+的引入使蛋白质分子肽链更加紧缩,疏水性增加.

图2 Δλ=15 nm和Δλ=60 nm时Al3+存在下槲皮素对BSA同步荧光光谱
3 结语
通过比较荧光猝灭常数、结合常数、结合位点数、作用力类型及同步荧光光谱,推知Al3+存在下,可能同时与槲皮素和蛋白质发生络合作用,络合后使槲皮素与BSA的结合程度增大.Al3+加入后,改变了槲皮素对BSA的荧光猝灭类型,可能变成静态猝灭和动态猝灭同时存在的混合猝灭.Al3+加入后,不改变槲皮素与BSA的作用力类型,仍以氢键和范德华力为主.Al3+能够改变槲皮素对BSA空间构象的影响,使蛋白分子肽链紧缩,疏水性增加.因此在考虑应用槲皮素以及含有以槲皮素为主成分的食品或药物,外源性Al3+的引入可能会降低槲皮素在体内的游离浓度,从而降低药效.
[1]蒋新宇,李文秀,陈景文.锌离子存在下槲皮素、杨梅素与牛血清蛋白的结合[J].无机化学学报,2008,28(10):1588-1595.
[2]王旭,吴淑春,王家学,等.水杨酸和牛血清白蛋白的相互作用研究及共存铜离子的影响[J].中国现代应用药学,2013,30(10):1066-1070.
[3]邵爽,邱瑾.金属离子对齐多夫定与牛血清白蛋白结合作用的影响[J].物理化学学报,2009,25(7):1342-1346.
[4]孙涓,余世春.槲皮素的研究进展[J].现代中药研究与实践,2011,25(3):85-88.
[5]谢孟峡,徐晓云,王英典,等.4'-5'-7-三羟基二氢黄酮与人血清白蛋白相互作用的光谱学研究[J].化学学报,2005,63(22):2055-2062.
[6]邹淑君,许树军,董黎明,等.光谱法比较木犀草素及槲皮素与牛血清白蛋白相互作用[J].光谱实验室,2013,30 (6):2870-2877.
[7]李丽,陈凤浩,赵玉华,8周有氧运动对不同月龄SD大鼠清中CK活性变化的影响[J].哈尔滨师范大学自然科学学报,2015,31(6):119-121.
Influence of Al3+on interaction between quercetin and bovine serum album in
XU Yang1,XU Shu-jun1,ZHANG Lei1,YU Fang2,ZOU Shu-jun1
(1.School of Pharmacy,Heilongjiang University of Chinese Medicine,Harbin 150040,China;2.Research and Development Department,Di Long Pharmaceutical companies,Harbin 151400,China)
The interaction between quercetin and bovine serum albumin(BSA)was studied in the presence of Al3+by using fluorescence spectroscopy and synchronous fluorescence. Results indicated that quercetin could enhance the fluorescence quenching degree of BSA,and increase the binding constant of quercetin on BSA in the presence of Al3+.And Al3+influences the quercetin fluorescence quenchingmechanism to BSA.Al3+could make the peptide chain of BSA intomore austerity state and increased hydrophobicity.But themain binding force of quercetin on BSA did not change in the presence of Al3+.
quercetin;bovine serum albumin;Al3+;fluorescence spectrometry
R285
A
1672-0946(2016)02-0150-04
2015-04-14.
黑龙江省教育厅资助项目(No.12531648);黑龙江中医药大学科研课题(201103).
徐暘(1977-),女,博士,副教授,研究方向:药物分析研究.
邹淑君(1974-),女,博士,副教授,研究方向:药物分析研究.
